1.1.1能层与能级 构造原理与电子排布式课件(共41张PPT)2022-2023学年下学期高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 1.1.1能层与能级 构造原理与电子排布式课件(共41张PPT)2022-2023学年下学期高二化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-15 19:19:42 | ||
图片预览







文档简介
(共41张PPT)
第一节 原子结构
基础课时1
能层与能级 构造原理与电子排布式
第一章 原子结构与性质
学习任务
学习目标 1min
√
√
×
×
C
自学检测 2min
“原子”一词源自古希腊语“ATOM”,是不可再分的意思。古希腊哲学家假想原子是世间万物最小的粒子。
19世纪初,英国人道尔顿创立了近代原子学说,假设原子是化学元素的最小粒子,每一种元素有一种原子。
丹麦科学家玻尔提出了构造原理,即从氢开始,随核电荷数递增,新增电子填入原子核外“壳层”的顺序,由此开启了用原子结构解释元素周期律的篇章。5年后,玻尔的“壳层”落实为“能层”与“能级”,厘清了核外电子的可能状态,复杂的原子光谱得以诠释。
能级能层
能层与能级
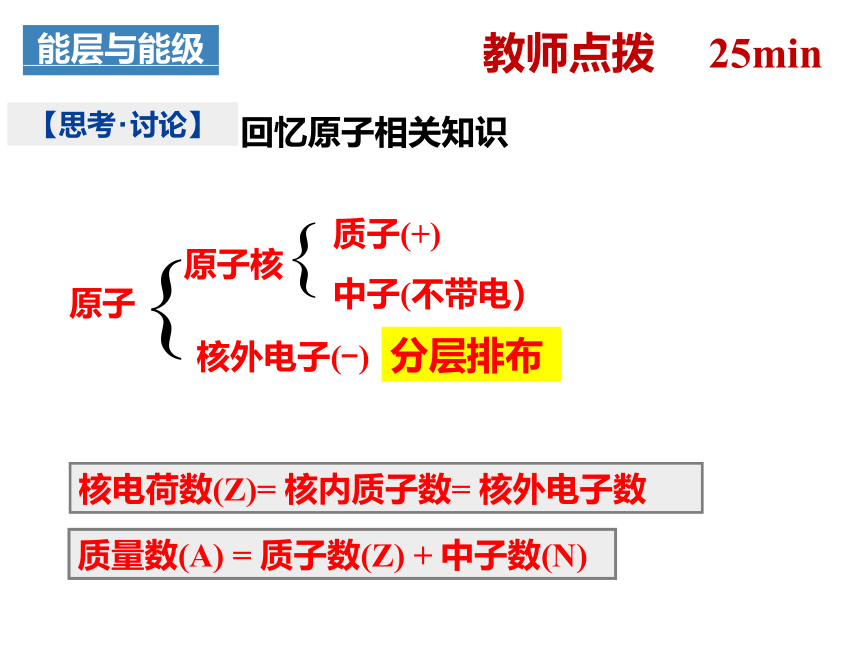
原子
原子核
核外电子(-)
质子(+)
中子(不带电)
核电荷数(Z)= 核内质子数= 核外电子数
质量数(A) = 质子数(Z) + 中子数(N)
【思考 讨论】
回忆原子相关知识
教师点拨 25min
分层排布
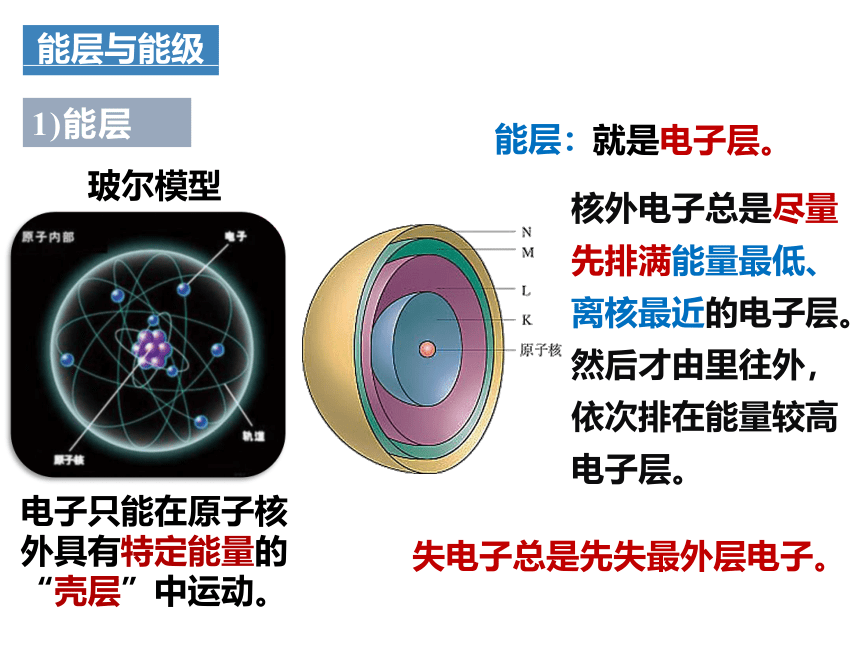
玻尔模型
电子只能在原子核外具有特定能量的“壳层”中运动。
能层:
就是电子层。
1)能层
核外电子总是尽量先排满能量最低、离核最近的电子层。
然后才由里往外,依次排在能量较高电子层。
失电子总是先失最外层电子。
能层与能级
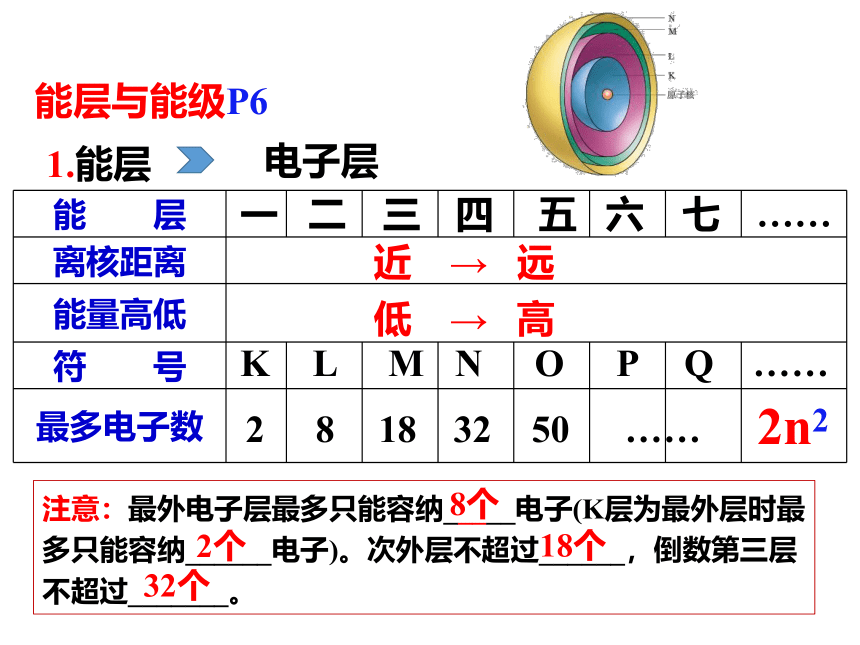
能 层
离核距离
能量高低
符 号
最多电子数
一
二
三
四
五
六
七
……
近 → 远
低 → 高
2
L
N
O
P
Q
8
32
50
……
K
……
M
18
能层与能级P6
1.能层
电子层
2n2
注意:最外电子层最多只能容纳_____电子(K层为最外层时最多只能容纳______电子)。次外层不超过______,倒数第三层不超过_______。
8个
2个
18个
32个
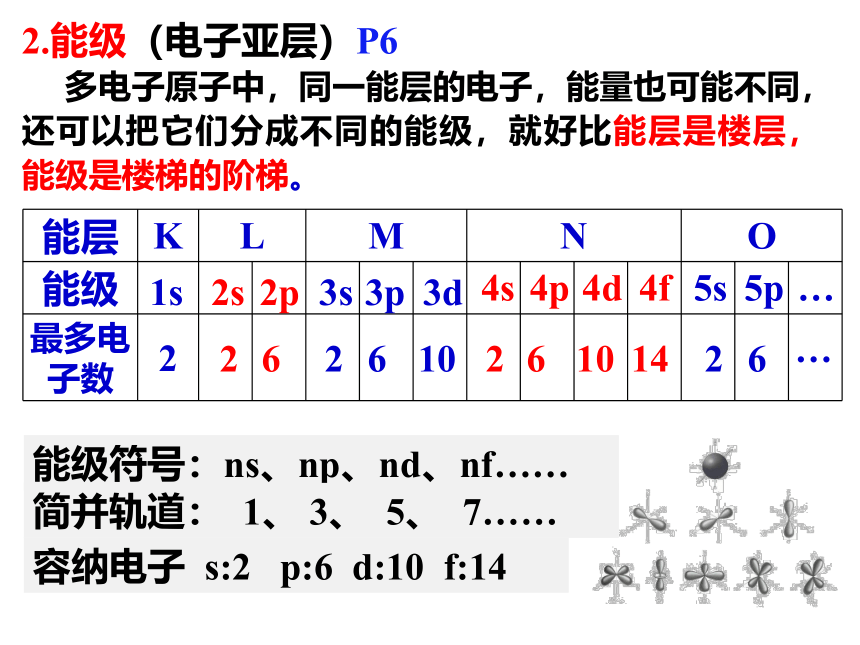
能层 K L M N O
能级
最多电子数
2.能级(电子亚层)P6
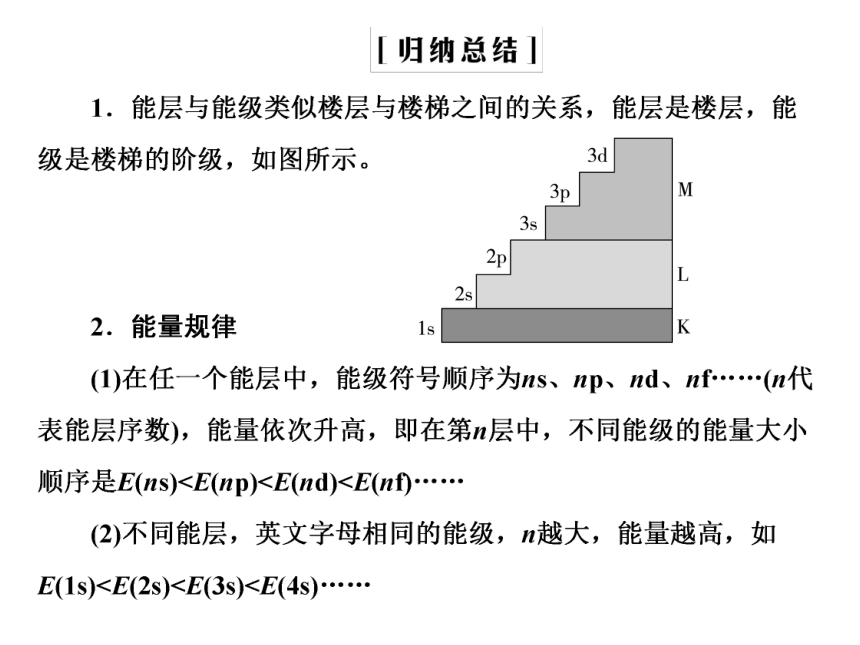
多电子原子中,同一能层的电子,能量也可能不同,还可以把它们分成不同的能级,就好比能层是楼层,能级是楼梯的阶梯。
2
2
6
2
6
10
1s
2s
2p
4s
4p
4d
4f
3s
3p
3d
2
6
10
14
5s
5p
…
2
6
…
能级符号:ns、np、nd、nf……
容纳电子 s:2 p:6 d:10 f:14
简并轨道: 1、 3、 5、 7……
第五能层最多可以容纳多少个电子?分别容纳在哪些能级中?
各能级最多容纳多少个电子?
第五能层最多可以容纳的电子数: 2×52 = 50
分别容纳在5s、5p、5d、5f、5g五个能级中。
各能级最多容纳的电子数为:
5s能级 2×1=2
5p能级 2×3=6
5d能级 2×5=10
5f能级 2×7=14
5g能级 2×9=18 总计50个电子。
【思考】
1.能量最低原理
原子的电子排布遵循构造原理能使整个原子的能量处于___________,简称能量最低原理。
2.基态原子与激发态原子
处于___________的原子叫做基态原子,
当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子。
最低状态
最低能量
基态原子 (稳定)
释放能量
吸收能量
激发态原子(不稳定)
如:Na 1s22s22p63s1
如:Na 1s22s22p63p1
一般遵循构造原理的原子均处于基态,而激发态原子则一般都不遵循构造原理。
基态、激发态相互转化与能量的关系
光(辐射)是电子释放能量的重要形式之一。
基态&激发态 原子光谱
一些生活中的光现象
霓虹灯
激光
都与原子核外电子发生跃迁释放能量有关
烟花
3.原子光谱
不同的元素的原子的核外电子发生跃迁时会吸收或者释放不同频率的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,总称为原子光谱。
基态与激发态的关系原子光谱
基态原子
激发态原子
吸收能量
释放能量
发射光谱
吸收光谱
能量较高
能量最低
锂、氦、汞的发射光谱
锂、氦、汞的吸收光谱
特征: 暗背景
亮线
线状不连续
特征: 亮背景
暗线
线状不连续
注意:同种原子的两种光谱是可以互补的
作用:在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。
原子光谱的应用
He 氦
① 发现新元素
② 检验元素
不同元素的焰色试验
霓虹灯能发出五颜六色的光,如何从原子中电子能量变化的角度去认识光产生的原因?
霓虹灯灯管中装载的气体不同,在高压电的激发下发出的光的颜色就不同。例如,在灯管中充入氖气,通电后在电场作用下,氖原子的电子吸收能量跃迁到能量较高的能级,但很快又会以光的形式释放能量而跃迁回能量较低的能级,所发出的光的波长恰好位于可见光区域中的红色波段,所以看见红色光。类似地,在通电后氩气发蓝色光,氦气发粉红色光;
焰色试验就是某些金属原子的电子在高温火焰中,接受了能量,使原子外层的电子从基态激跃迁到激发态;处于激发态的电子是十分不稳定的,在极短的时间内(约10-8s)便跃迁到基态或较低的能级上,并在跃迁过程中将能量以一定波长(颜色)的光释放出来。由于各种元素的能级是被限定的,因此在向基态跃迁时释放的能量也就不同。碱金属及碱土金属的能级差正好对应于可见光范围,于是我们就看到了各种色彩。
焰火呈现五颜六色的原因
激发态原子中的电子跃迁到低能级时,多余的能量以光的形式释放出来。释放的能量不同,光的颜色不同。
厘清能层与能级的关系
电子层(能层)不能理解为电子在核外一薄层空间内运动,而是按电子能量不同来划分的。
正确。通常状况下,同一能层的电子,根据能量高低分为不同的能级,各能级电子只能在特定的、分立的轨道上运动,同一能级的电子的能量相同。
正确。电子吸收能量后可以从低能级跃迁到高能级形成吸收光谱,处于较高能级的电子可跃迁到低能级形成发射光谱。
D
D
s、p、d
同一能层中的p轨道电子的能量一定比s轨道电子能量高,但能层较高的s轨道电子能量则比能层低的p轨道电子能量高
18个
3d
4d
4f
5d
(1)构造原理揭示了原子的核外电子的能级分布,从中可以看出,不同能层的能级有交错现象,
如:E(3d)>E(4s) E(4f)>E(5p) 等等
(2)构造原理中的电子排布顺序,其实质是各能级的能量高低顺序,即有以下关系:
E(ns) < E[(n-2)f ] < E[(n-1)d] < E(np)
(n代表能层序数)
构造原理
电子填入轨道次序图
通式:
ns······(n-2)f、(n-1)d、np
【思考】
在多电子原子中,失去电子的顺序是否与电子填充的顺序相反?
不一定。原子在填充电子时,由低能量向高能量填充,在3d和4s等能级中出现能级交错现象,先填充4s后再填充3d,但是失去电子的时候,却是先失去最外层的4s电子,后失去3d电子,与填充顺序不一致。
由于出现能级交错现象,因此K原子排满第一层、第二层后,先排满3s、3p能级,最后2个电子排进能量较低的4s能级,而不是能量较高的3d能级。
根据构造原理知,
原子的最外层由ns、np两个能级构成, 排满时排1×2+3×2=8个电子;
次外层由(n-1)s、(n-1)p、(n-1)d
三个能级构成,
排满时排1×2+3×2+5×2=18个电子;
倒数第三层由(n-2)s、(n-2)p、(n-2)d、(n-2)f 四个能级构成,
排满时排1×2+3×2+5×2+7×2=32个电子。
ns、(n-2)f、(n-1)d、np
倒数第三层,次外层,最外层
2+6+10+14,2+6+10,2+6
规律
构造原理的能级组顺序是要求必须熟记的!
巧妙的方法是背能级顺序只背数字,同时要记住各数字相关的轨道符号。
7个能级组共7组数字:
1、22、33、434、545、6456、7567,
找一找数字排列规则,就很容易记住了。
-----速记能级组
Na:1s22s22p63s1
能层序数
该能级上排布的电子数
能级符号
K
L
M
Fe:1s22s22p63s23p63d64s2
K
L
M
N
按能层次序书写(能层低的能级写在左边),按构造原理填充电子。
2.电子排布式:
将能级上所容纳的电子数标在该能级符号右上角,并按照能层从左到右的顺序排列的式子,称为电子排布式。
3.简化电子排布式
如:
[Ne]3s1
表示钠的内层电子排布与稀有气体元素Ne的核外电子排布相同
简化为
Na:1s22s22p63s1
1s22s22p63s23p4
1s22s22p6
1s22s22p63s23p64s2
1s22s22p63s23p63d64s2
1s22s22p63s23p63d104s1
1s22s22p63s1
1s
2s 2p
3s 3p
4s 3d 4p
5s 4d 5p
6s 4f 5d 6p
7s 5f 6d 7p
(7)26Fe2+
(8)26Fe3+
(9)24Cr
1s22s22p63s23p63d54s1
1s22s22p63s23p63d6
1s22s22p63s23p63d5
24Cr:1s22s22p63s23p63d54s1
29Cu:1s22s22p63s23p63d104s1
而不是3d44s2
半满稳定
全满稳定
而不是3d94s2
洪特规则:半充满、全充满更稳定
全充满 p6 d10
半充满 p3 d5
全 空 p0 d0
以上几种情况对称性高,体系稳定,能量较低。
电子填充时将尽可能成为这种状态。
1s
2s 2p
3s 3p
4s 3d 4p
5s 4d 5p
6s 4f 5d 6p
7s 5f 6d 7p
构造原理与电子排布式
不一定相同,电子排布式的书写按电子层由里到外和s、p、d顺序,而核外电子填充顺序是按构造原理。过渡元素电子排布式的书写与电子填充顺序不一致。
方括号里符号的意义是稀有气体元素原子的结构,表示该元素前一周期的稀有气体元素原子的电子排布结构;O:[He]2s22p4 Si:[Ne]3s23p2 Fe:[Ar]3d64s2。
B
如某些过渡元素
C
6
最外层电子(价层电子)排布式
1s22s22p63s23p2
L层有8个电子,则M层有4个电子,故A为硅。
1s22s22p1
当次外层为K层时,最外层电子数则为3,则B为硼;
当次外层为L层时,最外层电子数为1.5×8=12,不存在。
1s22s22p63s23p63d8
1s22s22p63s23p63d5
1s22s22p6
28Ni、26Fe、N
随堂自测
A
最多6个
B
ns<(n-2)f<(n-1)dAC
电子由低能级跃迁到高能级,原子由基态变为激发态,应吸收能量,产生吸收光谱
D
CO2 SO2
MgF2 Na和Si
Ar
S2-
K+
Cl-
第一节 原子结构
基础课时1
能层与能级 构造原理与电子排布式
第一章 原子结构与性质
学习任务
学习目标 1min
√
√
×
×
C
自学检测 2min
“原子”一词源自古希腊语“ATOM”,是不可再分的意思。古希腊哲学家假想原子是世间万物最小的粒子。
19世纪初,英国人道尔顿创立了近代原子学说,假设原子是化学元素的最小粒子,每一种元素有一种原子。
丹麦科学家玻尔提出了构造原理,即从氢开始,随核电荷数递增,新增电子填入原子核外“壳层”的顺序,由此开启了用原子结构解释元素周期律的篇章。5年后,玻尔的“壳层”落实为“能层”与“能级”,厘清了核外电子的可能状态,复杂的原子光谱得以诠释。
能级能层
能层与能级
原子
原子核
核外电子(-)
质子(+)
中子(不带电)
核电荷数(Z)= 核内质子数= 核外电子数
质量数(A) = 质子数(Z) + 中子数(N)
【思考 讨论】
回忆原子相关知识
教师点拨 25min
分层排布
玻尔模型
电子只能在原子核外具有特定能量的“壳层”中运动。
能层:
就是电子层。
1)能层
核外电子总是尽量先排满能量最低、离核最近的电子层。
然后才由里往外,依次排在能量较高电子层。
失电子总是先失最外层电子。
能层与能级
能 层
离核距离
能量高低
符 号
最多电子数
一
二
三
四
五
六
七
……
近 → 远
低 → 高
2
L
N
O
P
Q
8
32
50
……
K
……
M
18
能层与能级P6
1.能层
电子层
2n2
注意:最外电子层最多只能容纳_____电子(K层为最外层时最多只能容纳______电子)。次外层不超过______,倒数第三层不超过_______。
8个
2个
18个
32个
能层 K L M N O
能级
最多电子数
2.能级(电子亚层)P6
多电子原子中,同一能层的电子,能量也可能不同,还可以把它们分成不同的能级,就好比能层是楼层,能级是楼梯的阶梯。
2
2
6
2
6
10
1s
2s
2p
4s
4p
4d
4f
3s
3p
3d
2
6
10
14
5s
5p
…
2
6
…
能级符号:ns、np、nd、nf……
容纳电子 s:2 p:6 d:10 f:14
简并轨道: 1、 3、 5、 7……
第五能层最多可以容纳多少个电子?分别容纳在哪些能级中?
各能级最多容纳多少个电子?
第五能层最多可以容纳的电子数: 2×52 = 50
分别容纳在5s、5p、5d、5f、5g五个能级中。
各能级最多容纳的电子数为:
5s能级 2×1=2
5p能级 2×3=6
5d能级 2×5=10
5f能级 2×7=14
5g能级 2×9=18 总计50个电子。
【思考】
1.能量最低原理
原子的电子排布遵循构造原理能使整个原子的能量处于___________,简称能量最低原理。
2.基态原子与激发态原子
处于___________的原子叫做基态原子,
当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子。
最低状态
最低能量
基态原子 (稳定)
释放能量
吸收能量
激发态原子(不稳定)
如:Na 1s22s22p63s1
如:Na 1s22s22p63p1
一般遵循构造原理的原子均处于基态,而激发态原子则一般都不遵循构造原理。
基态、激发态相互转化与能量的关系
光(辐射)是电子释放能量的重要形式之一。
基态&激发态 原子光谱
一些生活中的光现象
霓虹灯
激光
都与原子核外电子发生跃迁释放能量有关
烟花
3.原子光谱
不同的元素的原子的核外电子发生跃迁时会吸收或者释放不同频率的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,总称为原子光谱。
基态与激发态的关系原子光谱
基态原子
激发态原子
吸收能量
释放能量
发射光谱
吸收光谱
能量较高
能量最低
锂、氦、汞的发射光谱
锂、氦、汞的吸收光谱
特征: 暗背景
亮线
线状不连续
特征: 亮背景
暗线
线状不连续
注意:同种原子的两种光谱是可以互补的
作用:在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。
原子光谱的应用
He 氦
① 发现新元素
② 检验元素
不同元素的焰色试验
霓虹灯能发出五颜六色的光,如何从原子中电子能量变化的角度去认识光产生的原因?
霓虹灯灯管中装载的气体不同,在高压电的激发下发出的光的颜色就不同。例如,在灯管中充入氖气,通电后在电场作用下,氖原子的电子吸收能量跃迁到能量较高的能级,但很快又会以光的形式释放能量而跃迁回能量较低的能级,所发出的光的波长恰好位于可见光区域中的红色波段,所以看见红色光。类似地,在通电后氩气发蓝色光,氦气发粉红色光;
焰色试验就是某些金属原子的电子在高温火焰中,接受了能量,使原子外层的电子从基态激跃迁到激发态;处于激发态的电子是十分不稳定的,在极短的时间内(约10-8s)便跃迁到基态或较低的能级上,并在跃迁过程中将能量以一定波长(颜色)的光释放出来。由于各种元素的能级是被限定的,因此在向基态跃迁时释放的能量也就不同。碱金属及碱土金属的能级差正好对应于可见光范围,于是我们就看到了各种色彩。
焰火呈现五颜六色的原因
激发态原子中的电子跃迁到低能级时,多余的能量以光的形式释放出来。释放的能量不同,光的颜色不同。
厘清能层与能级的关系
电子层(能层)不能理解为电子在核外一薄层空间内运动,而是按电子能量不同来划分的。
正确。通常状况下,同一能层的电子,根据能量高低分为不同的能级,各能级电子只能在特定的、分立的轨道上运动,同一能级的电子的能量相同。
正确。电子吸收能量后可以从低能级跃迁到高能级形成吸收光谱,处于较高能级的电子可跃迁到低能级形成发射光谱。
D
D
s、p、d
同一能层中的p轨道电子的能量一定比s轨道电子能量高,但能层较高的s轨道电子能量则比能层低的p轨道电子能量高
18个
3d
4d
4f
5d
(1)构造原理揭示了原子的核外电子的能级分布,从中可以看出,不同能层的能级有交错现象,
如:E(3d)>E(4s) E(4f)>E(5p) 等等
(2)构造原理中的电子排布顺序,其实质是各能级的能量高低顺序,即有以下关系:
E(ns) < E[(n-2)f ] < E[(n-1)d] < E(np)
(n代表能层序数)
构造原理
电子填入轨道次序图
通式:
ns······(n-2)f、(n-1)d、np
【思考】
在多电子原子中,失去电子的顺序是否与电子填充的顺序相反?
不一定。原子在填充电子时,由低能量向高能量填充,在3d和4s等能级中出现能级交错现象,先填充4s后再填充3d,但是失去电子的时候,却是先失去最外层的4s电子,后失去3d电子,与填充顺序不一致。
由于出现能级交错现象,因此K原子排满第一层、第二层后,先排满3s、3p能级,最后2个电子排进能量较低的4s能级,而不是能量较高的3d能级。
根据构造原理知,
原子的最外层由ns、np两个能级构成, 排满时排1×2+3×2=8个电子;
次外层由(n-1)s、(n-1)p、(n-1)d
三个能级构成,
排满时排1×2+3×2+5×2=18个电子;
倒数第三层由(n-2)s、(n-2)p、(n-2)d、(n-2)f 四个能级构成,
排满时排1×2+3×2+5×2+7×2=32个电子。
ns、(n-2)f、(n-1)d、np
倒数第三层,次外层,最外层
2+6+10+14,2+6+10,2+6
规律
构造原理的能级组顺序是要求必须熟记的!
巧妙的方法是背能级顺序只背数字,同时要记住各数字相关的轨道符号。
7个能级组共7组数字:
1、22、33、434、545、6456、7567,
找一找数字排列规则,就很容易记住了。
-----速记能级组
Na:1s22s22p63s1
能层序数
该能级上排布的电子数
能级符号
K
L
M
Fe:1s22s22p63s23p63d64s2
K
L
M
N
按能层次序书写(能层低的能级写在左边),按构造原理填充电子。
2.电子排布式:
将能级上所容纳的电子数标在该能级符号右上角,并按照能层从左到右的顺序排列的式子,称为电子排布式。
3.简化电子排布式
如:
[Ne]3s1
表示钠的内层电子排布与稀有气体元素Ne的核外电子排布相同
简化为
Na:1s22s22p63s1
1s22s22p63s23p4
1s22s22p6
1s22s22p63s23p64s2
1s22s22p63s23p63d64s2
1s22s22p63s23p63d104s1
1s22s22p63s1
1s
2s 2p
3s 3p
4s 3d 4p
5s 4d 5p
6s 4f 5d 6p
7s 5f 6d 7p
(7)26Fe2+
(8)26Fe3+
(9)24Cr
1s22s22p63s23p63d54s1
1s22s22p63s23p63d6
1s22s22p63s23p63d5
24Cr:1s22s22p63s23p63d54s1
29Cu:1s22s22p63s23p63d104s1
而不是3d44s2
半满稳定
全满稳定
而不是3d94s2
洪特规则:半充满、全充满更稳定
全充满 p6 d10
半充满 p3 d5
全 空 p0 d0
以上几种情况对称性高,体系稳定,能量较低。
电子填充时将尽可能成为这种状态。
1s
2s 2p
3s 3p
4s 3d 4p
5s 4d 5p
6s 4f 5d 6p
7s 5f 6d 7p
构造原理与电子排布式
不一定相同,电子排布式的书写按电子层由里到外和s、p、d顺序,而核外电子填充顺序是按构造原理。过渡元素电子排布式的书写与电子填充顺序不一致。
方括号里符号的意义是稀有气体元素原子的结构,表示该元素前一周期的稀有气体元素原子的电子排布结构;O:[He]2s22p4 Si:[Ne]3s23p2 Fe:[Ar]3d64s2。
B
如某些过渡元素
C
6
最外层电子(价层电子)排布式
1s22s22p63s23p2
L层有8个电子,则M层有4个电子,故A为硅。
1s22s22p1
当次外层为K层时,最外层电子数则为3,则B为硼;
当次外层为L层时,最外层电子数为1.5×8=12,不存在。
1s22s22p63s23p63d8
1s22s22p63s23p63d5
1s22s22p6
28Ni、26Fe、N
随堂自测
A
最多6个
B
ns<(n-2)f<(n-1)d
电子由低能级跃迁到高能级,原子由基态变为激发态,应吸收能量,产生吸收光谱
D
CO2 SO2
MgF2 Na和Si
Ar
S2-
K+
Cl-
