化学人教版(2019)选择性必修2 3.2.2共价晶体 课件(共54张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.2.2共价晶体 课件(共54张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 24.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-15 21:38:22 | ||
图片预览







文档简介
(共54张PPT)
第二节 分子晶体与共价晶体
共价晶体
第三章 晶体结构与性质
学习任务
学习目标 1min
校对答案
一、1. 原子 共价键 网状
2. 非金属单质 非金属化合物 氧化物
3. 很高 小 短 大 高
二、3. sp3 109°28′ 4 6 2
2. 硅氧四面体 ① sp3 109°28′
② 4 4 Si O 2 2 2 1:2
③ 12 6 6 ④ 4
自学指导 6min
阅读课本第81-84页,完成大本自学指导
自学检测 3min
×
×
×
√
只
稀有气体为分子晶体
分子晶体 共价晶体
教师点拨 25min
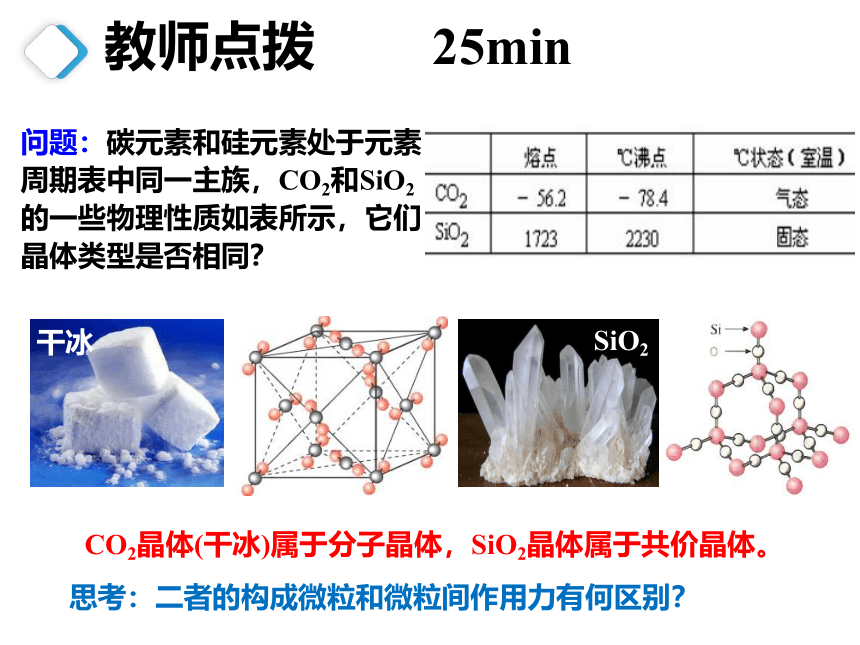
问题:碳元素和硅元素处于元素周期表中同一主族,CO2和SiO2的一些物理性质如表所示,它们晶体类型是否相同?
CO2晶体(干冰)属于分子晶体,SiO2晶体属于共价晶体。
干冰
SiO2
思考:二者的构成微粒和微粒间作用力有何区别?
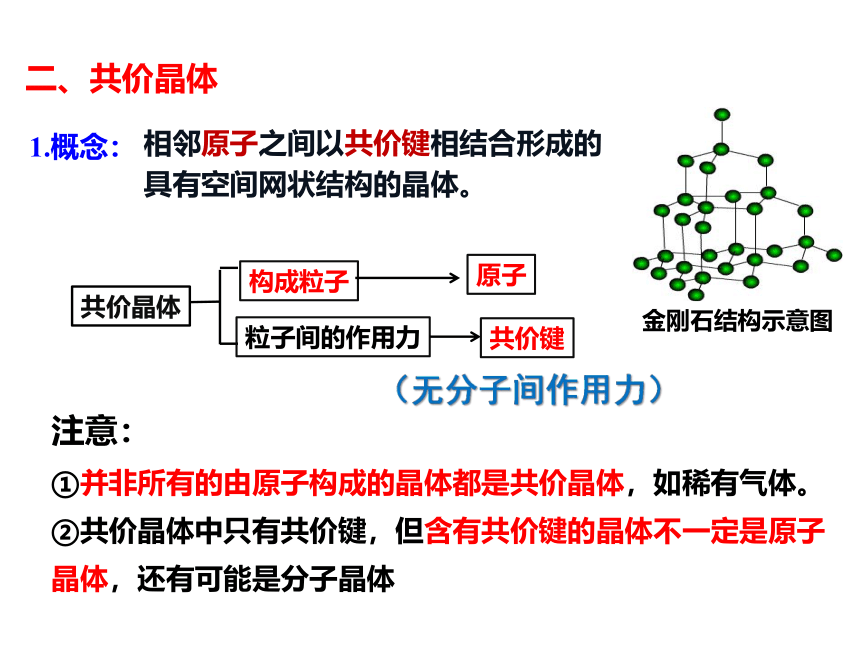
二、共价晶体
1.概念:
相邻原子之间以共价键相结合形成的具有空间网状结构的晶体。
构成粒子
共价晶体
原子
粒子间的作用力
共价键
注意:
①并非所有的由原子构成的晶体都是共价晶体,如稀有气体。
②共价晶体中只有共价键,但含有共价键的晶体不一定是原子晶体,还有可能是分子晶体
金刚石结构示意图
(无分子间作用力)
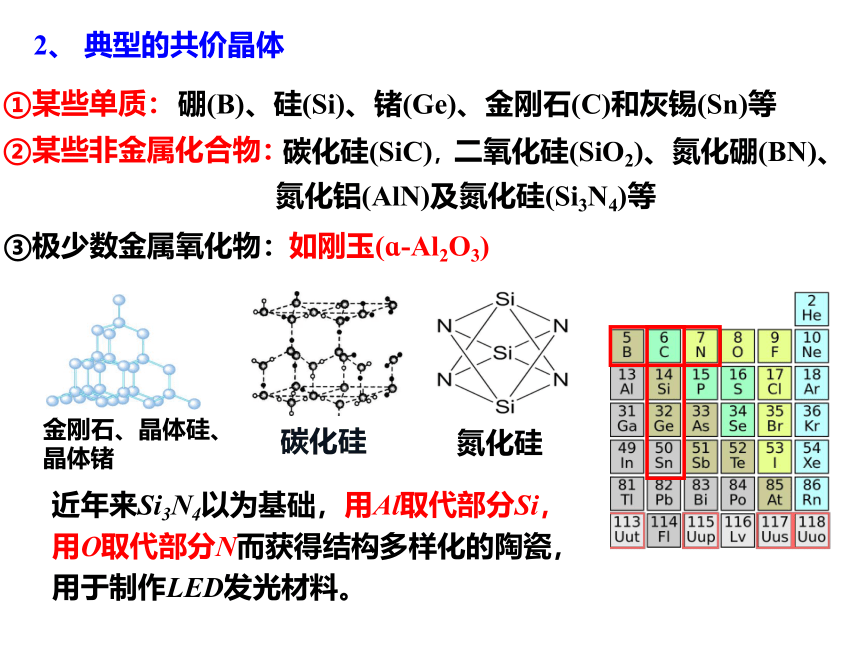
硼(B)、硅(Si)、锗(Ge)、金刚石(C)和灰锡(Sn)等
碳化硅(SiC),二氧化硅(SiO2)、氮化硼(BN)、氮化铝(AlN)及氮化硅(Si3N4)等
③极少数金属氧化物:
①某些单质:
②某些非金属化合物:
如刚玉(ɑ-Al2O3)
2、 典型的共价晶体
金刚石、晶体硅、晶体锗
碳化硅
氮化硅
近年来Si3N4以为基础,用Al取代部分Si,用O取代部分N而获得结构多样化的陶瓷,用于制作LED发光材料。
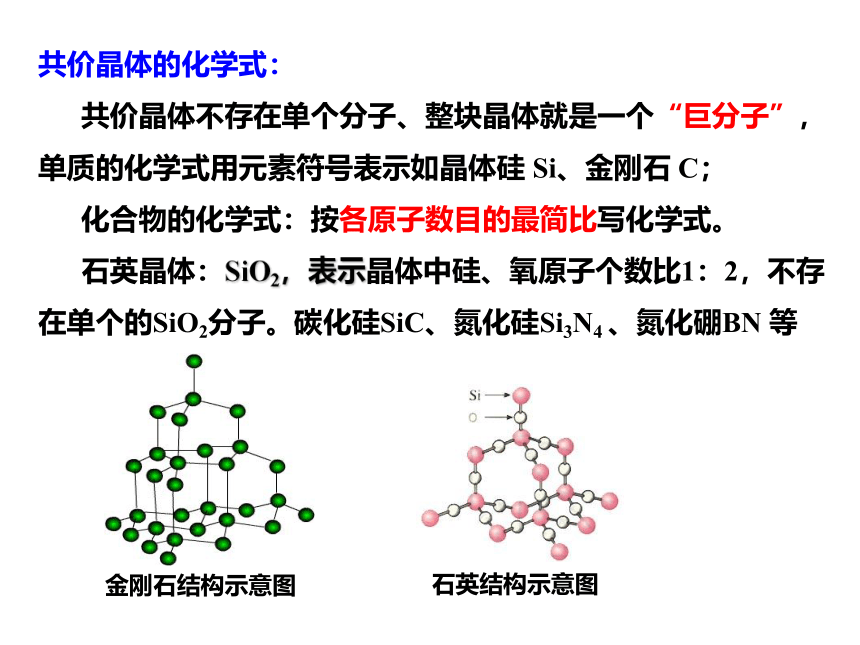
共价晶体的化学式:
共价晶体不存在单个分子、整块晶体就是一个“巨分子”,
单质的化学式用元素符号表示如晶体硅 Si、金刚石 C;
化合物的化学式:按各原子数目的最简比写化学式。
石英晶体:SiO2,表示晶体中硅、氧原子个数比1:2,不存在单个的SiO2分子。碳化硅SiC、氮化硅Si3N4 、氮化硼BN 等
金刚石结构示意图
石英结构示意图
3、共价晶体的物理性质
共价晶体 金刚石 氮化硼 碳化硅 石英 硅 锗
熔点/0C >3550 3000 2700 1710 1410 1211
硬 度 10 9.5 9.5 7 6.5 6.0
①熔点很高:
②硬度很大。
③一般不导电,但晶体硅、锗是半导体。
④难溶于一般溶剂。
共价晶体中,原子间以较强的共价键相结合,
要使物质熔化就要克服共价键,需要很高的能量。
Si3N4用作航天耐高温材料,SiC用作耐磨砂轮。
(1)怎样从原子结构的角度理解金刚石,硅和锗的熔点和硬度
依次下降?
(2)“具有共价键的晶体叫做共价晶体”,这种说法对吗?为什么?
【思考与讨论】
不对,分子晶体中通常也含有共价键。如干冰,只有分子内部才通过共价键结合,而分子间通过范德华力结合成分子晶体;此外,某些离子晶体中也含共价键,如NaOH、NH4Cl。
金刚石、碳化硅、晶体硅都是共价晶体,原子半径:C碳化硅>晶体硅。
小结:一般原子半径越小,键长越短,键能越大,共价键越稳定,晶体的熔、沸点越高,硬度越大。
*硬度是衡量固体软硬程度的指标。硬度有不同的标度,最普通的硬度标度是画痕硬度,即摩氏硬度,以固体互相刻画时出现刻痕的固体的硬度较低。金刚石不能被任何天然矿物刻画出刻痕,因而是最硬的。以金刚石的硬度为10,以另9种天然矿物为代表,可将摩氏硬度分为十度,即:
硬度的 代表物质 金刚石 刚玉 黄玉 石英 正长石 磷灰石 萤石 方解石 石膏 滑石
摩氏硬度 10 9 8 7 6 5 4 3 2 1
应当指出,硬度大的物质不一定经得起锤击,如金刚石硬度最大,却很容易经锤击而破碎。物质经受锤击的性质属于延展性。由于共价晶体中的共价键具有方向性,当受到大的外力作用会发生原子错位而断裂。你要是有粒钻石,切不要用锤子砸哟!
资料卡片
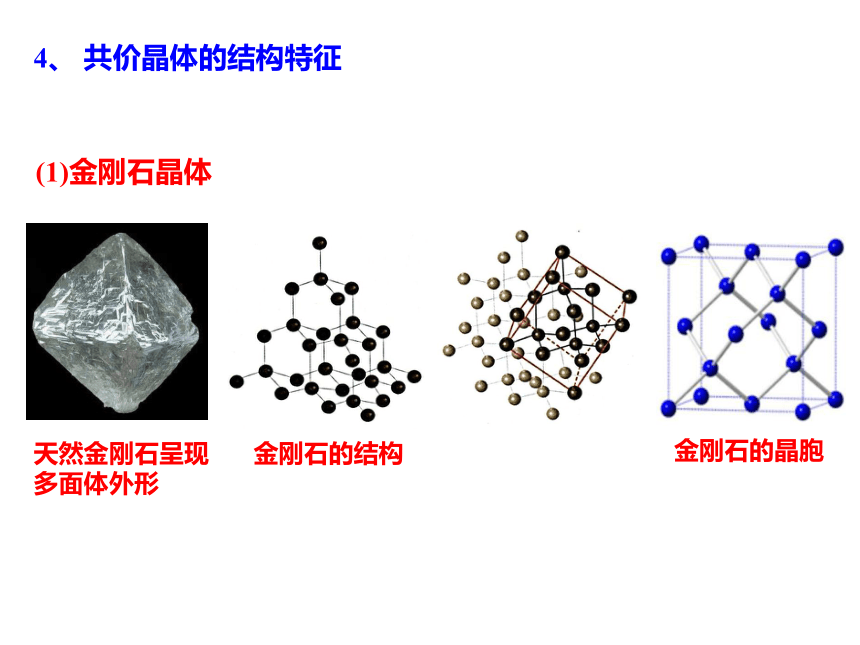
4、 共价晶体的结构特征
(1)金刚石晶体
天然金刚石呈现多面体外形
金刚石的结构
金刚石的晶胞
金刚石晶体的结构特点
①每个碳与相邻___个碳以______键结合,
形成__________结构。键角为________.每个C原子都采取_______。
sp3杂化
③每个C被___个六元环共用,每个环平均拥有____个C原子。
每个C—C键被___个最小环共用,每个环平均拥有___个C—C。
109°28'
②晶体中最小的碳环由___个C原子组成,最多___个C在同一平面内。
6
4
4
金刚石晶体的结构特点
正四面体
共价
正四面体
①黄蓝
①黄蓝②黄绿③黄橙④橙绿⑤橙蓝⑥蓝绿
②黄绿
③黄橙
一个C-C键被2×3=6个六元环共用
④橙绿
⑤橙蓝
⑥蓝绿
每个C原子形成4个共价键,
可组合6个角,
每个角可延伸两个六元环,
则每个C原子被2×6=12个六元环共用。
则每个C-C键被2×3=6个六元环共用。
一个角形成两个环
①每个碳与相邻___个碳以______键结合,
形成__________结构。键角为________.每个C原子都采取_______。
sp3杂化
③每个C被___个六元环共用,每个环平均拥有____个C原子。
每个C—C键被___个最小环共用,每个环平均拥有___个C—C。
109°28'
②晶体中最小的碳环由___个C原子组成,最多___个C在同一平面内。
6
4
4
金刚石晶体的结构特点
12
正四面体
共价
1/2
金刚石晶胞中:六元环结构 : 碳原子数目 : C-C键数目 = 2 : 1 : 2
正四面体
一个角形成两个环
1
6
金刚石晶胞
在一个晶胞中,碳原子位于立方体的8个顶点、6个面心以及晶胞内部4个。
①金刚石晶胞中C原子配位数为___
4
②金刚石晶胞中含有的C原子数为___
8
8×1/8+ 6×1/2+4=8
③12g 金刚石含有_____个C原子,含有_____ 个C-C键
NA
2NA
配位数:一个C原子周围最邻近的C原子数
金刚石 晶体硅 SiC GaAs
金刚石模型的演变 —— 等电子体原理
(1)与碳同族单质(如Si、Ge)都具有与金刚石相似的结构;
(2)第ⅣA族相邻元素间也可形成相似结构的晶体(如SiC)
(3)与第ⅣA族同周期的元素间根据等电子体原理,
如BN、GaAs等也可形成与金刚石结构相似的晶体。
SiO2是自然界含量最高的二元氧化物,熔点1713 ℃,有多种结构 ,最常见的是低温石英。遍布河岸的黄沙、带状的石英矿脉、花岗石里的白色晶体以及透明的水晶都低温石英。
黄沙
花岗岩
石英矿
水晶
①SiO2在自然界分布:
(2)二氧化硅晶体
②低温石英的结构
其结构中有顶角相连的硅氧四面体形成螺旋上升的长链,而没有封闭的环状结构。这一结构决定了它具有手性,被广泛用作压电材料,如石英手表。
石英晶体中
硅氧四面体相连构成的螺旋链
石英的
左、右型晶体
SiO2用途:制造水泥、玻璃、人造红宝石、单晶硅、硅光电池、芯片和光导纤维的原料
【典例】在硅酸盐中,SiO44-四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为 ,Si与O的原子数之比为 ,化学式为 。
sp3 1:3
SiO32-
晶体硅的结构
晶体硅的晶胞中,在Si-Si键之间插入O原子,即得到方石英的晶胞(最常见的SiO2晶胞)。
二氧化硅晶胞
二氧化硅的结构
①二氧化硅晶胞中含有的Si原子数为___,O原子数为___。
8
16
②1molSiO2晶体中含_____molSi-O键。
4
Ⅰ、晶体中1个Si与__个O以共价键结合,形成________结构;1个O与__个Si结合,每个正四面体占有___个Si,__个O。故SiO2晶体中Si与O之比为______。
Ⅱ、最小环上有___个原子(__个Si和__个O)。
每个Si被___个最小环共用,每个Si—O—Si键被___个最小环共用,每个最小的环实际拥有的硅原子为___________,氧原子数为___________。
4
正四面体
1
2
1 : 2
12
6
6
109 28
2
6×1/12=1/2
③常见的二氧化硅的晶体结构
12
6
6×1/6=1
小结:常见共价晶体的结构
物质 金刚石 二氧化硅
晶体 结构
结构 特点 ①碳原子采取sp3杂化,每个碳原子以4个共价单键对称地与相邻的4个碳原子相结合,形成正四面体结构。 ②晶体中C—C—C夹角为109°28′。 ③最小环上有6个碳原子。 ④1mol晶体中有2molC—C键。 ⑤1个晶胞中有8个碳原子。 ①每个硅原子均以4个共价键对称地与相邻的4个氧原子相结合,每个氧原子与2个硅原子相结合,向空间扩展,形成三维骨架结构。
②硅、氧原子个数比为1∶2。
③最小的环上有6个硅原子和6个氧原子。
④1molSiO2中有4molSi—O键。
科学 技术 社会——金刚石
1、天然金刚石
2、人工合成金刚石
以石墨为原料高压合成金刚石
以甲烷、氢气为原料低温低压合成金刚石
天然金刚石形成条件:高温高压
空间结构俯视图
石墨中C原子以____杂化;石墨晶体中最小环为___元环;最小环中___个原子共平面,平均含有___个C原子,___个C-C键 ;12g石墨含有____molC-C 。
sp2 6
6 2 3
1.5
5、石墨及其结构
(1)依据构成晶体的微粒和微粒间的作用力判断。
构成共价晶体的微粒是原子,微粒间的作用力是共价键;构成分子晶体的微粒是分子或原子(稀有气体),微粒间作用力是分子间作用力。
(2)依据晶体的熔点判断。
共价晶体的熔点高,常在1 000 ℃以上;而分子晶体熔点低,常在数百摄氏度以下甚至更低。
(3)还可以依据晶体的硬度与机械性能判断。
共价晶体硬度大,分子晶体硬度小且较脆。
小结:分子晶体和共价晶体的判断方法
(4)依据导电性判断。
分子晶体为非导体,但部分溶于水后能导电;原子晶体多数为非导体,但晶体硅、锗是半导体。
(5)依据物质的分类判断
常见的共价晶体单质有金刚石、晶体硅、晶体硼等,常见的共价晶体化合物有SiC、BN、AlN、Si3N4、C3N4、SiO2等;
大多数非金属单质(除金刚石、石墨、晶体硅、晶体硼外)、气态氢化物、非金属氧化物(除SiO2外)、酸、绝大多数有机物(除有机盐外)都是分子晶体。
(6)依据物质的状态判断
一般常温常压下,呈气态或液态的单质与化合物,在固态时属于分子晶体。
二氧化硅为共价晶体,晶体中不存在单个分子,其化学式为Si与O的最简个数比,不是分子式。
D
Si O
1:2
共价晶体与分子晶体的比较
分子 原子
共价键 分子间作用力
①构成微粒不同,共价晶体中只存在原子,没有分子。②微粒间作用力不同,共价晶体中原子间只存在共价键,而分子晶体中分子之间存在分子间作用力。
C
组成和结构相似的分子晶体,相对分子质量越大,熔点越高
共价晶体,原子半径:r(C)C—Si>Si—Si
NH3分子间存在氢键
白磷和冰都是分子晶体,二氧化硅是共价晶体
晶体硼的熔、沸点以及硬度都介于晶体硅和金刚石之间,而金刚石和晶体硅均为共价晶体,在元素周期表中B与C相邻、与Si处于对角线位置,则晶体硼也属于共价晶体。
共价 晶体硼的熔、沸点高,硬度大
共价 晶体硼的熔、沸点高,硬度大
12
60° 30
认识典型共价晶体的结构
不能。因为共价晶体是一个三维骨架结构,无小分子存在。
SiO2晶体中最小环上有12个原子。1 mol SiO2中含有4 mol Si—O。
D
共价晶体
12
4
正四面体形
随堂评估自测
B
D
半径C>N,则键长C—N<C—C,故C—N键比C—C键更牢固
金刚石:非极性共价键,C3N4晶体:极性共价键
B
金刚石的晶体结构
分子
SiC
共价晶体 共价
一种结晶形碳,有天然出产的矿物。铁黑色至深钢灰色。质软具滑腻感,可沾污手指成灰黑色。有金属光泽。六方晶系,成叶片状、鳞片状和致密块状。密度2.25g/cm3,化学性质不活泼。具有耐腐蚀性,在空气或氧气中强热可以燃烧生成二氧化碳。石墨可用作润滑剂,并用于制造坩锅、电极、铅笔芯等。
5、石墨及其结构
石墨为层状结构,各层之间是范德华力结合,容易滑动,所以石墨很软。
石墨中C原子sp2杂化,金刚石中C原子sp3杂化,sp2杂化中,s轨道的成分比sp3杂化更多,所以形成的共价键更短,更牢固,即石墨的层内共价键键长比金刚石的的键长短,作用力更大,破坏化学键需要更大能量。石墨各层均为平面网状结构,碳原子之间存在很强的共价键(大π键),故熔沸点很高。
(混合型晶体)
第二节 分子晶体与共价晶体
共价晶体
第三章 晶体结构与性质
学习任务
学习目标 1min
校对答案
一、1. 原子 共价键 网状
2. 非金属单质 非金属化合物 氧化物
3. 很高 小 短 大 高
二、3. sp3 109°28′ 4 6 2
2. 硅氧四面体 ① sp3 109°28′
② 4 4 Si O 2 2 2 1:2
③ 12 6 6 ④ 4
自学指导 6min
阅读课本第81-84页,完成大本自学指导
自学检测 3min
×
×
×
√
只
稀有气体为分子晶体
分子晶体 共价晶体
教师点拨 25min
问题:碳元素和硅元素处于元素周期表中同一主族,CO2和SiO2的一些物理性质如表所示,它们晶体类型是否相同?
CO2晶体(干冰)属于分子晶体,SiO2晶体属于共价晶体。
干冰
SiO2
思考:二者的构成微粒和微粒间作用力有何区别?
二、共价晶体
1.概念:
相邻原子之间以共价键相结合形成的具有空间网状结构的晶体。
构成粒子
共价晶体
原子
粒子间的作用力
共价键
注意:
①并非所有的由原子构成的晶体都是共价晶体,如稀有气体。
②共价晶体中只有共价键,但含有共价键的晶体不一定是原子晶体,还有可能是分子晶体
金刚石结构示意图
(无分子间作用力)
硼(B)、硅(Si)、锗(Ge)、金刚石(C)和灰锡(Sn)等
碳化硅(SiC),二氧化硅(SiO2)、氮化硼(BN)、氮化铝(AlN)及氮化硅(Si3N4)等
③极少数金属氧化物:
①某些单质:
②某些非金属化合物:
如刚玉(ɑ-Al2O3)
2、 典型的共价晶体
金刚石、晶体硅、晶体锗
碳化硅
氮化硅
近年来Si3N4以为基础,用Al取代部分Si,用O取代部分N而获得结构多样化的陶瓷,用于制作LED发光材料。
共价晶体的化学式:
共价晶体不存在单个分子、整块晶体就是一个“巨分子”,
单质的化学式用元素符号表示如晶体硅 Si、金刚石 C;
化合物的化学式:按各原子数目的最简比写化学式。
石英晶体:SiO2,表示晶体中硅、氧原子个数比1:2,不存在单个的SiO2分子。碳化硅SiC、氮化硅Si3N4 、氮化硼BN 等
金刚石结构示意图
石英结构示意图
3、共价晶体的物理性质
共价晶体 金刚石 氮化硼 碳化硅 石英 硅 锗
熔点/0C >3550 3000 2700 1710 1410 1211
硬 度 10 9.5 9.5 7 6.5 6.0
①熔点很高:
②硬度很大。
③一般不导电,但晶体硅、锗是半导体。
④难溶于一般溶剂。
共价晶体中,原子间以较强的共价键相结合,
要使物质熔化就要克服共价键,需要很高的能量。
Si3N4用作航天耐高温材料,SiC用作耐磨砂轮。
(1)怎样从原子结构的角度理解金刚石,硅和锗的熔点和硬度
依次下降?
(2)“具有共价键的晶体叫做共价晶体”,这种说法对吗?为什么?
【思考与讨论】
不对,分子晶体中通常也含有共价键。如干冰,只有分子内部才通过共价键结合,而分子间通过范德华力结合成分子晶体;此外,某些离子晶体中也含共价键,如NaOH、NH4Cl。
金刚石、碳化硅、晶体硅都是共价晶体,原子半径:C
小结:一般原子半径越小,键长越短,键能越大,共价键越稳定,晶体的熔、沸点越高,硬度越大。
*硬度是衡量固体软硬程度的指标。硬度有不同的标度,最普通的硬度标度是画痕硬度,即摩氏硬度,以固体互相刻画时出现刻痕的固体的硬度较低。金刚石不能被任何天然矿物刻画出刻痕,因而是最硬的。以金刚石的硬度为10,以另9种天然矿物为代表,可将摩氏硬度分为十度,即:
硬度的 代表物质 金刚石 刚玉 黄玉 石英 正长石 磷灰石 萤石 方解石 石膏 滑石
摩氏硬度 10 9 8 7 6 5 4 3 2 1
应当指出,硬度大的物质不一定经得起锤击,如金刚石硬度最大,却很容易经锤击而破碎。物质经受锤击的性质属于延展性。由于共价晶体中的共价键具有方向性,当受到大的外力作用会发生原子错位而断裂。你要是有粒钻石,切不要用锤子砸哟!
资料卡片
4、 共价晶体的结构特征
(1)金刚石晶体
天然金刚石呈现多面体外形
金刚石的结构
金刚石的晶胞
金刚石晶体的结构特点
①每个碳与相邻___个碳以______键结合,
形成__________结构。键角为________.每个C原子都采取_______。
sp3杂化
③每个C被___个六元环共用,每个环平均拥有____个C原子。
每个C—C键被___个最小环共用,每个环平均拥有___个C—C。
109°28'
②晶体中最小的碳环由___个C原子组成,最多___个C在同一平面内。
6
4
4
金刚石晶体的结构特点
正四面体
共价
正四面体
①黄蓝
①黄蓝②黄绿③黄橙④橙绿⑤橙蓝⑥蓝绿
②黄绿
③黄橙
一个C-C键被2×3=6个六元环共用
④橙绿
⑤橙蓝
⑥蓝绿
每个C原子形成4个共价键,
可组合6个角,
每个角可延伸两个六元环,
则每个C原子被2×6=12个六元环共用。
则每个C-C键被2×3=6个六元环共用。
一个角形成两个环
①每个碳与相邻___个碳以______键结合,
形成__________结构。键角为________.每个C原子都采取_______。
sp3杂化
③每个C被___个六元环共用,每个环平均拥有____个C原子。
每个C—C键被___个最小环共用,每个环平均拥有___个C—C。
109°28'
②晶体中最小的碳环由___个C原子组成,最多___个C在同一平面内。
6
4
4
金刚石晶体的结构特点
12
正四面体
共价
1/2
金刚石晶胞中:六元环结构 : 碳原子数目 : C-C键数目 = 2 : 1 : 2
正四面体
一个角形成两个环
1
6
金刚石晶胞
在一个晶胞中,碳原子位于立方体的8个顶点、6个面心以及晶胞内部4个。
①金刚石晶胞中C原子配位数为___
4
②金刚石晶胞中含有的C原子数为___
8
8×1/8+ 6×1/2+4=8
③12g 金刚石含有_____个C原子,含有_____ 个C-C键
NA
2NA
配位数:一个C原子周围最邻近的C原子数
金刚石 晶体硅 SiC GaAs
金刚石模型的演变 —— 等电子体原理
(1)与碳同族单质(如Si、Ge)都具有与金刚石相似的结构;
(2)第ⅣA族相邻元素间也可形成相似结构的晶体(如SiC)
(3)与第ⅣA族同周期的元素间根据等电子体原理,
如BN、GaAs等也可形成与金刚石结构相似的晶体。
SiO2是自然界含量最高的二元氧化物,熔点1713 ℃,有多种结构 ,最常见的是低温石英。遍布河岸的黄沙、带状的石英矿脉、花岗石里的白色晶体以及透明的水晶都低温石英。
黄沙
花岗岩
石英矿
水晶
①SiO2在自然界分布:
(2)二氧化硅晶体
②低温石英的结构
其结构中有顶角相连的硅氧四面体形成螺旋上升的长链,而没有封闭的环状结构。这一结构决定了它具有手性,被广泛用作压电材料,如石英手表。
石英晶体中
硅氧四面体相连构成的螺旋链
石英的
左、右型晶体
SiO2用途:制造水泥、玻璃、人造红宝石、单晶硅、硅光电池、芯片和光导纤维的原料
【典例】在硅酸盐中,SiO44-四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为 ,Si与O的原子数之比为 ,化学式为 。
sp3 1:3
SiO32-
晶体硅的结构
晶体硅的晶胞中,在Si-Si键之间插入O原子,即得到方石英的晶胞(最常见的SiO2晶胞)。
二氧化硅晶胞
二氧化硅的结构
①二氧化硅晶胞中含有的Si原子数为___,O原子数为___。
8
16
②1molSiO2晶体中含_____molSi-O键。
4
Ⅰ、晶体中1个Si与__个O以共价键结合,形成________结构;1个O与__个Si结合,每个正四面体占有___个Si,__个O。故SiO2晶体中Si与O之比为______。
Ⅱ、最小环上有___个原子(__个Si和__个O)。
每个Si被___个最小环共用,每个Si—O—Si键被___个最小环共用,每个最小的环实际拥有的硅原子为___________,氧原子数为___________。
4
正四面体
1
2
1 : 2
12
6
6
109 28
2
6×1/12=1/2
③常见的二氧化硅的晶体结构
12
6
6×1/6=1
小结:常见共价晶体的结构
物质 金刚石 二氧化硅
晶体 结构
结构 特点 ①碳原子采取sp3杂化,每个碳原子以4个共价单键对称地与相邻的4个碳原子相结合,形成正四面体结构。 ②晶体中C—C—C夹角为109°28′。 ③最小环上有6个碳原子。 ④1mol晶体中有2molC—C键。 ⑤1个晶胞中有8个碳原子。 ①每个硅原子均以4个共价键对称地与相邻的4个氧原子相结合,每个氧原子与2个硅原子相结合,向空间扩展,形成三维骨架结构。
②硅、氧原子个数比为1∶2。
③最小的环上有6个硅原子和6个氧原子。
④1molSiO2中有4molSi—O键。
科学 技术 社会——金刚石
1、天然金刚石
2、人工合成金刚石
以石墨为原料高压合成金刚石
以甲烷、氢气为原料低温低压合成金刚石
天然金刚石形成条件:高温高压
空间结构俯视图
石墨中C原子以____杂化;石墨晶体中最小环为___元环;最小环中___个原子共平面,平均含有___个C原子,___个C-C键 ;12g石墨含有____molC-C 。
sp2 6
6 2 3
1.5
5、石墨及其结构
(1)依据构成晶体的微粒和微粒间的作用力判断。
构成共价晶体的微粒是原子,微粒间的作用力是共价键;构成分子晶体的微粒是分子或原子(稀有气体),微粒间作用力是分子间作用力。
(2)依据晶体的熔点判断。
共价晶体的熔点高,常在1 000 ℃以上;而分子晶体熔点低,常在数百摄氏度以下甚至更低。
(3)还可以依据晶体的硬度与机械性能判断。
共价晶体硬度大,分子晶体硬度小且较脆。
小结:分子晶体和共价晶体的判断方法
(4)依据导电性判断。
分子晶体为非导体,但部分溶于水后能导电;原子晶体多数为非导体,但晶体硅、锗是半导体。
(5)依据物质的分类判断
常见的共价晶体单质有金刚石、晶体硅、晶体硼等,常见的共价晶体化合物有SiC、BN、AlN、Si3N4、C3N4、SiO2等;
大多数非金属单质(除金刚石、石墨、晶体硅、晶体硼外)、气态氢化物、非金属氧化物(除SiO2外)、酸、绝大多数有机物(除有机盐外)都是分子晶体。
(6)依据物质的状态判断
一般常温常压下,呈气态或液态的单质与化合物,在固态时属于分子晶体。
二氧化硅为共价晶体,晶体中不存在单个分子,其化学式为Si与O的最简个数比,不是分子式。
D
Si O
1:2
共价晶体与分子晶体的比较
分子 原子
共价键 分子间作用力
①构成微粒不同,共价晶体中只存在原子,没有分子。②微粒间作用力不同,共价晶体中原子间只存在共价键,而分子晶体中分子之间存在分子间作用力。
C
组成和结构相似的分子晶体,相对分子质量越大,熔点越高
共价晶体,原子半径:r(C)
NH3分子间存在氢键
白磷和冰都是分子晶体,二氧化硅是共价晶体
晶体硼的熔、沸点以及硬度都介于晶体硅和金刚石之间,而金刚石和晶体硅均为共价晶体,在元素周期表中B与C相邻、与Si处于对角线位置,则晶体硼也属于共价晶体。
共价 晶体硼的熔、沸点高,硬度大
共价 晶体硼的熔、沸点高,硬度大
12
60° 30
认识典型共价晶体的结构
不能。因为共价晶体是一个三维骨架结构,无小分子存在。
SiO2晶体中最小环上有12个原子。1 mol SiO2中含有4 mol Si—O。
D
共价晶体
12
4
正四面体形
随堂评估自测
B
D
半径C>N,则键长C—N<C—C,故C—N键比C—C键更牢固
金刚石:非极性共价键,C3N4晶体:极性共价键
B
金刚石的晶体结构
分子
SiC
共价晶体 共价
一种结晶形碳,有天然出产的矿物。铁黑色至深钢灰色。质软具滑腻感,可沾污手指成灰黑色。有金属光泽。六方晶系,成叶片状、鳞片状和致密块状。密度2.25g/cm3,化学性质不活泼。具有耐腐蚀性,在空气或氧气中强热可以燃烧生成二氧化碳。石墨可用作润滑剂,并用于制造坩锅、电极、铅笔芯等。
5、石墨及其结构
石墨为层状结构,各层之间是范德华力结合,容易滑动,所以石墨很软。
石墨中C原子sp2杂化,金刚石中C原子sp3杂化,sp2杂化中,s轨道的成分比sp3杂化更多,所以形成的共价键更短,更牢固,即石墨的层内共价键键长比金刚石的的键长短,作用力更大,破坏化学键需要更大能量。石墨各层均为平面网状结构,碳原子之间存在很强的共价键(大π键),故熔沸点很高。
(混合型晶体)
