化学人教版(2019)选择性必修2 3.4.1配合物与超分子 课件(共54张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.4.1配合物与超分子 课件(共54张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 11.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-15 22:22:39 | ||
图片预览







文档简介
(共54张PPT)
第四节 配合物与超分子
配合物与超分子
第三章 晶体结构与性质
学习任务
学习目标 1min
自学指导 5min
阅读课本第81-84页,完成课堂导学案
√
√
√
√
自学检测 3min
D
无水CuSO4固体是白色的,但CuSO4·5H2O晶体却是蓝色的,为什么呢?
CuSO4 CuSO4·5H2O
【思考】
教师点拨 25min
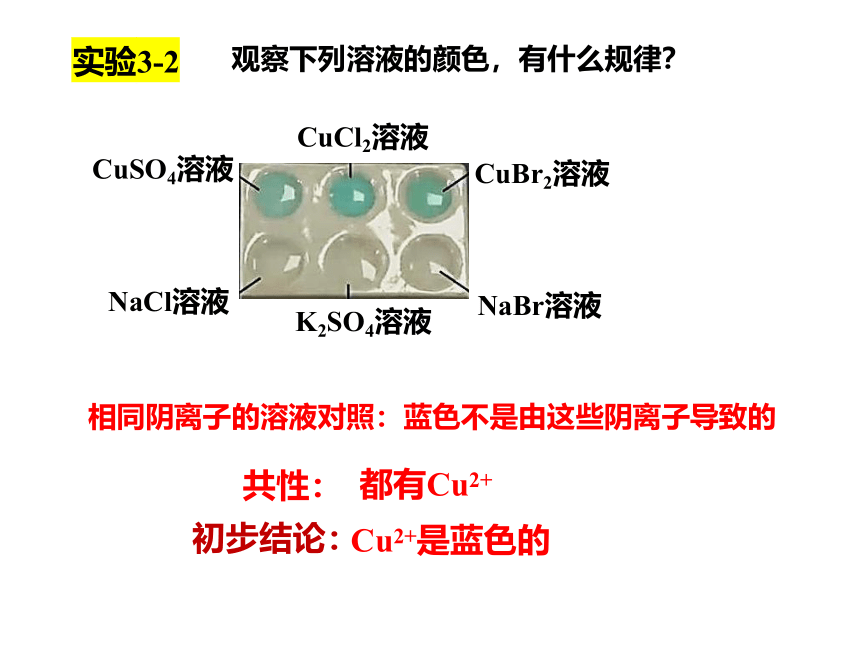
观察下列溶液的颜色,有什么规律?
CuSO4溶液
CuCl2溶液
CuBr2溶液
K2SO4溶液
NaCl溶液
NaBr溶液
相同阴离子的溶液对照:蓝色不是由这些阴离子导致的
共性:
初步结论:
实验3-2
都有Cu2+
Cu2+是蓝色的
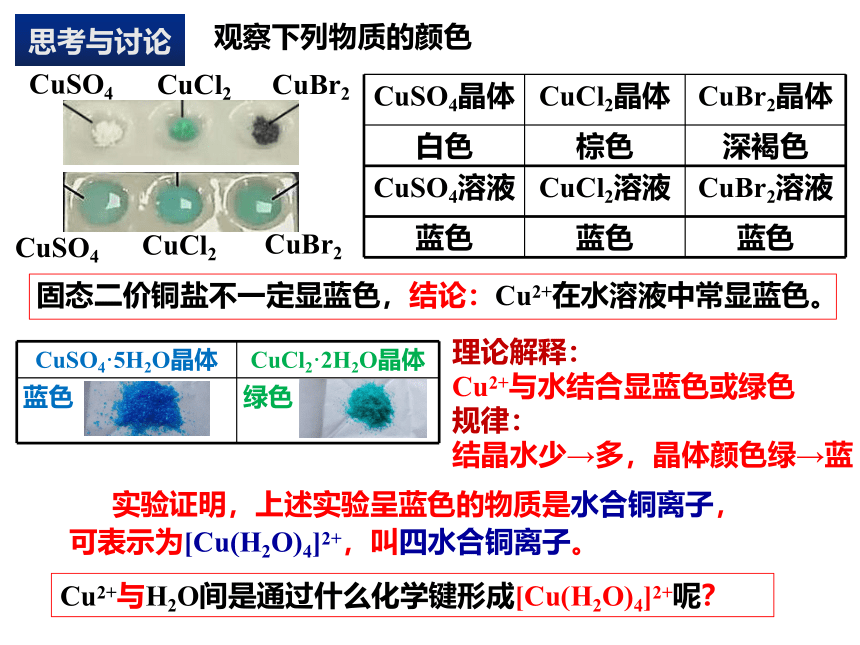
观察下列物质的颜色
CuSO4晶体 CuCl2晶体 CuBr2晶体
白色 棕色 深褐色
CuSO4溶液 CuCl2溶液 CuBr2溶液
蓝色 蓝色 蓝色
固态二价铜盐不一定显蓝色,结论:Cu2+在水溶液中常显蓝色。
CuSO4
CuCl2
CuBr2
CuSO4
CuCl2
CuBr2
理论解释:
Cu2+与水结合显蓝色或绿色
规律:
结晶水少→多,晶体颜色绿→蓝
Cu2+与H2O间是通过什么化学键形成[Cu(H2O)4]2+呢?
实验证明,上述实验呈蓝色的物质是水合铜离子,可表示为[Cu(H2O)4]2+,叫四水合铜离子。
CuSO4·5H2O晶体 CuCl2·2H2O晶体
蓝色 绿色
思考与讨论
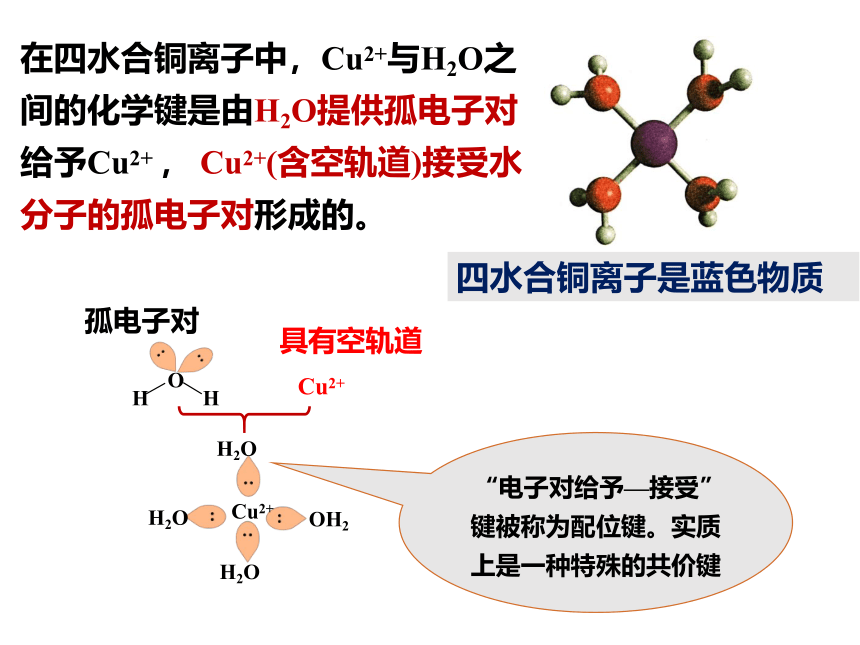
在四水合铜离子中,Cu2+与H2O之间的化学键是由H2O提供孤电子对给予Cu2+ , Cu2+(含空轨道)接受水分子的孤电子对形成的。
O
H
H
孤电子对
Cu2+
具有空轨道
Cu2+
H2O
H2O
H2O
OH2
“电子对给予—接受”键被称为配位键。实质上是一种特殊的共价键
四水合铜离子是蓝色物质
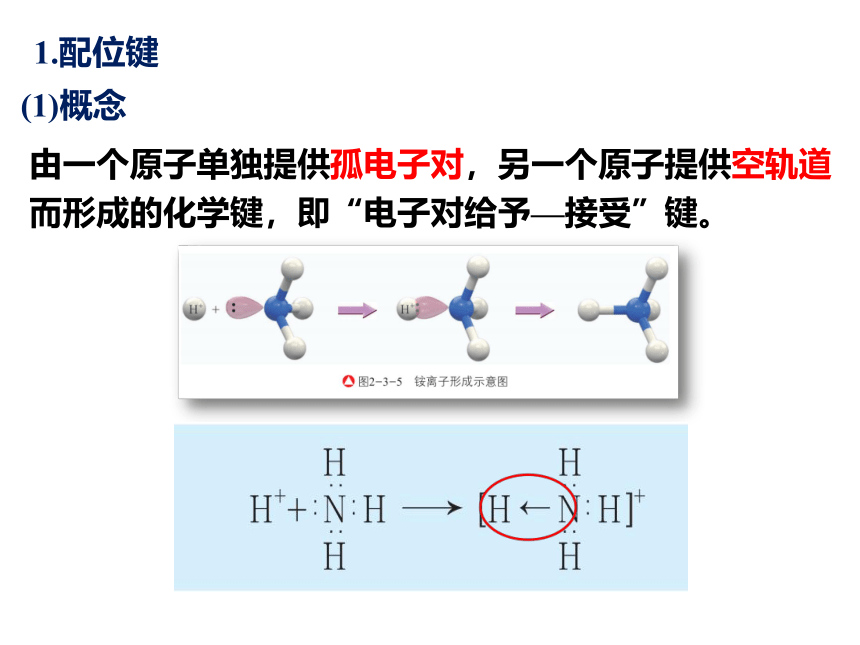
1.配位键
(1)概念
由一个原子单独提供孤电子对,另一个原子提供空轨道而形成的化学键,即“电子对给予—接受”键。
(2)形成条件
③配位键同样具有饱和性和方向性。一般来说,多数过渡金属元素的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。
①成键原子一方能提供孤电子对(如分子有NH3、H2O、HF、CO等;离子有Cl-、OH-、CN-、SCN-等);
②成键原子另一方能提供空轨道(如H+、Al3+、B及过渡金属的原子或离子,如Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、Co3+、Cr3+等)
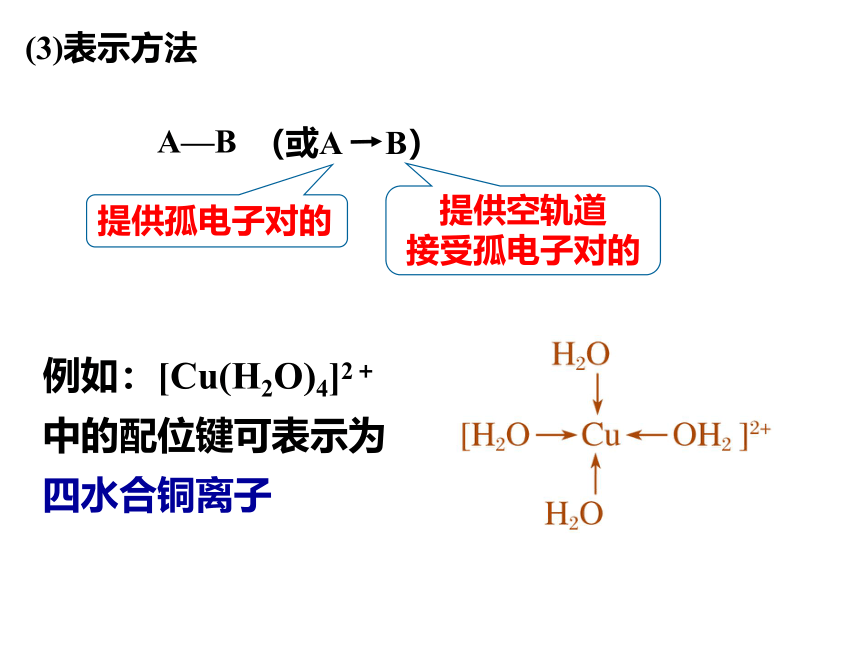
(3)表示方法
A—B
提供孤电子对的
提供空轨道
接受孤电子对的
(或A B)
例如:[Cu(H2O)4]2+中的配位键可表示为四水合铜离子
2. 配合物
(1)概念
通常把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物称为配位化合物,简称配合物。如[Cu(NH3)4]SO4、[Ag(NH3)2]OH等均为配合物。
[Cu(NH3)4 ]SO4
配离子(内界)
离子(外界)
中
心
离
子
配
体
配
位
数
(2)组成:一般是由内界和外界构成,内界由中心离子
(或原子)、配体构成。
中心原子:提供空轨道接受孤电子对的原子。中心原子一般都是带正电荷的阳离子(此时又叫中心离子),最常见的有过渡金属离子:Fe3+、Ag+、Cu2+、Zn2+等。
配体:提供孤电子对的阴离子或分子,如Cl-、NH3、H2O等。配体中直接同中心原子配位的原子叫做配位原子。配位原子必须是含有孤电子对的原子,如NH3中的N,H2O中的O等。
配位数:直接与中心原子形成的配位键的数目。如[Fe(CN)6]4-中Fe2+的配位数为6。
配合物 内界 外界 中心粒子 配体 配位数
[Ag(NH3)2]OH 氢氧化二氨合银
K3[Fe(CN)6] 六氰合铁酸钾
[Co(NH3)5Cl]Cl2
Ni(CO)4 四羰基镍
请根据给出的配合物完成下表
[Ag(NH3)2]+
OH-
Ag+
NH3
2
[Fe(CN)6]3-
K+
Fe3+
CN-
6
[Co(NH3)5Cl]2+
Cl-
Co3+
NH3、Cl-
6
Ni(CO)4
无
Ni
CO
4
氨水
氨水
产生蓝色沉淀
Cu2++2NH3·H2O===Cu(OH)2↓+2
氨水过量后沉淀逐渐溶解,得到深蓝色的透明溶液
Cu(OH)2+4NH3===[Cu(NH3)4]2++2OH-
Cu(OH)2(s) Cu2+(aq) + 2OH-(aq)
+
4NH3
[Cu(NH3)4]2+
=
3. 配合物的的相关实验
[Cu(H2O)4]2+
[Cu(NH3)4]2+
Cu(OH)2
配位键的强度有大有小,有的配合物较稳定,有的配合物较不稳定。通常情况,较稳定的配合物可以转化为稳定性更强的配合物。
析出深蓝色的晶体
溶剂极性:乙醇 < 水
[Cu(NH3)4]SO4·H2O在乙醇中的溶解度小
铜氨配合物
氨水
氨水
95% 乙醇
[Cu(NH3)4]2+++H2O ===[Cu(NH3)4]SO4·H2O↓
乙醇
KSCN 溶液
溶液变为红色
Fe3++3SCN-Fe(SCN)3
利用硫氰化铁配离子的颜色,可鉴定溶液中存在Fe3+;又由于该离子的颜色极似血液,常被用于电影特技和魔术表演。
少量
AgNO3 溶液
氨水
出现白色沉淀
Ag++Cl-=AgCl↓
沉淀溶解,溶液呈无色
AgCl+2NH3==[Ag(NH3)2]++Cl-
AgCl(s) Ag+(aq) + Cl-(aq)
+
2NH3
[Ag(NH3)2]+
=
NaCl溶液
Ag
NH3
H3N
+
电解氧化铝的助熔剂 Na3[AlF6]
热水瓶胆镀银(银镜反应)
[Ag(NH3)2]OH
(1)在生产、生活中的应用
4. 配合物的应用
叶绿素
(2)生命体中的应用
血红蛋白
维生素B12
(3)在医药中的应用
第二代铂类抗癌药(碳铂)
电负性:F>H,使得NF3提供孤电子对的能力小于NH3。
思考(1)人体内血红蛋白是Fe2+卟啉配合物,Fe2+与O2结合形成配合物,而CO与血红蛋白中的Fe2+也能形成配合物。根据生活常识,比较其配合物的稳定性。
血红蛋白中Fe2+与CO形成的配合物更稳定。
(2)[Cu(NH3)4]2+与[Cu(H2O)4]2+哪个配位离子更稳定?原因是什么?
[Cu(NH3)4]2+更稳定。因为N和O都有孤电子对,但O的电负性大,吸引孤电子对的能力强,故NH3提供孤电子对的能力比H2O大。
(3)NH3与Cu2+形成配合物,但NF3很难与Cu2+形成配合物,原因是什么?
归纳总结
(1)配合物的稳定性
配合物具有一定的稳定性。配合物中的配位键越强,配合物越稳定。当作为中心原子(或离子)的金属原子(或离子)相同时,配合物的稳定性与配体的性质有关。
(2)配位键的稳定性
①电子对给予体形成配位键的能力:NH3>H2O。
②接受体形成配位键的能力:H+>过渡金属>主族金属。
Cu(NH3)4 Cu(H2O)4 Fe(SCN)2+
(1)下列物质中,不能作为配合物的配体的是( )。
A.NH3 B.NH4 C.H2O D.SCN-
+
2+
2+
B
(2)能区别[Co(NH3)4Cl2]Cl和[Co(NH3)4Cl2]NO3两种溶液的试剂是( )。
A.AgNO3溶液 B.NaOH溶液 C.CCl4 D.浓氨水
A
H:N:H
H
:
:
H:O:H
:
:
H:N:H
H
:
:
H
:S::C::N:
:
:
-
+
超分子
1. 定义
超分子有的是有限的,有的是无限伸展的
是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。
分子是广义的,包括离子。
主要是静电作用、范德华力和氢键等
①DNA碱基配对
双螺旋DNA的两条分子链是通过什么结合的?
2. 重要特征及其应用
特征一:分子识别
常见的DNA碱基配对结构
A T
G C
DNA碱基对是通过氢键相互识别并结合的
错开后空间结构不匹配,不能形成稳定结构
通过氢键给体和受体的结合关系来实现分子识别的。
超分子是由两种或两种以上的分子(或离子)通过分子间相互作用形成的分子聚集体
氢键
C60
C70
②分离 C60 和 C70
特征一:分子识别
杯酚与C60通过范德华力相结合,通过尺寸匹配实现分子识别
O
O
O
O
O
O
O
O
O
15-冠-5 填充模型
15-冠-5 键线式
12-冠-4 球棍模型
14-冠-4 键线式
冠醚是皇冠状的分子,可有不同大小的空穴适配不同大小的碱金属离子
③冠醚识别碱金属阳离子
特征一:分子识别
冠醚 冠醚空腔直径/pm 合适的粒子(直径/pm)
12-冠-4 120~150 Li+(152) 15-冠-5 170~220 Na+(204) 18-冠-6 260~320 K+(276) Rb+(304) 21-冠-7 340~430 Cs+(334) 表3-6 冠醚识别钾离子
18-冠-6–K+超分子
冠醚与金属阳离子通过配位作用相结合,
不同大小的冠醚可以识别不同大小的碱金属离子。
冠醚环的大小与金属离子匹配,才能识别
冠醚能与阳离子尤其是碱金属阳离子作用,并且随环的大小不同而与不同的金属离子作用,将阳离子以及对应的阴离子都带入有机溶剂,因而成为有机反应中很好的催化剂。
超分子应用举例:相转移催化剂
高锰酸钾溶液可以氧化甲苯,从而褪色。
但是高锰酸钾溶解在水中,难溶于甲苯,难以和甲苯充分接触;将甲苯和18-冠-6混合后与高锰酸钾水溶液反应,可以加快反应速率。
超分子组装的过程称为分子自组装,自组装过程是使超分子产生高度有序的过程。
特征二:自组装
表面活性剂:从分子结构上说,也可以叫“两亲分子”,一端为亲水基团,另一端为疏水基团。
硬脂酸根(传统肥皂的有效成分之一)
十二烷基苯磺酸根
(合成洗涤剂中常用的表面活性剂)
低浓度时,优先在溶液表面形成单分子层,降低表面张力。
高浓度时,剩余的表面活性剂在溶液中形成胶束。
超分子有序体
烷基磺酸根离子
在水中自组装为胶束
纯水 洗涤灵 胶束
自组装
细胞和细胞器的
双分子膜的自组装
极性基团(亲水)
非极性基团(疏水)
极性基团
人体细胞和细胞器的膜是双分子膜,双分子膜是由大量两性分子(一端有极性、另一端无极性)组装而成的。
为什么双分子膜以头向外而尾向内的方式排列?
这是由于细胞膜的两侧都是水溶液,水是极性分子,而构成膜的两性分子的头基是极性基团而尾基是非极性基团。
超分子技术在催化、分析、药物合成、染料合成等领域都有应用。
已报道的超分子大环主体有:DNA,冠醚,环糊精,杯芳烃,杯吡咯,杯咔唑,瓜环胡葫芦脲,柱芳烃等。
超分子成果:
认识配位键及配位化合物
Cu2++ 4H2O=[Cu(H2O)4]2+
×
sp3杂化 2σ+2孤→3σ+1孤
V形→三角锥形
键角变大
H3O+兼有水和氢离子的性质
C
说明Cl-、NH3均处于内界
故该配合物中心原子Pt的配位数为6,电荷数为4,Cl-和NH3分子均与Pt4+配位。
八面体形
BD
凡能给出H+的物质中一般含有配位键
+H2―→C2H5OC2H5+H2O
随堂评估自测
D
D
CO CN-
Ag+、H+、Co3+能提供空轨道,NH3、H2O、CO能提供孤电子对
C
D
不存在配位键,复盐
分子以非共价键或仅以分子间作用力形成超分子
一方能够提供孤电子对,另一方具有能够接受孤电子对的空轨道
N
B
硫氰酸络铵
六氰合铁酸钾
氟硼酸钾
NO3- NO2-
3σ 2σ+1孤
3σ
C
ABC
第四节 配合物与超分子
配合物与超分子
第三章 晶体结构与性质
学习任务
学习目标 1min
自学指导 5min
阅读课本第81-84页,完成课堂导学案
√
√
√
√
自学检测 3min
D
无水CuSO4固体是白色的,但CuSO4·5H2O晶体却是蓝色的,为什么呢?
CuSO4 CuSO4·5H2O
【思考】
教师点拨 25min
观察下列溶液的颜色,有什么规律?
CuSO4溶液
CuCl2溶液
CuBr2溶液
K2SO4溶液
NaCl溶液
NaBr溶液
相同阴离子的溶液对照:蓝色不是由这些阴离子导致的
共性:
初步结论:
实验3-2
都有Cu2+
Cu2+是蓝色的
观察下列物质的颜色
CuSO4晶体 CuCl2晶体 CuBr2晶体
白色 棕色 深褐色
CuSO4溶液 CuCl2溶液 CuBr2溶液
蓝色 蓝色 蓝色
固态二价铜盐不一定显蓝色,结论:Cu2+在水溶液中常显蓝色。
CuSO4
CuCl2
CuBr2
CuSO4
CuCl2
CuBr2
理论解释:
Cu2+与水结合显蓝色或绿色
规律:
结晶水少→多,晶体颜色绿→蓝
Cu2+与H2O间是通过什么化学键形成[Cu(H2O)4]2+呢?
实验证明,上述实验呈蓝色的物质是水合铜离子,可表示为[Cu(H2O)4]2+,叫四水合铜离子。
CuSO4·5H2O晶体 CuCl2·2H2O晶体
蓝色 绿色
思考与讨论
在四水合铜离子中,Cu2+与H2O之间的化学键是由H2O提供孤电子对给予Cu2+ , Cu2+(含空轨道)接受水分子的孤电子对形成的。
O
H
H
孤电子对
Cu2+
具有空轨道
Cu2+
H2O
H2O
H2O
OH2
“电子对给予—接受”键被称为配位键。实质上是一种特殊的共价键
四水合铜离子是蓝色物质
1.配位键
(1)概念
由一个原子单独提供孤电子对,另一个原子提供空轨道而形成的化学键,即“电子对给予—接受”键。
(2)形成条件
③配位键同样具有饱和性和方向性。一般来说,多数过渡金属元素的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。
①成键原子一方能提供孤电子对(如分子有NH3、H2O、HF、CO等;离子有Cl-、OH-、CN-、SCN-等);
②成键原子另一方能提供空轨道(如H+、Al3+、B及过渡金属的原子或离子,如Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、Co3+、Cr3+等)
(3)表示方法
A—B
提供孤电子对的
提供空轨道
接受孤电子对的
(或A B)
例如:[Cu(H2O)4]2+中的配位键可表示为四水合铜离子
2. 配合物
(1)概念
通常把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物称为配位化合物,简称配合物。如[Cu(NH3)4]SO4、[Ag(NH3)2]OH等均为配合物。
[Cu(NH3)4 ]SO4
配离子(内界)
离子(外界)
中
心
离
子
配
体
配
位
数
(2)组成:一般是由内界和外界构成,内界由中心离子
(或原子)、配体构成。
中心原子:提供空轨道接受孤电子对的原子。中心原子一般都是带正电荷的阳离子(此时又叫中心离子),最常见的有过渡金属离子:Fe3+、Ag+、Cu2+、Zn2+等。
配体:提供孤电子对的阴离子或分子,如Cl-、NH3、H2O等。配体中直接同中心原子配位的原子叫做配位原子。配位原子必须是含有孤电子对的原子,如NH3中的N,H2O中的O等。
配位数:直接与中心原子形成的配位键的数目。如[Fe(CN)6]4-中Fe2+的配位数为6。
配合物 内界 外界 中心粒子 配体 配位数
[Ag(NH3)2]OH 氢氧化二氨合银
K3[Fe(CN)6] 六氰合铁酸钾
[Co(NH3)5Cl]Cl2
Ni(CO)4 四羰基镍
请根据给出的配合物完成下表
[Ag(NH3)2]+
OH-
Ag+
NH3
2
[Fe(CN)6]3-
K+
Fe3+
CN-
6
[Co(NH3)5Cl]2+
Cl-
Co3+
NH3、Cl-
6
Ni(CO)4
无
Ni
CO
4
氨水
氨水
产生蓝色沉淀
Cu2++2NH3·H2O===Cu(OH)2↓+2
氨水过量后沉淀逐渐溶解,得到深蓝色的透明溶液
Cu(OH)2+4NH3===[Cu(NH3)4]2++2OH-
Cu(OH)2(s) Cu2+(aq) + 2OH-(aq)
+
4NH3
[Cu(NH3)4]2+
=
3. 配合物的的相关实验
[Cu(H2O)4]2+
[Cu(NH3)4]2+
Cu(OH)2
配位键的强度有大有小,有的配合物较稳定,有的配合物较不稳定。通常情况,较稳定的配合物可以转化为稳定性更强的配合物。
析出深蓝色的晶体
溶剂极性:乙醇 < 水
[Cu(NH3)4]SO4·H2O在乙醇中的溶解度小
铜氨配合物
氨水
氨水
95% 乙醇
[Cu(NH3)4]2+++H2O ===[Cu(NH3)4]SO4·H2O↓
乙醇
KSCN 溶液
溶液变为红色
Fe3++3SCN-Fe(SCN)3
利用硫氰化铁配离子的颜色,可鉴定溶液中存在Fe3+;又由于该离子的颜色极似血液,常被用于电影特技和魔术表演。
少量
AgNO3 溶液
氨水
出现白色沉淀
Ag++Cl-=AgCl↓
沉淀溶解,溶液呈无色
AgCl+2NH3==[Ag(NH3)2]++Cl-
AgCl(s) Ag+(aq) + Cl-(aq)
+
2NH3
[Ag(NH3)2]+
=
NaCl溶液
Ag
NH3
H3N
+
电解氧化铝的助熔剂 Na3[AlF6]
热水瓶胆镀银(银镜反应)
[Ag(NH3)2]OH
(1)在生产、生活中的应用
4. 配合物的应用
叶绿素
(2)生命体中的应用
血红蛋白
维生素B12
(3)在医药中的应用
第二代铂类抗癌药(碳铂)
电负性:F>H,使得NF3提供孤电子对的能力小于NH3。
思考(1)人体内血红蛋白是Fe2+卟啉配合物,Fe2+与O2结合形成配合物,而CO与血红蛋白中的Fe2+也能形成配合物。根据生活常识,比较其配合物的稳定性。
血红蛋白中Fe2+与CO形成的配合物更稳定。
(2)[Cu(NH3)4]2+与[Cu(H2O)4]2+哪个配位离子更稳定?原因是什么?
[Cu(NH3)4]2+更稳定。因为N和O都有孤电子对,但O的电负性大,吸引孤电子对的能力强,故NH3提供孤电子对的能力比H2O大。
(3)NH3与Cu2+形成配合物,但NF3很难与Cu2+形成配合物,原因是什么?
归纳总结
(1)配合物的稳定性
配合物具有一定的稳定性。配合物中的配位键越强,配合物越稳定。当作为中心原子(或离子)的金属原子(或离子)相同时,配合物的稳定性与配体的性质有关。
(2)配位键的稳定性
①电子对给予体形成配位键的能力:NH3>H2O。
②接受体形成配位键的能力:H+>过渡金属>主族金属。
Cu(NH3)4 Cu(H2O)4 Fe(SCN)2+
(1)下列物质中,不能作为配合物的配体的是( )。
A.NH3 B.NH4 C.H2O D.SCN-
+
2+
2+
B
(2)能区别[Co(NH3)4Cl2]Cl和[Co(NH3)4Cl2]NO3两种溶液的试剂是( )。
A.AgNO3溶液 B.NaOH溶液 C.CCl4 D.浓氨水
A
H:N:H
H
:
:
H:O:H
:
:
H:N:H
H
:
:
H
:S::C::N:
:
:
-
+
超分子
1. 定义
超分子有的是有限的,有的是无限伸展的
是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。
分子是广义的,包括离子。
主要是静电作用、范德华力和氢键等
①DNA碱基配对
双螺旋DNA的两条分子链是通过什么结合的?
2. 重要特征及其应用
特征一:分子识别
常见的DNA碱基配对结构
A T
G C
DNA碱基对是通过氢键相互识别并结合的
错开后空间结构不匹配,不能形成稳定结构
通过氢键给体和受体的结合关系来实现分子识别的。
超分子是由两种或两种以上的分子(或离子)通过分子间相互作用形成的分子聚集体
氢键
C60
C70
②分离 C60 和 C70
特征一:分子识别
杯酚与C60通过范德华力相结合,通过尺寸匹配实现分子识别
O
O
O
O
O
O
O
O
O
15-冠-5 填充模型
15-冠-5 键线式
12-冠-4 球棍模型
14-冠-4 键线式
冠醚是皇冠状的分子,可有不同大小的空穴适配不同大小的碱金属离子
③冠醚识别碱金属阳离子
特征一:分子识别
冠醚 冠醚空腔直径/pm 合适的粒子(直径/pm)
12-冠-4 120~150 Li+(152) 15-冠-5 170~220 Na+(204) 18-冠-6 260~320 K+(276) Rb+(304) 21-冠-7 340~430 Cs+(334) 表3-6 冠醚识别钾离子
18-冠-6–K+超分子
冠醚与金属阳离子通过配位作用相结合,
不同大小的冠醚可以识别不同大小的碱金属离子。
冠醚环的大小与金属离子匹配,才能识别
冠醚能与阳离子尤其是碱金属阳离子作用,并且随环的大小不同而与不同的金属离子作用,将阳离子以及对应的阴离子都带入有机溶剂,因而成为有机反应中很好的催化剂。
超分子应用举例:相转移催化剂
高锰酸钾溶液可以氧化甲苯,从而褪色。
但是高锰酸钾溶解在水中,难溶于甲苯,难以和甲苯充分接触;将甲苯和18-冠-6混合后与高锰酸钾水溶液反应,可以加快反应速率。
超分子组装的过程称为分子自组装,自组装过程是使超分子产生高度有序的过程。
特征二:自组装
表面活性剂:从分子结构上说,也可以叫“两亲分子”,一端为亲水基团,另一端为疏水基团。
硬脂酸根(传统肥皂的有效成分之一)
十二烷基苯磺酸根
(合成洗涤剂中常用的表面活性剂)
低浓度时,优先在溶液表面形成单分子层,降低表面张力。
高浓度时,剩余的表面活性剂在溶液中形成胶束。
超分子有序体
烷基磺酸根离子
在水中自组装为胶束
纯水 洗涤灵 胶束
自组装
细胞和细胞器的
双分子膜的自组装
极性基团(亲水)
非极性基团(疏水)
极性基团
人体细胞和细胞器的膜是双分子膜,双分子膜是由大量两性分子(一端有极性、另一端无极性)组装而成的。
为什么双分子膜以头向外而尾向内的方式排列?
这是由于细胞膜的两侧都是水溶液,水是极性分子,而构成膜的两性分子的头基是极性基团而尾基是非极性基团。
超分子技术在催化、分析、药物合成、染料合成等领域都有应用。
已报道的超分子大环主体有:DNA,冠醚,环糊精,杯芳烃,杯吡咯,杯咔唑,瓜环胡葫芦脲,柱芳烃等。
超分子成果:
认识配位键及配位化合物
Cu2++ 4H2O=[Cu(H2O)4]2+
×
sp3杂化 2σ+2孤→3σ+1孤
V形→三角锥形
键角变大
H3O+兼有水和氢离子的性质
C
说明Cl-、NH3均处于内界
故该配合物中心原子Pt的配位数为6,电荷数为4,Cl-和NH3分子均与Pt4+配位。
八面体形
BD
凡能给出H+的物质中一般含有配位键
+H2―→C2H5OC2H5+H2O
随堂评估自测
D
D
CO CN-
Ag+、H+、Co3+能提供空轨道,NH3、H2O、CO能提供孤电子对
C
D
不存在配位键,复盐
分子以非共价键或仅以分子间作用力形成超分子
一方能够提供孤电子对,另一方具有能够接受孤电子对的空轨道
N
B
硫氰酸络铵
六氰合铁酸钾
氟硼酸钾
NO3- NO2-
3σ 2σ+1孤
3σ
C
ABC
