2024年高三化学一轮专题复习 寻踪觅迹,多维度探究 SO2的性质与应用(共23张PPT)
文档属性
| 名称 | 2024年高三化学一轮专题复习 寻踪觅迹,多维度探究 SO2的性质与应用(共23张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 14.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-16 10:17:09 | ||
图片预览







文档简介
(共23张PPT)
寻踪觅迹,多维度探究 SO2的性质与应用
——依托元素化学,运用科学探究,提升化学素养
【学习目标】
1. 以硫元素“物质家族”重要成员——二氧化硫为依托,进一步认识和掌握从“价类二维图”、“化学学科的任务与特征”等维度构建元素化合物知识体系的认知模型;
2. 通过对二氧化硫性质及其实际应用的多维度探究,将元素化合物知识与化学反应原理进行整合及运用,提升获取信息、分析问题和解决问题的能力;
3. 通过理论及实验探索,进一步认识“定性与定量结合”的科学态度,能对食品安全等社会热点问题作出正确的价值判断。
课前学案
构建元素化合物知识复习的模型
一、运用价类二维图对研究的物质“定位”和“定性”
二、运用“微粒观”认识物质的组成与结构,从宏观(辨识)和微观(探析)两个角度认识物质的性质与转化,运用化学符号准确熟练地表征化学转化
三、运用“分类与比较”、“定性与定量”、“变化与平衡”等学科思想认识有关转化
三、运用“分类与比较”、“定性与定量”、“变化与平衡”等学科思想认识有关转化
已知常温下,HClO的电离常数Ka=3.20×10-8,H2CO3的电离常数Ka1=4.30×10-7,Ka2=5.60×10-11,H2SO3的电离常数Ka1=1.54×10-2,Ka2=1.02×10-7。
写出下列转化中的离子方程式:
(1)少量CO2通入NaClO溶液中:
(2)少量CO2通入Ca(ClO)2溶液中出现白色沉淀:
ClO-+CO2+H2O = HClO+HCO3-
Ca2++2ClO-+CO2+H2O =2HClO + CaCO3↓
H2CO3 > HClO> HCO3-
HCO3- < ClO-< CO32-
三、运用“分类与比较”、“定性与定量”、“变化与平衡”等学科思想认识有关转化
已知常温下,HClO的电离常数Ka=3.20×10-8,H2CO3的电离常数Ka1=4.30×10-7,Ka2=5.60×10-11,H2SO3的电离常数Ka1=1.54×10-2,Ka2=1.02×10-7。
写出下列转化中的离子方程式:
(3)少量SO2通入NaClO溶液中:
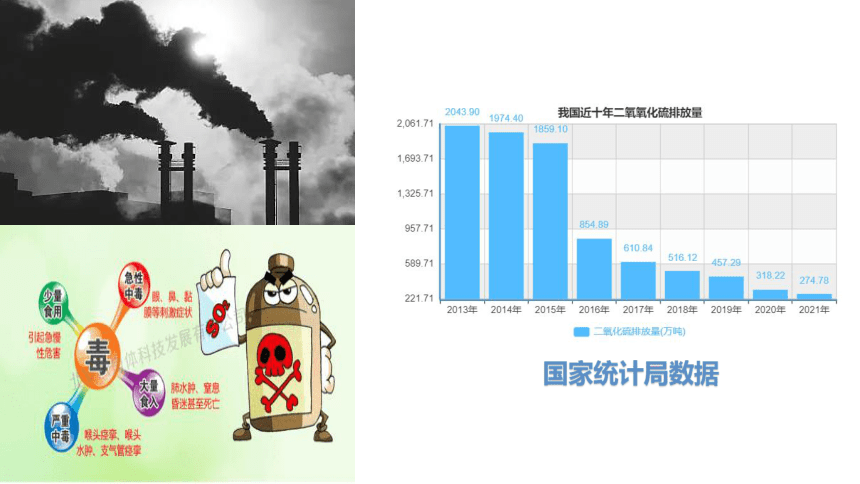
国家统计局数据
任务一、 定性检验二氧化硫
酒瓶里的二氧化硫
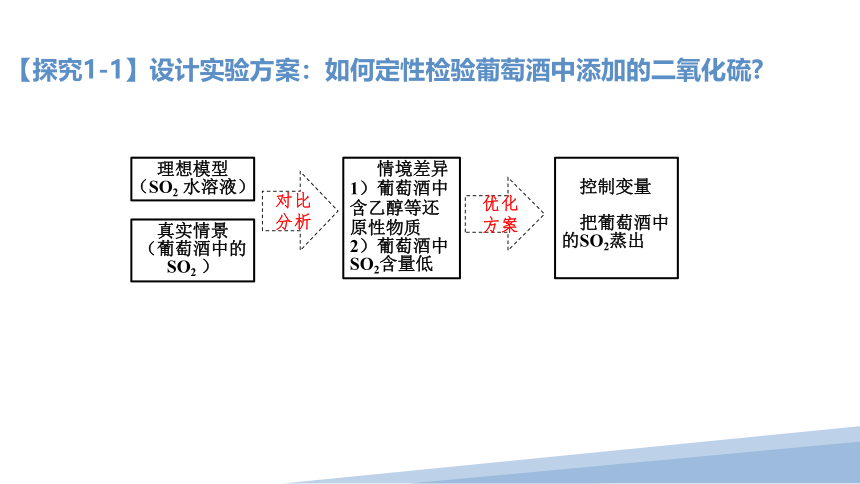
【探究1-1】设计实验方案:如何定性检验葡萄酒中添加的二氧化硫
理想模型
(SO2 水溶液)
真实情景
(葡萄酒中的SO2 )
对比
分析
情境差异
1)葡萄酒中含乙醇等还原性物质
2)葡萄酒中SO2含量低
优化方案
控制变量
把葡萄酒中的SO2蒸出
【探究1-1】设计实验方案:如何定性检验葡萄酒中添加的二氧化硫
化学定性实验方案通常需包含三个要素:
试剂(或仪器)、路径(主要操作过程)、预期实验现象与结论的关系
任务二、定量测定二氧化硫
银耳里的二氧化硫
用抽气泵抽气的目的是什么?
【探究2-1】如何测定银耳中二氧化硫(以亚硫酸盐的形式存在)的残留量
沉淀法,气体法,滴定法,
比色法
定量分析方法:
比色法
(2022·河北卷改编)根据GB2760-2014《食品添加剂使用卫生标准》,每千克银耳中亚硫酸盐的含量最高允许值为0.05g(以SO2计)。某研究小组为了更准确检测银耳中添加剂亚硫酸盐的含量,设计实验如下:
①三颈烧瓶中加入20.00g银耳样品和400mL水;锥形瓶中加入125mL水、1mL淀粉溶液,搅拌。
②以0.2L·min-1流速通氮气,再加入过量稀硫酸,加热并保持微沸,同时用碘标准溶液滴定,至终点时滴定消耗了1.00mL碘标准溶液。
(1)若先加硫酸再通氮气,会使测定结果__________(填“偏高”、“偏低”或“无影响”)。
(2)该样品中亚硫酸盐含量为__________(以SO2计,结果保留三位有效数字)。该样品中二氧化硫的残留量是否超标?
√
关系式法:I2~SO2
没有超标
[素材2-2]
【探究2-2】
(3)上述实验过程中,将稀硫酸改作磷酸也能生成SO2,试解释原因。
[已知:Ka1(H2SO3)=1.5×10-2,Ka1(H3PO4)=7.1×10-3]
H3PO4 +HSO3- H2PO4-+ H2SO3
SO2↑
+
H2O
H2SO3> H3PO4
加入H3PO4后,溶液中存在化学平衡H2SO3 SO2+H2O,SO2的溶解度随着温度升高而减小,SO2逸出后,促进了化学平衡H2SO3 SO2+H2O向右移动
【课前学案(4)】将一定量的SO2通入Na2CO3溶液中可发生反应:HSO3- + HCO3-? ?SO32-+H2CO3,
计算常温下该反应的平衡常数K= ________
分析该反应的趋势大小。
HSO3-+HCO3-? ?SO32- + H2CO3
CO2↑
+
H2O
试写出:将SO2通入等物质的量的Na2CO3溶液中
发生的离子反应方程式:
《课前学案》(4)、将一定量的SO2通入Na2CO3溶液中可发生反应:HSO3- + HCO3-? ?SO32-+H2CO3,
计算常温下该反应的平衡常数K= ________
分析该反应的趋势大小。
SO2+H2O+CO32- = HSO3-+HCO3-? ?SO32- + H2CO3
CO2↑
+
H2O
SO2 + CO32-?=?SO32- + CO2
试写出:将SO2通入等物质的量的Na2CO3溶液中
发生的离子反应方程式:
HSO3-+HCO3-? ?SO32- + H2CO3
任务三、探究二氧化硫的应用
烧瓶里的二氧化硫
硫代硫酸钠(Na2S2O3)常用作纸浆漂白的脱氯剂以及感光工业中的定影剂等。实验室可用如下装置(略去部分加持仪器)模拟生成过程。
(1)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 ______。
a. 蒸馏水 b . 饱和Na2SO3溶液
c. 饱和NaHSO3溶液 d . 饱和NaHCO3溶液
C
[素材3-1]
【探究3-1】
(2)补充完整装置C中的方程式(以下三个反应为连续反应)
(I)___________________________________ (体现SO2酸性)
(II)___________________________________ (体现SO2氧化性)
(III)
2H2S +SO2 =3S ↓+2H2O
(3)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为 _______。
2:1
Na 2S +H2O +SO2 =Na2SO3 +H2S
2Na 2S+Na2SO3+3SO2=3Na2S2O3
欲制得较纯净产品,装置C中Na2S和 Na2CO3物质的量之比为______。
2:1
(山东卷)
(浙江卷)
[素材3-2]
【探究3-2】
SO2+Na2CO3= Na2SO3+ CO2
2Na2S+Na2SO3+3SO2=3Na2S2O3
2Na2S+Na2CO3+4SO2=3Na2S2O3+ CO2
收获
奋斗者,正青春!
寻踪觅迹,多维度探究 SO2的性质与应用
——依托元素化学,运用科学探究,提升化学素养
【学习目标】
1. 以硫元素“物质家族”重要成员——二氧化硫为依托,进一步认识和掌握从“价类二维图”、“化学学科的任务与特征”等维度构建元素化合物知识体系的认知模型;
2. 通过对二氧化硫性质及其实际应用的多维度探究,将元素化合物知识与化学反应原理进行整合及运用,提升获取信息、分析问题和解决问题的能力;
3. 通过理论及实验探索,进一步认识“定性与定量结合”的科学态度,能对食品安全等社会热点问题作出正确的价值判断。
课前学案
构建元素化合物知识复习的模型
一、运用价类二维图对研究的物质“定位”和“定性”
二、运用“微粒观”认识物质的组成与结构,从宏观(辨识)和微观(探析)两个角度认识物质的性质与转化,运用化学符号准确熟练地表征化学转化
三、运用“分类与比较”、“定性与定量”、“变化与平衡”等学科思想认识有关转化
三、运用“分类与比较”、“定性与定量”、“变化与平衡”等学科思想认识有关转化
已知常温下,HClO的电离常数Ka=3.20×10-8,H2CO3的电离常数Ka1=4.30×10-7,Ka2=5.60×10-11,H2SO3的电离常数Ka1=1.54×10-2,Ka2=1.02×10-7。
写出下列转化中的离子方程式:
(1)少量CO2通入NaClO溶液中:
(2)少量CO2通入Ca(ClO)2溶液中出现白色沉淀:
ClO-+CO2+H2O = HClO+HCO3-
Ca2++2ClO-+CO2+H2O =2HClO + CaCO3↓
H2CO3 > HClO> HCO3-
HCO3- < ClO-< CO32-
三、运用“分类与比较”、“定性与定量”、“变化与平衡”等学科思想认识有关转化
已知常温下,HClO的电离常数Ka=3.20×10-8,H2CO3的电离常数Ka1=4.30×10-7,Ka2=5.60×10-11,H2SO3的电离常数Ka1=1.54×10-2,Ka2=1.02×10-7。
写出下列转化中的离子方程式:
(3)少量SO2通入NaClO溶液中:
国家统计局数据
任务一、 定性检验二氧化硫
酒瓶里的二氧化硫
【探究1-1】设计实验方案:如何定性检验葡萄酒中添加的二氧化硫
理想模型
(SO2 水溶液)
真实情景
(葡萄酒中的SO2 )
对比
分析
情境差异
1)葡萄酒中含乙醇等还原性物质
2)葡萄酒中SO2含量低
优化方案
控制变量
把葡萄酒中的SO2蒸出
【探究1-1】设计实验方案:如何定性检验葡萄酒中添加的二氧化硫
化学定性实验方案通常需包含三个要素:
试剂(或仪器)、路径(主要操作过程)、预期实验现象与结论的关系
任务二、定量测定二氧化硫
银耳里的二氧化硫
用抽气泵抽气的目的是什么?
【探究2-1】如何测定银耳中二氧化硫(以亚硫酸盐的形式存在)的残留量
沉淀法,气体法,滴定法,
比色法
定量分析方法:
比色法
(2022·河北卷改编)根据GB2760-2014《食品添加剂使用卫生标准》,每千克银耳中亚硫酸盐的含量最高允许值为0.05g(以SO2计)。某研究小组为了更准确检测银耳中添加剂亚硫酸盐的含量,设计实验如下:
①三颈烧瓶中加入20.00g银耳样品和400mL水;锥形瓶中加入125mL水、1mL淀粉溶液,搅拌。
②以0.2L·min-1流速通氮气,再加入过量稀硫酸,加热并保持微沸,同时用碘标准溶液滴定,至终点时滴定消耗了1.00mL碘标准溶液。
(1)若先加硫酸再通氮气,会使测定结果__________(填“偏高”、“偏低”或“无影响”)。
(2)该样品中亚硫酸盐含量为__________(以SO2计,结果保留三位有效数字)。该样品中二氧化硫的残留量是否超标?
√
关系式法:I2~SO2
没有超标
[素材2-2]
【探究2-2】
(3)上述实验过程中,将稀硫酸改作磷酸也能生成SO2,试解释原因。
[已知:Ka1(H2SO3)=1.5×10-2,Ka1(H3PO4)=7.1×10-3]
H3PO4 +HSO3- H2PO4-+ H2SO3
SO2↑
+
H2O
H2SO3> H3PO4
加入H3PO4后,溶液中存在化学平衡H2SO3 SO2+H2O,SO2的溶解度随着温度升高而减小,SO2逸出后,促进了化学平衡H2SO3 SO2+H2O向右移动
【课前学案(4)】将一定量的SO2通入Na2CO3溶液中可发生反应:HSO3- + HCO3-? ?SO32-+H2CO3,
计算常温下该反应的平衡常数K= ________
分析该反应的趋势大小。
HSO3-+HCO3-? ?SO32- + H2CO3
CO2↑
+
H2O
试写出:将SO2通入等物质的量的Na2CO3溶液中
发生的离子反应方程式:
《课前学案》(4)、将一定量的SO2通入Na2CO3溶液中可发生反应:HSO3- + HCO3-? ?SO32-+H2CO3,
计算常温下该反应的平衡常数K= ________
分析该反应的趋势大小。
SO2+H2O+CO32- = HSO3-+HCO3-? ?SO32- + H2CO3
CO2↑
+
H2O
SO2 + CO32-?=?SO32- + CO2
试写出:将SO2通入等物质的量的Na2CO3溶液中
发生的离子反应方程式:
HSO3-+HCO3-? ?SO32- + H2CO3
任务三、探究二氧化硫的应用
烧瓶里的二氧化硫
硫代硫酸钠(Na2S2O3)常用作纸浆漂白的脱氯剂以及感光工业中的定影剂等。实验室可用如下装置(略去部分加持仪器)模拟生成过程。
(1)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 ______。
a. 蒸馏水 b . 饱和Na2SO3溶液
c. 饱和NaHSO3溶液 d . 饱和NaHCO3溶液
C
[素材3-1]
【探究3-1】
(2)补充完整装置C中的方程式(以下三个反应为连续反应)
(I)___________________________________ (体现SO2酸性)
(II)___________________________________ (体现SO2氧化性)
(III)
2H2S +SO2 =3S ↓+2H2O
(3)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为 _______。
2:1
Na 2S +H2O +SO2 =Na2SO3 +H2S
2Na 2S+Na2SO3+3SO2=3Na2S2O3
欲制得较纯净产品,装置C中Na2S和 Na2CO3物质的量之比为______。
2:1
(山东卷)
(浙江卷)
[素材3-2]
【探究3-2】
SO2+Na2CO3= Na2SO3+ CO2
2Na2S+Na2SO3+3SO2=3Na2S2O3
2Na2S+Na2CO3+4SO2=3Na2S2O3+ CO2
收获
奋斗者,正青春!
同课章节目录
