江西省部分高中学校2023-2024学年高二上学期10月联考化学试题(含答案)
文档属性
| 名称 | 江西省部分高中学校2023-2024学年高二上学期10月联考化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 650.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-16 11:27:27 | ||
图片预览



文档简介
江西省部分高中学校2023-2024学年高二上学期10月联考
化学试卷
本试卷满分100分,考试用时75分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.本试卷主要考试内容:人教版选择性必修1第一章至第二章。
5.可能用到的相对原子质量:H1 C12 O16 Na23 S32
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项符合题目要求。
1.人们可通过改变条件来调控化学反应的速率与限度,使其向着对人类更有益的方向发展。下列条件的改变不是从化学反应速率与限度的角度考虑的是( )
A.燃煤中加入 B.制取时使用催化剂
C.汽车排气管中使用三元倠化器 D.橡胶轮胎中加入防老剂
2.化学与生活密切相关。下列说法错误的是( )
A.对铁制品表而进行钝化处理,可延缓腐蚀
B.蛟龙号潜水器的耐压球壳使用的钛合金,抗压强度高
C.耐腐蚀,可用于制作计算机芯片
D.棉花的主要成分-纤维素是一种多糖
3.下列各组物质,不能按a→b→c(“→”表示反应一步完成)关系转化的是( )
选项 a b c
A
B
C
D
4.下列说法中错误的是( )
A.云变成雨的过程中,减小
B.吸热反应在一定条件下也能自发进行
C.热化学方程式中的系数表示物质的量,因此可以是分数
D.化学反应达到平衡状态时,体系中各物质的反应速率均等于零
5.已知在一定条件下可转化为高附加值的燃料,反应原理为。实验测得在四种不同条件下的反应速率分别为
①、②,③、④,则四种条件下的速率关系为( )
A.②>①>④>③ B.④=③>②>① C.④>③>②>① D.③④>②>①
6.正确理解概念对于学习化学知识非常重要。下列对化学概念的理解错误的是( )
A.增大反应物的浓度,反应速率不一定增大
B.活化分子间的碰撞不一定会发生反应
C.压缩反应体系体积,反应体系中单位体积的活化分子百分数一定增大
D.对反应体系升温,反应体系中的活化分子百分数一定增大
7.、条件下、完全燃烧放出的能量,下列表示燃烧热的热化学方程式正确的是( )
A.
B.
C.
D.
8.为原子序数依次增大的短周期主族元素。元素原子的最外层电子数比元素原子的最外层电子数多1个,元素原子的最外层电子数比元素原子的最外层电子数多1个,元素原子的最外层电子数是其内层电子数的2倍,元素原子的最外层电子数是元素原子最外层电子数的2倍。下列叙述正确的是( )
A.元素的单质能与水剧烈反应 B.最简单氢化物的稳定性:
C.的最高价氧化物对应的水化物具有两性 D.简单离子半径:
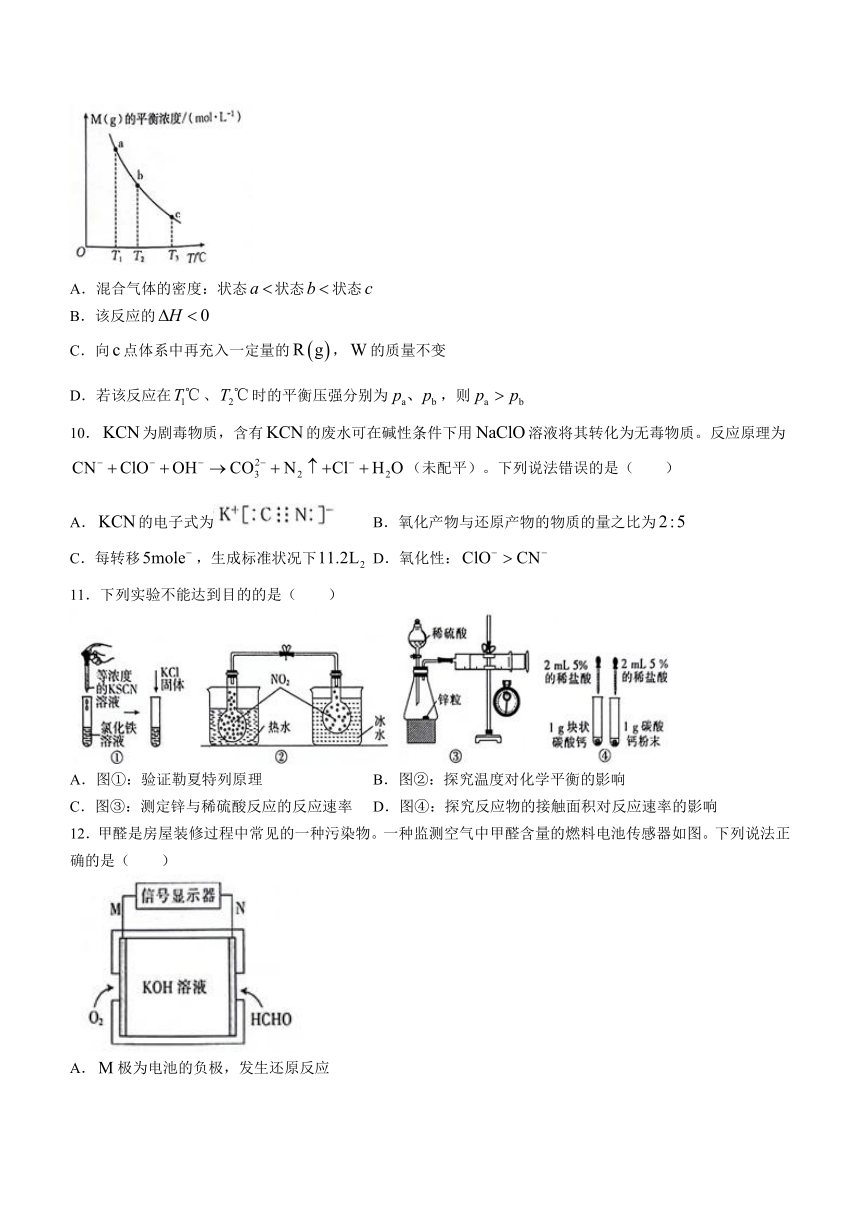
9.已知在一恒容密闭容器中,加入一定量的和足量的,发生反应,平衡状态时的物质的量浓度与温度的关系如图所示。下列说法正确的是( )
A.混合气体的密度:状态状态状态
B.该反应的
C.向点体系中再充入一定量的,的质量不变
D.若该反应在、时的平衡压强分别为,则
10.为剧毒物质,含有的废水可在碱性条件下用溶液将其转化为无毒物质。反应原理为(未配平)。下列说法错误的是( )
A.的电子式为 B.氧化产物与还原产物的物质的量之比为
C.每转移,生成标准状况下 D.氧化性:
11.下列实验不能达到目的的是( )
A.图①:验证勒夏特列原理 B.图②:探究温度对化学平衡的影响
C.图③:测定锌与稀硫酸反应的反应速率 D.图④:探究反应物的接触面积对反应速率的影响
12.甲醛是房屋装修过程中常见的一种污染物。一种监测空气中甲醛含量的燃料电池传感器如图。下列说法正确的是( )
A.极为电池的负极,发生还原反应
B.N极的电极反应式为
C.传感器工作过程中,移向极
D.当电路中转移电子时,消耗
13.在催化作用下,既可以除去天然气中的,又可以获得,反应原理为。设为阿伏加德罗常数的值,下列说法错误的是( )
A.标准状况下,含有的中子数为
B.含有的极性共价键数为
C.和充分反应转移的电子数为
D.由和组成的混合气体中含有原子的总数为
14.如图所示,关闭,向甲中充入和,向乙中充入和,起始,在相同温度下,两容器中均发生反应。打开,反应达到平衡时,。下列说法正确的是( )
A.若不打开,则平衡后,
B.若不打开,反应达到平衡时,
C.打开,反应达到平衡后,(反应物)(生成物)
D.打开,反应达到平衡后,的物质的量分数为
二、非选择题:本题共4小题,共58分。
15.(14分)用可以消除的污染,反应原理为。请回答下列问题:
化学健
键能 946 463 942 391
(1)该反应的______,反应物的总能量______(填“大于”、“小于”或“等于”)生成物的总能量。
(2)一定条件下,向一体积为的恒容密闭容器中充入和,发生反应,反应过程中,每次达到平衡后仅改变一个条件,的物质的是浓度限时间的变化关系如图所示。
①该反应的平衡常数表达式为______。
②时刻改变温度,时间段内,(填“>”“<”或“=”,下同)v逆,KI______KII。
③时刻改变的条件为;若时刻使用催化剂,在图上画出NO的物质的量浓度随时间的变化曲线。
16.(15分)某同学欲利用如下实验仪器及药品,完成酸碱中和反应反应热的测定实验。回答下列相关问题:
I.配制溶液
分别配制的盐酸和的氢氧化的溶液各.
(1)完成该配制实验还需要的仪器为______(填名称)。
(2)需要称量固体的质量为______g。
(3)配制过程中玻璃棒的作用为______。
II.测定中和反应的反应热
(4)组装简易量热计需要的仪器有大小烧杯(分别作为外壳和内筒)、杯盖、______(填标号),为使测量更准确,还需要______填充在外壳和内筒之间,其作用为______。
(5)用组装好的仪器和配制好的溶液按要求测定中和反应的反应热,做三次平行实验(每次量取50mL盐酸和50mL氢氧化钠溶液,反应后混合溶液的密度视为1g·mL-1,混合溶液的比热容)。
①做完三次平行实验至少要使用______次温度计测量溶液温度。
②三次平行实验所测的温度差数据如表所示。
第一次 第二次 第三次
该实验所测的中和反应反应热______(保留3位有效数字),该结果与理论值(在25℃、101kPa下,强酸的稀溶液和强碱的稀溶液发生中和反应生成时,放出的热量)有偏差,其原因可能是______(任填一条)。
17.(14分)乙炔与氯化氢加成制备氯乙烯的反应原理为。回答下列问题:
(1)标准状态时,由指定单质生成化合物的焓变称为标准摩尔生成焓,如氨气的标准摩尔生成焓可用表示,规定(C,石墨)和为0,利用标准摩尔生成焓可以求出化学反应反应热。部分物质的标准摩尔生成焓如表所示。
物质
-92.3 226.7 35.6
请计算热化学方程式的______。在_______(填“高温”、“低温”或“任何温度”)下有利于该反应自发进行。
(2)在某催化剂作用下该反应的反应历程如图1所示,决速步为______(填“I”或“II”)。
图1
(3)在下,将和充入恒容密闭容器中,初始总压强为,反应经过后达到平衡状态,此时总压强为。
①下列条件能作为该反应达到平衡状态标志的是______(填标号)。
a.的浓度不再改变
b.单位时间内断裂键,同时形成键
c.容器中气体的平均摩尔质量不变
d.容器中混合气体的密度保持不变
②的平衡转化率为______,内,为______。
③下该反应的压强平衡常数______。为用分压表示的平衡常数,分压总压物质的成分数)
④与平衡分压的对数随温度的变化图像如图2所示,则表示分压的曲线为______(境“甲”或“乙”)。
图2
18.(15分)农业固体废弃物经处理可用于生产沼气。沼气生产过程中物质(未全部列出)转化关系图如图。请根据所学知识回答下列问题:
(1)已知甘油的结构简式为,按官能团分类,该物质属于______类,甘油与足量的金属钠反应最多可产生标准状况下______。
(2)、丙酸、丁酸的关系是互为______(填“同系物”、“同分异构体”或“同素异形体”)。
(3)乳酸的结构简式为,其所含官能团的名称为______,写出它与足量溶液反应的离子方程式:______。
(4)为乙醇的______模型,乙醇在一定条件下能发生如下转化:
写出②⑤的化学方程式:______、______。
(5)正丁醇有多种同分异构体,与其含有相同官能团的同分异构体有______种。
高二化学试卷参考答案
1.A 2.C 3.C 4.D 5.D 6.C 7.B 8.C 9.B 10.B 11.A 12.D 13.C 14.D
15.(1)+58;小于
(2)① ②;
③移出生成物;
16.(1)容量瓶(1分) (2)5.5(2分) (3)搅拌、引流(2分)
(4)AG(2分);碎纸片(隔热泡沫等合理答案,1分);防止热量散失(或其他合理答案,2分)
(5)①9(1分)
②-53.5(2分);热量散失(或杯盖没盖好或其他合理答案,2分)
17.(1)-98.8(2分);低温(1分) (2)II(1分)
(3)①ac(2分)②50(2分);0.01(2分) ③2.5(2分) (4)乙(2分)
18.(1)醇;33.6
(2)同系物(1分)
(3)羟基、羟基;(用“→”也给分,2分)
(4)空间填充(1分);(2分);(2分)
(5)3(2分)
化学试卷
本试卷满分100分,考试用时75分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.本试卷主要考试内容:人教版选择性必修1第一章至第二章。
5.可能用到的相对原子质量:H1 C12 O16 Na23 S32
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项符合题目要求。
1.人们可通过改变条件来调控化学反应的速率与限度,使其向着对人类更有益的方向发展。下列条件的改变不是从化学反应速率与限度的角度考虑的是( )
A.燃煤中加入 B.制取时使用催化剂
C.汽车排气管中使用三元倠化器 D.橡胶轮胎中加入防老剂
2.化学与生活密切相关。下列说法错误的是( )
A.对铁制品表而进行钝化处理,可延缓腐蚀
B.蛟龙号潜水器的耐压球壳使用的钛合金,抗压强度高
C.耐腐蚀,可用于制作计算机芯片
D.棉花的主要成分-纤维素是一种多糖
3.下列各组物质,不能按a→b→c(“→”表示反应一步完成)关系转化的是( )
选项 a b c
A
B
C
D
4.下列说法中错误的是( )
A.云变成雨的过程中,减小
B.吸热反应在一定条件下也能自发进行
C.热化学方程式中的系数表示物质的量,因此可以是分数
D.化学反应达到平衡状态时,体系中各物质的反应速率均等于零
5.已知在一定条件下可转化为高附加值的燃料,反应原理为。实验测得在四种不同条件下的反应速率分别为
①、②,③、④,则四种条件下的速率关系为( )
A.②>①>④>③ B.④=③>②>① C.④>③>②>① D.③④>②>①
6.正确理解概念对于学习化学知识非常重要。下列对化学概念的理解错误的是( )
A.增大反应物的浓度,反应速率不一定增大
B.活化分子间的碰撞不一定会发生反应
C.压缩反应体系体积,反应体系中单位体积的活化分子百分数一定增大
D.对反应体系升温,反应体系中的活化分子百分数一定增大
7.、条件下、完全燃烧放出的能量,下列表示燃烧热的热化学方程式正确的是( )
A.
B.
C.
D.
8.为原子序数依次增大的短周期主族元素。元素原子的最外层电子数比元素原子的最外层电子数多1个,元素原子的最外层电子数比元素原子的最外层电子数多1个,元素原子的最外层电子数是其内层电子数的2倍,元素原子的最外层电子数是元素原子最外层电子数的2倍。下列叙述正确的是( )
A.元素的单质能与水剧烈反应 B.最简单氢化物的稳定性:
C.的最高价氧化物对应的水化物具有两性 D.简单离子半径:
9.已知在一恒容密闭容器中,加入一定量的和足量的,发生反应,平衡状态时的物质的量浓度与温度的关系如图所示。下列说法正确的是( )
A.混合气体的密度:状态状态状态
B.该反应的
C.向点体系中再充入一定量的,的质量不变
D.若该反应在、时的平衡压强分别为,则
10.为剧毒物质,含有的废水可在碱性条件下用溶液将其转化为无毒物质。反应原理为(未配平)。下列说法错误的是( )
A.的电子式为 B.氧化产物与还原产物的物质的量之比为
C.每转移,生成标准状况下 D.氧化性:
11.下列实验不能达到目的的是( )
A.图①:验证勒夏特列原理 B.图②:探究温度对化学平衡的影响
C.图③:测定锌与稀硫酸反应的反应速率 D.图④:探究反应物的接触面积对反应速率的影响
12.甲醛是房屋装修过程中常见的一种污染物。一种监测空气中甲醛含量的燃料电池传感器如图。下列说法正确的是( )
A.极为电池的负极,发生还原反应
B.N极的电极反应式为
C.传感器工作过程中,移向极
D.当电路中转移电子时,消耗
13.在催化作用下,既可以除去天然气中的,又可以获得,反应原理为。设为阿伏加德罗常数的值,下列说法错误的是( )
A.标准状况下,含有的中子数为
B.含有的极性共价键数为
C.和充分反应转移的电子数为
D.由和组成的混合气体中含有原子的总数为
14.如图所示,关闭,向甲中充入和,向乙中充入和,起始,在相同温度下,两容器中均发生反应。打开,反应达到平衡时,。下列说法正确的是( )
A.若不打开,则平衡后,
B.若不打开,反应达到平衡时,
C.打开,反应达到平衡后,(反应物)(生成物)
D.打开,反应达到平衡后,的物质的量分数为
二、非选择题:本题共4小题,共58分。
15.(14分)用可以消除的污染,反应原理为。请回答下列问题:
化学健
键能 946 463 942 391
(1)该反应的______,反应物的总能量______(填“大于”、“小于”或“等于”)生成物的总能量。
(2)一定条件下,向一体积为的恒容密闭容器中充入和,发生反应,反应过程中,每次达到平衡后仅改变一个条件,的物质的是浓度限时间的变化关系如图所示。
①该反应的平衡常数表达式为______。
②时刻改变温度,时间段内,(填“>”“<”或“=”,下同)v逆,KI______KII。
③时刻改变的条件为;若时刻使用催化剂,在图上画出NO的物质的量浓度随时间的变化曲线。
16.(15分)某同学欲利用如下实验仪器及药品,完成酸碱中和反应反应热的测定实验。回答下列相关问题:
I.配制溶液
分别配制的盐酸和的氢氧化的溶液各.
(1)完成该配制实验还需要的仪器为______(填名称)。
(2)需要称量固体的质量为______g。
(3)配制过程中玻璃棒的作用为______。
II.测定中和反应的反应热
(4)组装简易量热计需要的仪器有大小烧杯(分别作为外壳和内筒)、杯盖、______(填标号),为使测量更准确,还需要______填充在外壳和内筒之间,其作用为______。
(5)用组装好的仪器和配制好的溶液按要求测定中和反应的反应热,做三次平行实验(每次量取50mL盐酸和50mL氢氧化钠溶液,反应后混合溶液的密度视为1g·mL-1,混合溶液的比热容)。
①做完三次平行实验至少要使用______次温度计测量溶液温度。
②三次平行实验所测的温度差数据如表所示。
第一次 第二次 第三次
该实验所测的中和反应反应热______(保留3位有效数字),该结果与理论值(在25℃、101kPa下,强酸的稀溶液和强碱的稀溶液发生中和反应生成时,放出的热量)有偏差,其原因可能是______(任填一条)。
17.(14分)乙炔与氯化氢加成制备氯乙烯的反应原理为。回答下列问题:
(1)标准状态时,由指定单质生成化合物的焓变称为标准摩尔生成焓,如氨气的标准摩尔生成焓可用表示,规定(C,石墨)和为0,利用标准摩尔生成焓可以求出化学反应反应热。部分物质的标准摩尔生成焓如表所示。
物质
-92.3 226.7 35.6
请计算热化学方程式的______。在_______(填“高温”、“低温”或“任何温度”)下有利于该反应自发进行。
(2)在某催化剂作用下该反应的反应历程如图1所示,决速步为______(填“I”或“II”)。
图1
(3)在下,将和充入恒容密闭容器中,初始总压强为,反应经过后达到平衡状态,此时总压强为。
①下列条件能作为该反应达到平衡状态标志的是______(填标号)。
a.的浓度不再改变
b.单位时间内断裂键,同时形成键
c.容器中气体的平均摩尔质量不变
d.容器中混合气体的密度保持不变
②的平衡转化率为______,内,为______。
③下该反应的压强平衡常数______。为用分压表示的平衡常数,分压总压物质的成分数)
④与平衡分压的对数随温度的变化图像如图2所示,则表示分压的曲线为______(境“甲”或“乙”)。
图2
18.(15分)农业固体废弃物经处理可用于生产沼气。沼气生产过程中物质(未全部列出)转化关系图如图。请根据所学知识回答下列问题:
(1)已知甘油的结构简式为,按官能团分类,该物质属于______类,甘油与足量的金属钠反应最多可产生标准状况下______。
(2)、丙酸、丁酸的关系是互为______(填“同系物”、“同分异构体”或“同素异形体”)。
(3)乳酸的结构简式为,其所含官能团的名称为______,写出它与足量溶液反应的离子方程式:______。
(4)为乙醇的______模型,乙醇在一定条件下能发生如下转化:
写出②⑤的化学方程式:______、______。
(5)正丁醇有多种同分异构体,与其含有相同官能团的同分异构体有______种。
高二化学试卷参考答案
1.A 2.C 3.C 4.D 5.D 6.C 7.B 8.C 9.B 10.B 11.A 12.D 13.C 14.D
15.(1)+58;小于
(2)① ②;
③移出生成物;
16.(1)容量瓶(1分) (2)5.5(2分) (3)搅拌、引流(2分)
(4)AG(2分);碎纸片(隔热泡沫等合理答案,1分);防止热量散失(或其他合理答案,2分)
(5)①9(1分)
②-53.5(2分);热量散失(或杯盖没盖好或其他合理答案,2分)
17.(1)-98.8(2分);低温(1分) (2)II(1分)
(3)①ac(2分)②50(2分);0.01(2分) ③2.5(2分) (4)乙(2分)
18.(1)醇;33.6
(2)同系物(1分)
(3)羟基、羟基;(用“→”也给分,2分)
(4)空间填充(1分);(2分);(2分)
(5)3(2分)
同课章节目录
