苏教版(2019)高中化学选择性必修2 2.1.3原子核外电子的排布同步练习(含解析)
文档属性
| 名称 | 苏教版(2019)高中化学选择性必修2 2.1.3原子核外电子的排布同步练习(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 982.8KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-18 10:02:00 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2.1.3原子核外电子的排布同步练习-苏教版高中化学选择性必修2
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列元素的基态原子核外电子排布中,未成对电子最多的是
A.Cl B.Cr C.Mn D.As
2.原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+表示,与之相反的用-表示,称为电子的自旋磁量子数。对于基态的氧原子,其价电子自旋磁量子数的代数和为
A.+或- B.0 C.1或-1 D.+或-
3.下列说法正确的是
A.表示3p能级上有两个轨道
B.M能层中的原子轨道数目为3
C.是激发态原子的电子排布式
D.在基态多电子原子中,p轨道电子的能量一定高于s轨道电子的能量
4.在原子的第n电子层中,当n为最外层时,最多容纳电子数与(n-1)层相同;当n为次外层时,其最多容纳的电子数比(n-1)层最多容纳的电子数多10,则n层是
A.N层 B.M层 C.L层 D.K层
5.下列说法不正确的是
A.原子核外电子排布,先排满层再排层、先排满层再排层
B.从空间角度看,2s轨道比1s轨道大,其空间包含了1s轨道
C.2p、3p、4p的轨道形状均为哑铃形
D.各能层含有的原子轨道数为(n为能层序数)
6.下列化学用语正确的是
A.的核外电子排布式:
B.电子的电子云轮廓图:
C.的形成过程:
D.碳化硅的分子式:
7.磷灰石是制造磷肥和含磷化合物的最主要矿物原料,可表示为。下列有关化学用语或图示表达正确的是
A.的电子式:
B.基态磷原子的最外层电子的轨道表示式:
C.基态原子最高能级的电子云轮廓图:
D.中子数为20的氯原子:
8.由Li、Al、Si构成的晶体结构如图所示,晶胞边长为a,下列说法错误的是
A.基态Al原子的电子排布式为3s23p1
B.晶体中与Al距离最近且相等的Al有12个
C.晶体中Li、AI、Si三种微粒的数目比为1:1:1
D.晶体中Al原子与Si原子之间的最短距离为
9.下列Li原子电子排布图表示的状态中,能量最低为
A. B.
C. D.
10.下列关于电子云示意图的叙述正确的是
A.电子云表示电子的运动轨迹
B.黑点的多少表示电子个数的多少
C.处于1s轨道上的电子在空间出现的概率分布呈球形对称,而且电子在原子核附近出现的概率小,离核越远电子出现的概率越大
D.处在2pz轨道的电子主要在xy平面的上、下方出现
二、填空题
11.写出基态、、、、各元素原子的核外电子排布式,并判断它们在元素周期表中的位置和分区。
(1): , , 。
(2): , , 。
(3): , , 。
(4): , , 。
(5): , , 。
12.按要求完成下列填空:
(1)基态的电子排布式为 。
(2)基态的价层电子排布式为 。
(3)基态的结构示意图为 。
(4)基态的轨道表示式为 。
13.全球“青年化学家元素周期表”中多种元素由我国科学家代言,如氮、硫、钪(Sc)等。完成下列填空。
(1)钪(Sc)的原子结构示意图为 ,钪原子核外最外层电子排布式为 ;Sc与第II主族相邻,Sc位于元素周期表的第 族;钪的最高价态可能是 。
(2)下列比较正确的是___________(选填选项)。
A.原子半径: B.热稳定性:
C.溶解性: D.微粒种类:氢硫酸<氨水
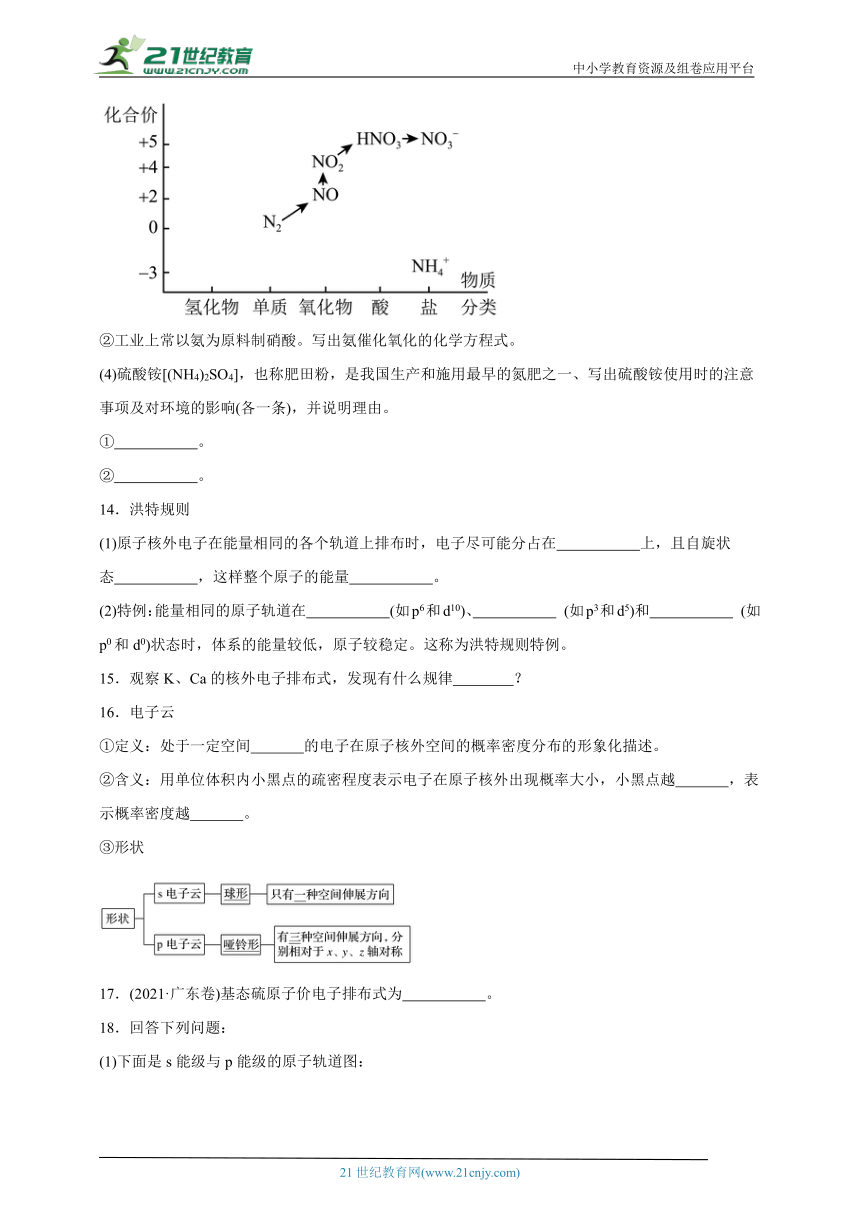
(3)工业上以N2为原料,以、为产品,实现了“向空气要氮肥”的目标。
①在如下价、类二维图中用“→”和途径中间产物的化学式,画出了由N2转化为路径。
②工业上常以氨为原料制硝酸。写出氨催化氧化的化学方程式。
(4)硫酸铵[(NH4)2SO4],也称肥田粉,是我国生产和施用最早的氮肥之一、写出硫酸铵使用时的注意事项及对环境的影响(各一条),并说明理由。
① 。
② 。
14.洪特规则
(1)原子核外电子在能量相同的各个轨道上排布时,电子尽可能分占在 上,且自旋状态 ,这样整个原子的能量 。
(2)特例:能量相同的原子轨道在 (如p6和d10)、 (如p3和d5)和 (如p0和d0)状态时,体系的能量较低,原子较稳定。这称为洪特规则特例。
15.观察K、Ca的核外电子排布式,发现有什么规律 ?
16.电子云
①定义:处于一定空间 的电子在原子核外空间的概率密度分布的形象化描述。
②含义:用单位体积内小黑点的疏密程度表示电子在原子核外出现概率大小,小黑点越 ,表示概率密度越 。
③形状
17.(2021·广东卷)基态硫原子价电子排布式为 。
18.回答下列问题:
(1)下面是s能级与p能级的原子轨道图:
请回答下列问题:
①s电子的原子轨道呈 形,每个s能级有 个原子轨道;
②p电子的原子轨道呈 形,每个p能级有 个原子轨道。
(2)写出下列元素基态原子的电子排布式。
①Co: ;
②Cu: 。
(3)画出下列元素基态原子的轨道表示式。
①P: ;
②F: 。
19.锌是人体的必需元素,可以促进人体的生长发育。但水体中如果含锌量超标,饮用后会导致急慢性锌中毒产生贫血等症状。纳米铝粉有很强的吸附性和还原性,常用于除去工业生产一水合甘氨酸锌的废水中过量的锌。
(1)写出Zn2+的核外电子排布式: 。
(2)一水合甘氨酸锌的结构简式如图所示,其中Zn2+的配位数为 。
(3)相对于用纳米铁粉处理废水中Zn2+,使用纳米铝粉效率更高的原因是 。
(4)向含有甘氨酸锌的酸性废水中加入纳米铝粉,水中溶解的氧在纳米铝粉表面产生·OH,将甘氨酸锌中的有机基团(以甘氨酸根表示)降解,释放出的Zn2+被纳米铝粉去除。
①写出·OH氧化甘氨酸根(C2NH4O)生成NO、CO2的离子方程式: 。
②实验测得溶液中总氮含量[]随时间的变化如图所示,反应初期溶液中的总氮含量先迅速降低后随即上升的原因是 。
20.(1)SP杂化轨道由 个S轨道和 P轨道杂化而得的。
(2)A-的核外电子排布式为:1s22s22p63s23p6,则它第 周期第 族。
三、实验题
21.三草酸合铁酸钾的化学K3[Fe(C2O4)3]·3H2O可用于制作工程图中“晒制蓝图”时的感光剂。
(1)钾离子最外层电子的轨道表示式 。
(2)已知草酸氢钾(KHC2O4)溶液中c(C2O42—)>c(H2C2O4),则该溶液呈性 (填酸、碱、中),并简述原因 ,写出HC2O4—水解的离子方程式 。
为探究三草酸合铁酸钾受热分解的产物,按下图进行实验。
(3)实验开始时,先要通一会氮气,其目的是 。
(4)实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有 、 。
(5)样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是: 。
22.实验室模拟水合肼(N2H4·H2O)化学还原硫酸四氨合铜{[Cu(NH3)4]SO4}制备纳米铜粉的主要步骤如下:
(1)水合肼的实验室制备
N2H4H2O有淡氨味,有弱碱性和强还原性,能与铜离子形成络合物。可由NaClO碱性溶液与尿素[CONH2)2]水溶液在一定条件 下反应制得,装置如题图所示。
①恒压漏斗中的装的溶液是 。
②三颈烧瓶中反应的离子方程式为 。
(2)纳米铜粉的制备
一定温度和pH条件下,将水合肼溶液与硫酸四氨合铜溶液按照适当比例混合发生氧化还原反应,制备纳米铜粉。
①[Cu(NH3)4]2+中铜离子基态核外电子排布式为 。
②固定水温70°C,反应时间1h,铜产率、水合肼的还原能力随pH值的变化如图所示,由图可知,随着溶液的pH增大,铜产率先增加后减小,结合信息分析其原因 。
(3)胆矾是制备硫酸四氨合铜的重要原材料,请补充以废铜屑[主要成分是Cu,含有少量的油污、CuO、 CuCO3、 Cu(OH)2]为原料制备胆矾的实验方案: ,低温干燥,得到CuSO4·5H2O。[实验须使用的试剂: CaCl2溶液、饱和Na2CO3溶液、稀硫酸、H2O2]
23.三氯化铬()在工业上主要用作媒染剂和催化剂,实验室模拟工业上以为原料制备。
(1)制备。取一定质量的和对应量的水加入到三颈烧瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成并放出气体。
①Cr原子的外围电子排布式为 。
②上述反应的化学方程式为 。
③上述反应中的乙醇与投料的物质的量比例大约为,原因是 。
(2)测定的质量分数。
I.称取样品0.3300g,加水溶解并配成250.0mL的溶液。
II.移取25.00mL样品溶液于带塞的锥形瓶中,加热至沸后加入稍过量的,稀释并加热煮沸,再加入过量的硫酸酸化,将氧化为;再加入过量KI固体加塞摇匀,使铬元素完全以的形式存在。
III.加入1mL淀粉溶液,用标准溶液滴定至终点,平行测定3次,平均消耗标准溶液24.00mL。
已知反应:
(未配平)
(未配平)
①滴定终点的现象是 。
②计算的质量分数(写出计算过程) 。
参考答案:
1.B
2.C
3.C
4.B
5.A
6.A
7.B
8.A
9.D
10.D
11. 或 第三周期第ⅢA族 p 或 第四周期第ⅥB族 d 或 第四周期第Ⅷ族 d 或 第四周期第ⅤA族 p 或 第四周期第ⅡB族 ds
12.
13.(1) 4s2 ⅢB +3
(2)C
(3)4NH3+5O24NO+6H2O
(4) 不要与碱性物质混放或混用;硫酸铵遇碱时放出氨气,所以不要与碱性物质混放或混用。 不宜长期施用;长期施用,会使土壤酸化、板结,所以不宜长期施用
14.(1) 不同的原子轨道 相同 最低
(2) 全充满 半充满 全空
15.(1)不同能层的能级有交错现象,如E(3d)>E(4s)、E(4d)>E(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等
(2)能级交错现象(从第3电子层开始):随着电荷数递增,电子并不总是填满一个能层后再开始填入下一个能层的,电子是按能量由低到高的顺序填充的
(3)电子先填最外层的ns,后填次外层的(n-1)d,甚至填入倒数第三层的(n-2)f,最后填入np
16. 运动状态 密 大
17.
18.(1) 球形 1 纺锤 3
(2) 1s22s22p63s23p63d74s2或[Ar]3d74s2 1s22s22p63s23p63d104s1[Ar]3d104s1
(3)
19.(1)1s22s22p63s23p63d10或[Ar]3d10
(2)5
(3)铝可以将Zn2+转化为Zn除去,而Fe不能置换出Zn
(4) 14·OH+C2NH4O=NO+2CO2↑+9H2O 纳米铝粉吸附甘氨酸锌,使得溶液中总氮量迅速降低,吸附后的甘氨酸锌被纳米铝粉表面产生的·OH降解为可溶性的含氮物质,使溶液中的总氮含量上升
20. 1 1 三 ⅦA
21. 酸 溶液中的HC2O4-电离大于水解,氢离子浓度大于氢氧根浓度 HC2O4-+ H2O H2C2O4+OH- 排尽装置中的空气(氧气) CO CO2 取少量装置A中残留物放入试管中,加入稀硫酸溶解,再滴加几滴KSCN溶液,若观察到溶液变红,则证明A中残留物中含Fe2O3
22.(1) NaClO溶液 ClO-+CO(NH2)2+2OH-=Cl-+N2H4+H2O+CO
(2) 3d9或1s22s22p63s23p63d9 pH较小时,水合肼还原[Cu(NH3)4]2+生成Cu,Cu产率增大;pH值较大时,水合肼与铜离子形成配合物,Cu产率下降
(3)向废铜屑中加入饱和碳酸钠溶液浸泡,然后过滤,得到的滤渣中加入稀硫酸、双氧水进行浸泡,滤渣完全溶解后得到CuSO4溶液,将CuSO4溶液蒸发浓缩、冷却结晶、过滤、洗涤
23.(1) 增大乙醇用量,利于提高利用率
(2) 滴入最后半滴标准液,溶液由蓝色变为无色,且30s内不复原 96.1%
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2.1.3原子核外电子的排布同步练习-苏教版高中化学选择性必修2
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列元素的基态原子核外电子排布中,未成对电子最多的是
A.Cl B.Cr C.Mn D.As
2.原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+表示,与之相反的用-表示,称为电子的自旋磁量子数。对于基态的氧原子,其价电子自旋磁量子数的代数和为
A.+或- B.0 C.1或-1 D.+或-
3.下列说法正确的是
A.表示3p能级上有两个轨道
B.M能层中的原子轨道数目为3
C.是激发态原子的电子排布式
D.在基态多电子原子中,p轨道电子的能量一定高于s轨道电子的能量
4.在原子的第n电子层中,当n为最外层时,最多容纳电子数与(n-1)层相同;当n为次外层时,其最多容纳的电子数比(n-1)层最多容纳的电子数多10,则n层是
A.N层 B.M层 C.L层 D.K层
5.下列说法不正确的是
A.原子核外电子排布,先排满层再排层、先排满层再排层
B.从空间角度看,2s轨道比1s轨道大,其空间包含了1s轨道
C.2p、3p、4p的轨道形状均为哑铃形
D.各能层含有的原子轨道数为(n为能层序数)
6.下列化学用语正确的是
A.的核外电子排布式:
B.电子的电子云轮廓图:
C.的形成过程:
D.碳化硅的分子式:
7.磷灰石是制造磷肥和含磷化合物的最主要矿物原料,可表示为。下列有关化学用语或图示表达正确的是
A.的电子式:
B.基态磷原子的最外层电子的轨道表示式:
C.基态原子最高能级的电子云轮廓图:
D.中子数为20的氯原子:
8.由Li、Al、Si构成的晶体结构如图所示,晶胞边长为a,下列说法错误的是
A.基态Al原子的电子排布式为3s23p1
B.晶体中与Al距离最近且相等的Al有12个
C.晶体中Li、AI、Si三种微粒的数目比为1:1:1
D.晶体中Al原子与Si原子之间的最短距离为
9.下列Li原子电子排布图表示的状态中,能量最低为
A. B.
C. D.
10.下列关于电子云示意图的叙述正确的是
A.电子云表示电子的运动轨迹
B.黑点的多少表示电子个数的多少
C.处于1s轨道上的电子在空间出现的概率分布呈球形对称,而且电子在原子核附近出现的概率小,离核越远电子出现的概率越大
D.处在2pz轨道的电子主要在xy平面的上、下方出现
二、填空题
11.写出基态、、、、各元素原子的核外电子排布式,并判断它们在元素周期表中的位置和分区。
(1): , , 。
(2): , , 。
(3): , , 。
(4): , , 。
(5): , , 。
12.按要求完成下列填空:
(1)基态的电子排布式为 。
(2)基态的价层电子排布式为 。
(3)基态的结构示意图为 。
(4)基态的轨道表示式为 。
13.全球“青年化学家元素周期表”中多种元素由我国科学家代言,如氮、硫、钪(Sc)等。完成下列填空。
(1)钪(Sc)的原子结构示意图为 ,钪原子核外最外层电子排布式为 ;Sc与第II主族相邻,Sc位于元素周期表的第 族;钪的最高价态可能是 。
(2)下列比较正确的是___________(选填选项)。
A.原子半径: B.热稳定性:
C.溶解性: D.微粒种类:氢硫酸<氨水
(3)工业上以N2为原料,以、为产品,实现了“向空气要氮肥”的目标。
①在如下价、类二维图中用“→”和途径中间产物的化学式,画出了由N2转化为路径。
②工业上常以氨为原料制硝酸。写出氨催化氧化的化学方程式。
(4)硫酸铵[(NH4)2SO4],也称肥田粉,是我国生产和施用最早的氮肥之一、写出硫酸铵使用时的注意事项及对环境的影响(各一条),并说明理由。
① 。
② 。
14.洪特规则
(1)原子核外电子在能量相同的各个轨道上排布时,电子尽可能分占在 上,且自旋状态 ,这样整个原子的能量 。
(2)特例:能量相同的原子轨道在 (如p6和d10)、 (如p3和d5)和 (如p0和d0)状态时,体系的能量较低,原子较稳定。这称为洪特规则特例。
15.观察K、Ca的核外电子排布式,发现有什么规律 ?
16.电子云
①定义:处于一定空间 的电子在原子核外空间的概率密度分布的形象化描述。
②含义:用单位体积内小黑点的疏密程度表示电子在原子核外出现概率大小,小黑点越 ,表示概率密度越 。
③形状
17.(2021·广东卷)基态硫原子价电子排布式为 。
18.回答下列问题:
(1)下面是s能级与p能级的原子轨道图:
请回答下列问题:
①s电子的原子轨道呈 形,每个s能级有 个原子轨道;
②p电子的原子轨道呈 形,每个p能级有 个原子轨道。
(2)写出下列元素基态原子的电子排布式。
①Co: ;
②Cu: 。
(3)画出下列元素基态原子的轨道表示式。
①P: ;
②F: 。
19.锌是人体的必需元素,可以促进人体的生长发育。但水体中如果含锌量超标,饮用后会导致急慢性锌中毒产生贫血等症状。纳米铝粉有很强的吸附性和还原性,常用于除去工业生产一水合甘氨酸锌的废水中过量的锌。
(1)写出Zn2+的核外电子排布式: 。
(2)一水合甘氨酸锌的结构简式如图所示,其中Zn2+的配位数为 。
(3)相对于用纳米铁粉处理废水中Zn2+,使用纳米铝粉效率更高的原因是 。
(4)向含有甘氨酸锌的酸性废水中加入纳米铝粉,水中溶解的氧在纳米铝粉表面产生·OH,将甘氨酸锌中的有机基团(以甘氨酸根表示)降解,释放出的Zn2+被纳米铝粉去除。
①写出·OH氧化甘氨酸根(C2NH4O)生成NO、CO2的离子方程式: 。
②实验测得溶液中总氮含量[]随时间的变化如图所示,反应初期溶液中的总氮含量先迅速降低后随即上升的原因是 。
20.(1)SP杂化轨道由 个S轨道和 P轨道杂化而得的。
(2)A-的核外电子排布式为:1s22s22p63s23p6,则它第 周期第 族。
三、实验题
21.三草酸合铁酸钾的化学K3[Fe(C2O4)3]·3H2O可用于制作工程图中“晒制蓝图”时的感光剂。
(1)钾离子最外层电子的轨道表示式 。
(2)已知草酸氢钾(KHC2O4)溶液中c(C2O42—)>c(H2C2O4),则该溶液呈性 (填酸、碱、中),并简述原因 ,写出HC2O4—水解的离子方程式 。
为探究三草酸合铁酸钾受热分解的产物,按下图进行实验。
(3)实验开始时,先要通一会氮气,其目的是 。
(4)实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有 、 。
(5)样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是: 。
22.实验室模拟水合肼(N2H4·H2O)化学还原硫酸四氨合铜{[Cu(NH3)4]SO4}制备纳米铜粉的主要步骤如下:
(1)水合肼的实验室制备
N2H4H2O有淡氨味,有弱碱性和强还原性,能与铜离子形成络合物。可由NaClO碱性溶液与尿素[CONH2)2]水溶液在一定条件 下反应制得,装置如题图所示。
①恒压漏斗中的装的溶液是 。
②三颈烧瓶中反应的离子方程式为 。
(2)纳米铜粉的制备
一定温度和pH条件下,将水合肼溶液与硫酸四氨合铜溶液按照适当比例混合发生氧化还原反应,制备纳米铜粉。
①[Cu(NH3)4]2+中铜离子基态核外电子排布式为 。
②固定水温70°C,反应时间1h,铜产率、水合肼的还原能力随pH值的变化如图所示,由图可知,随着溶液的pH增大,铜产率先增加后减小,结合信息分析其原因 。
(3)胆矾是制备硫酸四氨合铜的重要原材料,请补充以废铜屑[主要成分是Cu,含有少量的油污、CuO、 CuCO3、 Cu(OH)2]为原料制备胆矾的实验方案: ,低温干燥,得到CuSO4·5H2O。[实验须使用的试剂: CaCl2溶液、饱和Na2CO3溶液、稀硫酸、H2O2]
23.三氯化铬()在工业上主要用作媒染剂和催化剂,实验室模拟工业上以为原料制备。
(1)制备。取一定质量的和对应量的水加入到三颈烧瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成并放出气体。
①Cr原子的外围电子排布式为 。
②上述反应的化学方程式为 。
③上述反应中的乙醇与投料的物质的量比例大约为,原因是 。
(2)测定的质量分数。
I.称取样品0.3300g,加水溶解并配成250.0mL的溶液。
II.移取25.00mL样品溶液于带塞的锥形瓶中,加热至沸后加入稍过量的,稀释并加热煮沸,再加入过量的硫酸酸化,将氧化为;再加入过量KI固体加塞摇匀,使铬元素完全以的形式存在。
III.加入1mL淀粉溶液,用标准溶液滴定至终点,平行测定3次,平均消耗标准溶液24.00mL。
已知反应:
(未配平)
(未配平)
①滴定终点的现象是 。
②计算的质量分数(写出计算过程) 。
参考答案:
1.B
2.C
3.C
4.B
5.A
6.A
7.B
8.A
9.D
10.D
11. 或 第三周期第ⅢA族 p 或 第四周期第ⅥB族 d 或 第四周期第Ⅷ族 d 或 第四周期第ⅤA族 p 或 第四周期第ⅡB族 ds
12.
13.(1) 4s2 ⅢB +3
(2)C
(3)4NH3+5O24NO+6H2O
(4) 不要与碱性物质混放或混用;硫酸铵遇碱时放出氨气,所以不要与碱性物质混放或混用。 不宜长期施用;长期施用,会使土壤酸化、板结,所以不宜长期施用
14.(1) 不同的原子轨道 相同 最低
(2) 全充满 半充满 全空
15.(1)不同能层的能级有交错现象,如E(3d)>E(4s)、E(4d)>E(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等
(2)能级交错现象(从第3电子层开始):随着电荷数递增,电子并不总是填满一个能层后再开始填入下一个能层的,电子是按能量由低到高的顺序填充的
(3)电子先填最外层的ns,后填次外层的(n-1)d,甚至填入倒数第三层的(n-2)f,最后填入np
16. 运动状态 密 大
17.
18.(1) 球形 1 纺锤 3
(2) 1s22s22p63s23p63d74s2或[Ar]3d74s2 1s22s22p63s23p63d104s1[Ar]3d104s1
(3)
19.(1)1s22s22p63s23p63d10或[Ar]3d10
(2)5
(3)铝可以将Zn2+转化为Zn除去,而Fe不能置换出Zn
(4) 14·OH+C2NH4O=NO+2CO2↑+9H2O 纳米铝粉吸附甘氨酸锌,使得溶液中总氮量迅速降低,吸附后的甘氨酸锌被纳米铝粉表面产生的·OH降解为可溶性的含氮物质,使溶液中的总氮含量上升
20. 1 1 三 ⅦA
21. 酸 溶液中的HC2O4-电离大于水解,氢离子浓度大于氢氧根浓度 HC2O4-+ H2O H2C2O4+OH- 排尽装置中的空气(氧气) CO CO2 取少量装置A中残留物放入试管中,加入稀硫酸溶解,再滴加几滴KSCN溶液,若观察到溶液变红,则证明A中残留物中含Fe2O3
22.(1) NaClO溶液 ClO-+CO(NH2)2+2OH-=Cl-+N2H4+H2O+CO
(2) 3d9或1s22s22p63s23p63d9 pH较小时,水合肼还原[Cu(NH3)4]2+生成Cu,Cu产率增大;pH值较大时,水合肼与铜离子形成配合物,Cu产率下降
(3)向废铜屑中加入饱和碳酸钠溶液浸泡,然后过滤,得到的滤渣中加入稀硫酸、双氧水进行浸泡,滤渣完全溶解后得到CuSO4溶液,将CuSO4溶液蒸发浓缩、冷却结晶、过滤、洗涤
23.(1) 增大乙醇用量,利于提高利用率
(2) 滴入最后半滴标准液,溶液由蓝色变为无色,且30s内不复原 96.1%
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
