9.5有机推断与合成 课件(共41张PPT)-2024年高考化学一轮复习课件
文档属性
| 名称 | 9.5有机推断与合成 课件(共41张PPT)-2024年高考化学一轮复习课件 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-16 15:11:15 | ||
图片预览







文档简介
(共41张PPT)
第5讲 有机推断与合成
2024届高考化学一轮复习课件
第九章 有机化合物
考点一 有机综合推断
考点二 有机合成
链接高考
本节目录
内容要求 核心素养
认识加成、取代、消去反应及氧化还原反应的特点和规律,了解有机反应类型和有机化合物组成结构特点的关系。认识有机合成的关键是碳骨架的构建和官能团的转化,了解设计有机合成路线的一般方法 [证据推理与模型认知] 综合应用有关知识完成推断有机化合物、检验官能团、设计有机合成路线
一、有机综合推断的突破口
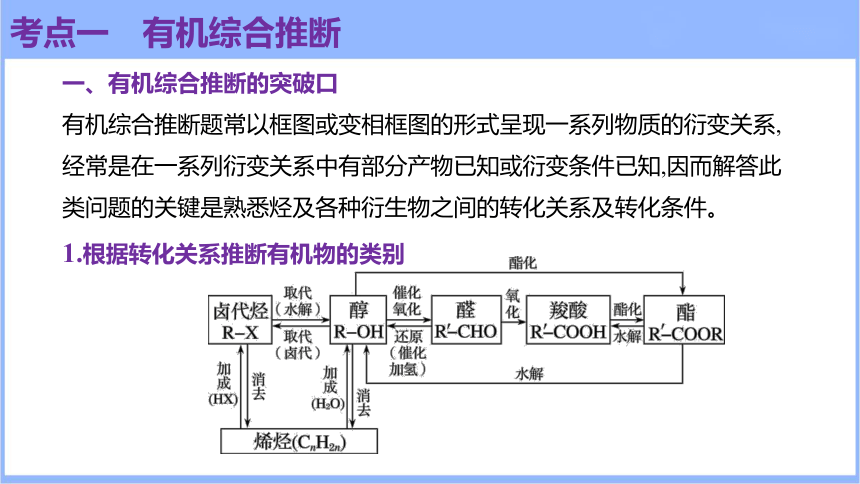
有机综合推断题常以框图或变相框图的形式呈现一系列物质的衍变关系,经常是在一系列衍变关系中有部分产物已知或衍变条件已知,因而解答此类问题的关键是熟悉烃及各种衍生物之间的转化关系及转化条件。
1.根据转化关系推断有机物的类别
考点一 有机综合推断
醇、醛、羧酸、酯之间的相互衍变关系是有机物结构推断的重要突破口,它们之间的相互转化关系如图所示:
上图中,A能连续氧化生成C,且A、C在浓硫酸存在下加热生成D,则:
(1)A为 ,B为醛,C为 ,D为 。
(2)A、B、C三种物质中碳原子数 ,碳骨架结构 。
(3)A分子中含 结构。
醇
羧酸
酯
相同
相同
—CH2OH
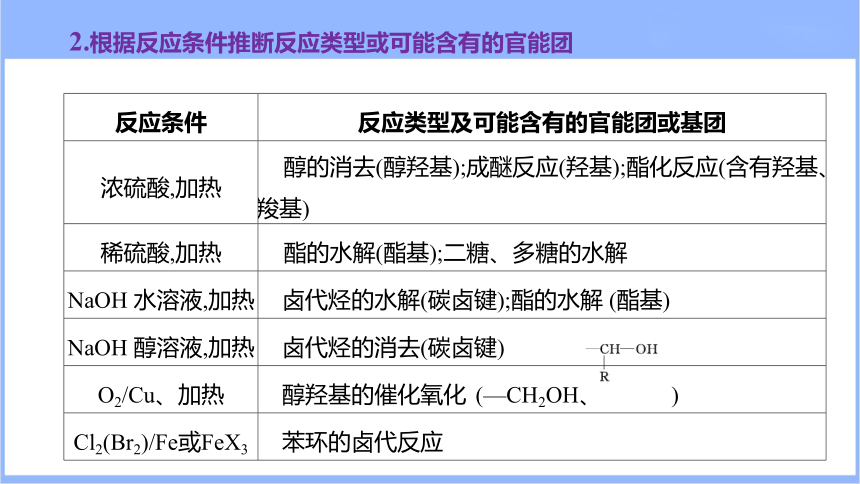
2.根据反应条件推断反应类型或可能含有的官能团
反应条件 反应类型及可能含有的官能团或基团
浓硫酸,加热 醇的消去(醇羟基);成醚反应(羟基);酯化反应(含有羟基、羧基)
稀硫酸,加热 酯的水解(酯基);二糖、多糖的水解
NaOH 水溶液,加热 卤代烃的水解(碳卤键);酯的水解 (酯基)
NaOH 醇溶液,加热 卤代烃的消去(碳卤键)
O2/Cu、加热 醇羟基的催化氧化 (—CH2OH、 )
Cl2(Br2)/Fe或FeX3 苯环的卤代反应
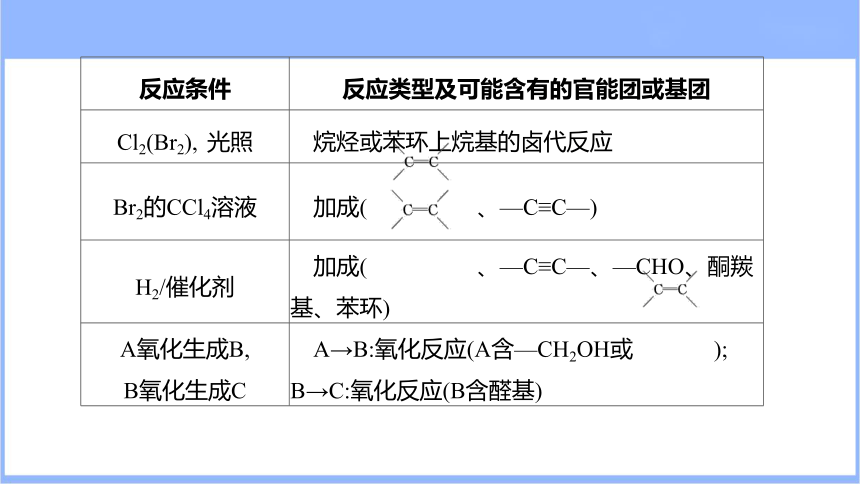
反应条件 反应类型及可能含有的官能团或基团
Cl2(Br2), 光照 烷烃或苯环上烷基的卤代反应
Br2的CCl4溶液 加成( 、—C≡C—)
H2/催化剂 加成( 、—C≡C—、—CHO、酮羰基、苯环)
A氧化生成B, B氧化生成C A→B:氧化反应(A含—CH2OH或 );
B→C:氧化反应(B含醛基)
3.根据有机反应中定量关系推断官能团的数目
(1)烃和卤素单质的取代:取代1 mol氢原子,消耗1 mol卤素单质(X2)。
(2) 的加成:与H2、Br2、HCl、H2O等加成时按物质的量之比为1∶1加成。
(3)含—OH的有机物与Na反应时:2 mol —OH生成1 mol H2。
(4)1 mol —CHO对应2 mol Ag或1 mol —CHO对应1 mol Cu2O(注意:HCHO中相当于有2个—CHO)。
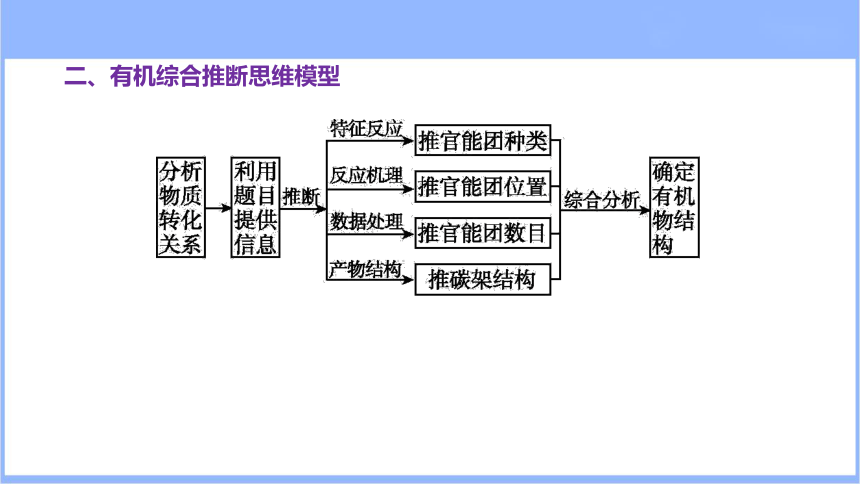
二、有机综合推断思维模型
[学科能力提升]
分析反应物、产物的分子式,根据其差异,联想已知有机化学知识,猜想可能的有机反应类型,由此确定反应物、产物的结构特点,结合框图中的其他物质,确定具体的结构。举例如下:
(1)F(C6H6O) → G(C6H5NO3):对比F与G的分子式,G比F的分子少1个H,多1个N和2个O,可判断反应类型可能为取代反应,F若为苯酚,则G可能为硝基苯酚。
(2)C(C3H6OCl2) → D(C3H8O3):对比C与D的分子式,D比C的分子少2个Cl,多2个O和2个H,根据分子式可判断反应类型可能为取代反应,是卤代烃在碱性条件下的水解反应。
(3) C(C6H8N2) D(C6H6O2):对比C与D的分子式,D比C的分子少了2个N和2个H,多2个O,根据分子式可判断反应类型可能为取代反应,为苯环上的2个—NH2被2个—OH取代。
(4) :对比C、D、F的分子式,C、D中碳原子数之和与F相等,氢原子少2个,则C+D→E先发生加成反应(醛与醛的加成),再发生消去反应生成碳碳双键,E→F可能为醛基的氧化。
(5) :C、D的分子式恰好相差1个C2H4,故C→D为加成反应,可能是H3COOCCH =CH—CH =CHCOOCH3与CH2 =CH2发生的1,4-加成反应。
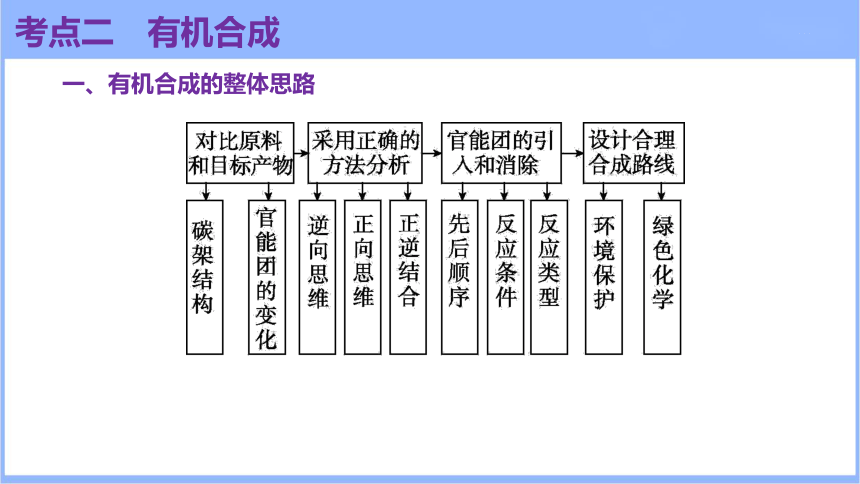
一、有机合成的整体思路
考点二 有机合成
二、有机合成中常见结构变化
1.有机合成中碳骨架的构建
(1)链增长的反应
加聚反应;缩聚反应;酯化反应;利用题目信息所给反应(如卤代烃的取代反应,醛、酮的加成反应等)。
①醛、酮与HCN加成
+H—CN →
②醛、酮与RMgX加成
+RMgX →
③醛、酮的羟醛缩合(其中至少一种有α-H)
+
④卤代烃与活泼金属作用
2R—Cl+2Na R—R+2NaCl
(2)链缩短的反应
①烷烃的裂化反应;②利用题目信息所给的反应,如烯烃、炔烃、苯的某些同系物的氧化反应,羧酸及其盐的脱羧反应等。
(3)成环的方法
①二元醇脱水成环醚;②二元醇与二元羧酸成环酯;
③羟基酸分子间成环酯;④氨基酸分子间成环等。
2.常见官能团转化
(1)官能团的引入
引入官能团 引入方法
碳卤键 ①烃、酚的取代;
②不饱和烃与HX、X2的加成;
③醇与氢卤酸(HX)反应
羟基 ①烯烃与水加成;
②醛或酮与氢气加成;
③卤代烃在碱性条件下水解;
④酯的水解;
⑤葡萄糖发酵产生乙醇;
⑥酚钠盐中滴加酸或通入CO2
引入官能团 引入方法
碳碳双键 ①某些醇或卤代烃的消去;
②炔烃不完全加成;
③烷烃裂化
醛基或 酮羰基 ①醇的催化氧化;
②连在同一个碳上的两个羟基脱水;
③含碳碳三键的物质与水加成
羧基 ①醛基氧化;
②酯、酰胺、肽、蛋白质、羧酸盐的水解
(2)官能团的改变
①通过某些化学途径使一个官能团变成两个
a.CH3CH2OH→CH2 =CH2→CH2XCH2X→CH2OHCH2OH;
b.CH2 =CHCH2CH3→CH3CHXCH2CH3→CH3CH=CHCH3
→CH3CHXCHXCH3→CH2 =CHCH =CH2。
②通过某些手段改变官能团的位置
CH3CHXCHXCH3→H2C =CHCH =CH2→CH2XCH2CH2CH2X。
③利用官能团的衍生关系进行衍变
R—CH2OH R—CHO R—COOH。
(3)官能团的消除
①通过加成反应可消除 或—C≡C—。
②通过消去、氧化或酯化反应可消除—OH。
③通过加成或氧化反应可消除—CHO。
④通过水解反应可消除 、酰胺基。
⑤通过消去反应或水解反应消除碳卤键。
三、有机合成中常用方法
1.正合成分析法
从基础原料入手,找出合成所需的直接或间接的中间体,逐步推向合成的目标有机物,其合成示意图为基础原料→中间体1→中间体2→……→目标有机物。
2.逆合成分析法
设计复杂有机物的合成路线时常用的方法。它是由目标有机物倒推寻找上一步反应的中间体n,而中间体n又可以由中间体(n-1)得到,依次倒推,最后确定最适宜的基础原料和最终的合成路线。常用“ ”表示逆推过程。
(1)有机合成的思路就是通过有机反应构建目标化合物分子的碳骨架,并引入或转化成所需的官能团 ( )
(2)逆合成分析法可以简单表示为目标化合物 中间体Ⅱ 中间体Ⅰ
基础原料 ( )
(3)为减少污染,有机合成设计不能使用辅助原料,不能有副产物 ( )
√
√
×
[解析]有机合成中需要一些必要的辅助原料,但使用辅助原料应是低毒、低污染、易得和廉价的。
基础知识秒杀(正确的打“√”,错误的打“×”)
(4)通过加成反应不能引入碳碳双键官能团 ( )
×
[解析]碳碳三键通过加成反应能引入碳碳双键。
(5)酯基官能团只能通过酯化反应得到( )
×
[解析]酯基官能团还可用酰卤或酸酐与醇反应,或由羧酸盐与卤代烃反应制得。
(6)由CH3CH3→CH3CH2Cl→CH2 =CH2→CH3CH2OH的转化过程中,经过的反应类型是取代反应→消去反应→加成反应( )
√
以CH2 =CHCH2OH为主要原料(无机试剂任用),设计CH2 =CHCOOH的合成路线流程图(已知CH2 =CH2可被氧气催化氧化为 ),通过此题的解答,总结设计有机合成路线需注意的情况(至少写2条):
。
CH2 =CHCH2OH CH3CHClCH2OH CH3CHClCOOH
CH2 =CHCOONa CH2 =CHCOOH;
选择合适的反应条件、要注意官能团的保护
[解析]以CH2 =CHCH2OH为主要原料合成CH2 =CHCOOH,CH2 =CHCH2OH可先和HCl发生加成反应,保护碳碳双键,再利用强氧化剂将醇羟基氧化为羧基,最后结合卤代烃的消去引入碳碳双键;在选择合成路线时,需要选择合适的反应条件,同时注意官能团的保护,上述流程中用强氧化剂氧化羟基生成羧基时需要防止碳碳双键被氧化,故需要先保护碳碳双键。
[归纳总结] 常见有机合成路线
(1)一元合成路线
R—CH =CH2 卤代烃 一元醇→一元醛→一元羧酸→酯
(2)二元合成路线
CH2 =CH2 X CH2—CH2X 二元醇→二元醛→二元羧酸→链酯、环酯、高聚酯
(3)芳香族化合物合成路线
①苯的一系列常见的衍变关系
②甲苯的一系列常见的衍变关系
a.
b.
c.
③对二甲苯的一系列常见的衍变关系
1. [2022·湖北卷] 化合物F是制备某种
改善睡眠药物的中间体,其合成
路线如下:
回答下列问题:
(1)A→B的反应类型是
。
取代反应(或酯化反应)
链接高考
[解析]由A、B的结构及反应条件可知,A→B为酯化反应,B和CH3I在有机强碱作用下生成C,结合C的分子式以及D的结构简式可分析得出C的结构简式为
,C与H2C =CHCH2Br发生取代反应生成D,E结构中存在环状酯结构,采用逆推的方式可得到 ,存在羧基和醇羟基,再结合两种官能团的位置及支链中碳原子的个数可知,D中酯基先被还原成醇羟基: ,
碳碳双键再被氧化成羧基: ,然后发生酯化反应生成E,E与Pd配合物在碱的催化下反应生成F。 (1)由分析可知,A→B为酯化反应,也属于取代反应。
(2)化合物B核磁共振氢谱的吸收峰有 组。
(3)化合物C的结构简式为 。
(4)D→E的过程中,被还原的官能团是 ,
被氧化的官能团是 。
5
[解析] (2)核磁共振氢谱的吸收峰数目等于有机化合物中氢原子的种类数,即有多少种化学环境不同的氢原子,由B的结构简式可知,B中有5种氢原子,所以核磁共振氢谱有5组吸收峰。
酯基
碳碳双键
(5)若只考虑氟的位置异构,则化合物F的同分异构体有 种。
(6)已知A→D、D→E和E→F的产率分别为
70%、82%和80%,则A→F的总产率为 。
5
[解析] (5)只考虑氟的位置异构, F中氟原子没取代之前有6种类型氢原子,如图: ,取代后有6种氟代物,除去F本身,应为5种同分异构体。
(6)A→F的过程中,A→D、D→E和E→F的产率分别为70%、82%和80%,则A→F的产率为70%×82%×80%=45.92%。
45.92%
(7)Pd配合物可催化E→F转化中C—Br键断裂,也能催化反应①:
反应①:
为探究有机小分子催化反应①的可能性,甲、乙两个研究小组分别合成了有机小分子S-1(结构如图所示)。在合成S-1的过程中,甲组使用了Pd催化剂,并在纯化过程中用沉淀剂除Pd;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
根据上述信息,甲、乙两组合成的S-1产品催化性能出现差异的原因是
。
甲组使用的Pd催化剂未完全除尽,与S-1形成的Pd配合物继续催化反应①
[解析]甲乙两组合成的小分子催化剂结构相同,但只有使用了Pd催化剂的甲组才能催化反应①,而乙组不能催化反应①,说明有机小分子S-1不是反应①的催化剂,根据已知条件,Pd配合物也能催化反应①,可推测,金属Pd在催化甲组合成S-1后,并没有完全除尽,有残留,与S-1形成的Pd配合物继续催化反应①。
2. [2022·湖南卷] 物质J是一种具有生物活性的化合物。该化合物的合成路线如下:
已知:
① +[Ph3CH2R']Br-
②
回答下列问题:
(1)A中官能团的名称为 、 ;
(2)F→G、G→H的反应类型分别是 、 ;
醚键
醛基
取代反应
加成反应
[解析] 根据已知①可以推出B的结构简式为 ;B和HCOONH4在Pd/C作用下发生反应得到C(C12H16O4),C又转化为D(C12O14O3),根据已知②可推出C的结构简式为 ,D的结构简式为 ;D和 反应生成E;E在一定条件下被氧化转化为F;F和CH3I在碱的作用下反应得到G(C15H18O5),G和 在碱的作用下反应得到H,对比F和H的结构简式可知G的结构简式为 。(2)由分析可知,G的结构简式为 ,对比F和G的结构简式可知F→G的反应为取代反应;G→H的反应中, 的碳碳双键变为碳碳单键,则该反应为加成反应。
(3)B的结构简式为 ;
(4)C→D反应方程式为 ;
(5) 是一种重要的化工原料,其同分异构体中能够发生银镜反应的有
种(考虑立体异构),其中核磁共振氢谱有3组峰,且峰面积之比为4∶1∶1的结构简式为 ;
+H2O
5
[解析] (5) 的同分异构体能发生银镜反应,说明该物质含有醛基,根据分子式C4H6O可知,该物质还含有碳碳双键或者三元环,则符合条件的同分异构体(考虑立体异构)有5种,它们分别是H2C =CHCH2CHO、 、 、 和
,其中核磁共振氢谱有3组峰,且峰面积之比为4∶1∶1的结构简式是 。
(6)I中的手性碳原子个数为 (连四个不同的原子或原子团的碳原子称为手性碳原子);
1
[解析]连四个不同的原子或原子团的碳原子称为手性碳原子,则I中手性碳原子的个数为1,是连有甲基的碳原子。
(7)参照上述合成路线,以 和 为原料,设计合成 的路线(无机试剂任选)。
[答案]
[解析]结合G→I的转化过程可知,可先将 转化为 ,再使
和 在碱的作用下反应生成 ,最终在碱的作用下转化为 。
阳光总在风雨后 2024,高考加油!
第5讲 有机推断与合成
2024届高考化学一轮复习课件
第九章 有机化合物
考点一 有机综合推断
考点二 有机合成
链接高考
本节目录
内容要求 核心素养
认识加成、取代、消去反应及氧化还原反应的特点和规律,了解有机反应类型和有机化合物组成结构特点的关系。认识有机合成的关键是碳骨架的构建和官能团的转化,了解设计有机合成路线的一般方法 [证据推理与模型认知] 综合应用有关知识完成推断有机化合物、检验官能团、设计有机合成路线
一、有机综合推断的突破口
有机综合推断题常以框图或变相框图的形式呈现一系列物质的衍变关系,经常是在一系列衍变关系中有部分产物已知或衍变条件已知,因而解答此类问题的关键是熟悉烃及各种衍生物之间的转化关系及转化条件。
1.根据转化关系推断有机物的类别
考点一 有机综合推断
醇、醛、羧酸、酯之间的相互衍变关系是有机物结构推断的重要突破口,它们之间的相互转化关系如图所示:
上图中,A能连续氧化生成C,且A、C在浓硫酸存在下加热生成D,则:
(1)A为 ,B为醛,C为 ,D为 。
(2)A、B、C三种物质中碳原子数 ,碳骨架结构 。
(3)A分子中含 结构。
醇
羧酸
酯
相同
相同
—CH2OH
2.根据反应条件推断反应类型或可能含有的官能团
反应条件 反应类型及可能含有的官能团或基团
浓硫酸,加热 醇的消去(醇羟基);成醚反应(羟基);酯化反应(含有羟基、羧基)
稀硫酸,加热 酯的水解(酯基);二糖、多糖的水解
NaOH 水溶液,加热 卤代烃的水解(碳卤键);酯的水解 (酯基)
NaOH 醇溶液,加热 卤代烃的消去(碳卤键)
O2/Cu、加热 醇羟基的催化氧化 (—CH2OH、 )
Cl2(Br2)/Fe或FeX3 苯环的卤代反应
反应条件 反应类型及可能含有的官能团或基团
Cl2(Br2), 光照 烷烃或苯环上烷基的卤代反应
Br2的CCl4溶液 加成( 、—C≡C—)
H2/催化剂 加成( 、—C≡C—、—CHO、酮羰基、苯环)
A氧化生成B, B氧化生成C A→B:氧化反应(A含—CH2OH或 );
B→C:氧化反应(B含醛基)
3.根据有机反应中定量关系推断官能团的数目
(1)烃和卤素单质的取代:取代1 mol氢原子,消耗1 mol卤素单质(X2)。
(2) 的加成:与H2、Br2、HCl、H2O等加成时按物质的量之比为1∶1加成。
(3)含—OH的有机物与Na反应时:2 mol —OH生成1 mol H2。
(4)1 mol —CHO对应2 mol Ag或1 mol —CHO对应1 mol Cu2O(注意:HCHO中相当于有2个—CHO)。
二、有机综合推断思维模型
[学科能力提升]
分析反应物、产物的分子式,根据其差异,联想已知有机化学知识,猜想可能的有机反应类型,由此确定反应物、产物的结构特点,结合框图中的其他物质,确定具体的结构。举例如下:
(1)F(C6H6O) → G(C6H5NO3):对比F与G的分子式,G比F的分子少1个H,多1个N和2个O,可判断反应类型可能为取代反应,F若为苯酚,则G可能为硝基苯酚。
(2)C(C3H6OCl2) → D(C3H8O3):对比C与D的分子式,D比C的分子少2个Cl,多2个O和2个H,根据分子式可判断反应类型可能为取代反应,是卤代烃在碱性条件下的水解反应。
(3) C(C6H8N2) D(C6H6O2):对比C与D的分子式,D比C的分子少了2个N和2个H,多2个O,根据分子式可判断反应类型可能为取代反应,为苯环上的2个—NH2被2个—OH取代。
(4) :对比C、D、F的分子式,C、D中碳原子数之和与F相等,氢原子少2个,则C+D→E先发生加成反应(醛与醛的加成),再发生消去反应生成碳碳双键,E→F可能为醛基的氧化。
(5) :C、D的分子式恰好相差1个C2H4,故C→D为加成反应,可能是H3COOCCH =CH—CH =CHCOOCH3与CH2 =CH2发生的1,4-加成反应。
一、有机合成的整体思路
考点二 有机合成
二、有机合成中常见结构变化
1.有机合成中碳骨架的构建
(1)链增长的反应
加聚反应;缩聚反应;酯化反应;利用题目信息所给反应(如卤代烃的取代反应,醛、酮的加成反应等)。
①醛、酮与HCN加成
+H—CN →
②醛、酮与RMgX加成
+RMgX →
③醛、酮的羟醛缩合(其中至少一种有α-H)
+
④卤代烃与活泼金属作用
2R—Cl+2Na R—R+2NaCl
(2)链缩短的反应
①烷烃的裂化反应;②利用题目信息所给的反应,如烯烃、炔烃、苯的某些同系物的氧化反应,羧酸及其盐的脱羧反应等。
(3)成环的方法
①二元醇脱水成环醚;②二元醇与二元羧酸成环酯;
③羟基酸分子间成环酯;④氨基酸分子间成环等。
2.常见官能团转化
(1)官能团的引入
引入官能团 引入方法
碳卤键 ①烃、酚的取代;
②不饱和烃与HX、X2的加成;
③醇与氢卤酸(HX)反应
羟基 ①烯烃与水加成;
②醛或酮与氢气加成;
③卤代烃在碱性条件下水解;
④酯的水解;
⑤葡萄糖发酵产生乙醇;
⑥酚钠盐中滴加酸或通入CO2
引入官能团 引入方法
碳碳双键 ①某些醇或卤代烃的消去;
②炔烃不完全加成;
③烷烃裂化
醛基或 酮羰基 ①醇的催化氧化;
②连在同一个碳上的两个羟基脱水;
③含碳碳三键的物质与水加成
羧基 ①醛基氧化;
②酯、酰胺、肽、蛋白质、羧酸盐的水解
(2)官能团的改变
①通过某些化学途径使一个官能团变成两个
a.CH3CH2OH→CH2 =CH2→CH2XCH2X→CH2OHCH2OH;
b.CH2 =CHCH2CH3→CH3CHXCH2CH3→CH3CH=CHCH3
→CH3CHXCHXCH3→CH2 =CHCH =CH2。
②通过某些手段改变官能团的位置
CH3CHXCHXCH3→H2C =CHCH =CH2→CH2XCH2CH2CH2X。
③利用官能团的衍生关系进行衍变
R—CH2OH R—CHO R—COOH。
(3)官能团的消除
①通过加成反应可消除 或—C≡C—。
②通过消去、氧化或酯化反应可消除—OH。
③通过加成或氧化反应可消除—CHO。
④通过水解反应可消除 、酰胺基。
⑤通过消去反应或水解反应消除碳卤键。
三、有机合成中常用方法
1.正合成分析法
从基础原料入手,找出合成所需的直接或间接的中间体,逐步推向合成的目标有机物,其合成示意图为基础原料→中间体1→中间体2→……→目标有机物。
2.逆合成分析法
设计复杂有机物的合成路线时常用的方法。它是由目标有机物倒推寻找上一步反应的中间体n,而中间体n又可以由中间体(n-1)得到,依次倒推,最后确定最适宜的基础原料和最终的合成路线。常用“ ”表示逆推过程。
(1)有机合成的思路就是通过有机反应构建目标化合物分子的碳骨架,并引入或转化成所需的官能团 ( )
(2)逆合成分析法可以简单表示为目标化合物 中间体Ⅱ 中间体Ⅰ
基础原料 ( )
(3)为减少污染,有机合成设计不能使用辅助原料,不能有副产物 ( )
√
√
×
[解析]有机合成中需要一些必要的辅助原料,但使用辅助原料应是低毒、低污染、易得和廉价的。
基础知识秒杀(正确的打“√”,错误的打“×”)
(4)通过加成反应不能引入碳碳双键官能团 ( )
×
[解析]碳碳三键通过加成反应能引入碳碳双键。
(5)酯基官能团只能通过酯化反应得到( )
×
[解析]酯基官能团还可用酰卤或酸酐与醇反应,或由羧酸盐与卤代烃反应制得。
(6)由CH3CH3→CH3CH2Cl→CH2 =CH2→CH3CH2OH的转化过程中,经过的反应类型是取代反应→消去反应→加成反应( )
√
以CH2 =CHCH2OH为主要原料(无机试剂任用),设计CH2 =CHCOOH的合成路线流程图(已知CH2 =CH2可被氧气催化氧化为 ),通过此题的解答,总结设计有机合成路线需注意的情况(至少写2条):
。
CH2 =CHCH2OH CH3CHClCH2OH CH3CHClCOOH
CH2 =CHCOONa CH2 =CHCOOH;
选择合适的反应条件、要注意官能团的保护
[解析]以CH2 =CHCH2OH为主要原料合成CH2 =CHCOOH,CH2 =CHCH2OH可先和HCl发生加成反应,保护碳碳双键,再利用强氧化剂将醇羟基氧化为羧基,最后结合卤代烃的消去引入碳碳双键;在选择合成路线时,需要选择合适的反应条件,同时注意官能团的保护,上述流程中用强氧化剂氧化羟基生成羧基时需要防止碳碳双键被氧化,故需要先保护碳碳双键。
[归纳总结] 常见有机合成路线
(1)一元合成路线
R—CH =CH2 卤代烃 一元醇→一元醛→一元羧酸→酯
(2)二元合成路线
CH2 =CH2 X CH2—CH2X 二元醇→二元醛→二元羧酸→链酯、环酯、高聚酯
(3)芳香族化合物合成路线
①苯的一系列常见的衍变关系
②甲苯的一系列常见的衍变关系
a.
b.
c.
③对二甲苯的一系列常见的衍变关系
1. [2022·湖北卷] 化合物F是制备某种
改善睡眠药物的中间体,其合成
路线如下:
回答下列问题:
(1)A→B的反应类型是
。
取代反应(或酯化反应)
链接高考
[解析]由A、B的结构及反应条件可知,A→B为酯化反应,B和CH3I在有机强碱作用下生成C,结合C的分子式以及D的结构简式可分析得出C的结构简式为
,C与H2C =CHCH2Br发生取代反应生成D,E结构中存在环状酯结构,采用逆推的方式可得到 ,存在羧基和醇羟基,再结合两种官能团的位置及支链中碳原子的个数可知,D中酯基先被还原成醇羟基: ,
碳碳双键再被氧化成羧基: ,然后发生酯化反应生成E,E与Pd配合物在碱的催化下反应生成F。 (1)由分析可知,A→B为酯化反应,也属于取代反应。
(2)化合物B核磁共振氢谱的吸收峰有 组。
(3)化合物C的结构简式为 。
(4)D→E的过程中,被还原的官能团是 ,
被氧化的官能团是 。
5
[解析] (2)核磁共振氢谱的吸收峰数目等于有机化合物中氢原子的种类数,即有多少种化学环境不同的氢原子,由B的结构简式可知,B中有5种氢原子,所以核磁共振氢谱有5组吸收峰。
酯基
碳碳双键
(5)若只考虑氟的位置异构,则化合物F的同分异构体有 种。
(6)已知A→D、D→E和E→F的产率分别为
70%、82%和80%,则A→F的总产率为 。
5
[解析] (5)只考虑氟的位置异构, F中氟原子没取代之前有6种类型氢原子,如图: ,取代后有6种氟代物,除去F本身,应为5种同分异构体。
(6)A→F的过程中,A→D、D→E和E→F的产率分别为70%、82%和80%,则A→F的产率为70%×82%×80%=45.92%。
45.92%
(7)Pd配合物可催化E→F转化中C—Br键断裂,也能催化反应①:
反应①:
为探究有机小分子催化反应①的可能性,甲、乙两个研究小组分别合成了有机小分子S-1(结构如图所示)。在合成S-1的过程中,甲组使用了Pd催化剂,并在纯化过程中用沉淀剂除Pd;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
根据上述信息,甲、乙两组合成的S-1产品催化性能出现差异的原因是
。
甲组使用的Pd催化剂未完全除尽,与S-1形成的Pd配合物继续催化反应①
[解析]甲乙两组合成的小分子催化剂结构相同,但只有使用了Pd催化剂的甲组才能催化反应①,而乙组不能催化反应①,说明有机小分子S-1不是反应①的催化剂,根据已知条件,Pd配合物也能催化反应①,可推测,金属Pd在催化甲组合成S-1后,并没有完全除尽,有残留,与S-1形成的Pd配合物继续催化反应①。
2. [2022·湖南卷] 物质J是一种具有生物活性的化合物。该化合物的合成路线如下:
已知:
① +[Ph3CH2R']Br-
②
回答下列问题:
(1)A中官能团的名称为 、 ;
(2)F→G、G→H的反应类型分别是 、 ;
醚键
醛基
取代反应
加成反应
[解析] 根据已知①可以推出B的结构简式为 ;B和HCOONH4在Pd/C作用下发生反应得到C(C12H16O4),C又转化为D(C12O14O3),根据已知②可推出C的结构简式为 ,D的结构简式为 ;D和 反应生成E;E在一定条件下被氧化转化为F;F和CH3I在碱的作用下反应得到G(C15H18O5),G和 在碱的作用下反应得到H,对比F和H的结构简式可知G的结构简式为 。(2)由分析可知,G的结构简式为 ,对比F和G的结构简式可知F→G的反应为取代反应;G→H的反应中, 的碳碳双键变为碳碳单键,则该反应为加成反应。
(3)B的结构简式为 ;
(4)C→D反应方程式为 ;
(5) 是一种重要的化工原料,其同分异构体中能够发生银镜反应的有
种(考虑立体异构),其中核磁共振氢谱有3组峰,且峰面积之比为4∶1∶1的结构简式为 ;
+H2O
5
[解析] (5) 的同分异构体能发生银镜反应,说明该物质含有醛基,根据分子式C4H6O可知,该物质还含有碳碳双键或者三元环,则符合条件的同分异构体(考虑立体异构)有5种,它们分别是H2C =CHCH2CHO、 、 、 和
,其中核磁共振氢谱有3组峰,且峰面积之比为4∶1∶1的结构简式是 。
(6)I中的手性碳原子个数为 (连四个不同的原子或原子团的碳原子称为手性碳原子);
1
[解析]连四个不同的原子或原子团的碳原子称为手性碳原子,则I中手性碳原子的个数为1,是连有甲基的碳原子。
(7)参照上述合成路线,以 和 为原料,设计合成 的路线(无机试剂任选)。
[答案]
[解析]结合G→I的转化过程可知,可先将 转化为 ,再使
和 在碱的作用下反应生成 ,最终在碱的作用下转化为 。
阳光总在风雨后 2024,高考加油!
同课章节目录
