2024届高三化学一轮复习课件:化学反应的方向与调控 课件(共30张PPT)
文档属性
| 名称 | 2024届高三化学一轮复习课件:化学反应的方向与调控 课件(共30张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 943.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-16 17:17:37 | ||
图片预览











文档简介
(共30张PPT)
化学反应的方向与调控
1.自发反应
(1)含义
在温度和压强一定的条件下 就能自发进行的反应称为自发反应。
(2)特点
①体系趋向于从 状态转变为 状态(体系对外部 或
热量)。
②在密闭条件下,体系有从 自发地转变为 的倾向性(无序体系更加稳定)。
无需借助外力
高能
低能
做功
释放
有序
无序
2.熵和熵变
(1)熵是量度体系 的物理量,符号为S。
(2)影响熵大小的因素:
①相同条件下,物质不同熵不同。
②同一物质:S(g) S(l) S(s)。
(3)熵变(ΔS)= 的总熵- 的总熵。
混乱程度
>
>
生成物
反应物
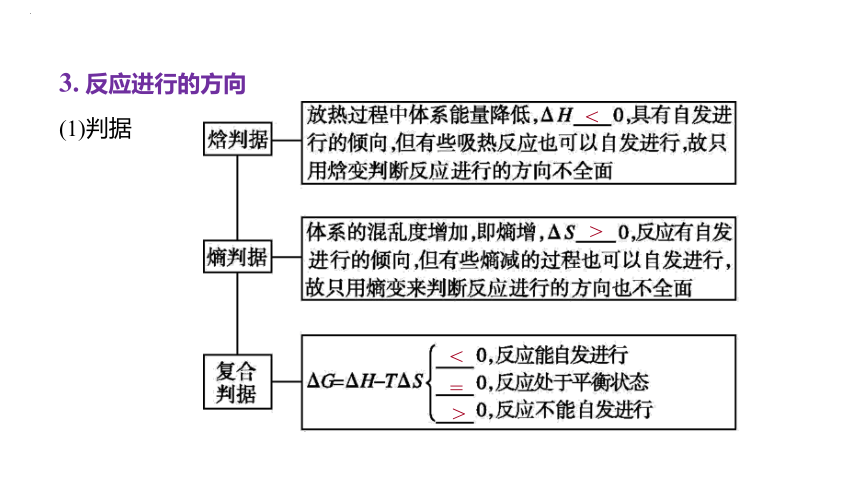
3. 反应进行的方向
(1)判据
<
>
<
=
>
(2)一般规律:
①ΔH 0,ΔS 0的反应任何温度下都能自发进行;
②ΔH 0,ΔS 0的反应任何温度下都不能自发进行;
③ΔH和ΔS的作用相反,且相差不大时, 对反应的方向起决定性作用。当ΔH<0,ΔS<0时 下反应能自发进行;当ΔH>0,ΔS>0时, 下反应能自发进行。
说明:对于一个特定的气相反应,熵变的大小取决于反应前后气体物质的化学计量数的大小。
<
>
>
<
温度
低温
高温
1.判断正误(正确的打“√”,错误的打“×”)
(1)能自发进行的反应,一定是放热反应( )
(2)同种物质不同状态时熵值不同,气态时最大 ( )
(3)在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大 ( )
(4)熵增的反应一定能自发进行( )
×
[解析]吸热反应也可能自发进行。
√
√
[解析]反应的自发性由焓判据和熵判据共同决定。
×
(5)一个反应能否自发进行取决于该反应是放热还是吸热( )
(6)用焓判据或熵判据判断同一反应进行的方向其结果相同( )
×
[解析]反应能否自发进行与ΔH、ΔS有关。
×
[解析]用焓判据或熵判据判断同一反应进行的方向其结果不一定相同。
2. 25 ℃和1.01×105 Pa时,反应:2N2O5(g) =4NO2(g)+O2(g) ΔH=+56.7 kJ·mol-1能自发进行,其原因是 。
熵增效应大于能量效应
[解析]根据熵判据,该反应是熵增反应,能自发进行;根据焓判据,该反应是吸热反应,不能自发进行。事实上该反应能自发进行,说明熵增效应大于能量效应。
1. 下列说法正确的是 ( )
A.常温下,1 mol SO2的熵值小于1 mol SO3
B.自发反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH>0,则ΔS>0
C.可以把CO分解:2CO(g) = 2C(s)+O2(g),收集碳,实现变废为宝
D.NaNO2溶于水,ΔH<0,ΔS<0
题组 化学反应进行的方向
B
[解析]常温下,SO2为气态,SO3为液态,所以1 mol SO2的熵值大于1 mol SO3,故A错误;
CO2(g)+H2(g) CO(g)+H2O(g) ΔH>0,因ΔH-TΔS<0能自发,所以ΔS>0,故B正确;
1. 下列说法正确的是 ( )
A.常温下,1 mol SO2的熵值小于1 mol SO3
B.自发反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH>0,则ΔS>0
C.可以把CO分解:2CO(g) = 2C(s)+O2(g),收集碳,实现变废为宝
D.NaNO2溶于水,ΔH<0,ΔS<0
题组 化学反应进行的方向
B
反应2CO(g) =2C(s)+O2(g)是ΔH>0,ΔS<0,则ΔH-TΔS>0,所以该反应不能自发进行,故C错误;
NaNO2溶于水吸收热量,ΔH>0,故D错误。
2.灰锡结构松散,不能用于制造器皿,而白锡结构坚固,可以制造器皿。现把白锡制成的器皿放在0 ℃、100 kPa的室内存放,它会不会变成灰锡而不能再继续使用(已知:在0 ℃、100 kPa条件下白锡转化为灰锡的反应焓变和熵变分别为ΔH=-2 180.9 J·mol-1,ΔS=-6.61 J·mol-1·K-1) ( )
A.会变成灰锡 B.不会变成灰锡
C.不能确定 D.升高温度才会变成灰锡
A
[解析]在等温、等压条件下,自发反应总是向着ΔH-TΔS<0的方向进行。因此,在0 ℃、100 kPa条件下,白锡会不会变为灰锡的问题就转化为求算反应:白锡→灰锡的ΔH-TΔS值的问题。ΔH-TΔS=-2 180.9 J·mol-1-273 K×(-6.61 J·mol-1·K-1)≈
-376.37 J·mol-1<0,因此在该条件下白锡会变为灰锡。
3.已知在100 kPa、298.15 K时石灰石分解的反应为CaCO3(s) =CaO(s)+CO2(g) ΔH=+178.3 kJ·mol-1、ΔS=160.4 J·mol-1·K-1,回答下列问题。
(1)该反应 (填“能”或“不能”)自发进行。
(2)据本题反应数据分析,温度 (填“能”或“否”)成为反应方向的决定因素。
(3)若温度能决定反应方向,则该反应自发进行的最低温度为 。
不能
[解析] (1)ΔH-TΔS=+178.3 kJ·mol-1-298.15 K×160.4×10-3 kJ·mol-1·K-1≈130.5 kJ·mol-1>0,所以该反应不能自发进行。
(2)因为该反应的ΔH>0、ΔS>0,所以在温度较高的时候,ΔH-TΔS可能小于0。
(3)根据ΔH-TΔS<0时,反应可自发进行,则有T>≈1 111.6 K。
能
1 111.6 K
[归纳总结] 四象限法判断反应能否自发进行
在温度、压强一定的条件下,反应总是向ΔG=ΔH-TΔS<0的方向进行,直至达到平衡状态。化学反应方向可归纳为如下四个方面:
1. 控制反应条件的目的
(1)促进有利的化学反应
通过控制反应条件,可以 化学反应速率, 反应物的转化率,从而促进有利的化学反应进行。
(2)抑制有害的化学反应
通过控制反应条件,可以 化学反应速率,减少甚至消除有害物质的产生或控制副反应的发生,从而抑制有害的化学反应继续进行。
加快
提高
减缓
2.控制反应条件的基本措施
(1)控制化学反应速率的措施
通过改变反应体系的 、溶液的浓度、气体的 (或浓度)、固体的 以及使用催化剂等途径调控反应速率。
(2)提高转化率的措施
通过改变可逆反应体系的温度、溶液的浓度、气体的压强(或浓度)等改变可逆反应的限度,从而提高转化率。如:以工业合成氨为例,理解运用化学反应原理选择化工生产中的适宜条件
温度
压强
表面积
①反应原理
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
②
放热
减少
③从反应快慢和反应限度两个角度选择反应条件
④综合考虑——选择适宜的生产条件
温度: ℃。 压强: MPa。
投料比:=。
以 作催化剂,采用 提高原料利用率。
升高
增大
催化剂
增大
降低
400~500
10~30
铁触媒
循环操作
[解析]合成氨反应ΔH<0,温度越低越利于平衡正向移动。
1.判断正误(正确的打“√”,错误的打“×”)
(1)合成氨反应在高温下能自发进行( )
(2)温度越高越利于合成氨反应平衡正向移动( )
×
[解析]合成氨反应ΔH<0,ΔS<0,ΔH-TΔS在低温下小于0。
×
(3)合成氨反应中,压强越大越利于反应速率加快和平衡正向移动 ( )
(4)使用催化剂能提高合成氨反应物的平衡转化率( )
√
×
[解析]催化剂同倍数地加快正、逆反应速率,对平衡转化率无影响。
2.工业上合成氨一般采用700 K左右的温度,其原因是 。
①适当提高氨的合成速率
②提高H2的转化率
③提高氨的产率
④催化剂在700 K时活性最大
①④
1. 主要成分为H2S的工业废气的回收利用有重要意义。根据文献,将H2S和CH4的混合气体导入石英管反应器热解(一边进料,另一边出料),发生如下反应:
Ⅰ.2H2S(g) 2H2(g)+S2(g) ΔH1=+170 kJ·mol-1
Ⅱ.CH4(g)+S2(g) CS2(g)+2H2(g) ΔH2=+64 kJ·mol-1
总反应:Ⅲ.2H2S(g)+CH4(g) CS2(g)+4H2(g)
投料按体积之比V(H2S)∶V(CH4)=2∶1,并用N2稀释;常压、不同温度下反应相同时间后,测得H2和CS2的体积分数
如下表:
题组 反应条件的控制
温度/℃ 950 1000 1050 1100 1150
H2/(V%) 0.5 1.5 3.6 5.5 8.5
CS2/(V%) 0.0 0.0 0.1 0.4 1.8
请回答:
(1)反应Ⅲ能自发进行的条件是 。
[解析]根据盖斯定律可知反应Ⅰ+反应Ⅱ即得到反应Ⅲ的ΔH=+234 kJ·mol-1,这说明反应Ⅲ是气体分子数增多(即ΔS>0)的吸热反应,根据ΔG=ΔH-TΔS<0反应自发进行可知,反应Ⅲ自发进行的条件是高温。
高温
(2)下列说法正确的是 。
A.其他条件不变时,用Ar替代N2作稀释气体,对实验结果几乎无影响
B.其他条件不变时,温度越高,H2S的转化率越高
C.由实验数据推出H2S中的S—H键强于CH4中的C—H键
D.恒温恒压下,增加N2的体积分数,H2的浓度升高
[解析] Ar是稀有气体,与体系中物质不反应,所以其他条件不变时,用Ar替代N2作稀释气体,对实验结果几乎无影响,A正确;
反应Ⅰ和Ⅲ的正反应均吸热,升高温度平衡正向移动,温度越高,H2S的转化率越高,B正确;
AB
(2)下列说法正确的是 。
A.其他条件不变时,用Ar替代N2作稀释气体,对实验结果几乎无影响
B.其他条件不变时,温度越高,H2S的转化率越高
C.由实验数据推出H2S中的S—H键强于CH4中的C—H键
D.恒温恒压下,增加N2的体积分数,H2的浓度升高
根据表中数据无法得出H2S中S—H和CH4中C—H的相对强弱,事实上C—H的键能大于S—H键能,C错误;
恒温恒压下,增加N2的体积分数,相当于增大容积减小压强,平衡正向移动,H2的物质的量增加,但容器容积增加,H2浓度减小,D错误。
AB
(3)在1000 ℃、常压下,保持通入的H2S体积分数不变,提高投料比[V(H2S)∶V(CH4)],H2S的转化率不变,原因是 。
[解析]根据表中数据可知1000 ℃时CH4不参与反应,相同分压的H2S经历相同的时间转化率相同,所以在1000 ℃、常压下,保持通入的H2S体积分数不变,提高投料比[V(H2S)∶V(CH4)]时H2S的转化率不变。
1000 ℃时CH4不参与反应,相同分压的H2S经历相同的时间转化率相同
温度/℃ 950 1000 1050 1100 1150
H2/(V%) 0.5 1.5 3.6 5.5 8.5
CS2/(V%) 0.0 0.0 0.1 0.4 1.8
(4)在950~1150 ℃范围内(其他条件不变),S2(g)的体积分数随温度升高发生变化,写出该变化规律并分析原因: 。
[解析]由于在低温段,以反应Ⅰ为主,随温度升高,S2(g)的体积分数增大;在高温段,随温度升高,反应Ⅱ消耗S2的速率大于反应Ⅰ生成S2的速率,S2(g)的体积分数减小,因此变化规律是先升后降。
先升后降。在低温段,以反应Ⅰ为主,随温度升高,S2(g)的体积分数增大;在高温段,随温度升高,反应Ⅱ消耗S2的速率大于反应Ⅰ生成S2的速率,S2(g)的体积分数减小
2.二氧化碳是一种宝贵的碳氧资源。以CO2和NH3为原料合成尿素是固定和利用CO2的成功范例。在尿素合成塔中的主要反应可表示为:
反应Ⅰ:2NH3(g)+CO2(g) NH2COONH4(s) ΔH1=-159.47 kJ·mol-1
反应Ⅱ:NH2COONH4(s) CO(NH2)2(s)+H2O(g) ΔH2=+72.49 kJ·mol-1
请回答下列问题:
(1)写出以CO2和NH3为原料生成尿素和气态水的热化学方程式: ,反应Ⅱ自发进行的条件是 。
2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ΔH=-86.98 kJ·mol-1
高温
[解析]反应Ⅰ:2NH3(g)+CO2(g) NH2COONH4(s) ΔH1=-159.47 kJ·mol-1,反应Ⅱ:NH2COONH4(s) CO(NH2)2(s)+H2O(g) ΔH2=+72.49 kJ·mol-1 ,由盖斯定律:反应Ⅰ+反应Ⅱ,得到2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ΔH3=-86.98 kJ·mol-1;反应Ⅱ的ΔH>0,ΔS>0,要使得ΔG=ΔH-T·ΔS<0,则T需要较大,即该反应为高温自发。
(2)以CO2和NH3为原料合成尿素的反应中影响CO2转化率的因素很多,图为某特定条件下,不同水碳比和温度影响CO2转化率变化的趋势曲线。
下列说法不正确的是 (填字母)。
A.温度升高该反应平衡常数逐渐减小,移走部分尿素平
衡向正反应方向移动
B.当温度低于190 ℃,随温度升高CO2转化率逐渐增大,
其原因可能是温度升高平衡向正方向移动
C.当温度高于190 ℃后,随温度升高CO2转化率逐渐减小,
其原因可能是温度升高发生了副反应
D.其他条件相同时,为提高CO2的转化率,生产中可以采取的措施是提高水碳比
ABD
[解析]合成尿素的反应是放热反应,温度升高,平衡逆向移动,平衡常数逐渐减小,尿素为固体,移走部分尿素平衡不移动,故A、B错误;
温度越高,发生副反应的可能性越高,会导致二氧化碳转化率减小,故C正确;
根据图像,水碳比越高,二氧化碳的转化率越低,故D错误。
化学反应的方向与调控
1.自发反应
(1)含义
在温度和压强一定的条件下 就能自发进行的反应称为自发反应。
(2)特点
①体系趋向于从 状态转变为 状态(体系对外部 或
热量)。
②在密闭条件下,体系有从 自发地转变为 的倾向性(无序体系更加稳定)。
无需借助外力
高能
低能
做功
释放
有序
无序
2.熵和熵变
(1)熵是量度体系 的物理量,符号为S。
(2)影响熵大小的因素:
①相同条件下,物质不同熵不同。
②同一物质:S(g) S(l) S(s)。
(3)熵变(ΔS)= 的总熵- 的总熵。
混乱程度
>
>
生成物
反应物
3. 反应进行的方向
(1)判据
<
>
<
=
>
(2)一般规律:
①ΔH 0,ΔS 0的反应任何温度下都能自发进行;
②ΔH 0,ΔS 0的反应任何温度下都不能自发进行;
③ΔH和ΔS的作用相反,且相差不大时, 对反应的方向起决定性作用。当ΔH<0,ΔS<0时 下反应能自发进行;当ΔH>0,ΔS>0时, 下反应能自发进行。
说明:对于一个特定的气相反应,熵变的大小取决于反应前后气体物质的化学计量数的大小。
<
>
>
<
温度
低温
高温
1.判断正误(正确的打“√”,错误的打“×”)
(1)能自发进行的反应,一定是放热反应( )
(2)同种物质不同状态时熵值不同,气态时最大 ( )
(3)在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大 ( )
(4)熵增的反应一定能自发进行( )
×
[解析]吸热反应也可能自发进行。
√
√
[解析]反应的自发性由焓判据和熵判据共同决定。
×
(5)一个反应能否自发进行取决于该反应是放热还是吸热( )
(6)用焓判据或熵判据判断同一反应进行的方向其结果相同( )
×
[解析]反应能否自发进行与ΔH、ΔS有关。
×
[解析]用焓判据或熵判据判断同一反应进行的方向其结果不一定相同。
2. 25 ℃和1.01×105 Pa时,反应:2N2O5(g) =4NO2(g)+O2(g) ΔH=+56.7 kJ·mol-1能自发进行,其原因是 。
熵增效应大于能量效应
[解析]根据熵判据,该反应是熵增反应,能自发进行;根据焓判据,该反应是吸热反应,不能自发进行。事实上该反应能自发进行,说明熵增效应大于能量效应。
1. 下列说法正确的是 ( )
A.常温下,1 mol SO2的熵值小于1 mol SO3
B.自发反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH>0,则ΔS>0
C.可以把CO分解:2CO(g) = 2C(s)+O2(g),收集碳,实现变废为宝
D.NaNO2溶于水,ΔH<0,ΔS<0
题组 化学反应进行的方向
B
[解析]常温下,SO2为气态,SO3为液态,所以1 mol SO2的熵值大于1 mol SO3,故A错误;
CO2(g)+H2(g) CO(g)+H2O(g) ΔH>0,因ΔH-TΔS<0能自发,所以ΔS>0,故B正确;
1. 下列说法正确的是 ( )
A.常温下,1 mol SO2的熵值小于1 mol SO3
B.自发反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH>0,则ΔS>0
C.可以把CO分解:2CO(g) = 2C(s)+O2(g),收集碳,实现变废为宝
D.NaNO2溶于水,ΔH<0,ΔS<0
题组 化学反应进行的方向
B
反应2CO(g) =2C(s)+O2(g)是ΔH>0,ΔS<0,则ΔH-TΔS>0,所以该反应不能自发进行,故C错误;
NaNO2溶于水吸收热量,ΔH>0,故D错误。
2.灰锡结构松散,不能用于制造器皿,而白锡结构坚固,可以制造器皿。现把白锡制成的器皿放在0 ℃、100 kPa的室内存放,它会不会变成灰锡而不能再继续使用(已知:在0 ℃、100 kPa条件下白锡转化为灰锡的反应焓变和熵变分别为ΔH=-2 180.9 J·mol-1,ΔS=-6.61 J·mol-1·K-1) ( )
A.会变成灰锡 B.不会变成灰锡
C.不能确定 D.升高温度才会变成灰锡
A
[解析]在等温、等压条件下,自发反应总是向着ΔH-TΔS<0的方向进行。因此,在0 ℃、100 kPa条件下,白锡会不会变为灰锡的问题就转化为求算反应:白锡→灰锡的ΔH-TΔS值的问题。ΔH-TΔS=-2 180.9 J·mol-1-273 K×(-6.61 J·mol-1·K-1)≈
-376.37 J·mol-1<0,因此在该条件下白锡会变为灰锡。
3.已知在100 kPa、298.15 K时石灰石分解的反应为CaCO3(s) =CaO(s)+CO2(g) ΔH=+178.3 kJ·mol-1、ΔS=160.4 J·mol-1·K-1,回答下列问题。
(1)该反应 (填“能”或“不能”)自发进行。
(2)据本题反应数据分析,温度 (填“能”或“否”)成为反应方向的决定因素。
(3)若温度能决定反应方向,则该反应自发进行的最低温度为 。
不能
[解析] (1)ΔH-TΔS=+178.3 kJ·mol-1-298.15 K×160.4×10-3 kJ·mol-1·K-1≈130.5 kJ·mol-1>0,所以该反应不能自发进行。
(2)因为该反应的ΔH>0、ΔS>0,所以在温度较高的时候,ΔH-TΔS可能小于0。
(3)根据ΔH-TΔS<0时,反应可自发进行,则有T>≈1 111.6 K。
能
1 111.6 K
[归纳总结] 四象限法判断反应能否自发进行
在温度、压强一定的条件下,反应总是向ΔG=ΔH-TΔS<0的方向进行,直至达到平衡状态。化学反应方向可归纳为如下四个方面:
1. 控制反应条件的目的
(1)促进有利的化学反应
通过控制反应条件,可以 化学反应速率, 反应物的转化率,从而促进有利的化学反应进行。
(2)抑制有害的化学反应
通过控制反应条件,可以 化学反应速率,减少甚至消除有害物质的产生或控制副反应的发生,从而抑制有害的化学反应继续进行。
加快
提高
减缓
2.控制反应条件的基本措施
(1)控制化学反应速率的措施
通过改变反应体系的 、溶液的浓度、气体的 (或浓度)、固体的 以及使用催化剂等途径调控反应速率。
(2)提高转化率的措施
通过改变可逆反应体系的温度、溶液的浓度、气体的压强(或浓度)等改变可逆反应的限度,从而提高转化率。如:以工业合成氨为例,理解运用化学反应原理选择化工生产中的适宜条件
温度
压强
表面积
①反应原理
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
②
放热
减少
③从反应快慢和反应限度两个角度选择反应条件
④综合考虑——选择适宜的生产条件
温度: ℃。 压强: MPa。
投料比:=。
以 作催化剂,采用 提高原料利用率。
升高
增大
催化剂
增大
降低
400~500
10~30
铁触媒
循环操作
[解析]合成氨反应ΔH<0,温度越低越利于平衡正向移动。
1.判断正误(正确的打“√”,错误的打“×”)
(1)合成氨反应在高温下能自发进行( )
(2)温度越高越利于合成氨反应平衡正向移动( )
×
[解析]合成氨反应ΔH<0,ΔS<0,ΔH-TΔS在低温下小于0。
×
(3)合成氨反应中,压强越大越利于反应速率加快和平衡正向移动 ( )
(4)使用催化剂能提高合成氨反应物的平衡转化率( )
√
×
[解析]催化剂同倍数地加快正、逆反应速率,对平衡转化率无影响。
2.工业上合成氨一般采用700 K左右的温度,其原因是 。
①适当提高氨的合成速率
②提高H2的转化率
③提高氨的产率
④催化剂在700 K时活性最大
①④
1. 主要成分为H2S的工业废气的回收利用有重要意义。根据文献,将H2S和CH4的混合气体导入石英管反应器热解(一边进料,另一边出料),发生如下反应:
Ⅰ.2H2S(g) 2H2(g)+S2(g) ΔH1=+170 kJ·mol-1
Ⅱ.CH4(g)+S2(g) CS2(g)+2H2(g) ΔH2=+64 kJ·mol-1
总反应:Ⅲ.2H2S(g)+CH4(g) CS2(g)+4H2(g)
投料按体积之比V(H2S)∶V(CH4)=2∶1,并用N2稀释;常压、不同温度下反应相同时间后,测得H2和CS2的体积分数
如下表:
题组 反应条件的控制
温度/℃ 950 1000 1050 1100 1150
H2/(V%) 0.5 1.5 3.6 5.5 8.5
CS2/(V%) 0.0 0.0 0.1 0.4 1.8
请回答:
(1)反应Ⅲ能自发进行的条件是 。
[解析]根据盖斯定律可知反应Ⅰ+反应Ⅱ即得到反应Ⅲ的ΔH=+234 kJ·mol-1,这说明反应Ⅲ是气体分子数增多(即ΔS>0)的吸热反应,根据ΔG=ΔH-TΔS<0反应自发进行可知,反应Ⅲ自发进行的条件是高温。
高温
(2)下列说法正确的是 。
A.其他条件不变时,用Ar替代N2作稀释气体,对实验结果几乎无影响
B.其他条件不变时,温度越高,H2S的转化率越高
C.由实验数据推出H2S中的S—H键强于CH4中的C—H键
D.恒温恒压下,增加N2的体积分数,H2的浓度升高
[解析] Ar是稀有气体,与体系中物质不反应,所以其他条件不变时,用Ar替代N2作稀释气体,对实验结果几乎无影响,A正确;
反应Ⅰ和Ⅲ的正反应均吸热,升高温度平衡正向移动,温度越高,H2S的转化率越高,B正确;
AB
(2)下列说法正确的是 。
A.其他条件不变时,用Ar替代N2作稀释气体,对实验结果几乎无影响
B.其他条件不变时,温度越高,H2S的转化率越高
C.由实验数据推出H2S中的S—H键强于CH4中的C—H键
D.恒温恒压下,增加N2的体积分数,H2的浓度升高
根据表中数据无法得出H2S中S—H和CH4中C—H的相对强弱,事实上C—H的键能大于S—H键能,C错误;
恒温恒压下,增加N2的体积分数,相当于增大容积减小压强,平衡正向移动,H2的物质的量增加,但容器容积增加,H2浓度减小,D错误。
AB
(3)在1000 ℃、常压下,保持通入的H2S体积分数不变,提高投料比[V(H2S)∶V(CH4)],H2S的转化率不变,原因是 。
[解析]根据表中数据可知1000 ℃时CH4不参与反应,相同分压的H2S经历相同的时间转化率相同,所以在1000 ℃、常压下,保持通入的H2S体积分数不变,提高投料比[V(H2S)∶V(CH4)]时H2S的转化率不变。
1000 ℃时CH4不参与反应,相同分压的H2S经历相同的时间转化率相同
温度/℃ 950 1000 1050 1100 1150
H2/(V%) 0.5 1.5 3.6 5.5 8.5
CS2/(V%) 0.0 0.0 0.1 0.4 1.8
(4)在950~1150 ℃范围内(其他条件不变),S2(g)的体积分数随温度升高发生变化,写出该变化规律并分析原因: 。
[解析]由于在低温段,以反应Ⅰ为主,随温度升高,S2(g)的体积分数增大;在高温段,随温度升高,反应Ⅱ消耗S2的速率大于反应Ⅰ生成S2的速率,S2(g)的体积分数减小,因此变化规律是先升后降。
先升后降。在低温段,以反应Ⅰ为主,随温度升高,S2(g)的体积分数增大;在高温段,随温度升高,反应Ⅱ消耗S2的速率大于反应Ⅰ生成S2的速率,S2(g)的体积分数减小
2.二氧化碳是一种宝贵的碳氧资源。以CO2和NH3为原料合成尿素是固定和利用CO2的成功范例。在尿素合成塔中的主要反应可表示为:
反应Ⅰ:2NH3(g)+CO2(g) NH2COONH4(s) ΔH1=-159.47 kJ·mol-1
反应Ⅱ:NH2COONH4(s) CO(NH2)2(s)+H2O(g) ΔH2=+72.49 kJ·mol-1
请回答下列问题:
(1)写出以CO2和NH3为原料生成尿素和气态水的热化学方程式: ,反应Ⅱ自发进行的条件是 。
2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ΔH=-86.98 kJ·mol-1
高温
[解析]反应Ⅰ:2NH3(g)+CO2(g) NH2COONH4(s) ΔH1=-159.47 kJ·mol-1,反应Ⅱ:NH2COONH4(s) CO(NH2)2(s)+H2O(g) ΔH2=+72.49 kJ·mol-1 ,由盖斯定律:反应Ⅰ+反应Ⅱ,得到2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ΔH3=-86.98 kJ·mol-1;反应Ⅱ的ΔH>0,ΔS>0,要使得ΔG=ΔH-T·ΔS<0,则T需要较大,即该反应为高温自发。
(2)以CO2和NH3为原料合成尿素的反应中影响CO2转化率的因素很多,图为某特定条件下,不同水碳比和温度影响CO2转化率变化的趋势曲线。
下列说法不正确的是 (填字母)。
A.温度升高该反应平衡常数逐渐减小,移走部分尿素平
衡向正反应方向移动
B.当温度低于190 ℃,随温度升高CO2转化率逐渐增大,
其原因可能是温度升高平衡向正方向移动
C.当温度高于190 ℃后,随温度升高CO2转化率逐渐减小,
其原因可能是温度升高发生了副反应
D.其他条件相同时,为提高CO2的转化率,生产中可以采取的措施是提高水碳比
ABD
[解析]合成尿素的反应是放热反应,温度升高,平衡逆向移动,平衡常数逐渐减小,尿素为固体,移走部分尿素平衡不移动,故A、B错误;
温度越高,发生副反应的可能性越高,会导致二氧化碳转化率减小,故C正确;
根据图像,水碳比越高,二氧化碳的转化率越低,故D错误。
同课章节目录
