2024年高三化学专题复习 化学反应能量转化与应用 课件(共18张PPT)
文档属性
| 名称 | 2024年高三化学专题复习 化学反应能量转化与应用 课件(共18张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 294.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-16 17:18:38 | ||
图片预览





文档简介
(共18张PPT)
化学反应能量转化与应用
复习目标
1. 能辨识化学反应中的能量转化形式,能解释化学反应中能量变化的本质。
2. 能进行反应焓变的简单计算,能用热化学方程式
表示反应中的能量变化。
3. 能运用反应焓变合理选择和利用化学反应。
任务一
化学反应能量的转化形式与本质
【复习回顾】
问题 1. 化学反应中的能量转化形式有哪些?
化学能、热能、机械能、电能、光能等
问题 2. 化学反应中能量变化的本质是什么?
旧键断吸收的能量和新键成释放的能量存在差异
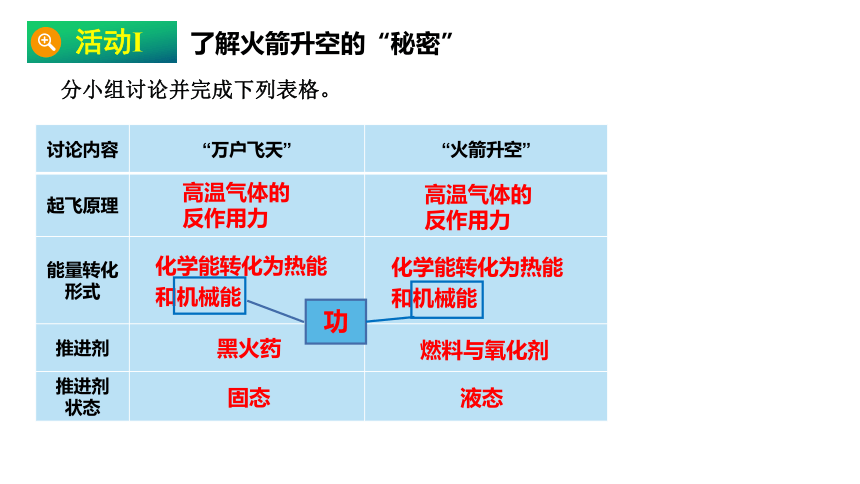
分小组讨论并完成下列表格。
讨论内容 “万户飞天” “火箭升空”
起飞原理
能量转化 形式
推进剂
推进剂 状态
高温气体的反作用力
高温气体的反作用力
化学能转化为热能
和机械能
化学能转化为热能
和机械能
黑火药
燃料与氧化剂
固态
液态
活动Ⅰ
了解火箭升空的“秘密”
功
液氢液氧组合是最高效的液体火箭推进剂,具有比冲大、无污染等优点。
有关化学键的键能数值如下
写出H2(g)和O2(g)燃烧生成H2O(g)的热化学方程式。
例题1
化学键 H-H O=O H-O
键能/kJ·mol-1 436 496 463
2H2(g)+O2(g)=2H2O(g) △H=-484 kJ·mol-1
思考:请借助相关数据说明上述反应是放热反应的本质原因。
旧键断吸收的总能量E1=436×2+496=1368kJ·mol-1
新键成释放的总能量E2=463×4=1852kJ·mol-1
因E1<E2,故该反应是放热反应。
任务二
热化学方程式的书写及焓变的计算
【复习回顾】
问题 1. 书写热化学方程式的注意事项有哪些?
物质的聚集状态、△H 的正负、△H 的单位、△H 的数值与计量数对应等
问题 2. 可以利用哪些物理量计算化学反应的焓变?
焓、反应热、键能、相对能量等
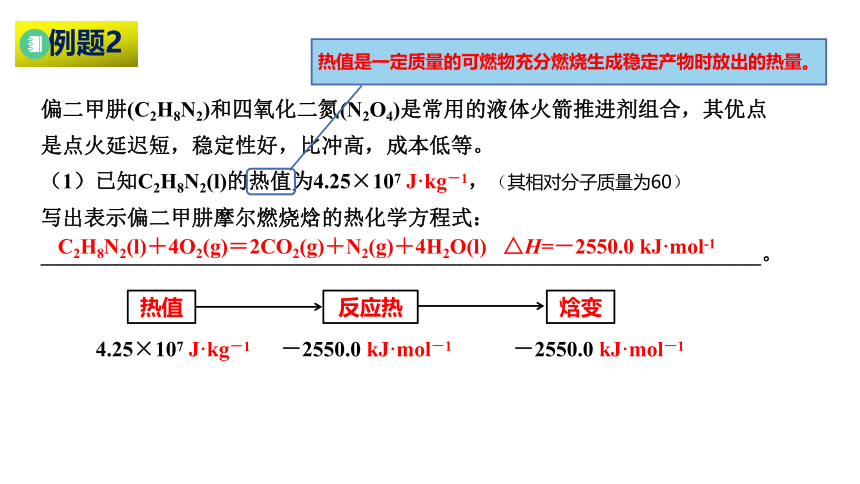
例题2
偏二甲肼(C2H8N2)和四氧化二氮(N2O4)是常用的液体火箭推进剂组合,其优点是点火延迟短,稳定性好,比冲高,成本低等。
(1)已知C2H8N2(l)的热值为4.25×107 J·kg-1,(其相对分子质量为60)
写出表示偏二甲肼摩尔燃烧焓的热化学方程式:
___________________________________________________________________。
C2H8N2(l)+4O2(g)=2CO2(g)+N2(g)+4H2O(l) △H=-2550.0 kJ·mol-1
热值是一定质量的可燃物充分燃烧生成稳定产物时放出的热量。
热值
反应热
焓变
4.25×107 J·kg-1
-2550.0 kJ·mol-1
-2550.0 kJ·mol-1
(2)已知N2O4(l)的标准摩尔生成焓△H=+50.0 kJ·mol-1,
[指定温度(通常是298K)和标准大气压下,由最稳定的单质合成1mol某物质B的反应焓变,叫做该温度下物质B的标准摩尔生成焓。]
写出C2H8N2(l)和N2O4(l)充分反应的热化学方程式:
___________________________________________________________________。
C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(l) △H=-2650.0 kJ·mol-1
例题2
N2(g)+2O2(g)=N2O4(l) △H=+50.0 kJ·mol-1
C2H8N2(l)+4O2(g)=2CO2(g)+N2(g)+4H2O(l) △H=-2550.0 kJ·mol-1
2N2(g)+4O2(g)=2N2O4(l) △H=+100.0 kJ·mol-1
肼(N2H4)常用作载人飞船姿态发动机的燃料。
已知200℃时,肼可能发生以下反应:
① 3N2H4(g)=N2(g)+4NH3(g) ΔH1=-32.9 kJ·mol-1
② N2H4(g)+H2(g)=2NH3(g) ΔH2= a kJ·mol-1
反应②的能量变化过程如图1所示。
(1)根据题意,计算反应②的焓变ΔH2=___________ kJ·mol-1
(2)200℃时,肼分解生成氮气和氢气的热化学方程式为:
_____________________________________________________________
例题3
-41.8
N2H4(g)= N2(g)+2H2(g) ΔH3=+50.7 kJ·mol-1
图 1
E2=2288.8 kJ·mol-1
小结
核心考点1 热化学方程式
一. 书写的“四注意”
(1)聚集状态要标明。
(2)ΔH的符号、单位要准确。
(3)各物质的系数可以是整数,也可以是分数。
(4)化学式前面的系数必须与ΔH一一对应。
二. 判断的“五看”
“一看”状态是否注明;
“二看”ΔH的“+”、“-”是否与吸热、放热一致;
“三看”ΔH的数值与计量数是否对应;
“四看”热化学方程式是否配平;
“五看”ΔH的单位是否为kJ·mol-1或J·mol-1。
任务三
合理选择和利用化学反应的能量
问题 1:
已知200℃时,肼可能发生以下反应:
① 3N2H4(g)=N2(g)+4NH3(g) ΔH1=-32.9 kJ·mol-1
② N2H4(g)= N2(g)+2H2(g) ΔH2=+50.7 kJ·mol-1
请根据能量变化,选择更合适的姿态发动机推进剂原理并说明理由。
选择反应①。
因ΔH1<0,反应放热,产生的气体能量更高,推力更大。
中国空间站的再生式环控生保系统共包括6个子系统。
①电解制氧子系统
②二氧化碳去除子系统
③微量有害气体去除子系统
④尿处理子系统
⑤水处理子系统
⑥二氧化碳还原子系统
问题 2:电解制氧过程中涉及哪些形式能量的转化?
光能(太阳能)、电能、化学能
活动Ⅱ
了解中国空间站的环控生保系统。
[2022年海南卷改编]中国空间站的环控生保系统功能之一是将人体代谢废物CO2中的氧元素转化为O2,实现氧循环。
(1)已知下列反应:
① CO2(g)+2H2O(g)=CH4(g)+2O2(g) ΔH1=+802.3 kJ·mol-1
② 2H2O(g)=2H2(g)+O2(g) ΔH2=+483.6 kJ·mol-1
③ CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH3
则反应③的焓变ΔH3=______________kJ·mol-1。
例题4
-164.9
过程④利用了电解制氧子系统的副产物H2,且反应a为放热反应,减少了能量的损耗;而过程①是吸热反应且容易形成积碳,过程②中的Na2O2需要地面输送,
过程③反应能耗太高,成本太大。
(2)可以实现CO2转化为O2的反应过程有:
① CO2(g)=C(g)+O2(g) ΔH1=+393.5 kJ·mol-1
② 2CO2(g)+2Na2O2(s)=2Na2CO3(s)+O2(g) ΔH2=-452.8 kJ·mol-1
③ CO2(g)+2H2O(g)=CH4(g)+2O2(g) ΔH3=+802.3 kJ·mol-1
④ CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH4=-164.9 kJ·mol-1
2H2O(g)=2H2(g)+O2(g) ΔH5=+483.6 kJ·mol-1
请从能量和物质的角度分析,上述四个过程更适合在空间站中应用的____,
理由是_______________________________________________________
_________________________________________________________。
例题4
④
例题4
(3)中国空间站氧气和水的循环再生示意图如下,下列有关说法错误的是( )
A. 为保证转化率、控制反应器内温度,一般会将
反应气体提前加热至反应温度再通入反应器
B. 该系统的缺陷是有50%的氢元素存在于甲烷中
而没有得到利用
C. 该系统充分利用了人体代谢废物二氧化碳和电解
制氧的副产物氢气,减少了能量的损失
D. 通过该系统使空间站的水资源物质闭合度达到100%,
完全不需要从地面补充
D
小结
核心考点2 焓变的计算
(1)能量差。
(2)反应热。
(3)键能差。
(4)相对能量差。
(5)盖斯定律。
△H=H(反应产物)-H(反应物)
△H=Qp(参加反应的n和化学计量数相等时,Qp和△H数值相等)
△H=E(旧键的键能和)-E(新键的键能和)
△H=E(反应产物的相对能量)-E(反应物的相对能量)
△H=△H1+△H2+△H3+… …
拓展活动
自制火箭,体验推进剂的反应原理
项目1. 用锡纸、火柴、竹签、打火机等自制固体火箭推进器。
项目2. 用注射针管、压电陶瓷、热熔枪、酒精等自制液体火箭推进器。
1.搜集资料、查阅文献,进一步了解中国航天发展史,
体会化学反应能量变化在中国航天事业上的应用。
2.通过调查问卷、咨询相关人士、网络搜集等方式,了解化学反应能量变化在生产、生活中的其他应用。
3.完成课后习题。
课后拓展活动
化学反应能量转化与应用
复习目标
1. 能辨识化学反应中的能量转化形式,能解释化学反应中能量变化的本质。
2. 能进行反应焓变的简单计算,能用热化学方程式
表示反应中的能量变化。
3. 能运用反应焓变合理选择和利用化学反应。
任务一
化学反应能量的转化形式与本质
【复习回顾】
问题 1. 化学反应中的能量转化形式有哪些?
化学能、热能、机械能、电能、光能等
问题 2. 化学反应中能量变化的本质是什么?
旧键断吸收的能量和新键成释放的能量存在差异
分小组讨论并完成下列表格。
讨论内容 “万户飞天” “火箭升空”
起飞原理
能量转化 形式
推进剂
推进剂 状态
高温气体的反作用力
高温气体的反作用力
化学能转化为热能
和机械能
化学能转化为热能
和机械能
黑火药
燃料与氧化剂
固态
液态
活动Ⅰ
了解火箭升空的“秘密”
功
液氢液氧组合是最高效的液体火箭推进剂,具有比冲大、无污染等优点。
有关化学键的键能数值如下
写出H2(g)和O2(g)燃烧生成H2O(g)的热化学方程式。
例题1
化学键 H-H O=O H-O
键能/kJ·mol-1 436 496 463
2H2(g)+O2(g)=2H2O(g) △H=-484 kJ·mol-1
思考:请借助相关数据说明上述反应是放热反应的本质原因。
旧键断吸收的总能量E1=436×2+496=1368kJ·mol-1
新键成释放的总能量E2=463×4=1852kJ·mol-1
因E1<E2,故该反应是放热反应。
任务二
热化学方程式的书写及焓变的计算
【复习回顾】
问题 1. 书写热化学方程式的注意事项有哪些?
物质的聚集状态、△H 的正负、△H 的单位、△H 的数值与计量数对应等
问题 2. 可以利用哪些物理量计算化学反应的焓变?
焓、反应热、键能、相对能量等
例题2
偏二甲肼(C2H8N2)和四氧化二氮(N2O4)是常用的液体火箭推进剂组合,其优点是点火延迟短,稳定性好,比冲高,成本低等。
(1)已知C2H8N2(l)的热值为4.25×107 J·kg-1,(其相对分子质量为60)
写出表示偏二甲肼摩尔燃烧焓的热化学方程式:
___________________________________________________________________。
C2H8N2(l)+4O2(g)=2CO2(g)+N2(g)+4H2O(l) △H=-2550.0 kJ·mol-1
热值是一定质量的可燃物充分燃烧生成稳定产物时放出的热量。
热值
反应热
焓变
4.25×107 J·kg-1
-2550.0 kJ·mol-1
-2550.0 kJ·mol-1
(2)已知N2O4(l)的标准摩尔生成焓△H=+50.0 kJ·mol-1,
[指定温度(通常是298K)和标准大气压下,由最稳定的单质合成1mol某物质B的反应焓变,叫做该温度下物质B的标准摩尔生成焓。]
写出C2H8N2(l)和N2O4(l)充分反应的热化学方程式:
___________________________________________________________________。
C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(l) △H=-2650.0 kJ·mol-1
例题2
N2(g)+2O2(g)=N2O4(l) △H=+50.0 kJ·mol-1
C2H8N2(l)+4O2(g)=2CO2(g)+N2(g)+4H2O(l) △H=-2550.0 kJ·mol-1
2N2(g)+4O2(g)=2N2O4(l) △H=+100.0 kJ·mol-1
肼(N2H4)常用作载人飞船姿态发动机的燃料。
已知200℃时,肼可能发生以下反应:
① 3N2H4(g)=N2(g)+4NH3(g) ΔH1=-32.9 kJ·mol-1
② N2H4(g)+H2(g)=2NH3(g) ΔH2= a kJ·mol-1
反应②的能量变化过程如图1所示。
(1)根据题意,计算反应②的焓变ΔH2=___________ kJ·mol-1
(2)200℃时,肼分解生成氮气和氢气的热化学方程式为:
_____________________________________________________________
例题3
-41.8
N2H4(g)= N2(g)+2H2(g) ΔH3=+50.7 kJ·mol-1
图 1
E2=2288.8 kJ·mol-1
小结
核心考点1 热化学方程式
一. 书写的“四注意”
(1)聚集状态要标明。
(2)ΔH的符号、单位要准确。
(3)各物质的系数可以是整数,也可以是分数。
(4)化学式前面的系数必须与ΔH一一对应。
二. 判断的“五看”
“一看”状态是否注明;
“二看”ΔH的“+”、“-”是否与吸热、放热一致;
“三看”ΔH的数值与计量数是否对应;
“四看”热化学方程式是否配平;
“五看”ΔH的单位是否为kJ·mol-1或J·mol-1。
任务三
合理选择和利用化学反应的能量
问题 1:
已知200℃时,肼可能发生以下反应:
① 3N2H4(g)=N2(g)+4NH3(g) ΔH1=-32.9 kJ·mol-1
② N2H4(g)= N2(g)+2H2(g) ΔH2=+50.7 kJ·mol-1
请根据能量变化,选择更合适的姿态发动机推进剂原理并说明理由。
选择反应①。
因ΔH1<0,反应放热,产生的气体能量更高,推力更大。
中国空间站的再生式环控生保系统共包括6个子系统。
①电解制氧子系统
②二氧化碳去除子系统
③微量有害气体去除子系统
④尿处理子系统
⑤水处理子系统
⑥二氧化碳还原子系统
问题 2:电解制氧过程中涉及哪些形式能量的转化?
光能(太阳能)、电能、化学能
活动Ⅱ
了解中国空间站的环控生保系统。
[2022年海南卷改编]中国空间站的环控生保系统功能之一是将人体代谢废物CO2中的氧元素转化为O2,实现氧循环。
(1)已知下列反应:
① CO2(g)+2H2O(g)=CH4(g)+2O2(g) ΔH1=+802.3 kJ·mol-1
② 2H2O(g)=2H2(g)+O2(g) ΔH2=+483.6 kJ·mol-1
③ CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH3
则反应③的焓变ΔH3=______________kJ·mol-1。
例题4
-164.9
过程④利用了电解制氧子系统的副产物H2,且反应a为放热反应,减少了能量的损耗;而过程①是吸热反应且容易形成积碳,过程②中的Na2O2需要地面输送,
过程③反应能耗太高,成本太大。
(2)可以实现CO2转化为O2的反应过程有:
① CO2(g)=C(g)+O2(g) ΔH1=+393.5 kJ·mol-1
② 2CO2(g)+2Na2O2(s)=2Na2CO3(s)+O2(g) ΔH2=-452.8 kJ·mol-1
③ CO2(g)+2H2O(g)=CH4(g)+2O2(g) ΔH3=+802.3 kJ·mol-1
④ CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH4=-164.9 kJ·mol-1
2H2O(g)=2H2(g)+O2(g) ΔH5=+483.6 kJ·mol-1
请从能量和物质的角度分析,上述四个过程更适合在空间站中应用的____,
理由是_______________________________________________________
_________________________________________________________。
例题4
④
例题4
(3)中国空间站氧气和水的循环再生示意图如下,下列有关说法错误的是( )
A. 为保证转化率、控制反应器内温度,一般会将
反应气体提前加热至反应温度再通入反应器
B. 该系统的缺陷是有50%的氢元素存在于甲烷中
而没有得到利用
C. 该系统充分利用了人体代谢废物二氧化碳和电解
制氧的副产物氢气,减少了能量的损失
D. 通过该系统使空间站的水资源物质闭合度达到100%,
完全不需要从地面补充
D
小结
核心考点2 焓变的计算
(1)能量差。
(2)反应热。
(3)键能差。
(4)相对能量差。
(5)盖斯定律。
△H=H(反应产物)-H(反应物)
△H=Qp(参加反应的n和化学计量数相等时,Qp和△H数值相等)
△H=E(旧键的键能和)-E(新键的键能和)
△H=E(反应产物的相对能量)-E(反应物的相对能量)
△H=△H1+△H2+△H3+… …
拓展活动
自制火箭,体验推进剂的反应原理
项目1. 用锡纸、火柴、竹签、打火机等自制固体火箭推进器。
项目2. 用注射针管、压电陶瓷、热熔枪、酒精等自制液体火箭推进器。
1.搜集资料、查阅文献,进一步了解中国航天发展史,
体会化学反应能量变化在中国航天事业上的应用。
2.通过调查问卷、咨询相关人士、网络搜集等方式,了解化学反应能量变化在生产、生活中的其他应用。
3.完成课后习题。
课后拓展活动
同课章节目录
