1.2 离子反应第一课时课件(共55张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.2 离子反应第一课时课件(共55张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 14.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-17 10:12:01 | ||
图片预览








文档简介
(共55张PPT)
第二节 离子反应
第1课时 电解质的电离
生活常识告诉我们,给电器设备通电时,湿手操作容易发生触电事故。这是为什么呢?
日常生活,发现问题
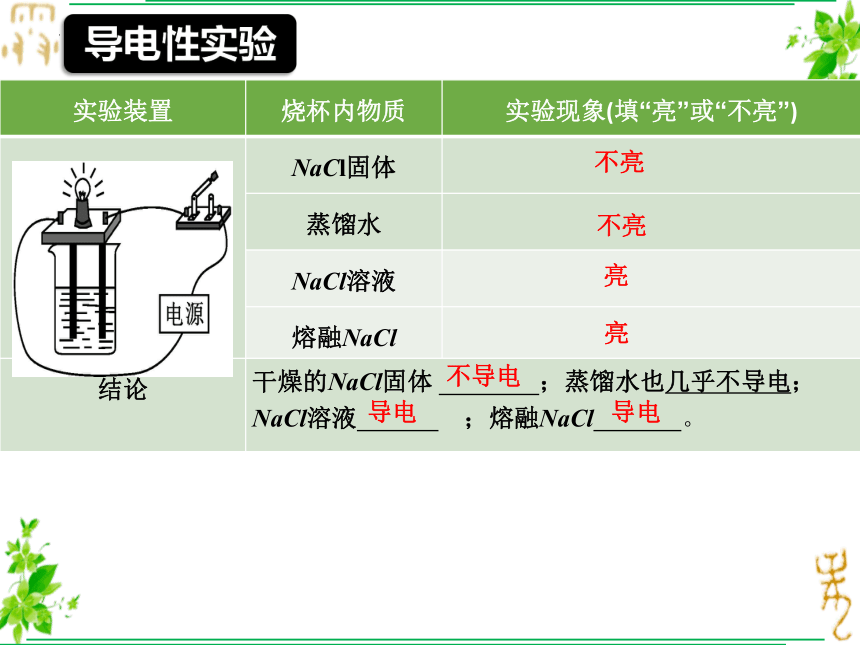
实验装置 烧杯内物质 实验现象(填“亮”或“不亮”)
NaCl固体
蒸馏水
NaCl溶液
熔融NaCl
结论 干燥的NaCl固体 ;蒸馏水也几乎不导电; NaCl溶液 ;熔融NaCl 。 不亮
亮
不导电
导电
亮
不亮
导电性实验
导电
NaCl晶体及其结构模型
由于带相反电荷的离子间的相互作用,NaCl固体中带正电荷的Na+和带负电荷的Cl-按一定规则紧密地排列着,不能自由移动
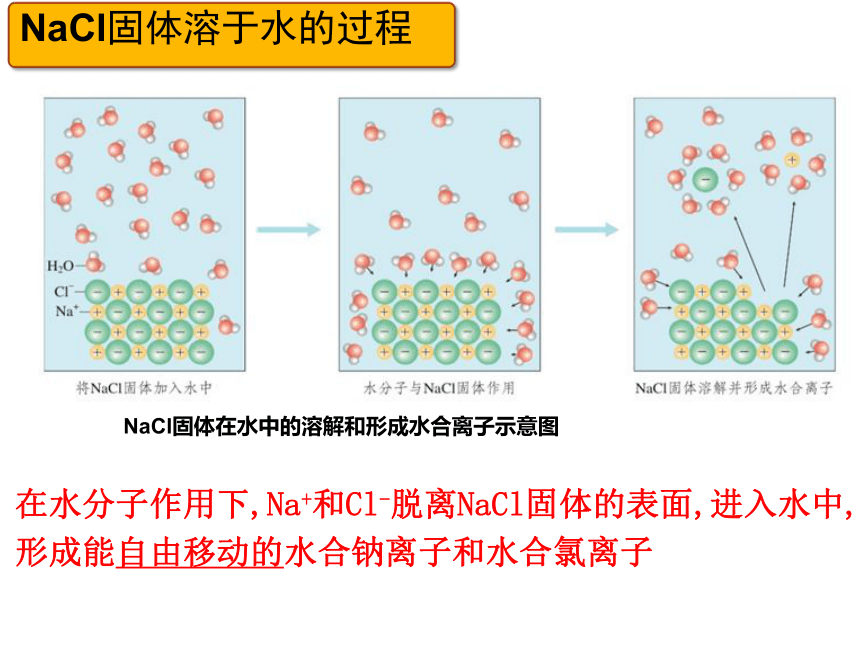
NaCl固体在水中的溶解和形成水合离子示意图
在水分子作用下,Na+和Cl-脱离NaCl固体的表面,进入水中,形成能自由移动的水合钠离子和水合氯离子
NaCl固体溶于水的过程
Cl-
Na+
NaCl固体溶于水微观模拟
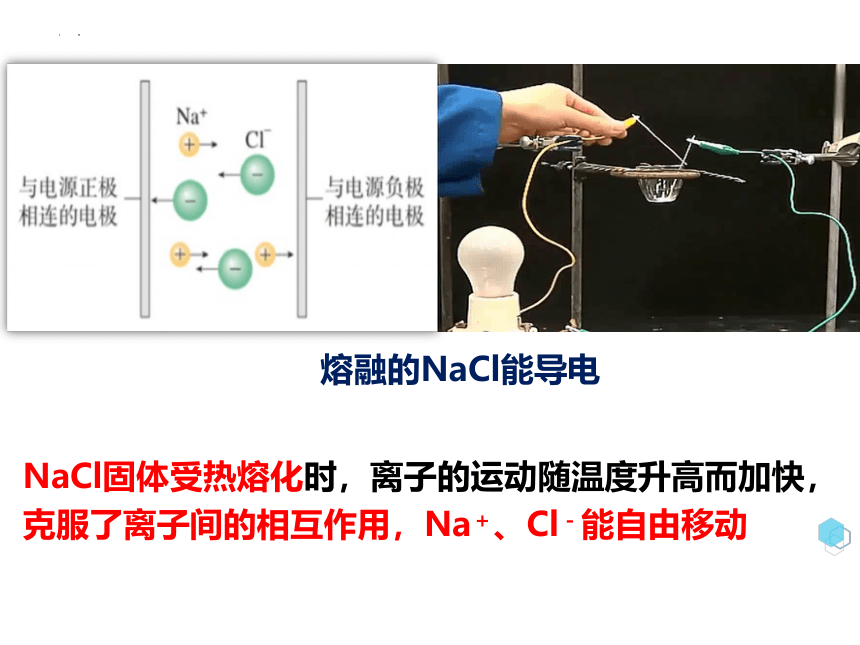
熔融的NaCl能导电
NaCl固体受热熔化时,离子的运动随温度升高而加快,克服了离子间的相互作用,Na+、Cl-能自由移动
无自由移动离子
有自由移动离子
有自由移动离子
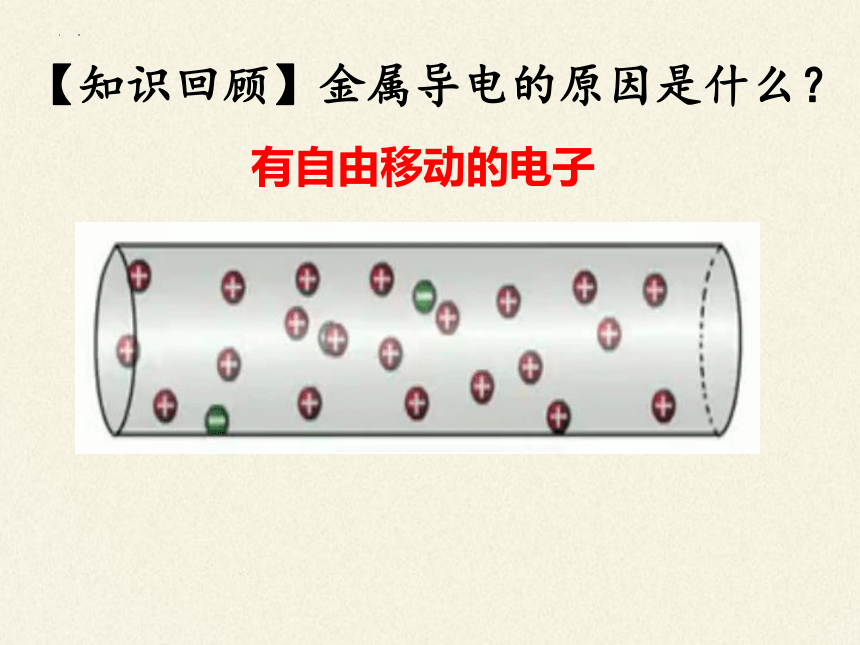
【知识回顾】金属导电的原因是什么?
有自由移动的电子
金属导电:有自由移动的电子
氯化钠溶液导电:有自由移动的离子
结合
物质导电的条件:
①有自由移动的
②带电荷的粒子
溶液的导电能力决定于离子浓度和离子所带电荷数,离子浓度越大、离子所带电荷数赿多,导电能力越强
电解质:
自由移动的离子
在水溶液里 熔融状态下能够导电的化合物
或
对象:化合物
电解质导电条件:水溶液或熔融状态
电解质导电实质:产生能够自由移动的离子
注
意
电解质:
自由移动的离子
在水溶液里 熔融状态下能够导电的化合物
或
类型: 酸,如H2SO4、H2CO3等
碱,如NaOH、Ca(OH)2等
盐,如NaCl、BaSO4等
④活泼金属氧化物,如CaO、Na2O等
⑤H2O
1. 金属铜、石墨都能导电,它们是电解质吗?
2.NaCl溶液、稀盐酸能导电,它们是电解质吗?
电解质必须是化合物!
问题
3. CaCO3 、BaSO4 、AgCl的水溶液几乎不能导电,
它们是电解质吗?
问题
电解质导电条件:
满足一个即可!
电解质与溶解性无必然联系,它们在熔融状态下
能导电,属电解质
在水溶液里 熔融状态下都不能导电的化合物
和
非电解质:
类型: 多数有机物,如酒精、蔗糖、CH4等
非金属氧化物(除H2O外),如CO2、SO2等
NH3
为什么氯化钠溶于水或受热熔化能导电?
因为NaCl溶于水或受热熔化时,形成了自由移动的离子,在通电条件下,这些离子做定向移动,所以能导电
结论:
电离:指电解质溶于水或受热熔化时
形成自由移动的离子的过程
电离方程式:表示电解质电离的式子
电离
电离方程式的书写
1.书写原则:
2.书写注意事项:
a.符合客观事实,阴阳离子拆开写, 原子团不拆开
b.离子所带电荷根据化合价判断
c.原子守恒 “=”两边原子种类和数目均不变
电荷守恒 “=”右边正电荷总数等于负电荷总数
左边写电解质的化学式,右边写电离出的离子符号,中间用“=”连接
练习:写出下列物质的电离方程式
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
HNO3 = H+ + NO3-
从电离的角度认识酸
酸:电离时生成的阳离子全部是H+ 的化合物
HCl、H2SO4、HNO3
NaOH = Na+ + OH -
Ba(OH)2= Ba2+ + 2OH -
Ca(OH)2= Ca2+ + 2OH -
从电离的角度认识碱
碱:电离时生成的阴离子全部是OH-的化合物
练习:写出下列物质的电离方程式
NaOH 、Ba(OH)2、Ca(OH)2
== NH4+ + Cl-
== 2K+ + CO32-
== Cu2+ + SO4 2-
盐:电离时生成金属阳离子(或NH4+)和
酸根离子的化合物
NH4Cl
K2CO3
CuSO4
练习:写出下列物质的电离方程式
NaHSO4在水溶液中的电离方程式为:
NaHSO4 = Na+ + H+ + SO42- ,NaHSO4属于酸吗?
请你辨析
酸:电离时生成的阳离子全部是H+的化合物
酸式盐:电离时生成的阳离子除金属离子(或NH4+)外还有H+,阴离子为酸根离子的盐
本堂小结:
一、酸、碱、盐在水溶液中的电离
电解质
(酸、碱、盐等)
非电解质
(蔗糖、酒精等)
化合物
在水溶液里或熔融
状态下能否电离
电离
电离方程式
重新认识
酸、碱、盐
1.下列电离方程式书写完全正确的是 ( )
A.H2SO4 === H+ + SO42-
B.Ca(OH)2 === Ca2+ + (OH)22-
C. NaCl === Na+ + Cl-
D.Al2(SO4)3 === Al23+ + 3SO42-
C
小试牛刀
2.下列说法中,正确的是( )
A.液态HCl、固态NaCl均不导电,所以HCl、NaCl均是非电解质
B.CO2的水溶液能导电,所以CO2是电解质
C.蔗糖、酒精在水溶液里和熔融状态下均不导电,所以它们是
非电解质
D.铜、石墨均导电,所以它们是电解质
C
小试牛刀
强电解质:在水溶液里能完全电离的电解质
强、弱电解质的本质区别:能否完全电离
强电解质和弱电解质
弱电解质:在水溶液里只有部分电离的电解质
强酸(H2SO4、HNO3、HCl、HBr、HI、HClO4 )
强碱(NaOH 、KOH、Ba(OH)2 、Ca(OH)2 )
绝大多数盐
弱酸(H2CO3、H2SO3、CH3COOH、HF、H2S )
弱碱(NH3· H2O 等)
水
电解质溶于水后,电离成了自由移动的离子,因此,
电解质在溶液中的反应实质上是离子之间的反应
实验操作
实验现象 ______________ ______________
混合前溶液中微粒 K+、Cl- Ba2+、Cl-
Na+、SO42- Na+、SO42-
混合后溶液中微粒 K+、Cl-、Na+、SO42- _________、Na+、Cl-
实验结论 离子反应使溶液中某些离子浓度________。 无明显现象
有白色沉淀
BaSO4
减小
【实验探究】
1.离子反应
概念:有离子参加或生成的反应
2.离子方程式
用实际参加反应的离子符号表示反应的式子
如何书写离子方程式?
1. “写”正确写出反应的化学方程式
2. “拆”把易溶于水、易电离的物质写成
离子形式
例:写出碳酸钠与盐酸反应的离子方程式
Na2SO4 + BaCl2 = 2NaCl + BaSO4↓
不能拆成离子的物质:
弱酸、弱碱、水、不溶性盐、单质、气体、氧化物
能拆成离子的物质
强 酸
强 碱
可溶性盐
( HCl H2SO4 HNO3等 )
( NaOH Ba(OH)2等)
微溶物的处理:
微溶物作反应物,若澄清,拆成离子(如澄清石灰水);
若浑浊,不拆(如石灰乳/浆)
微溶物作生成物,一般视为沉淀,不拆,
写成化学式并标"↓"符号
1. “写”正确写出反应的化学方程式
2. “拆”把易溶于水、易电离的物质写成
离子形式
3. “删”等量删去方程式两边不参加反应的离 子
4. “查”检查方程式两边各元素的原子个数和离子所带电荷总数是否相等
例:写出碳酸钠与盐酸反应的离子方程式
Na2SO4 + BaCl2 = 2NaCl + BaSO4↓
书写离子方程式应注意:
凡是不在溶液中进行的反应一般不写离子方程式
如:NH4Cl固体与Ca(OH)2固体混合加热,
只能写化学方程式
△
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑+ 2H2O
书写离子方程式应注意:
在水溶液中多元强酸的酸式酸根离子
要拆(HSO4-);
多元弱酸的酸式酸根离子均不拆
(如:HCO3-、HSO3-等)
写出下列四个中和反应的离子方程式:
①HCl与NaOH反应
②HCl与KOH反应
③H2SO4与NaOH反应
④H2SO4与KOH反应
HCl+NaOH=NaCl+H2O
HCl+KOH=KCl+H2O
H2SO4+2NaOH=Na2SO4+2H2O
H2SO4+2KOH=K2SO4+2H2O
H+ + OH- = H2O
离子方程式不仅可表示某一个具体的化学反应,还可表示同一类型的离子反应
H+ + OH- = H2O
可表示强酸与强碱生成可溶性盐和水的反应
复分解型离子反应发生的条件:
①生成沉淀(难溶物质)
②生成气体(挥发性物质)
③生成水 (难电离物质)
结果:使溶液中的某些离子浓度减小
①看离子反应是否符合客观事实
③看是否守恒:原子数、电荷数均守恒
②看物质是否可拆分
④看是否漏掉参加反应的离子
⑤看符号,各种反应条件、生成物状态符
号是否使用正确
5、离子方程式的正误判断
1.Cu放入盐酸中: Cu +2H+= Cu2+ +H2↑
3.Cu放入硝酸银溶液中: Cu +Ag+= Cu2+ +Ag
2.碳酸钙和稀盐酸反应:
CO32+ +2H+= CO2 ↑ +H2O
4.稀硫酸和氢氧化钡溶液反应:
SO42- + Ba2+ = BaSO4↓
×
×
×
×
判断下列离子方程式的对错
离子方程式的书写正误判断
2. 离子共存
离子反应的应用
离子方程式的书写正误判断
(1)“真不真”:符合客观事实
(2)“拆”对了没:拆(强酸、强碱、可溶性盐)
(3)“配平”:原子守恒、电荷守恒
(4)“漏不漏”:“=”“↑”“↓”
离子方程式的书写正误判断
(1)铁与稀硫酸反应:2Fe + 6H+ = 2Fe3+ + 3H2↑
×
(2)Ba(OH)2 溶液与稀 H2SO4 反应:
H+ + OH- + SO42- + Ba2+ = BaSO4↓ + H2O
×
(3)Ba(OH)2溶液与CuSO4溶液反应:
Ba2+ + SO42-=BaSO4↓
×
(4)向盐酸中滴加氨水:H+ + OH- = H2O
×
(5)铝与盐酸溶液反应:Al+3H+=Al3++H2↑
×
2. 离子共存
离子间不发生化学反应就可以大量共存。
(即不生成沉淀、气体、难电离的物质)
特殊条件:
①颜色。有色离子:Cu2+,Fe3+, Fe2+,MnO4-
②酸性:pH<7;
③碱性:pH>7
2. 离子共存
1.在无色透明溶液中,能大量共存的离子组是( )
A、K+、Cu2+、NO3-、 OH-
B、K+、Ba2+、Cl-、CO32-
C、 Ag+ 、OH-、NO3-、Cl-
D、K+、Na+、Fe3+、SO42-
D
2. 离子共存
2. 下列各组离子,能在指定溶液中共存的是( )
A. 无色溶液中:K+、Cl-、Na+、HCO3-、OH-
B.使pH试纸变深蓝色的溶液中:
K+、HCO3-、Na+、Cl-
C. pH=0的溶液中:
Fe2+、Al3+、Cl-、SO42-
D.加入Mg能放出H2的溶液中:
Mg2+、HCO3-、Cl-、Na+、SO42-
C
课堂练习
1、在下列化学方程式中,不能用离子方程式Ba2+ + SO42- = BaSO4↓表示的是( )
A、Ba(NO3)2 + H2SO4 = BaSO4↓ +2HNO3
B、BaCl2 + Na2SO4 = BaSO4↓ +2NaCl
C、BaCO3 +H2SO4 = BaSO4↓+CO2↑+H2O
D、BaCl2 + H2SO4 = BaSO4↓ +2HCl
C
课堂练习
2、判断下列物质间能否发生离子反应。
① KCl与NaOH;( )
② Ca(OH)2与HNO3;( )
③ AlCl3与AgNO3;( )
④ BaCl2溶液与Na2SO4溶液( )
√
√
√
×
课堂练习
3. 下列反应的离子方程式中,书写正确的是( )
A.钠跟水反应:
2Na+2H2O ═ 2Na++2OH﹣+H2↑
B.铁粉跟稀硫酸反应:
2Fe+6H+ ═ 2Fe3++3H2↑
C.氢氧化钡溶液跟稀硫酸反应:
Ba2++SO42﹣ ═ BaSO4↓
D.碳酸钙跟盐酸反应:
CO32﹣+2H+ ═ H2O+CO2↑
A
1. 在强酸性无色透明溶液中,下列各组离子能大量共存的是( )
A. Fe3+ 、 K+ 、 Cl- 、 NO3-
B. Ag+ 、 Na+ 、 NO3- 、 Cl-
C. Zn2+ 、 Al3+ 、 SO42- 、 Cl-
D. Ba2+ 、 NH4+ 、 Cl - 、 HCO3-
C
2. 在强碱性溶液中能大量共存并且溶液为无色透明的离子组是( )
A. Na+ 、 Cu2+ 、 NO3- 、 Cl-
B. K+ 、 Na+ 、 CO32- 、 NO3-
C. K+ 、 Ba2+ 、 CO32- 、 Cl-
D. Na+ 、 K+ 、 MnO4- 、 SO42-
B
【 知识延申2】
离子共存小结:
原则:能反应生成沉淀、气体、难电离物质的不能共存。
1 . 与H+ 不能
共存的离子:
CO32- 、CH3COO- 、HCO3-
OH-
H+
会生成氢氧化物沉淀的离子
3. 微溶物、难溶物的两种离子不能共存:如CaSO4是
微溶物,故Ca2+与SO42-不共存, AgCl是难溶物故Ag+与Cl-不共存。
2. 与OH— 不能
共存的离子:
4. 要注意题目隐含条件:溶液有无颜色【Cu2+(蓝)、Fe3+(棕黄)、
Fe2+(浅绿)、MnO4-(紫色)】,溶液的酸碱性、pH等。
离子反应在生活生产中有较广泛的应用。如混合物分离、物质提纯和鉴定、清除水中污染物等。水体中含量过高的Ca2+、Mg2+ 既会造成锅炉结垢,也会降低洗涤衣物时肥皂的使用效率。如何在不引入新杂质的情况下除去这些离子,使水得到净化
【方案设计】
①选择药品(溶液),确定加药顺序和操作顺序;
②确保所加药品(应适当过量)在后续反应中被清除。
【参考答案】
先加石灰除去Mg2+ ,再加碳酸钠除去Ca2+,最后加盐酸除去过量的OH-和CO32-。
【联系实际】
正盐:电离生成的阳离子全部是金属阳离子(或铵离子),电离生成的阴离子全部是酸根离子的盐。
酸式盐:电离生成的阳离子除了金属阳离子(或铵离子)外,还有氢离子的盐。
碱式盐:电离生成的阴离子除了酸根离子外,还有氢氧根离子的盐。
三、 从电离的角度认识酸碱盐
第二节 离子反应
第1课时 电解质的电离
生活常识告诉我们,给电器设备通电时,湿手操作容易发生触电事故。这是为什么呢?
日常生活,发现问题
实验装置 烧杯内物质 实验现象(填“亮”或“不亮”)
NaCl固体
蒸馏水
NaCl溶液
熔融NaCl
结论 干燥的NaCl固体 ;蒸馏水也几乎不导电; NaCl溶液 ;熔融NaCl 。 不亮
亮
不导电
导电
亮
不亮
导电性实验
导电
NaCl晶体及其结构模型
由于带相反电荷的离子间的相互作用,NaCl固体中带正电荷的Na+和带负电荷的Cl-按一定规则紧密地排列着,不能自由移动
NaCl固体在水中的溶解和形成水合离子示意图
在水分子作用下,Na+和Cl-脱离NaCl固体的表面,进入水中,形成能自由移动的水合钠离子和水合氯离子
NaCl固体溶于水的过程
Cl-
Na+
NaCl固体溶于水微观模拟
熔融的NaCl能导电
NaCl固体受热熔化时,离子的运动随温度升高而加快,克服了离子间的相互作用,Na+、Cl-能自由移动
无自由移动离子
有自由移动离子
有自由移动离子
【知识回顾】金属导电的原因是什么?
有自由移动的电子
金属导电:有自由移动的电子
氯化钠溶液导电:有自由移动的离子
结合
物质导电的条件:
①有自由移动的
②带电荷的粒子
溶液的导电能力决定于离子浓度和离子所带电荷数,离子浓度越大、离子所带电荷数赿多,导电能力越强
电解质:
自由移动的离子
在水溶液里 熔融状态下能够导电的化合物
或
对象:化合物
电解质导电条件:水溶液或熔融状态
电解质导电实质:产生能够自由移动的离子
注
意
电解质:
自由移动的离子
在水溶液里 熔融状态下能够导电的化合物
或
类型: 酸,如H2SO4、H2CO3等
碱,如NaOH、Ca(OH)2等
盐,如NaCl、BaSO4等
④活泼金属氧化物,如CaO、Na2O等
⑤H2O
1. 金属铜、石墨都能导电,它们是电解质吗?
2.NaCl溶液、稀盐酸能导电,它们是电解质吗?
电解质必须是化合物!
问题
3. CaCO3 、BaSO4 、AgCl的水溶液几乎不能导电,
它们是电解质吗?
问题
电解质导电条件:
满足一个即可!
电解质与溶解性无必然联系,它们在熔融状态下
能导电,属电解质
在水溶液里 熔融状态下都不能导电的化合物
和
非电解质:
类型: 多数有机物,如酒精、蔗糖、CH4等
非金属氧化物(除H2O外),如CO2、SO2等
NH3
为什么氯化钠溶于水或受热熔化能导电?
因为NaCl溶于水或受热熔化时,形成了自由移动的离子,在通电条件下,这些离子做定向移动,所以能导电
结论:
电离:指电解质溶于水或受热熔化时
形成自由移动的离子的过程
电离方程式:表示电解质电离的式子
电离
电离方程式的书写
1.书写原则:
2.书写注意事项:
a.符合客观事实,阴阳离子拆开写, 原子团不拆开
b.离子所带电荷根据化合价判断
c.原子守恒 “=”两边原子种类和数目均不变
电荷守恒 “=”右边正电荷总数等于负电荷总数
左边写电解质的化学式,右边写电离出的离子符号,中间用“=”连接
练习:写出下列物质的电离方程式
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
HNO3 = H+ + NO3-
从电离的角度认识酸
酸:电离时生成的阳离子全部是H+ 的化合物
HCl、H2SO4、HNO3
NaOH = Na+ + OH -
Ba(OH)2= Ba2+ + 2OH -
Ca(OH)2= Ca2+ + 2OH -
从电离的角度认识碱
碱:电离时生成的阴离子全部是OH-的化合物
练习:写出下列物质的电离方程式
NaOH 、Ba(OH)2、Ca(OH)2
== NH4+ + Cl-
== 2K+ + CO32-
== Cu2+ + SO4 2-
盐:电离时生成金属阳离子(或NH4+)和
酸根离子的化合物
NH4Cl
K2CO3
CuSO4
练习:写出下列物质的电离方程式
NaHSO4在水溶液中的电离方程式为:
NaHSO4 = Na+ + H+ + SO42- ,NaHSO4属于酸吗?
请你辨析
酸:电离时生成的阳离子全部是H+的化合物
酸式盐:电离时生成的阳离子除金属离子(或NH4+)外还有H+,阴离子为酸根离子的盐
本堂小结:
一、酸、碱、盐在水溶液中的电离
电解质
(酸、碱、盐等)
非电解质
(蔗糖、酒精等)
化合物
在水溶液里或熔融
状态下能否电离
电离
电离方程式
重新认识
酸、碱、盐
1.下列电离方程式书写完全正确的是 ( )
A.H2SO4 === H+ + SO42-
B.Ca(OH)2 === Ca2+ + (OH)22-
C. NaCl === Na+ + Cl-
D.Al2(SO4)3 === Al23+ + 3SO42-
C
小试牛刀
2.下列说法中,正确的是( )
A.液态HCl、固态NaCl均不导电,所以HCl、NaCl均是非电解质
B.CO2的水溶液能导电,所以CO2是电解质
C.蔗糖、酒精在水溶液里和熔融状态下均不导电,所以它们是
非电解质
D.铜、石墨均导电,所以它们是电解质
C
小试牛刀
强电解质:在水溶液里能完全电离的电解质
强、弱电解质的本质区别:能否完全电离
强电解质和弱电解质
弱电解质:在水溶液里只有部分电离的电解质
强酸(H2SO4、HNO3、HCl、HBr、HI、HClO4 )
强碱(NaOH 、KOH、Ba(OH)2 、Ca(OH)2 )
绝大多数盐
弱酸(H2CO3、H2SO3、CH3COOH、HF、H2S )
弱碱(NH3· H2O 等)
水
电解质溶于水后,电离成了自由移动的离子,因此,
电解质在溶液中的反应实质上是离子之间的反应
实验操作
实验现象 ______________ ______________
混合前溶液中微粒 K+、Cl- Ba2+、Cl-
Na+、SO42- Na+、SO42-
混合后溶液中微粒 K+、Cl-、Na+、SO42- _________、Na+、Cl-
实验结论 离子反应使溶液中某些离子浓度________。 无明显现象
有白色沉淀
BaSO4
减小
【实验探究】
1.离子反应
概念:有离子参加或生成的反应
2.离子方程式
用实际参加反应的离子符号表示反应的式子
如何书写离子方程式?
1. “写”正确写出反应的化学方程式
2. “拆”把易溶于水、易电离的物质写成
离子形式
例:写出碳酸钠与盐酸反应的离子方程式
Na2SO4 + BaCl2 = 2NaCl + BaSO4↓
不能拆成离子的物质:
弱酸、弱碱、水、不溶性盐、单质、气体、氧化物
能拆成离子的物质
强 酸
强 碱
可溶性盐
( HCl H2SO4 HNO3等 )
( NaOH Ba(OH)2等)
微溶物的处理:
微溶物作反应物,若澄清,拆成离子(如澄清石灰水);
若浑浊,不拆(如石灰乳/浆)
微溶物作生成物,一般视为沉淀,不拆,
写成化学式并标"↓"符号
1. “写”正确写出反应的化学方程式
2. “拆”把易溶于水、易电离的物质写成
离子形式
3. “删”等量删去方程式两边不参加反应的离 子
4. “查”检查方程式两边各元素的原子个数和离子所带电荷总数是否相等
例:写出碳酸钠与盐酸反应的离子方程式
Na2SO4 + BaCl2 = 2NaCl + BaSO4↓
书写离子方程式应注意:
凡是不在溶液中进行的反应一般不写离子方程式
如:NH4Cl固体与Ca(OH)2固体混合加热,
只能写化学方程式
△
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑+ 2H2O
书写离子方程式应注意:
在水溶液中多元强酸的酸式酸根离子
要拆(HSO4-);
多元弱酸的酸式酸根离子均不拆
(如:HCO3-、HSO3-等)
写出下列四个中和反应的离子方程式:
①HCl与NaOH反应
②HCl与KOH反应
③H2SO4与NaOH反应
④H2SO4与KOH反应
HCl+NaOH=NaCl+H2O
HCl+KOH=KCl+H2O
H2SO4+2NaOH=Na2SO4+2H2O
H2SO4+2KOH=K2SO4+2H2O
H+ + OH- = H2O
离子方程式不仅可表示某一个具体的化学反应,还可表示同一类型的离子反应
H+ + OH- = H2O
可表示强酸与强碱生成可溶性盐和水的反应
复分解型离子反应发生的条件:
①生成沉淀(难溶物质)
②生成气体(挥发性物质)
③生成水 (难电离物质)
结果:使溶液中的某些离子浓度减小
①看离子反应是否符合客观事实
③看是否守恒:原子数、电荷数均守恒
②看物质是否可拆分
④看是否漏掉参加反应的离子
⑤看符号,各种反应条件、生成物状态符
号是否使用正确
5、离子方程式的正误判断
1.Cu放入盐酸中: Cu +2H+= Cu2+ +H2↑
3.Cu放入硝酸银溶液中: Cu +Ag+= Cu2+ +Ag
2.碳酸钙和稀盐酸反应:
CO32+ +2H+= CO2 ↑ +H2O
4.稀硫酸和氢氧化钡溶液反应:
SO42- + Ba2+ = BaSO4↓
×
×
×
×
判断下列离子方程式的对错
离子方程式的书写正误判断
2. 离子共存
离子反应的应用
离子方程式的书写正误判断
(1)“真不真”:符合客观事实
(2)“拆”对了没:拆(强酸、强碱、可溶性盐)
(3)“配平”:原子守恒、电荷守恒
(4)“漏不漏”:“=”“↑”“↓”
离子方程式的书写正误判断
(1)铁与稀硫酸反应:2Fe + 6H+ = 2Fe3+ + 3H2↑
×
(2)Ba(OH)2 溶液与稀 H2SO4 反应:
H+ + OH- + SO42- + Ba2+ = BaSO4↓ + H2O
×
(3)Ba(OH)2溶液与CuSO4溶液反应:
Ba2+ + SO42-=BaSO4↓
×
(4)向盐酸中滴加氨水:H+ + OH- = H2O
×
(5)铝与盐酸溶液反应:Al+3H+=Al3++H2↑
×
2. 离子共存
离子间不发生化学反应就可以大量共存。
(即不生成沉淀、气体、难电离的物质)
特殊条件:
①颜色。有色离子:Cu2+,Fe3+, Fe2+,MnO4-
②酸性:pH<7;
③碱性:pH>7
2. 离子共存
1.在无色透明溶液中,能大量共存的离子组是( )
A、K+、Cu2+、NO3-、 OH-
B、K+、Ba2+、Cl-、CO32-
C、 Ag+ 、OH-、NO3-、Cl-
D、K+、Na+、Fe3+、SO42-
D
2. 离子共存
2. 下列各组离子,能在指定溶液中共存的是( )
A. 无色溶液中:K+、Cl-、Na+、HCO3-、OH-
B.使pH试纸变深蓝色的溶液中:
K+、HCO3-、Na+、Cl-
C. pH=0的溶液中:
Fe2+、Al3+、Cl-、SO42-
D.加入Mg能放出H2的溶液中:
Mg2+、HCO3-、Cl-、Na+、SO42-
C
课堂练习
1、在下列化学方程式中,不能用离子方程式Ba2+ + SO42- = BaSO4↓表示的是( )
A、Ba(NO3)2 + H2SO4 = BaSO4↓ +2HNO3
B、BaCl2 + Na2SO4 = BaSO4↓ +2NaCl
C、BaCO3 +H2SO4 = BaSO4↓+CO2↑+H2O
D、BaCl2 + H2SO4 = BaSO4↓ +2HCl
C
课堂练习
2、判断下列物质间能否发生离子反应。
① KCl与NaOH;( )
② Ca(OH)2与HNO3;( )
③ AlCl3与AgNO3;( )
④ BaCl2溶液与Na2SO4溶液( )
√
√
√
×
课堂练习
3. 下列反应的离子方程式中,书写正确的是( )
A.钠跟水反应:
2Na+2H2O ═ 2Na++2OH﹣+H2↑
B.铁粉跟稀硫酸反应:
2Fe+6H+ ═ 2Fe3++3H2↑
C.氢氧化钡溶液跟稀硫酸反应:
Ba2++SO42﹣ ═ BaSO4↓
D.碳酸钙跟盐酸反应:
CO32﹣+2H+ ═ H2O+CO2↑
A
1. 在强酸性无色透明溶液中,下列各组离子能大量共存的是( )
A. Fe3+ 、 K+ 、 Cl- 、 NO3-
B. Ag+ 、 Na+ 、 NO3- 、 Cl-
C. Zn2+ 、 Al3+ 、 SO42- 、 Cl-
D. Ba2+ 、 NH4+ 、 Cl - 、 HCO3-
C
2. 在强碱性溶液中能大量共存并且溶液为无色透明的离子组是( )
A. Na+ 、 Cu2+ 、 NO3- 、 Cl-
B. K+ 、 Na+ 、 CO32- 、 NO3-
C. K+ 、 Ba2+ 、 CO32- 、 Cl-
D. Na+ 、 K+ 、 MnO4- 、 SO42-
B
【 知识延申2】
离子共存小结:
原则:能反应生成沉淀、气体、难电离物质的不能共存。
1 . 与H+ 不能
共存的离子:
CO32- 、CH3COO- 、HCO3-
OH-
H+
会生成氢氧化物沉淀的离子
3. 微溶物、难溶物的两种离子不能共存:如CaSO4是
微溶物,故Ca2+与SO42-不共存, AgCl是难溶物故Ag+与Cl-不共存。
2. 与OH— 不能
共存的离子:
4. 要注意题目隐含条件:溶液有无颜色【Cu2+(蓝)、Fe3+(棕黄)、
Fe2+(浅绿)、MnO4-(紫色)】,溶液的酸碱性、pH等。
离子反应在生活生产中有较广泛的应用。如混合物分离、物质提纯和鉴定、清除水中污染物等。水体中含量过高的Ca2+、Mg2+ 既会造成锅炉结垢,也会降低洗涤衣物时肥皂的使用效率。如何在不引入新杂质的情况下除去这些离子,使水得到净化
【方案设计】
①选择药品(溶液),确定加药顺序和操作顺序;
②确保所加药品(应适当过量)在后续反应中被清除。
【参考答案】
先加石灰除去Mg2+ ,再加碳酸钠除去Ca2+,最后加盐酸除去过量的OH-和CO32-。
【联系实际】
正盐:电离生成的阳离子全部是金属阳离子(或铵离子),电离生成的阴离子全部是酸根离子的盐。
酸式盐:电离生成的阳离子除了金属阳离子(或铵离子)外,还有氢离子的盐。
碱式盐:电离生成的阴离子除了酸根离子外,还有氢氧根离子的盐。
三、 从电离的角度认识酸碱盐
