2014-2015学年九年级化学上册 第五单元 定量研究化学反应复习课件 (新版)鲁教版(共43张PPT)
文档属性
| 名称 | 2014-2015学年九年级化学上册 第五单元 定量研究化学反应复习课件 (新版)鲁教版(共43张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-02-05 00:00:00 | ||
图片预览










文档简介
课件43张PPT。阶段复习课
第五单元主题一 质量守恒定律
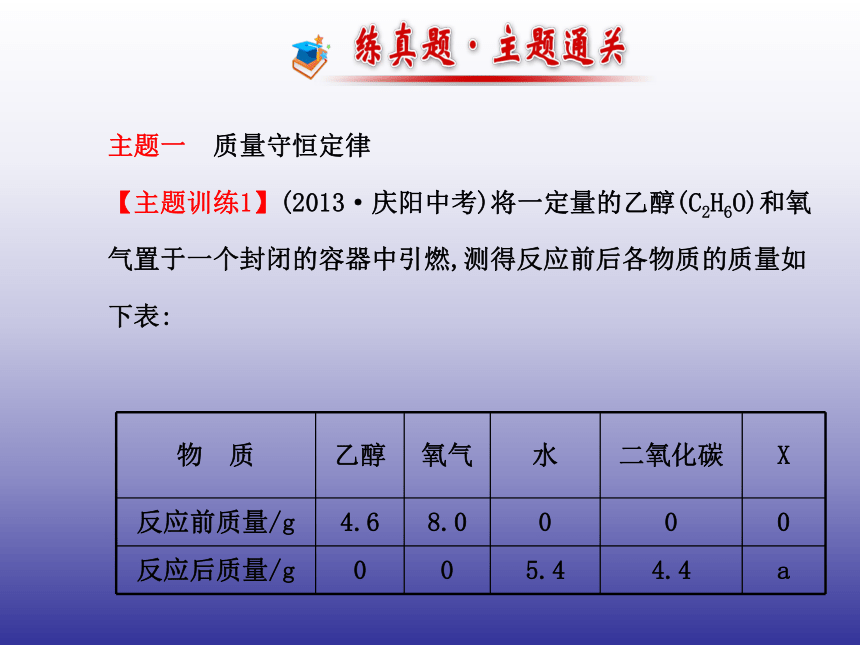
【主题训练1】(2013·庆阳中考)将一定量的乙醇(C2H6O)和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:下列判断正确的是( )
A.表中a的值为2.6
B.X一定是该反应的催化剂
C.X可能含有氢元素
D.若起始时氧气的质量是9.6 g,则无X生成【解析】选D。A选项由表中数据分析可知,反应前后,乙醇的质
量减少了4.6 g,故乙醇是反应物,参加反应的乙醇的质量为
4.6 g;同理可以确定氧气是反应物,参加反应的氧气的质量为
8.0 g;水是生成物,生成的水的质量为5.4 g;生成二氧化碳的
质量为4.4 g;由质量守恒定律,X应是生成物,且生成的X的质量
为4.6 g+8.0 g-5.4 g-4.4 g=2.8 g,故表中a的值为2.8,故选
项说法错误。由A选项分析可知,X的质量增加,故一定不是该反
应的催化剂,故B选项说法错误。C选项根据反应前后元素质量不变,反应物乙醇中含氢元素的质量为4.6 g×
×100%=0.6 g,生成物水中含氢元素的质量为5.4 g×
×100%=0.6 g,氢元素的质量相等,故X中不含氢元素;故选项说
法错误。D选项根据乙醇燃烧的方程式可知,4.6 g乙醇能与
9.6 g的氧气恰好完全反应,生成了二氧化碳和水;故选项说法
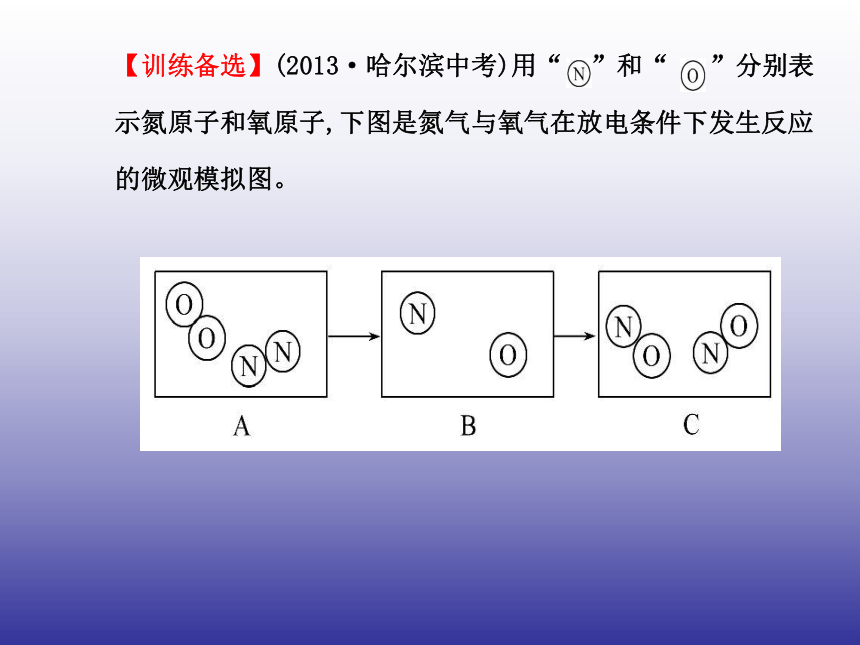
正确。故选D。【训练备选】(2013·哈尔滨中考)用“ ”和“ ”分别表
示氮原子和氧原子,下图是氮气与氧气在放电条件下发生反应
的微观模拟图。请回答下列问题:
(1)在B图中将相关粒子图形补充完整;
(2)此变化中发生改变的粒子是_________________________;
(3)结合该图示从微观角度解释由A到B变化的实质是_______
____________________________________________________。【解析】(1)由A→B是分子中的原子的分开过程,故B中应该是
原子数目与A中的相同,所以相关粒子图形为
(2)由图示可知该变化过程中氧气和氮气的分子发生了变化;
(3)从微观角度解释由A到B变化的实质是在放电的条件下氮分
子分解成氮原子,氧分子分解成氧原子。答案:(1) (2)氧气和氮气的分子发生了变化
(3)在放电的条件下氮分子分解成氮原子,氧分子分解成氧原子【关键点拨】 质量守恒定律及其应用
(1)对质量守恒定律的理解,可以归纳为“三个守恒”
宏观上元素守恒:元素种类、质量不变。
微观上原子守恒:原子种类、数目、质量不变。
质量上质量守恒:物质总质量不变。(2)质量守恒定律的运用,主要体现在以下几个方面:
解释现象;
确定化学方程式中某物质的化学式;
确定微观反应中某反应物或生成物的微粒构成及微粒个数比;
根据化学方程式求某元素的质量;
根据化学方程式确定物质间的质量关系或求某物质的质量。【真题体验】
1.(2012·山西中考)氯碱工业的反应原理是电解饱和食盐水,下列物质不可能是氯碱工业产品的是( )
A.H2 B.Cl2 C.Na2CO3 D.NaOH
【解析】选C。反应前后元素的种类保持不变,反应前有H、Na、Cl、O,反应后生成物的元素也应有这些元素,故生成物中不可能存在碳元素,故C物质不可能存在。2.(2013·南宁中考)镁在二氧化碳中燃烧的化学方程式为2Mg
+CO2 2MgO+X,则X的化学式为( )
A.CO B.C C.Mg(OH)2 D.MgCO3
【解析】选B。从化学方程式可以判断反应前有2个镁原子、1
个碳原子和2个氧原子,反应后除X外有2个镁原子和2个氧原子,
依据化学反应前后原子的种类和个数不变可知,X中有1个碳原
子,所以X的化学式为C。3.(2013·济南中考)某化学反应的微观过程如下图,则下列说法中,不合理的是( )
A.该反应属于氧化反应
B.甲、乙两物质参加反应的质量比为13∶16
C.物质丁的化学式是H2O
D.反应前后氧元素的化合价发生了改变【解析】选B。该反应的反应物乙为氧气,可以确定该反应有氧
气参加,故该反应属于氧化反应;由甲、乙的原子构成确定甲为
C2H2,乙为O2,根据两分子的分子个数比为2∶5,故质量比为(26
×2)∶(5×32)=13∶40;由反应前后原子的种类与个数不发生
变化,丁物质含2个氢原子,1个氧原子,即生成物丁为一个水分
子;反应前氧气中氧元素的化合价为0,反应后二氧化碳与水中
氧元素的化合价均为-2,化合价发生了变化。4.(2013·遂宁中考)从微观角度上,许多化学反应都可用模拟
图像形象地表示其反应的过程,图中“ ”和“ ”分别表
示不同元素的原子,下列关于图示反应的说法正确的是( )A.该反应不一定是化合反应
B.反应中甲、乙、丙的分子个数比为1∶1∶1
C.甲、丙可能是氧化物
D.ag甲和bg乙充分反应一定生成(a+b)g丙【解析】选C。可设图示中的原子元素符号分别为X、Y,则甲化学式为XY,乙化学式为Y2,丙化学式为XY2,反应的化学方程式可表示为2XY+Y2====2XY2,故反应一定属于化合反应,反应中甲、乙、丙的分子个数比为2∶1∶2,乙是单质,甲和丙都由相同的两种元素组成,若其中一种为氧元素,则甲和丙都是氧化物,如果ag甲和bg乙充分反应,不是恰好完全反应,则生成丙的质量小于(a+b)g,所以只有C正确。5.(2013·龙东中考)密闭容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表所示。下列说法正确的是( )A.该反应是化合反应
B.M的值是15
C.反应中甲、丙质量比为15∶27
D.该反应是分解反应
【解析】选D。根据质量守恒定律可知M=11,甲的质量减少为反应物,丙、丁的质量增加为生成物,乙的质量不变,可能是催化剂,也可能不参加反应,因此该反应属于分解反应;反应中甲、丙质量比为(90-36)g∶(35-5)g=9∶5。6.(2013·绥化中考)某有机物4.4 g在氧气中充分燃烧,生成13.2 g二氧化碳和7.2 g水。由此可确定物质是由________元素组成的,如果该物质的相对分子质量是44,该物质的化学式为________。【解析】本题考查质量守恒定律的应用。13.2 g二氧化碳中碳元素的质量为13.2 g×(12/44)=3.6 g,7.2 g水中含有的氢元素的质量为7.2 g×(2/18)=0.8 g,根据化学反应前后元素的质量不变,所以该有机物中也含有3.6 g碳元素与0.8 g氢元素,因为3.6 g+0.8 g=4.4 g,故该化合物中不含有氧元素,根据碳元素与氢元素的质量比可求两元素的原子个数比为3∶8,由于该物质的相对分子质量是44,所以化学式为C3H8。
答案:碳、氢(或C、H) C3H8【方法归纳】确定物质化学式的常用方法
(1)根据化合价确定化学式;
(2)根据原子结构确定化学式;
(3)根据元素的质量比确定化学式;
(4)根据质量守恒定律确定化学式;
(5)根据微观粒子图确定化学式;
(6)根据图像信息确定化学式。主题二 化学方程式
【主题训练2】(2012·乐山中考)取只含碳酸氢钙的硬水ag,充
分加热,发生如下反应:
Ca(HCO3)2 CaCO3↓+CO2↑+H2O,得到沉淀1.0 g。回答下列
问题:
(1)碳酸氢钙中钙元素与氧元素的质量比为_______________。
(2)计算此硬水中碳酸氢钙的质量是多少?
(3)将ag这样的硬水充分煮沸,理论上可得到的软水质量为
______________________。【解析】(1)由化学式Ca(HCO3)2可得,碳酸氢钙中钙元素与氧
元素的质量比为40∶(16×6)=5∶12;(2)分析题意可知,1.0 g
沉淀为CaCO3,根据该数据可求算碳酸氢钙的质量;(3)由化学方
程式可知,反应除生成沉淀外,还有气体生成,故得到水的质量
应为ag硬水质量减去沉淀和气体的质量。即由化学方程式可知,
生成的CaCO3和CO2的分子个数比为1∶1,质量比为100∶44,设
生成1 g CaCO3的同时,生成CO2的质量为Y,则100∶44 =1 g∶Y,
解得Y=0.44 g,故得到水的质量为ag-1 g-0.44 g=(a-1.44)g
(其他解法,只要合理即可)。答案:(1)5∶12
(2)解:设Ca(HCO3)2的质量为x
Ca(HCO3)2 CaCO3↓+CO2↑+H2O
162 100
x 1.0 g
162∶100=x∶1.0 g x=1.62 g
(3)(a-1.44)g【训练备选】(2013·厦门中考)为测定锌铜合金中锌的含量,
取该合金放入如图盛有稀硫酸的锥形瓶中,发生反应:Zn+H2SO4
====ZnSO4+H2↑。多次实验后,取平均值所得数据如下表:若不考虑干燥剂吸收空气中的水蒸气,计算:
(1)根据质量守恒定律求生成氢气的质量。
(2)该合金中锌的质量分数。【解析】本题通过表格数据分析考查根据化学方程式进行的计算。根据质量守恒定律反应前后减少的质量即为产生氢气的质量。根据题示的化学方程式,找锌与氢气的质量关系,列出比例式,由氢气的质量可以计算锌的质量,从而可以计算锌的质量分数。答案:(1)解:依题意可得氢气的质量=342.10 g+16.00 g-357.70 g=0.4 g
(2)解:设该合金中锌的质量分数为x。
Zn+H2SO4====ZnSO4+H2↑
65 2
16.00 g×x 0.4 g
x=81.25%
答:氢气的质量为0.4 g,该合金中锌的质量分数为81.25%。【关键点拨】
利用化学方程式的计算易发生的几个错误
(1)题意理解不清,答非所问。
(2)化学方程式书写错误,使计算失去正确依据。
(3)单位不统一,有时把体积直接代入进行计算。
(4)把不纯物质的量当作纯净物的量代入。
(5)求算物质的相对分子质量时出现错误。【真题体验】
1.(2012·宁夏中考)根据化学方程式不能获得的信息是( )
A.化学反应的快慢
B.该反应中的反应物和生成物
C.反应发生所需要的条件
D.各反应物和生成物的质量比
【解析】选A。根据化学方程式可以确定反应物、生成物及反
应条件,可以计算出各物质的质量比,但无法确定化学反应的快
慢。2.(2013·绥化中考)在化学反应2A+B2====2C中,已知20 g A和足量B2充分反应后,生成30 g C。已知B2的相对分子质量为32,则C的相对分子质量是( )
A.20 B.32 C.48 D.96
【解析】选C。由题意知参加反应的B2的质量为10 g,所以化学方程式中B2与C的质量比为1∶3,设C的相对分子质量为x,根据化学方程式可知32∶2x=1∶3,所以x=48。3.(2013·宿迁中考)如图为某化学反应的微观示意图,“ ”
和“ ”分别代表不同元素的原子,该反应可能是( )A.2CO+O2 2CO2
B.2H2+O2 2H2O
C.CH4+2O2 CO2+2H2O
D.2Mg+O2 2MgO
【解析】选A。根据图示信息可以看出,反应物为一种化合物和一种单质,生成物为一种化合物,符合以上信息的只有A项。【方法归纳】几种特殊类型的化学方程式书写
(1)信息型:根据所给信息找出反应物、生成物及反应条件是成功解答此类问题的关键。
(2)给出范例型:书写这类化学方程式的技巧是用好范例,但切忌机械模仿,必须根据化合价写化学式,并重新配平。(3)展示模型:微观粒子模型是解答问题的基础,根据模型中每种物质的构成确定反应物、生成物的化学式,进而写出反应的化学方程式。
(4)限制要求型:从反应类型,反应条件,物质的种类等角度对典型的化学方程式进行归纳、总结,进而正确写出化学方程式。4.(2013·无锡中考改编)写出下列反应的化学方程式,并在括号内注明基本反应类型:
(1)碳在氧气中完全燃烧_______________________________,
(______________)反应。
(2)过氧化氢在二氧化锰催化作用下制氧气_______________,
(______________)反应。【解析】(1)碳在氧气中完全燃烧生成二氧化碳,该反应符合“多变一”的特征,属于化合反应;
(2)过氧化氢在二氧化锰的催化作用下生成水和氧气,该反应符合“一变多”的特征,属于分解反应。
答案:(1)C+O2 CO2 化合
(2)2H2O2 2H2O+O2↑ 分解5.(2013·福州中考)用石灰石泥浆吸收工业废气中的二氧化硫,
可以有效地减少二氧化硫的排放。若用12.5 t含碳酸钙80%的
石灰石配成泥浆,理论上碳酸钙能完全吸收二氧化硫的质量为
多少?(精确到0.1 t)(该反应的化学方程式为2CaCO3+O2+2SO2
2CaSO4+2CO2)
【解析】本题考查有关化学方程式的计算。根据题示的化学方
程式,找碳酸钙与二氧化硫的质量关系,列出比例式,由碳酸钙
的质量可以计算二氧化硫的质量。答案:设:理论上碳酸钙能完全吸收二氧化硫的质量为x。
2CaCO3 + O2 + 2SO2 2CaSO4 + 2CO2
200 128
12.5 t×80% x
x=6.4 t
答:理论上碳酸钙能完全吸收二氧化硫的质量为6.4 t。
第五单元主题一 质量守恒定律
【主题训练1】(2013·庆阳中考)将一定量的乙醇(C2H6O)和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:下列判断正确的是( )
A.表中a的值为2.6
B.X一定是该反应的催化剂
C.X可能含有氢元素
D.若起始时氧气的质量是9.6 g,则无X生成【解析】选D。A选项由表中数据分析可知,反应前后,乙醇的质
量减少了4.6 g,故乙醇是反应物,参加反应的乙醇的质量为
4.6 g;同理可以确定氧气是反应物,参加反应的氧气的质量为
8.0 g;水是生成物,生成的水的质量为5.4 g;生成二氧化碳的
质量为4.4 g;由质量守恒定律,X应是生成物,且生成的X的质量
为4.6 g+8.0 g-5.4 g-4.4 g=2.8 g,故表中a的值为2.8,故选
项说法错误。由A选项分析可知,X的质量增加,故一定不是该反
应的催化剂,故B选项说法错误。C选项根据反应前后元素质量不变,反应物乙醇中含氢元素的质量为4.6 g×
×100%=0.6 g,生成物水中含氢元素的质量为5.4 g×
×100%=0.6 g,氢元素的质量相等,故X中不含氢元素;故选项说
法错误。D选项根据乙醇燃烧的方程式可知,4.6 g乙醇能与
9.6 g的氧气恰好完全反应,生成了二氧化碳和水;故选项说法
正确。故选D。【训练备选】(2013·哈尔滨中考)用“ ”和“ ”分别表
示氮原子和氧原子,下图是氮气与氧气在放电条件下发生反应
的微观模拟图。请回答下列问题:
(1)在B图中将相关粒子图形补充完整;
(2)此变化中发生改变的粒子是_________________________;
(3)结合该图示从微观角度解释由A到B变化的实质是_______
____________________________________________________。【解析】(1)由A→B是分子中的原子的分开过程,故B中应该是
原子数目与A中的相同,所以相关粒子图形为
(2)由图示可知该变化过程中氧气和氮气的分子发生了变化;
(3)从微观角度解释由A到B变化的实质是在放电的条件下氮分
子分解成氮原子,氧分子分解成氧原子。答案:(1) (2)氧气和氮气的分子发生了变化
(3)在放电的条件下氮分子分解成氮原子,氧分子分解成氧原子【关键点拨】 质量守恒定律及其应用
(1)对质量守恒定律的理解,可以归纳为“三个守恒”
宏观上元素守恒:元素种类、质量不变。
微观上原子守恒:原子种类、数目、质量不变。
质量上质量守恒:物质总质量不变。(2)质量守恒定律的运用,主要体现在以下几个方面:
解释现象;
确定化学方程式中某物质的化学式;
确定微观反应中某反应物或生成物的微粒构成及微粒个数比;
根据化学方程式求某元素的质量;
根据化学方程式确定物质间的质量关系或求某物质的质量。【真题体验】
1.(2012·山西中考)氯碱工业的反应原理是电解饱和食盐水,下列物质不可能是氯碱工业产品的是( )
A.H2 B.Cl2 C.Na2CO3 D.NaOH
【解析】选C。反应前后元素的种类保持不变,反应前有H、Na、Cl、O,反应后生成物的元素也应有这些元素,故生成物中不可能存在碳元素,故C物质不可能存在。2.(2013·南宁中考)镁在二氧化碳中燃烧的化学方程式为2Mg
+CO2 2MgO+X,则X的化学式为( )
A.CO B.C C.Mg(OH)2 D.MgCO3
【解析】选B。从化学方程式可以判断反应前有2个镁原子、1
个碳原子和2个氧原子,反应后除X外有2个镁原子和2个氧原子,
依据化学反应前后原子的种类和个数不变可知,X中有1个碳原
子,所以X的化学式为C。3.(2013·济南中考)某化学反应的微观过程如下图,则下列说法中,不合理的是( )
A.该反应属于氧化反应
B.甲、乙两物质参加反应的质量比为13∶16
C.物质丁的化学式是H2O
D.反应前后氧元素的化合价发生了改变【解析】选B。该反应的反应物乙为氧气,可以确定该反应有氧
气参加,故该反应属于氧化反应;由甲、乙的原子构成确定甲为
C2H2,乙为O2,根据两分子的分子个数比为2∶5,故质量比为(26
×2)∶(5×32)=13∶40;由反应前后原子的种类与个数不发生
变化,丁物质含2个氢原子,1个氧原子,即生成物丁为一个水分
子;反应前氧气中氧元素的化合价为0,反应后二氧化碳与水中
氧元素的化合价均为-2,化合价发生了变化。4.(2013·遂宁中考)从微观角度上,许多化学反应都可用模拟
图像形象地表示其反应的过程,图中“ ”和“ ”分别表
示不同元素的原子,下列关于图示反应的说法正确的是( )A.该反应不一定是化合反应
B.反应中甲、乙、丙的分子个数比为1∶1∶1
C.甲、丙可能是氧化物
D.ag甲和bg乙充分反应一定生成(a+b)g丙【解析】选C。可设图示中的原子元素符号分别为X、Y,则甲化学式为XY,乙化学式为Y2,丙化学式为XY2,反应的化学方程式可表示为2XY+Y2====2XY2,故反应一定属于化合反应,反应中甲、乙、丙的分子个数比为2∶1∶2,乙是单质,甲和丙都由相同的两种元素组成,若其中一种为氧元素,则甲和丙都是氧化物,如果ag甲和bg乙充分反应,不是恰好完全反应,则生成丙的质量小于(a+b)g,所以只有C正确。5.(2013·龙东中考)密闭容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表所示。下列说法正确的是( )A.该反应是化合反应
B.M的值是15
C.反应中甲、丙质量比为15∶27
D.该反应是分解反应
【解析】选D。根据质量守恒定律可知M=11,甲的质量减少为反应物,丙、丁的质量增加为生成物,乙的质量不变,可能是催化剂,也可能不参加反应,因此该反应属于分解反应;反应中甲、丙质量比为(90-36)g∶(35-5)g=9∶5。6.(2013·绥化中考)某有机物4.4 g在氧气中充分燃烧,生成13.2 g二氧化碳和7.2 g水。由此可确定物质是由________元素组成的,如果该物质的相对分子质量是44,该物质的化学式为________。【解析】本题考查质量守恒定律的应用。13.2 g二氧化碳中碳元素的质量为13.2 g×(12/44)=3.6 g,7.2 g水中含有的氢元素的质量为7.2 g×(2/18)=0.8 g,根据化学反应前后元素的质量不变,所以该有机物中也含有3.6 g碳元素与0.8 g氢元素,因为3.6 g+0.8 g=4.4 g,故该化合物中不含有氧元素,根据碳元素与氢元素的质量比可求两元素的原子个数比为3∶8,由于该物质的相对分子质量是44,所以化学式为C3H8。
答案:碳、氢(或C、H) C3H8【方法归纳】确定物质化学式的常用方法
(1)根据化合价确定化学式;
(2)根据原子结构确定化学式;
(3)根据元素的质量比确定化学式;
(4)根据质量守恒定律确定化学式;
(5)根据微观粒子图确定化学式;
(6)根据图像信息确定化学式。主题二 化学方程式
【主题训练2】(2012·乐山中考)取只含碳酸氢钙的硬水ag,充
分加热,发生如下反应:
Ca(HCO3)2 CaCO3↓+CO2↑+H2O,得到沉淀1.0 g。回答下列
问题:
(1)碳酸氢钙中钙元素与氧元素的质量比为_______________。
(2)计算此硬水中碳酸氢钙的质量是多少?
(3)将ag这样的硬水充分煮沸,理论上可得到的软水质量为
______________________。【解析】(1)由化学式Ca(HCO3)2可得,碳酸氢钙中钙元素与氧
元素的质量比为40∶(16×6)=5∶12;(2)分析题意可知,1.0 g
沉淀为CaCO3,根据该数据可求算碳酸氢钙的质量;(3)由化学方
程式可知,反应除生成沉淀外,还有气体生成,故得到水的质量
应为ag硬水质量减去沉淀和气体的质量。即由化学方程式可知,
生成的CaCO3和CO2的分子个数比为1∶1,质量比为100∶44,设
生成1 g CaCO3的同时,生成CO2的质量为Y,则100∶44 =1 g∶Y,
解得Y=0.44 g,故得到水的质量为ag-1 g-0.44 g=(a-1.44)g
(其他解法,只要合理即可)。答案:(1)5∶12
(2)解:设Ca(HCO3)2的质量为x
Ca(HCO3)2 CaCO3↓+CO2↑+H2O
162 100
x 1.0 g
162∶100=x∶1.0 g x=1.62 g
(3)(a-1.44)g【训练备选】(2013·厦门中考)为测定锌铜合金中锌的含量,
取该合金放入如图盛有稀硫酸的锥形瓶中,发生反应:Zn+H2SO4
====ZnSO4+H2↑。多次实验后,取平均值所得数据如下表:若不考虑干燥剂吸收空气中的水蒸气,计算:
(1)根据质量守恒定律求生成氢气的质量。
(2)该合金中锌的质量分数。【解析】本题通过表格数据分析考查根据化学方程式进行的计算。根据质量守恒定律反应前后减少的质量即为产生氢气的质量。根据题示的化学方程式,找锌与氢气的质量关系,列出比例式,由氢气的质量可以计算锌的质量,从而可以计算锌的质量分数。答案:(1)解:依题意可得氢气的质量=342.10 g+16.00 g-357.70 g=0.4 g
(2)解:设该合金中锌的质量分数为x。
Zn+H2SO4====ZnSO4+H2↑
65 2
16.00 g×x 0.4 g
x=81.25%
答:氢气的质量为0.4 g,该合金中锌的质量分数为81.25%。【关键点拨】
利用化学方程式的计算易发生的几个错误
(1)题意理解不清,答非所问。
(2)化学方程式书写错误,使计算失去正确依据。
(3)单位不统一,有时把体积直接代入进行计算。
(4)把不纯物质的量当作纯净物的量代入。
(5)求算物质的相对分子质量时出现错误。【真题体验】
1.(2012·宁夏中考)根据化学方程式不能获得的信息是( )
A.化学反应的快慢
B.该反应中的反应物和生成物
C.反应发生所需要的条件
D.各反应物和生成物的质量比
【解析】选A。根据化学方程式可以确定反应物、生成物及反
应条件,可以计算出各物质的质量比,但无法确定化学反应的快
慢。2.(2013·绥化中考)在化学反应2A+B2====2C中,已知20 g A和足量B2充分反应后,生成30 g C。已知B2的相对分子质量为32,则C的相对分子质量是( )
A.20 B.32 C.48 D.96
【解析】选C。由题意知参加反应的B2的质量为10 g,所以化学方程式中B2与C的质量比为1∶3,设C的相对分子质量为x,根据化学方程式可知32∶2x=1∶3,所以x=48。3.(2013·宿迁中考)如图为某化学反应的微观示意图,“ ”
和“ ”分别代表不同元素的原子,该反应可能是( )A.2CO+O2 2CO2
B.2H2+O2 2H2O
C.CH4+2O2 CO2+2H2O
D.2Mg+O2 2MgO
【解析】选A。根据图示信息可以看出,反应物为一种化合物和一种单质,生成物为一种化合物,符合以上信息的只有A项。【方法归纳】几种特殊类型的化学方程式书写
(1)信息型:根据所给信息找出反应物、生成物及反应条件是成功解答此类问题的关键。
(2)给出范例型:书写这类化学方程式的技巧是用好范例,但切忌机械模仿,必须根据化合价写化学式,并重新配平。(3)展示模型:微观粒子模型是解答问题的基础,根据模型中每种物质的构成确定反应物、生成物的化学式,进而写出反应的化学方程式。
(4)限制要求型:从反应类型,反应条件,物质的种类等角度对典型的化学方程式进行归纳、总结,进而正确写出化学方程式。4.(2013·无锡中考改编)写出下列反应的化学方程式,并在括号内注明基本反应类型:
(1)碳在氧气中完全燃烧_______________________________,
(______________)反应。
(2)过氧化氢在二氧化锰催化作用下制氧气_______________,
(______________)反应。【解析】(1)碳在氧气中完全燃烧生成二氧化碳,该反应符合“多变一”的特征,属于化合反应;
(2)过氧化氢在二氧化锰的催化作用下生成水和氧气,该反应符合“一变多”的特征,属于分解反应。
答案:(1)C+O2 CO2 化合
(2)2H2O2 2H2O+O2↑ 分解5.(2013·福州中考)用石灰石泥浆吸收工业废气中的二氧化硫,
可以有效地减少二氧化硫的排放。若用12.5 t含碳酸钙80%的
石灰石配成泥浆,理论上碳酸钙能完全吸收二氧化硫的质量为
多少?(精确到0.1 t)(该反应的化学方程式为2CaCO3+O2+2SO2
2CaSO4+2CO2)
【解析】本题考查有关化学方程式的计算。根据题示的化学方
程式,找碳酸钙与二氧化硫的质量关系,列出比例式,由碳酸钙
的质量可以计算二氧化硫的质量。答案:设:理论上碳酸钙能完全吸收二氧化硫的质量为x。
2CaCO3 + O2 + 2SO2 2CaSO4 + 2CO2
200 128
12.5 t×80% x
x=6.4 t
答:理论上碳酸钙能完全吸收二氧化硫的质量为6.4 t。
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
