化学人教版(2019)必修第一册2.3.3物质的量浓度 课件(共28张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.3.3物质的量浓度 课件(共28张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 8.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-17 17:20:35 | ||
图片预览








文档简介
(共28张PPT)
第三节 物质的量
第二章 海水中的重要元素—钠和氯
第3课时:物质的量浓度
目 录
CONTENTS
02
物质的量浓度的相关计算
01
物质的量浓度
03
一定物质的量浓度溶液的配制
学习目标
1.能够根据物质的量浓度的概念表达式进行简单的计算。
2.了解容量瓶的特点、用途和使用方法。
3.掌握配制一定物质的量浓度溶液的实验操作,建立实验误差分析的思维模型,并能应用模型解决实际问题。
(本页可根据需要自行删除)
①由于ppt含较多高质量素材和视频,故资源比较大。
②所用视频均内嵌在ppt中,不需要另外下载。本节共有1个视频,根据需要选择即时播放。
视频清单
①一定物质的量浓度溶液的配制
致老师和同学们
质量分数
体积分数
生活中溶液浓度的表示方法很多.....
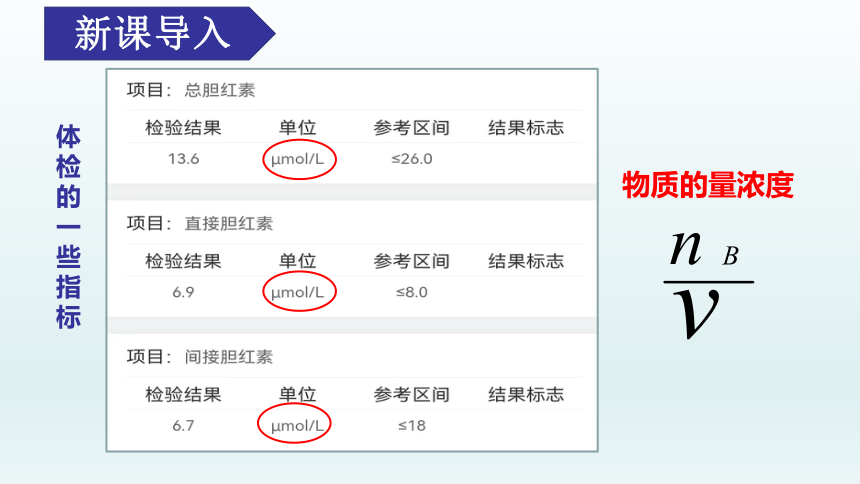
新课导入
体积浓度
体检的一些指标
物质的量浓度
新课导入
1
物质的量浓度
mol/L或 mol·L-1
1. 定义:
单位体积溶液中所含溶质B的物质的量。(可理解成1L溶液)
3. 计算公式:
4. 单位:
2. 符号:
CB
nB
CB
V=
nB =
CB×V
5. 公式变换:
一、物质的量浓度
cB =
溶质物质的量
溶液的体积
物质的量浓度
6.公式使用注意事项:
(1)B表示溶液中的溶质(物质或离子)
(2)V表示溶液体积,单位是L
(3)质量具有加和性,m液 = m剂 + m质
(4)体积不具有加和性,V液 ≠ V剂 + V质(除非题中标明)
(5)均一性:同一溶液,溶质物质的量浓度与所取溶液体积无关
一、物质的量浓度
V溶液 =
m溶液
ρ溶剂
cB =
经典例题
【典例1】下列溶液中溶质的物质的量浓度为1 mol·L-1的是( )
A.将40 g 氢氧化钠溶解于1 L水中
B.将22.4 L氯化氢气体溶于水配成1 L溶液
C.将1 L 10 mol·L-1 的浓盐酸与9 L水混合
D.将10.6 g碳酸钠溶解于水得到100 mL溶液
D
一、物质的量浓度
【典例2】将2.86 g Na2CO3·10 H2O溶于水配成1 L溶液,则:
(1) 该溶液的溶质为 ,其物质的量浓度为 mol/L
(2) 从所配溶液中取出10 mL溶液,取出溶液的物质的量浓度为_________ mol/L,Na+的物质的量浓度为 mol·L-1,溶液中溶质的质量为 g。
Na2CO3
0.01
0.01
0.02
1.06×10-2
一、物质的量浓度
2
物质的量浓度的相关计算
二、物质的量浓度的相关计算
1.依据公式cB = 计算物质的量浓度
计算的基本类型和方法:
二、物质的量浓度的相关计算
2.溶液的稀释与混合 (1)稀释 溶液稀释前后溶液的体积发生变化但溶质质量不变:m1w1=m2w2; 溶质的物质的量不变:c1·V1=c2·V2。 (2)混合: c(混)·V(混)=c1V1+c2V2。
3.物质的量浓度(C)与溶质质量分数(ω)之间的换算
二、物质的量浓度的相关计算
【典例3】标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,则下列关系中不正确的是( ) A.ρ=22.4+22.4V(17V+22400) B.w=1000ρ(17c) C.w=17V+22400(17V) D.c=17V+22400(1000Vρ)
答案 A解析 A项的错误在于它将溶液的体积误作水的体积加气体的体积;B项,取1 L溶液计算,1 L溶液中NH3的物质的量等于c mol·L-1×1 L=c mol,故NH3的质量等于17c g,溶液的质量等于1000 mL×ρ g·mL-1,所以w=1000ρ(17c);C项,NH3的质量等于22.4 L·mol-1(V L×17 g·mol-1)=22.4(17V) g,故w=+1000(17V)=17V+22400(17V);D项,将C项中的w和M=17代入c=M(1000ρw)中即可。
二、物质的量浓度的相关计算
【典例4】取100 mL 0.3 mol·L-1的硫酸溶液和200 mL 0.25 mol·L-1的硫酸溶液混合后加水稀释至400 mL,该混合溶液中硫酸的物质的量浓度是( )
A.0.1 mol·L-1 B.0.2 mol·L-1
C.0.3 mol·L-1 D.0.4 mol·L-1
答案 B
【典例5】市售浓硫酸中溶质的质量分数为98%,密度为1.84g/cm3。则该浓硫酸中的物质的量浓度是多少?
18.4 mol/L
3
一定物质的量浓度溶液的配制
三、一定物质的量浓度溶液的配制
【实验2-10】配制100 mL 1.00 mol / L NaCl溶液
三、一定物质的量浓度溶液的配制
1.主要仪器介绍:容量瓶(常用规格有500ml,250ml,100ml,50ml)
(1)构造:细颈、梨形的平底玻璃瓶,瓶口配有磨口玻璃塞或塑料塞
(2)特点:①容量瓶上标有温度和容积
②容量瓶瓶颈处有刻度线
(3)用途:用于配制一定物质的量浓度的溶液
(4)注意事项:
①使用前要检查是否漏水
②不能在容量瓶中进行溶解或稀释操作
③不能用做反应容器或长期存放溶液
(1) 计算
(2)称量(托盘天平或量筒)
(3)溶解(烧杯、玻璃棒)
(4)冷却
(5)转移和洗涤(容量瓶、玻璃棒)
(6)定容(胶头滴管)
(7)摇匀
(8)装瓶贴签
2.操作步骤小结
平视读数、液面与刻度线相切
三、一定物质的量浓度溶液的配制
三、一定物质的量浓度溶液的配制
3.误差分析
三、一定物质的量浓度溶液的配制
能引起误差的一些操作 因变量 c/(mol·L-1)
m(溶质) V(溶液)
托 盘 天 平 a.天平的砝码粘有其他物质或生锈
b.称量易潮解的物质(如NaOH固体)时间过长
c.用称量纸称易潮解的物质(如NaOH固体)
量筒 d.量取液体时,仰视读数
e.量取液体时,俯视读数
烧杯及玻璃棒 f.搅拌时部分液体溅出
g.未洗涤烧杯和玻璃棒
偏大
不变
偏大
偏小
不变
偏小
偏小
不变
偏小
偏大
不变
偏大
偏小
不变
偏小
偏小
不变
偏小
偏小
不变
偏小
3.误差分析
cB =
三、一定物质的量浓度溶液的配制
3.误差分析
能引起误差的一些操作 因变量 c/(mol·L-1)
m(溶质) V(溶液)
容 量 瓶 h.未冷却到室温就注入容量瓶定容
i.从烧杯向容量瓶转移溶液时有少量液体溅出
j.定容时,水加多了,用滴管吸出
k.定容后,轻振荡,摇匀,静置,液面下降再加水
l.定容时,俯视刻度线
m.定容时,仰视刻度线
n.配好的溶液转入干净的试剂瓶时,不慎溅出部分溶液
不变
偏小
偏大
偏小
不变
偏小
偏小
不变
偏小
不变
偏大
偏小
不变
偏小
偏大
不变
偏大
偏小
偏小
偏小
无影响
cB =
04 对 点 训 练
1.判断正误,正确的打“√”,错误的打“×”。(1)1 mol NaCl溶于1 L水所得溶液的物质的量浓度是1 mol·L-1。( )(2)将25 g CuSO4·5H2O溶解在1 L水中,所得溶液的物质的量浓度为0.1 mol·L-1。( )(3)把1 mol NH3通入水中得到1 L溶液,其物质的量浓度为1 mol·L-1。( )(4)将10 g CaCO3粉末加水配成100 mL溶液,CaCO3的物质的量浓度为1 mol·L-1。( )(5)配制一定物质的量浓度的溶液时,若液面超过刻度线,应立即用胶头滴管吸出多余的部分。( )
答案 (1)× (2)× (3)√ (4)× (5)×
C
04 对 点 训 练
2.1 mol·L-1硫酸溶液的含义是( ) A.1 L水中含有1 mol硫酸 B.1 L溶液中含1 mol H+ C.将98 g硫酸溶于1 L水所配成的溶液 D.从1 L溶液中取出500 mL后,剩余溶液的浓度仍为1 mol·L-1
D
04 对 点 训 练
3.下列实验操作正确的是( ) A.使用容量瓶配制溶液时,移液后应洗涤烧杯内壁和玻璃棒2~3次 B.用100 mL量筒量取5.5 mL稀盐酸 C.用托盘天平称量11.50 g NaCl固体 D.配制一定物质的量浓度的溶液时,固体物质可以直接在容量瓶中溶解
A
04 对 点 训 练
4.实验室欲用Na2CO3·10H2O晶体配制100 mL 1 mol/L的Na2CO3溶液,下列说法正确的是( ) A.要完成实验需称取10.6 g Na2CO3·10H2O晶体 B.本实验需用到的仪器有天平、药匙、玻璃棒、烧杯、500 mL容量瓶 C.配制时若容量瓶不干燥,含有少量蒸馏水会导致溶液浓度偏低 D.定容时俯视刻度线会导致溶液浓度偏高
D
谢谢观赏
第三节 物质的量
第二章 海水中的重要元素—钠和氯
第3课时:物质的量浓度
目 录
CONTENTS
02
物质的量浓度的相关计算
01
物质的量浓度
03
一定物质的量浓度溶液的配制
学习目标
1.能够根据物质的量浓度的概念表达式进行简单的计算。
2.了解容量瓶的特点、用途和使用方法。
3.掌握配制一定物质的量浓度溶液的实验操作,建立实验误差分析的思维模型,并能应用模型解决实际问题。
(本页可根据需要自行删除)
①由于ppt含较多高质量素材和视频,故资源比较大。
②所用视频均内嵌在ppt中,不需要另外下载。本节共有1个视频,根据需要选择即时播放。
视频清单
①一定物质的量浓度溶液的配制
致老师和同学们
质量分数
体积分数
生活中溶液浓度的表示方法很多.....
新课导入
体积浓度
体检的一些指标
物质的量浓度
新课导入
1
物质的量浓度
mol/L或 mol·L-1
1. 定义:
单位体积溶液中所含溶质B的物质的量。(可理解成1L溶液)
3. 计算公式:
4. 单位:
2. 符号:
CB
nB
CB
V=
nB =
CB×V
5. 公式变换:
一、物质的量浓度
cB =
溶质物质的量
溶液的体积
物质的量浓度
6.公式使用注意事项:
(1)B表示溶液中的溶质(物质或离子)
(2)V表示溶液体积,单位是L
(3)质量具有加和性,m液 = m剂 + m质
(4)体积不具有加和性,V液 ≠ V剂 + V质(除非题中标明)
(5)均一性:同一溶液,溶质物质的量浓度与所取溶液体积无关
一、物质的量浓度
V溶液 =
m溶液
ρ溶剂
cB =
经典例题
【典例1】下列溶液中溶质的物质的量浓度为1 mol·L-1的是( )
A.将40 g 氢氧化钠溶解于1 L水中
B.将22.4 L氯化氢气体溶于水配成1 L溶液
C.将1 L 10 mol·L-1 的浓盐酸与9 L水混合
D.将10.6 g碳酸钠溶解于水得到100 mL溶液
D
一、物质的量浓度
【典例2】将2.86 g Na2CO3·10 H2O溶于水配成1 L溶液,则:
(1) 该溶液的溶质为 ,其物质的量浓度为 mol/L
(2) 从所配溶液中取出10 mL溶液,取出溶液的物质的量浓度为_________ mol/L,Na+的物质的量浓度为 mol·L-1,溶液中溶质的质量为 g。
Na2CO3
0.01
0.01
0.02
1.06×10-2
一、物质的量浓度
2
物质的量浓度的相关计算
二、物质的量浓度的相关计算
1.依据公式cB = 计算物质的量浓度
计算的基本类型和方法:
二、物质的量浓度的相关计算
2.溶液的稀释与混合 (1)稀释 溶液稀释前后溶液的体积发生变化但溶质质量不变:m1w1=m2w2; 溶质的物质的量不变:c1·V1=c2·V2。 (2)混合: c(混)·V(混)=c1V1+c2V2。
3.物质的量浓度(C)与溶质质量分数(ω)之间的换算
二、物质的量浓度的相关计算
【典例3】标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,则下列关系中不正确的是( ) A.ρ=22.4+22.4V(17V+22400) B.w=1000ρ(17c) C.w=17V+22400(17V) D.c=17V+22400(1000Vρ)
答案 A解析 A项的错误在于它将溶液的体积误作水的体积加气体的体积;B项,取1 L溶液计算,1 L溶液中NH3的物质的量等于c mol·L-1×1 L=c mol,故NH3的质量等于17c g,溶液的质量等于1000 mL×ρ g·mL-1,所以w=1000ρ(17c);C项,NH3的质量等于22.4 L·mol-1(V L×17 g·mol-1)=22.4(17V) g,故w=+1000(17V)=17V+22400(17V);D项,将C项中的w和M=17代入c=M(1000ρw)中即可。
二、物质的量浓度的相关计算
【典例4】取100 mL 0.3 mol·L-1的硫酸溶液和200 mL 0.25 mol·L-1的硫酸溶液混合后加水稀释至400 mL,该混合溶液中硫酸的物质的量浓度是( )
A.0.1 mol·L-1 B.0.2 mol·L-1
C.0.3 mol·L-1 D.0.4 mol·L-1
答案 B
【典例5】市售浓硫酸中溶质的质量分数为98%,密度为1.84g/cm3。则该浓硫酸中的物质的量浓度是多少?
18.4 mol/L
3
一定物质的量浓度溶液的配制
三、一定物质的量浓度溶液的配制
【实验2-10】配制100 mL 1.00 mol / L NaCl溶液
三、一定物质的量浓度溶液的配制
1.主要仪器介绍:容量瓶(常用规格有500ml,250ml,100ml,50ml)
(1)构造:细颈、梨形的平底玻璃瓶,瓶口配有磨口玻璃塞或塑料塞
(2)特点:①容量瓶上标有温度和容积
②容量瓶瓶颈处有刻度线
(3)用途:用于配制一定物质的量浓度的溶液
(4)注意事项:
①使用前要检查是否漏水
②不能在容量瓶中进行溶解或稀释操作
③不能用做反应容器或长期存放溶液
(1) 计算
(2)称量(托盘天平或量筒)
(3)溶解(烧杯、玻璃棒)
(4)冷却
(5)转移和洗涤(容量瓶、玻璃棒)
(6)定容(胶头滴管)
(7)摇匀
(8)装瓶贴签
2.操作步骤小结
平视读数、液面与刻度线相切
三、一定物质的量浓度溶液的配制
三、一定物质的量浓度溶液的配制
3.误差分析
三、一定物质的量浓度溶液的配制
能引起误差的一些操作 因变量 c/(mol·L-1)
m(溶质) V(溶液)
托 盘 天 平 a.天平的砝码粘有其他物质或生锈
b.称量易潮解的物质(如NaOH固体)时间过长
c.用称量纸称易潮解的物质(如NaOH固体)
量筒 d.量取液体时,仰视读数
e.量取液体时,俯视读数
烧杯及玻璃棒 f.搅拌时部分液体溅出
g.未洗涤烧杯和玻璃棒
偏大
不变
偏大
偏小
不变
偏小
偏小
不变
偏小
偏大
不变
偏大
偏小
不变
偏小
偏小
不变
偏小
偏小
不变
偏小
3.误差分析
cB =
三、一定物质的量浓度溶液的配制
3.误差分析
能引起误差的一些操作 因变量 c/(mol·L-1)
m(溶质) V(溶液)
容 量 瓶 h.未冷却到室温就注入容量瓶定容
i.从烧杯向容量瓶转移溶液时有少量液体溅出
j.定容时,水加多了,用滴管吸出
k.定容后,轻振荡,摇匀,静置,液面下降再加水
l.定容时,俯视刻度线
m.定容时,仰视刻度线
n.配好的溶液转入干净的试剂瓶时,不慎溅出部分溶液
不变
偏小
偏大
偏小
不变
偏小
偏小
不变
偏小
不变
偏大
偏小
不变
偏小
偏大
不变
偏大
偏小
偏小
偏小
无影响
cB =
04 对 点 训 练
1.判断正误,正确的打“√”,错误的打“×”。(1)1 mol NaCl溶于1 L水所得溶液的物质的量浓度是1 mol·L-1。( )(2)将25 g CuSO4·5H2O溶解在1 L水中,所得溶液的物质的量浓度为0.1 mol·L-1。( )(3)把1 mol NH3通入水中得到1 L溶液,其物质的量浓度为1 mol·L-1。( )(4)将10 g CaCO3粉末加水配成100 mL溶液,CaCO3的物质的量浓度为1 mol·L-1。( )(5)配制一定物质的量浓度的溶液时,若液面超过刻度线,应立即用胶头滴管吸出多余的部分。( )
答案 (1)× (2)× (3)√ (4)× (5)×
C
04 对 点 训 练
2.1 mol·L-1硫酸溶液的含义是( ) A.1 L水中含有1 mol硫酸 B.1 L溶液中含1 mol H+ C.将98 g硫酸溶于1 L水所配成的溶液 D.从1 L溶液中取出500 mL后,剩余溶液的浓度仍为1 mol·L-1
D
04 对 点 训 练
3.下列实验操作正确的是( ) A.使用容量瓶配制溶液时,移液后应洗涤烧杯内壁和玻璃棒2~3次 B.用100 mL量筒量取5.5 mL稀盐酸 C.用托盘天平称量11.50 g NaCl固体 D.配制一定物质的量浓度的溶液时,固体物质可以直接在容量瓶中溶解
A
04 对 点 训 练
4.实验室欲用Na2CO3·10H2O晶体配制100 mL 1 mol/L的Na2CO3溶液,下列说法正确的是( ) A.要完成实验需称取10.6 g Na2CO3·10H2O晶体 B.本实验需用到的仪器有天平、药匙、玻璃棒、烧杯、500 mL容量瓶 C.配制时若容量瓶不干燥,含有少量蒸馏水会导致溶液浓度偏低 D.定容时俯视刻度线会导致溶液浓度偏高
D
谢谢观赏
