福建省福州市闽侯县第一中学2023-2024学年高二上学期10月月考化学试题(含答案)
文档属性
| 名称 | 福建省福州市闽侯县第一中学2023-2024学年高二上学期10月月考化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-17 17:40:15 | ||
图片预览

文档简介
闽侯县第一中学2023-2024学年高二上学期10月月考
化学试卷
可能用到的相对原子质量:
H:1 C:12 N:14 O:16 S:32 Cl:35.5 Na:23 Cu:64
第Ⅰ卷
一、选择题(每小题只有一个选项符合题意,每小题4分,共60分)
1.下列叙述不正确的是( )
A.物质发生化学变化一定会伴有能量的变化
B.可逆反应的表示完全反应时的热量变化,与反应是否可逆无关
C.同温同压下,反应在光照和点燃条件下的相同
D.水蒸气变为液态水时放出的能量就是该变化的反应热
2.下列用来表示物质变化的化学用语中,正确的是( )
A.碱性氢氧燃料电池的负极反应式:
B.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:
C.用惰性电极电解饱和食盐水时,阳极的电极反应式为:
D.钢铁发生吸氧腐蚀时的正极反应式:
3.下列为四个常用的电化学装置,关于它们的叙述正确的是( )
A.图(a)中,的作用是催化剂
B.图(b)所示电池放电过程中,两极板的质量不断增大
C.图(c)所示装置工作过程中,电解质溶液中浓度始终不变
D.图(d)所示电池充电过程中,是氧化剂,电池工作过程中还原为Ag
4.已知:① ;② ;
③ ;④ .
下列关于反应焓变的判断正确的是( )
A.的燃烧热为 B.
C.增加氧气的量可改变、的值 D.
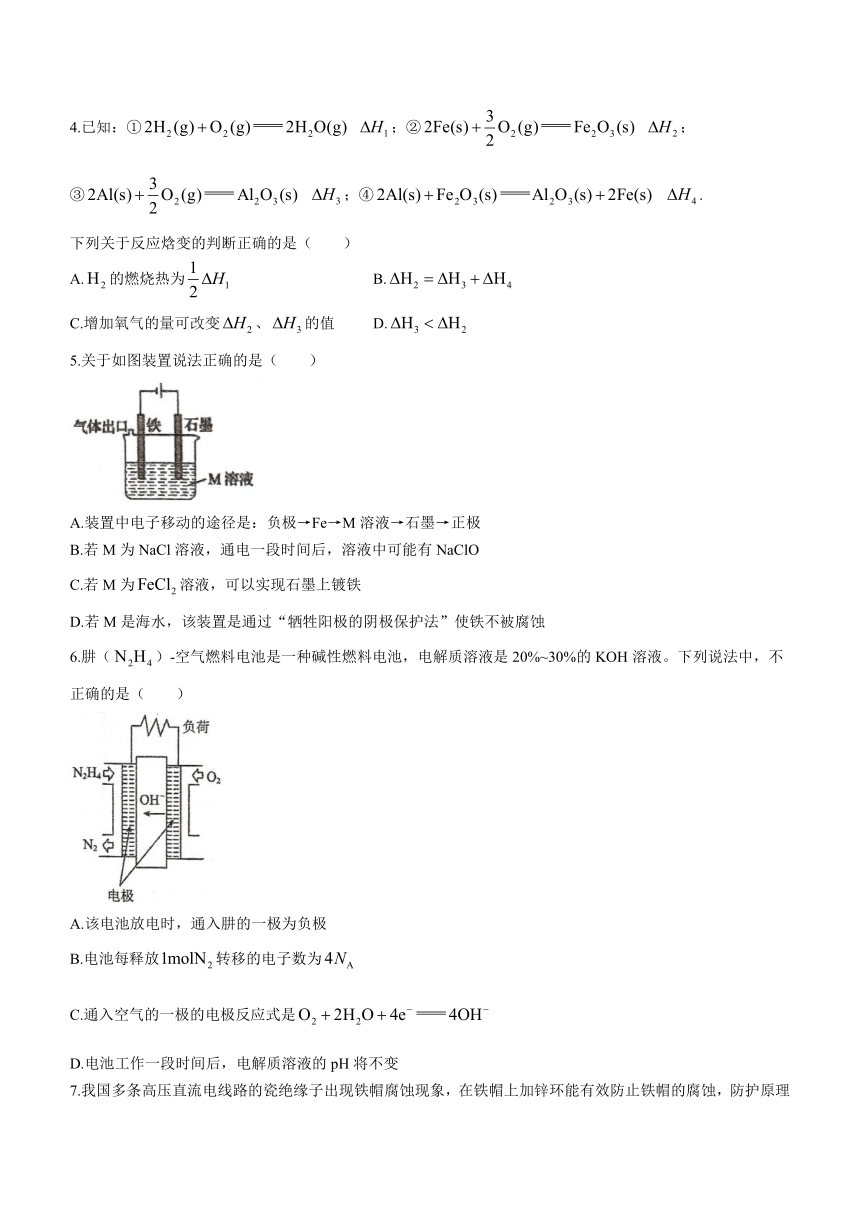
5.关于如图装置说法正确的是( )
A.装置中电子移动的途径是:负极→Fe→M溶液→石墨→正极
B.若M为NaCl溶液,通电一段时间后,溶液中可能有NaClO
C.若M为溶液,可以实现石墨上镀铁
D.若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
6.肼()-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。下列说法中,不正确的是( )
A.该电池放电时,通入肼的一极为负极
B.电池每释放转移的电子数为
C.通入空气的一极的电极反应式是
D.电池工作一段时间后,电解质溶液的pH将不变
7.我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀,防护原理如图所示。下列说法错误的是( )
A.通电时,锌环是阳极,发生氧化反应
B.通电时,阴极上的电极反应为
C.断电时,锌环上的电极反应为
D.断电时,仍能防止铁帽被腐蚀
8.某燃料电池以乙醇-空气-强碱溶液组成,有关该电池的说法正确的是( )
A.放电时正极发生氧化反应
B.放电一段时间后,正极附近溶液的pH减小
C.放电时负极电极反应为:
D.消耗0.2mol乙醇,有转移
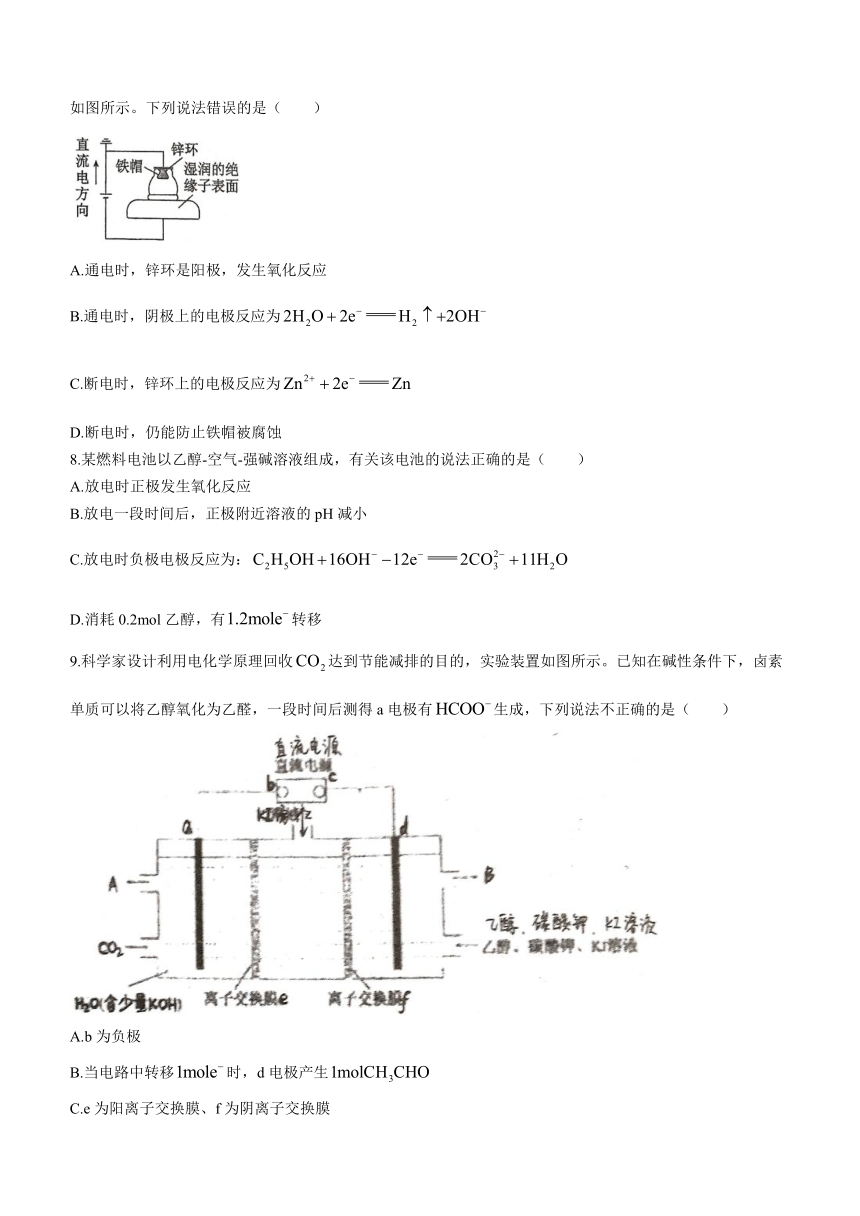
9.科学家设计利用电化学原理回收达到节能减排的目的,实验装置如图所示。已知在碱性条件下,卤素单质可以将乙醇氧化为乙醛,一段时间后测得a电极有生成,下列说法不正确的是( )
A.b为负极
B.当电路中转移时,d电极产生
C.e为阳离子交换膜、f为阴离子交换膜
D.a电极的电极反应式为
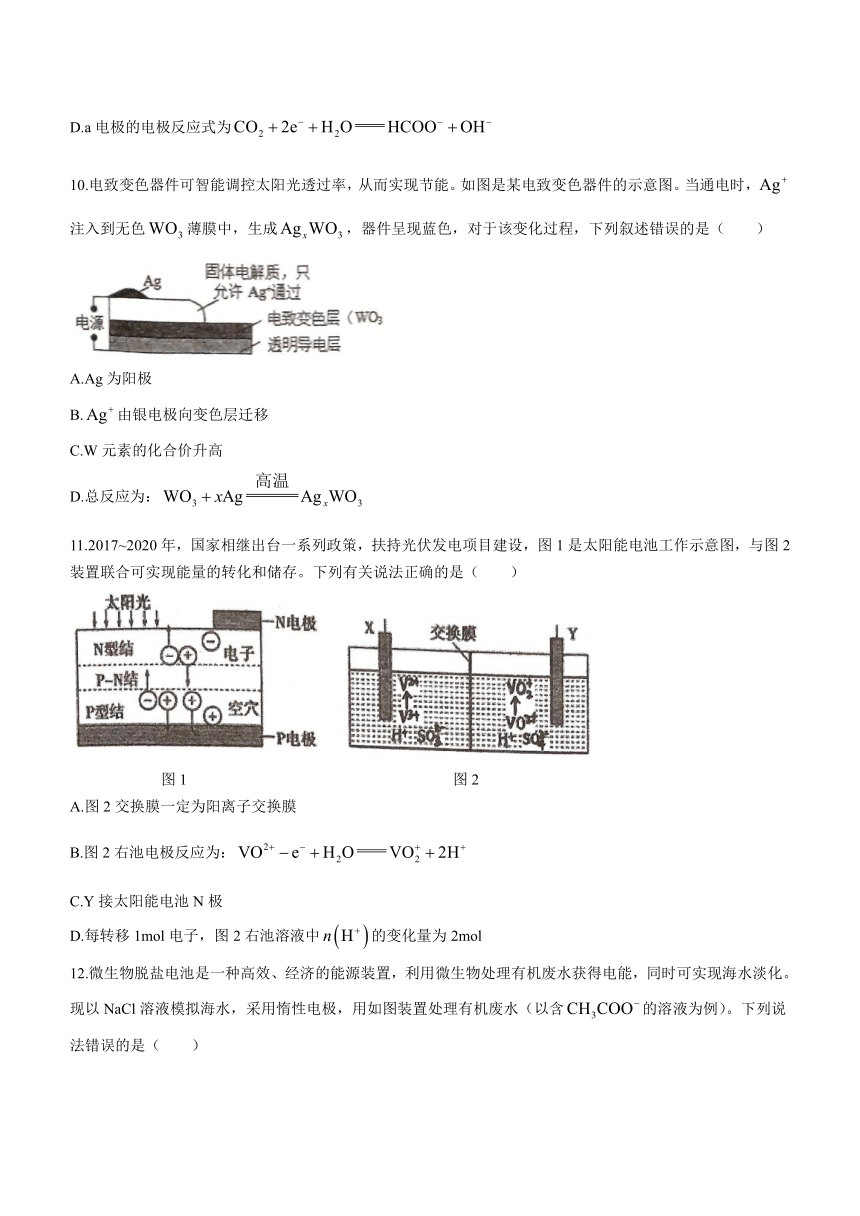
10.电致变色器件可智能调控太阳光透过率,从而实现节能。如图是某电致变色器件的示意图。当通电时,注入到无色薄膜中,生成,器件呈现蓝色,对于该变化过程,下列叙述错误的是( )
A.Ag为阳极
B.由银电极向变色层迁移
C.W元素的化合价升高
D.总反应为:
11.2017~2020年,国家相继出台一系列政策,扶持光伏发电项目建设,图1是太阳能电池工作示意图,与图2装置联合可实现能量的转化和储存。下列有关说法正确的是( )
图1 图2
A.图2交换膜一定为阳离子交换膜
B.图2右池电极反应为:
C.Y接太阳能电池N极
D.每转移1mol电子,图2右池溶液中的变化量为2mol
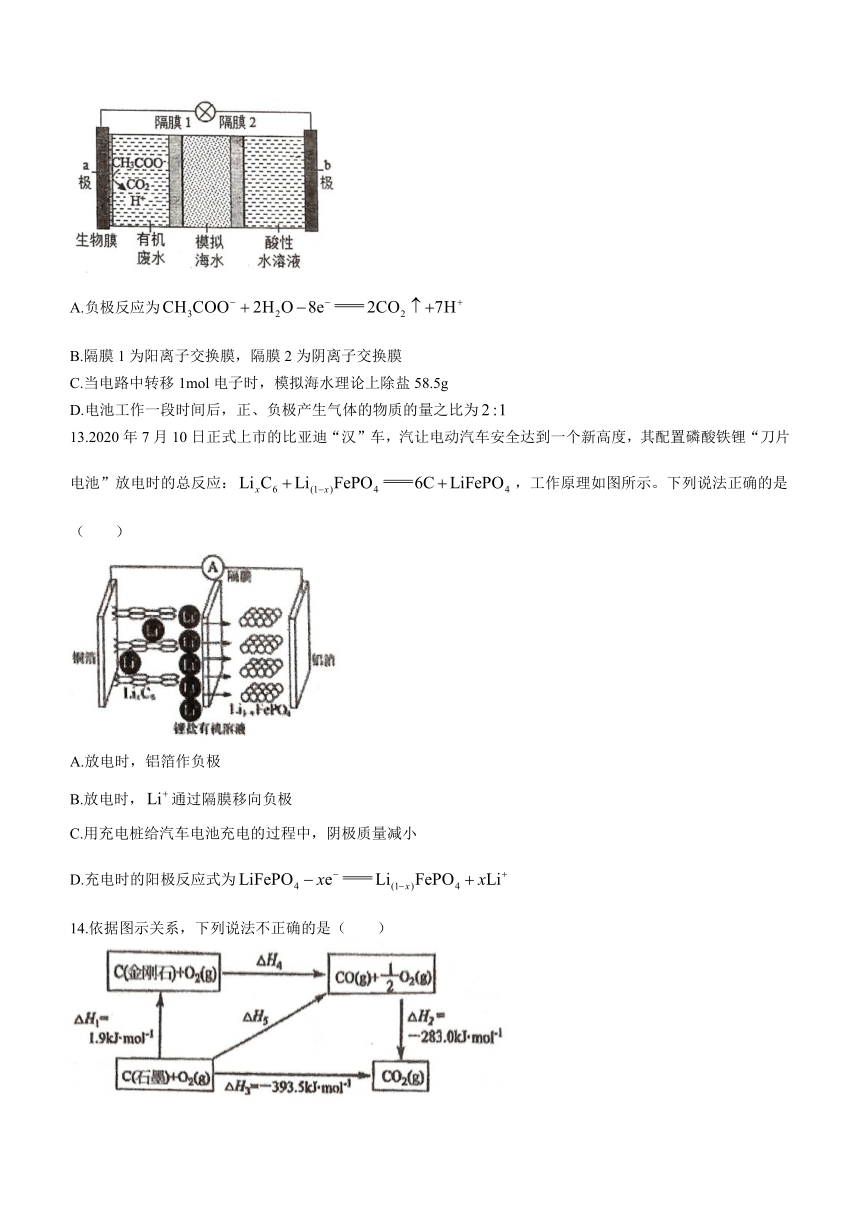
12.微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用如图装置处理有机废水(以含的溶液为例)。下列说法错误的是( )
A.负极反应为
B.隔膜1为阳离子交换膜,隔膜2为阴离子交换膜
C.当电路中转移1mol电子时,模拟海水理论上除盐58.5g
D.电池工作一段时间后,正、负极产生气体的物质的量之比为
13.2020年7月10日正式上市的比亚迪“汉”车,汽让电动汽车安全达到一个新高度,其配置磷酸铁锂“刀片电池”放电时的总反应:,工作原理如图所示。下列说法正确的是( )
A.放电时,铝箔作负极
B.放电时,通过隔膜移向负极
C.用充电桩给汽车电池充电的过程中,阴极质量减小
D.充电时的阳极反应式为
14.依据图示关系,下列说法不正确的是( )
A.
B.石墨的稳定性比金刚石高
C.
D.1mol石墨或1molCO分别完全燃烧,石墨放出热量多
15.某同学按如图所示的装置进行实验。电极A、B为两种常见金属,当K闭合时,X极上产生的气体能使湿润的淀粉碘化钾试纸变蓝。下列说法正确的是( )
A.B极和Y极上均发生还原反应,且Y极的电极反应式为
B.电池工作一段时间后,丙池中两极的总质量不变
C.当通过阴离子交换膜时,X极收集到标准状况下11.2L的气体
D.当0.1molB参与反应时,丙池中流经电解液的电子数目约为
第Ⅱ卷
二、填空题(共5题,共40分)
16.(1)实验测得16g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25kJ的热量,试写出甲醇完全燃烧的热化学方程式:________。
(2)合成氨反应 ,能量变化如图所示:
①该反应通常用铁作催化剂,加催化剂会使图中________(填“变大”“变小”或“不变”)。
②有关键能数据如下:
化学键 H-H N-H N≡N
键能() 436 391 945
试根据表中所列键能数据计算a为________。
(3)现根据下列的3个热化学反应方程式:
试写出CO气体还原FeO固体得到Fe固体和气体的热化学反应方程式:________。
17.利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取氢氧化钠溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测混合液最高温度。回答下列问题:
(1)下列在测定过程中的操作正确的是________(填字母)。
A.将NaOH溶液沿玻璃棒缓慢倒入盐酸中
B.用测过盐酸温度的温度计直接测量NaOH溶液的温度
C.用环形玻璃搅拌棒顺时针搅拌使液体混合充分
D.用同浓度硝酸代替盐酸进行上述实验
(2)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和的稀盐酸恰好完全反应,其反应热分别为、、,则、、的大小关系为________。
(3)假设盐酸和氢氧化钠溶液的密度都是,又知中和反应后生成溶液的比热容。为了计算中和热,某学生实验记录数据如下:
实验序号 起始温度/℃ 终止温度/℃
盐酸 氢氧化钠溶液 混合溶液
1 20.0 20.1 23.2
2 19.8 19.9 24.5
3 20.5 20.6 23.6
依据该学生的实验数据计算,该实验测得的中和热________(结果保留一位小数)。
18.电化学普遍应用于生活和生产中,前途广泛,是科研的重点方向。
(1)铅蓄电池为常见的二次电池,其原理为,放电时铅蓄电池的正极反应式为________,该电池充电时原负极应接外接电源的________极。
(2)工业上采用Fe、C为电极电解溶液制。电解时,应以________作阴极,电解过程中阴极附近溶液pH将会________(填“增大”、“减小”或“不变”),电解时阳极反应式为________,总反应的化学方程式为________。
(3)根据下图装置信息填空:
①乙池中电极反应式为________。
②当电池反应转移0.2mol电子时,甲池溶液质量增加________。
19.如图所示的是某研究性学习小组探究金属腐蚀条件的实验装置图,试分析实验并回答下列问题:
(1)若起始时甲、乙、丙三套装置的导管中液面高度相同,过一段时间后液面最高的是________。
(2)通过甲、乙装置的对比说明钢铁中碳的含量越________(填“高”或“低”)越易腐蚀。
(3)乙装置中发生电化学腐蚀时正极的电极反应式为________。
20.电解原理在化学工业中有广泛应用。
(1)电解食盐水是氯碱工业的基础。目前比较先进的方法是阳离子交换膜法,电解示意图如图所示,图中的阳离子交换膜只允许阳离子通过,请回答以下问题:
①电解饱和食盐水的总反应的离子方程式是________。
②电解饱和食盐水,在b口加入的物质为________(写化学式)。
(2)将PbO溶解在HCl和NaCl的混合溶液中,得到含的电解液,电解溶液生成Pb的装置如图所示。
①写出电解时阴极的电极反应式________。
②电解过程中通过阳离子交换膜的离子主要为________。
③电解过程中,电解液浓度不断减小,为了恢复其浓度,应该向________极室(填“阴”或者“阳”)加入________(填化学式)。
闽侯县第一中学2023-2024学年高二上学期10月月考
化学试卷
1--5 DCBDB 6--10 DCCBC 11--15 BBDCC
16.(9分)(1) (3分)
(2)不变(1分) -93(2分)
(3) (3分)
17.(5分)(1)D(1分) (2)(2分) (3)(2分)
18.(13分)(1)①(2分) ②负(1分)
(2)①Fe(1分) ②增大(1分) ③(2分)
④(2分)
(3)①(或)(2分)
②13.5g(2分)
19.(4分)(1)乙(1分) (2)高(1分) (3)(2分)
20.(9分)(1)①(2分) ②NaOH(1分)
(2)①(2分) ②(1分) ③阴(1分) ④PbO(2分)
化学试卷
可能用到的相对原子质量:
H:1 C:12 N:14 O:16 S:32 Cl:35.5 Na:23 Cu:64
第Ⅰ卷
一、选择题(每小题只有一个选项符合题意,每小题4分,共60分)
1.下列叙述不正确的是( )
A.物质发生化学变化一定会伴有能量的变化
B.可逆反应的表示完全反应时的热量变化,与反应是否可逆无关
C.同温同压下,反应在光照和点燃条件下的相同
D.水蒸气变为液态水时放出的能量就是该变化的反应热
2.下列用来表示物质变化的化学用语中,正确的是( )
A.碱性氢氧燃料电池的负极反应式:
B.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:
C.用惰性电极电解饱和食盐水时,阳极的电极反应式为:
D.钢铁发生吸氧腐蚀时的正极反应式:
3.下列为四个常用的电化学装置,关于它们的叙述正确的是( )
A.图(a)中,的作用是催化剂
B.图(b)所示电池放电过程中,两极板的质量不断增大
C.图(c)所示装置工作过程中,电解质溶液中浓度始终不变
D.图(d)所示电池充电过程中,是氧化剂,电池工作过程中还原为Ag
4.已知:① ;② ;
③ ;④ .
下列关于反应焓变的判断正确的是( )
A.的燃烧热为 B.
C.增加氧气的量可改变、的值 D.
5.关于如图装置说法正确的是( )
A.装置中电子移动的途径是:负极→Fe→M溶液→石墨→正极
B.若M为NaCl溶液,通电一段时间后,溶液中可能有NaClO
C.若M为溶液,可以实现石墨上镀铁
D.若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
6.肼()-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。下列说法中,不正确的是( )
A.该电池放电时,通入肼的一极为负极
B.电池每释放转移的电子数为
C.通入空气的一极的电极反应式是
D.电池工作一段时间后,电解质溶液的pH将不变
7.我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀,防护原理如图所示。下列说法错误的是( )
A.通电时,锌环是阳极,发生氧化反应
B.通电时,阴极上的电极反应为
C.断电时,锌环上的电极反应为
D.断电时,仍能防止铁帽被腐蚀
8.某燃料电池以乙醇-空气-强碱溶液组成,有关该电池的说法正确的是( )
A.放电时正极发生氧化反应
B.放电一段时间后,正极附近溶液的pH减小
C.放电时负极电极反应为:
D.消耗0.2mol乙醇,有转移
9.科学家设计利用电化学原理回收达到节能减排的目的,实验装置如图所示。已知在碱性条件下,卤素单质可以将乙醇氧化为乙醛,一段时间后测得a电极有生成,下列说法不正确的是( )
A.b为负极
B.当电路中转移时,d电极产生
C.e为阳离子交换膜、f为阴离子交换膜
D.a电极的电极反应式为
10.电致变色器件可智能调控太阳光透过率,从而实现节能。如图是某电致变色器件的示意图。当通电时,注入到无色薄膜中,生成,器件呈现蓝色,对于该变化过程,下列叙述错误的是( )
A.Ag为阳极
B.由银电极向变色层迁移
C.W元素的化合价升高
D.总反应为:
11.2017~2020年,国家相继出台一系列政策,扶持光伏发电项目建设,图1是太阳能电池工作示意图,与图2装置联合可实现能量的转化和储存。下列有关说法正确的是( )
图1 图2
A.图2交换膜一定为阳离子交换膜
B.图2右池电极反应为:
C.Y接太阳能电池N极
D.每转移1mol电子,图2右池溶液中的变化量为2mol
12.微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用如图装置处理有机废水(以含的溶液为例)。下列说法错误的是( )
A.负极反应为
B.隔膜1为阳离子交换膜,隔膜2为阴离子交换膜
C.当电路中转移1mol电子时,模拟海水理论上除盐58.5g
D.电池工作一段时间后,正、负极产生气体的物质的量之比为
13.2020年7月10日正式上市的比亚迪“汉”车,汽让电动汽车安全达到一个新高度,其配置磷酸铁锂“刀片电池”放电时的总反应:,工作原理如图所示。下列说法正确的是( )
A.放电时,铝箔作负极
B.放电时,通过隔膜移向负极
C.用充电桩给汽车电池充电的过程中,阴极质量减小
D.充电时的阳极反应式为
14.依据图示关系,下列说法不正确的是( )
A.
B.石墨的稳定性比金刚石高
C.
D.1mol石墨或1molCO分别完全燃烧,石墨放出热量多
15.某同学按如图所示的装置进行实验。电极A、B为两种常见金属,当K闭合时,X极上产生的气体能使湿润的淀粉碘化钾试纸变蓝。下列说法正确的是( )
A.B极和Y极上均发生还原反应,且Y极的电极反应式为
B.电池工作一段时间后,丙池中两极的总质量不变
C.当通过阴离子交换膜时,X极收集到标准状况下11.2L的气体
D.当0.1molB参与反应时,丙池中流经电解液的电子数目约为
第Ⅱ卷
二、填空题(共5题,共40分)
16.(1)实验测得16g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25kJ的热量,试写出甲醇完全燃烧的热化学方程式:________。
(2)合成氨反应 ,能量变化如图所示:
①该反应通常用铁作催化剂,加催化剂会使图中________(填“变大”“变小”或“不变”)。
②有关键能数据如下:
化学键 H-H N-H N≡N
键能() 436 391 945
试根据表中所列键能数据计算a为________。
(3)现根据下列的3个热化学反应方程式:
试写出CO气体还原FeO固体得到Fe固体和气体的热化学反应方程式:________。
17.利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取氢氧化钠溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测混合液最高温度。回答下列问题:
(1)下列在测定过程中的操作正确的是________(填字母)。
A.将NaOH溶液沿玻璃棒缓慢倒入盐酸中
B.用测过盐酸温度的温度计直接测量NaOH溶液的温度
C.用环形玻璃搅拌棒顺时针搅拌使液体混合充分
D.用同浓度硝酸代替盐酸进行上述实验
(2)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和的稀盐酸恰好完全反应,其反应热分别为、、,则、、的大小关系为________。
(3)假设盐酸和氢氧化钠溶液的密度都是,又知中和反应后生成溶液的比热容。为了计算中和热,某学生实验记录数据如下:
实验序号 起始温度/℃ 终止温度/℃
盐酸 氢氧化钠溶液 混合溶液
1 20.0 20.1 23.2
2 19.8 19.9 24.5
3 20.5 20.6 23.6
依据该学生的实验数据计算,该实验测得的中和热________(结果保留一位小数)。
18.电化学普遍应用于生活和生产中,前途广泛,是科研的重点方向。
(1)铅蓄电池为常见的二次电池,其原理为,放电时铅蓄电池的正极反应式为________,该电池充电时原负极应接外接电源的________极。
(2)工业上采用Fe、C为电极电解溶液制。电解时,应以________作阴极,电解过程中阴极附近溶液pH将会________(填“增大”、“减小”或“不变”),电解时阳极反应式为________,总反应的化学方程式为________。
(3)根据下图装置信息填空:
①乙池中电极反应式为________。
②当电池反应转移0.2mol电子时,甲池溶液质量增加________。
19.如图所示的是某研究性学习小组探究金属腐蚀条件的实验装置图,试分析实验并回答下列问题:
(1)若起始时甲、乙、丙三套装置的导管中液面高度相同,过一段时间后液面最高的是________。
(2)通过甲、乙装置的对比说明钢铁中碳的含量越________(填“高”或“低”)越易腐蚀。
(3)乙装置中发生电化学腐蚀时正极的电极反应式为________。
20.电解原理在化学工业中有广泛应用。
(1)电解食盐水是氯碱工业的基础。目前比较先进的方法是阳离子交换膜法,电解示意图如图所示,图中的阳离子交换膜只允许阳离子通过,请回答以下问题:
①电解饱和食盐水的总反应的离子方程式是________。
②电解饱和食盐水,在b口加入的物质为________(写化学式)。
(2)将PbO溶解在HCl和NaCl的混合溶液中,得到含的电解液,电解溶液生成Pb的装置如图所示。
①写出电解时阴极的电极反应式________。
②电解过程中通过阳离子交换膜的离子主要为________。
③电解过程中,电解液浓度不断减小,为了恢复其浓度,应该向________极室(填“阴”或者“阳”)加入________(填化学式)。
闽侯县第一中学2023-2024学年高二上学期10月月考
化学试卷
1--5 DCBDB 6--10 DCCBC 11--15 BBDCC
16.(9分)(1) (3分)
(2)不变(1分) -93(2分)
(3) (3分)
17.(5分)(1)D(1分) (2)(2分) (3)(2分)
18.(13分)(1)①(2分) ②负(1分)
(2)①Fe(1分) ②增大(1分) ③(2分)
④(2分)
(3)①(或)(2分)
②13.5g(2分)
19.(4分)(1)乙(1分) (2)高(1分) (3)(2分)
20.(9分)(1)①(2分) ②NaOH(1分)
(2)①(2分) ②(1分) ③阴(1分) ④PbO(2分)
同课章节目录
