2024届高考一轮复习 第八章 水溶液中的离子反应与平衡 第4讲 难溶电解质的溶解平衡 课件(共42张PPT)
文档属性
| 名称 | 2024届高考一轮复习 第八章 水溶液中的离子反应与平衡 第4讲 难溶电解质的溶解平衡 课件(共42张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 970.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-17 21:32:52 | ||
图片预览








文档简介
(共42张PPT)
第4讲 难溶电解质的溶解平衡(基础落实课)
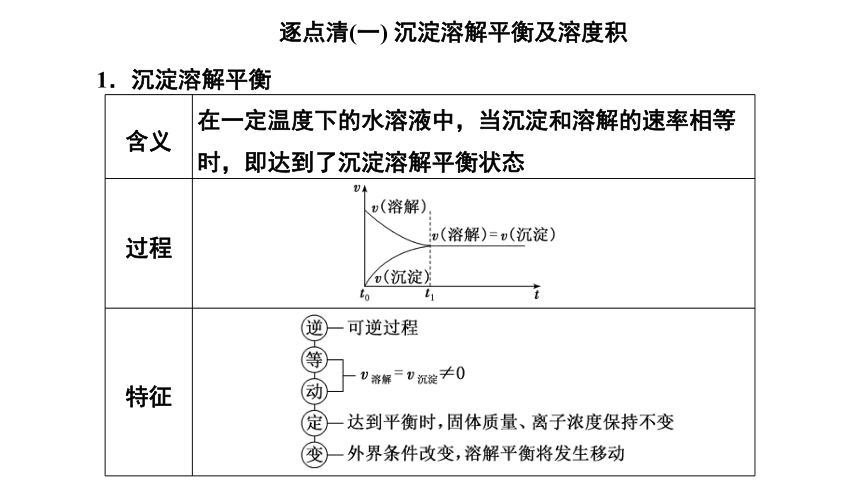
逐点清(一) 沉淀溶解平衡及溶度积
1.沉淀溶解平衡
含义 在一定温度下的水溶液中,当沉淀和溶解的速率相等时,即达到了沉淀溶解平衡状态
过程
特征
2.影响沉淀溶解平衡的因素
(1)内因:难溶电解质本身的性质,这是决定因素。
(2)外因
温度 规律 升温,大多数溶解平衡向溶解的方向移动,Ksp________
原因 大多数难溶电解质的溶解过程是______的
浓度 规律 加水稀释,平衡向溶解的方向移动,Ksp_________
相同离子 加入与难溶电解质构成微粒相同离子组成的物质,平衡向生成沉淀的方向移动 反应离子 加入能消耗难溶物离子的物质,平衡向溶解的方向移动 增大
吸热
不变
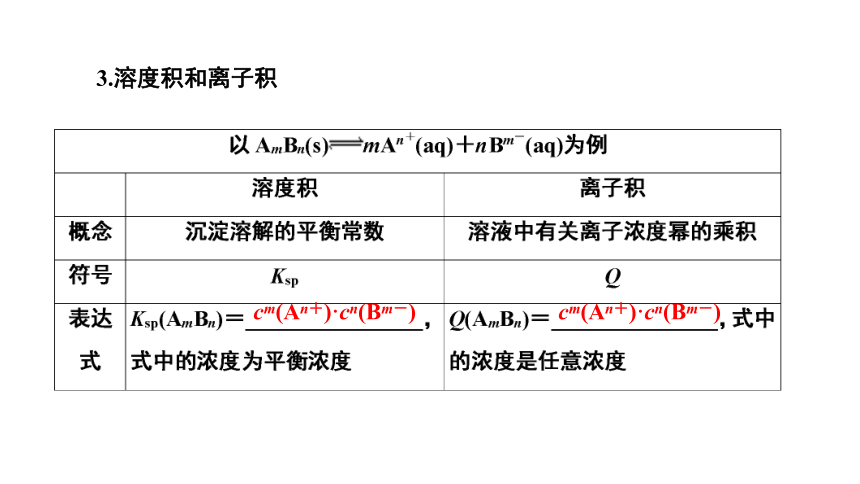
3.溶度积和离子积
cm(An+)·cn(Bm-)
cm(An+)·cn(Bm-)
应用 判断在一定条件下沉淀或溶解情况:
①Q②Q=Ksp:沉淀与溶解处于______状态
③Q>Ksp:溶液中有沉淀析出
续表
沉淀
平衡
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)沉淀达到溶解平衡状态,溶液中各离子浓度一定相等 ( )
(2)升高温度,沉淀溶解平衡一定正向移动 ( )
(3)某物质的溶解性为难溶,则该物质不溶于水 ( )
(4)室温下,AgCl在水中的溶解度小于在食盐水中的溶解度 ( )
×
×
×
×
√
×
√
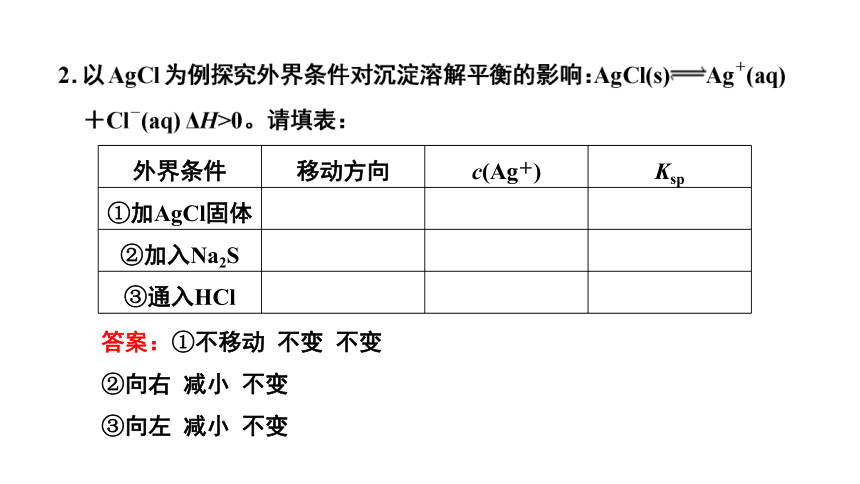
外界条件 移动方向 c(Ag+) Ksp
①加AgCl固体
②加入Na2S
③通入HCl
答案:①不移动 不变 不变
②向右 减小 不变
③向左 减小 不变
解析:在浊液a中,存在AgCl的沉淀溶解平衡,即在滤液b中,仍含有少量Ag+,故在b中生成了AgI沉淀,A正确,B错误;向白色沉淀AgCl中滴加KI溶液生成黄色AgI,由此可说明AgI比AgCl更难溶,C项和D项都正确。
答案:B
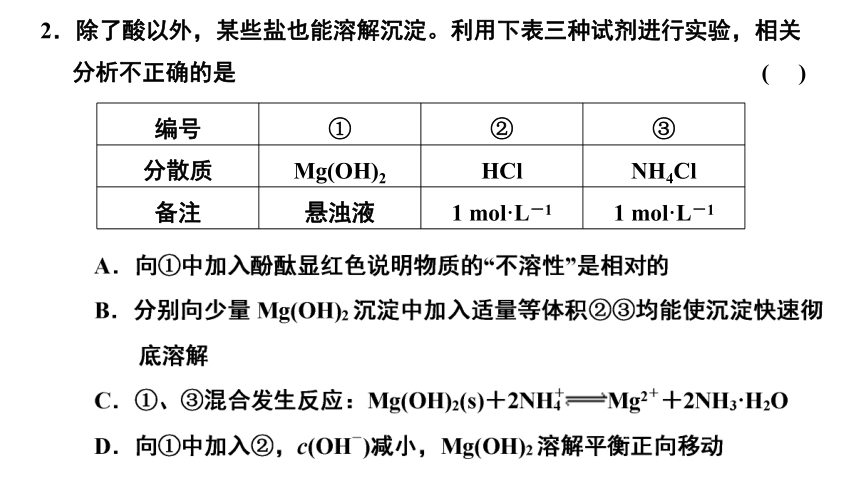
2.除了酸以外,某些盐也能溶解沉淀。利用下表三种试剂进行实验,相关分析不正确的是 ( )
编号 ① ② ③
分散质 Mg(OH)2 HCl NH4Cl
备注 悬浊液 1 mol·L-1 1 mol·L-1
答案:B
3.用平衡移动原理解释下列事实。
(1)已知Ba2+有毒,为什么医疗上能用BaSO4作钡餐透视,而不能用BaCO3作钡餐?
______________________________________________
______________________________________________
(2)分别用等体积的蒸馏水和0.01 mol·L-1的盐酸洗涤AgCl沉淀,用水洗涤造成的AgCl的损失大于用稀盐酸洗涤的损失量。
______________________________________________
______________________________________________
解析:图中p、q对应纵横坐标数值相等,即c(Cd2+)=c(S2-),则a和b分别为T1、T2温度下CdS在水中的溶解度,A正确;
图中m、n、p点对应的温度相同,小于q点对应的温度,对应的Ksp的关系为Ksp(m)=Ksp(n)=Ksp(p)向m点的溶液中加入少量Na2S固体,c(S2-)增大,而Ksp不变,c(Cd2+)减小,溶液组成由m沿mpn线向p方向移动,C正确;
温度降低时,CdS在水中的溶解度逐渐减小,饱和溶液降温后离子浓度减小,但仍为饱和溶液,q点的饱和溶液的组成由q沿qp线向p方向移动,D正确。
答案:B
解析:温度升高,Ca(OH)2的溶解度降低,不利于沉淀溶解平衡向正反应方向移动,溶度积常数减小,图中T2时的溶度积常数大于T1时的溶度积常数,因此温度关系为T1>T2,故A错误;
温度不变的情况下,生石灰加入消耗水,析出固体后上层清液仍为氢氧化钙饱和溶液,c(OH-)不变,溶液体积减小,OH-的数目减少,故B错误;
温度为T1时,P点Q>Ksp,反应向生成沉淀的方向移动,得到悬浊液,P点分散系中分散质粒子直径大于100 nm,故D正确。
答案:D
题点(三) Ksp的基本计算和应用
6.常温下,有关物质的溶度积如下,下列有关说法不正确的是 ( )
A.常温下,除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
B.常温下,除去NaCl溶液中的CaCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
C.向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+)∶c(Fe3+)=2.125×1021
D.将适量的Ca(OH)2固体溶于100 mL水中,刚好达到饱和[c(Ca2+)=1.0×10-2 mol·L-1],若保持温度不变,向其中加入100 mL 0.012 mol·L-1的NaOH,则该溶液变为不饱和溶液
解析:因为MgCO3是微溶物、Mg(OH)2是难溶物,所以除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好,故A正确;
因为Ca(OH)2是微溶物、CaCO3是难溶物,所以除去NaCl溶液中的CaCl2杂质,选用Na2CO3溶液比NaOH溶液效果好,故B错误;
答案:B
(2)若FeCl2与MgCl2混合溶液中c(Mg2+)=0.02 mol·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5 mol·L-1,此时是否有Mg3(PO4)2沉淀生成?___________________________
_____________________________[列式计算,FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24]。
(3)有关数据如表所示:
用废电池的锌皮制备ZnSO4·7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是加稀H2SO4和H2O2溶解,铁变为__________,加碱调节至pH为____________时,铁刚好沉淀完全(离子浓度小于1×10-5mol·L-1时,即可认为该离子沉淀完全);继续加碱至pH为____________时,锌开始沉淀(假定Zn2+浓度为0.1 mol·L-1)。若上述过程不加H2O2后果是__________________________________________________________,原因是_________________________________________________________。
化合物 Zn(OH)2 Fe(OH)2 Fe(OH)3
Ksp近似值 10-17 10-17 10-39
答案:(1)24
(3)Fe3+ 2.7 6 无法将Zn2+和Fe2+分离 Fe(OH)2和Zn(OH)2的Ksp相近
逐点清(二) 沉淀溶解平衡的应用
1.沉淀的生成
H2S+Cu2+===CuS↓+2H+
沉淀的溶解
CaCO3+2H+===Ca2++CO2↑+H2O
2.
AgCl+2NH3·H2O===[Ag(NH3)2]++Cl-+2H2O
3.沉淀的转化
[题点考法·全面练通]
1.自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是 ( )
A.CuS的溶解度大于PbS的溶解度
B.原生铜的硫化物具有还原性,而铜蓝没有还原性
C.CuSO4与ZnS反应的离子方程式是Cu2++S2-===CuS↓
D.整个过程涉及的反应类型有氧化还原反应和复分解反应
解析:沉淀转化的实质是溶解度小的沉淀转化成溶解度更小的沉淀,PbS转变为铜蓝(CuS),说明CuS的溶解度小于PbS的溶解度,故A错误;
原生铜的硫化物具有还原性,而铜蓝也应该具有还原性,因为硫元素处于最低价态-2价,故B错误;
CuSO4与ZnS反应的离子方程式应该是Cu2++ZnS===CuS+Zn2+,这是一个复分解反应,故C错误;
自然界地表层原生铜的硫化物被氧化的过程是氧化还原反应,故D正确。
答案:D
2.已知:T ℃时,Ksp(PbS)=1.3×10-24,Ksp(ZnS)=1.0×10-22;当溶液中离子浓度≤10-5 mol·L-1时,表明该离子已除尽。T ℃时,下列有关ZnS和PbS的说法不正确的是 ( )
A.ZnS的饱和溶液中,c(Zn2+)=c(S2-)=1.0×10-11 mol·L-1
B.欲将某工业废水中的Pb2+除去,则加入Na2S溶液后应保证溶液中c(S2-)≥1.3×10-19 mol·L-1
C.向同浓度的ZnCl2和PbCl2的混合溶液中滴加Na2S溶液,PbS先析出
D.向PbS悬浊液中加入ZnCl2浓溶液,PbS不可能转化为ZnS
ZnS与PbS的组成离子比相同,而混合溶液中Zn2+、Pb2+的浓度相同,故加入Na2S溶液时,溶度积小的先沉淀,C项正确;
答案:D
3.常温下某CuSO4溶液中混有少量FeSO4和Fe2(SO4)3杂质。已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Fe(OH)2]=8.0×10-16,Ksp[Cu(OH)2]=2.2×10-20。
(1)为了除去杂质,通常是加入H2O2再调节溶液pH,其中加入H2O2的作用是__________________;与其他试剂相比,使用H2O2的优点是________________________________(答出两点即可)。
(2)调节溶液pH时,加入的物质是______________(填化学式);常温下,控制溶液的pH≥_________即可除去杂质离子。
解析:(1)由于Ksp[Fe(OH)2]、Ksp[Cu(OH)2]相差不大,则Fe(OH)2和Cu(OH)2的溶解度相差不大,故加入H2O2的作用是将Fe2+氧化成Fe3+,便于形成Fe(OH)3沉淀。
答案:(1)将Fe2+氧化为Fe3+ 不引入其他杂质; 对环境无污染(其他合理答案均可)
(2)CuO[或Cu(OH)2、CuCO3、Cu2(OH)2CO3等] 3.2
谢
谢
观
看
第4讲 难溶电解质的溶解平衡(基础落实课)
逐点清(一) 沉淀溶解平衡及溶度积
1.沉淀溶解平衡
含义 在一定温度下的水溶液中,当沉淀和溶解的速率相等时,即达到了沉淀溶解平衡状态
过程
特征
2.影响沉淀溶解平衡的因素
(1)内因:难溶电解质本身的性质,这是决定因素。
(2)外因
温度 规律 升温,大多数溶解平衡向溶解的方向移动,Ksp________
原因 大多数难溶电解质的溶解过程是______的
浓度 规律 加水稀释,平衡向溶解的方向移动,Ksp_________
相同离子 加入与难溶电解质构成微粒相同离子组成的物质,平衡向生成沉淀的方向移动 反应离子 加入能消耗难溶物离子的物质,平衡向溶解的方向移动 增大
吸热
不变
3.溶度积和离子积
cm(An+)·cn(Bm-)
cm(An+)·cn(Bm-)
应用 判断在一定条件下沉淀或溶解情况:
①Q
③Q>Ksp:溶液中有沉淀析出
续表
沉淀
平衡
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)沉淀达到溶解平衡状态,溶液中各离子浓度一定相等 ( )
(2)升高温度,沉淀溶解平衡一定正向移动 ( )
(3)某物质的溶解性为难溶,则该物质不溶于水 ( )
(4)室温下,AgCl在水中的溶解度小于在食盐水中的溶解度 ( )
×
×
×
×
√
×
√
外界条件 移动方向 c(Ag+) Ksp
①加AgCl固体
②加入Na2S
③通入HCl
答案:①不移动 不变 不变
②向右 减小 不变
③向左 减小 不变
解析:在浊液a中,存在AgCl的沉淀溶解平衡,即在滤液b中,仍含有少量Ag+,故在b中生成了AgI沉淀,A正确,B错误;向白色沉淀AgCl中滴加KI溶液生成黄色AgI,由此可说明AgI比AgCl更难溶,C项和D项都正确。
答案:B
2.除了酸以外,某些盐也能溶解沉淀。利用下表三种试剂进行实验,相关分析不正确的是 ( )
编号 ① ② ③
分散质 Mg(OH)2 HCl NH4Cl
备注 悬浊液 1 mol·L-1 1 mol·L-1
答案:B
3.用平衡移动原理解释下列事实。
(1)已知Ba2+有毒,为什么医疗上能用BaSO4作钡餐透视,而不能用BaCO3作钡餐?
______________________________________________
______________________________________________
(2)分别用等体积的蒸馏水和0.01 mol·L-1的盐酸洗涤AgCl沉淀,用水洗涤造成的AgCl的损失大于用稀盐酸洗涤的损失量。
______________________________________________
______________________________________________
解析:图中p、q对应纵横坐标数值相等,即c(Cd2+)=c(S2-),则a和b分别为T1、T2温度下CdS在水中的溶解度,A正确;
图中m、n、p点对应的温度相同,小于q点对应的温度,对应的Ksp的关系为Ksp(m)=Ksp(n)=Ksp(p)
温度降低时,CdS在水中的溶解度逐渐减小,饱和溶液降温后离子浓度减小,但仍为饱和溶液,q点的饱和溶液的组成由q沿qp线向p方向移动,D正确。
答案:B
解析:温度升高,Ca(OH)2的溶解度降低,不利于沉淀溶解平衡向正反应方向移动,溶度积常数减小,图中T2时的溶度积常数大于T1时的溶度积常数,因此温度关系为T1>T2,故A错误;
温度不变的情况下,生石灰加入消耗水,析出固体后上层清液仍为氢氧化钙饱和溶液,c(OH-)不变,溶液体积减小,OH-的数目减少,故B错误;
温度为T1时,P点Q>Ksp,反应向生成沉淀的方向移动,得到悬浊液,P点分散系中分散质粒子直径大于100 nm,故D正确。
答案:D
题点(三) Ksp的基本计算和应用
6.常温下,有关物质的溶度积如下,下列有关说法不正确的是 ( )
A.常温下,除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
B.常温下,除去NaCl溶液中的CaCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
C.向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+)∶c(Fe3+)=2.125×1021
D.将适量的Ca(OH)2固体溶于100 mL水中,刚好达到饱和[c(Ca2+)=1.0×10-2 mol·L-1],若保持温度不变,向其中加入100 mL 0.012 mol·L-1的NaOH,则该溶液变为不饱和溶液
解析:因为MgCO3是微溶物、Mg(OH)2是难溶物,所以除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好,故A正确;
因为Ca(OH)2是微溶物、CaCO3是难溶物,所以除去NaCl溶液中的CaCl2杂质,选用Na2CO3溶液比NaOH溶液效果好,故B错误;
答案:B
(2)若FeCl2与MgCl2混合溶液中c(Mg2+)=0.02 mol·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5 mol·L-1,此时是否有Mg3(PO4)2沉淀生成?___________________________
_____________________________[列式计算,FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24]。
(3)有关数据如表所示:
用废电池的锌皮制备ZnSO4·7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是加稀H2SO4和H2O2溶解,铁变为__________,加碱调节至pH为____________时,铁刚好沉淀完全(离子浓度小于1×10-5mol·L-1时,即可认为该离子沉淀完全);继续加碱至pH为____________时,锌开始沉淀(假定Zn2+浓度为0.1 mol·L-1)。若上述过程不加H2O2后果是__________________________________________________________,原因是_________________________________________________________。
化合物 Zn(OH)2 Fe(OH)2 Fe(OH)3
Ksp近似值 10-17 10-17 10-39
答案:(1)24
(3)Fe3+ 2.7 6 无法将Zn2+和Fe2+分离 Fe(OH)2和Zn(OH)2的Ksp相近
逐点清(二) 沉淀溶解平衡的应用
1.沉淀的生成
H2S+Cu2+===CuS↓+2H+
沉淀的溶解
CaCO3+2H+===Ca2++CO2↑+H2O
2.
AgCl+2NH3·H2O===[Ag(NH3)2]++Cl-+2H2O
3.沉淀的转化
[题点考法·全面练通]
1.自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是 ( )
A.CuS的溶解度大于PbS的溶解度
B.原生铜的硫化物具有还原性,而铜蓝没有还原性
C.CuSO4与ZnS反应的离子方程式是Cu2++S2-===CuS↓
D.整个过程涉及的反应类型有氧化还原反应和复分解反应
解析:沉淀转化的实质是溶解度小的沉淀转化成溶解度更小的沉淀,PbS转变为铜蓝(CuS),说明CuS的溶解度小于PbS的溶解度,故A错误;
原生铜的硫化物具有还原性,而铜蓝也应该具有还原性,因为硫元素处于最低价态-2价,故B错误;
CuSO4与ZnS反应的离子方程式应该是Cu2++ZnS===CuS+Zn2+,这是一个复分解反应,故C错误;
自然界地表层原生铜的硫化物被氧化的过程是氧化还原反应,故D正确。
答案:D
2.已知:T ℃时,Ksp(PbS)=1.3×10-24,Ksp(ZnS)=1.0×10-22;当溶液中离子浓度≤10-5 mol·L-1时,表明该离子已除尽。T ℃时,下列有关ZnS和PbS的说法不正确的是 ( )
A.ZnS的饱和溶液中,c(Zn2+)=c(S2-)=1.0×10-11 mol·L-1
B.欲将某工业废水中的Pb2+除去,则加入Na2S溶液后应保证溶液中c(S2-)≥1.3×10-19 mol·L-1
C.向同浓度的ZnCl2和PbCl2的混合溶液中滴加Na2S溶液,PbS先析出
D.向PbS悬浊液中加入ZnCl2浓溶液,PbS不可能转化为ZnS
ZnS与PbS的组成离子比相同,而混合溶液中Zn2+、Pb2+的浓度相同,故加入Na2S溶液时,溶度积小的先沉淀,C项正确;
答案:D
3.常温下某CuSO4溶液中混有少量FeSO4和Fe2(SO4)3杂质。已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Fe(OH)2]=8.0×10-16,Ksp[Cu(OH)2]=2.2×10-20。
(1)为了除去杂质,通常是加入H2O2再调节溶液pH,其中加入H2O2的作用是__________________;与其他试剂相比,使用H2O2的优点是________________________________(答出两点即可)。
(2)调节溶液pH时,加入的物质是______________(填化学式);常温下,控制溶液的pH≥_________即可除去杂质离子。
解析:(1)由于Ksp[Fe(OH)2]、Ksp[Cu(OH)2]相差不大,则Fe(OH)2和Cu(OH)2的溶解度相差不大,故加入H2O2的作用是将Fe2+氧化成Fe3+,便于形成Fe(OH)3沉淀。
答案:(1)将Fe2+氧化为Fe3+ 不引入其他杂质; 对环境无污染(其他合理答案均可)
(2)CuO[或Cu(OH)2、CuCO3、Cu2(OH)2CO3等] 3.2
谢
谢
观
看
同课章节目录
