2024届高考一轮复习 第八章 水溶液中的离子反应与平衡 第5讲 水溶液中的新型图像分析 课件(共66张PPT)
文档属性
| 名称 | 2024届高考一轮复习 第八章 水溶液中的离子反应与平衡 第5讲 水溶液中的新型图像分析 课件(共66张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-17 21:35:15 | ||
图片预览









文档简介
(共66张PPT)
第5讲 水溶液中的新型图像分析(综合应用课)
有关水溶液中的离子平衡图像题,已成为近年来高考考查的一类重要题型。此类题情境新颖、综合性强,突出对学生迁移运用能力和综合素养的考查。突破此类题型,准确分析图像,捕捉有效信息是解题的关键。
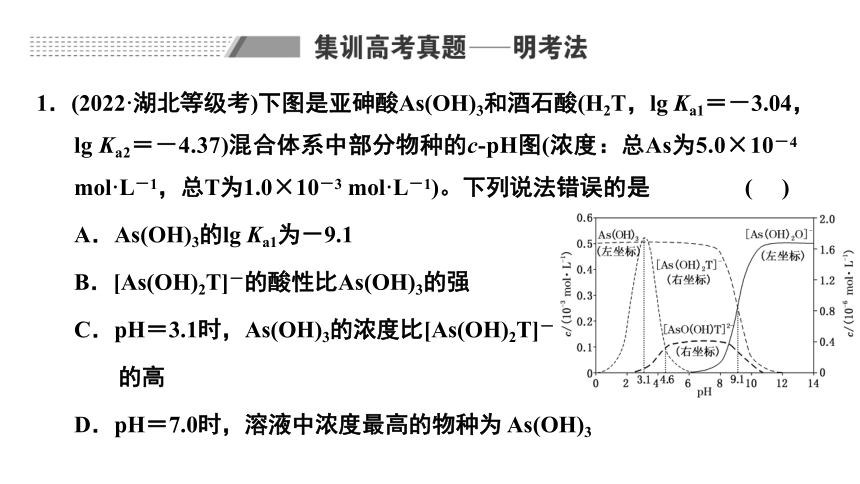
1.(2022·湖北等级考)下图是亚砷酸As(OH)3和酒石酸(H2T,lg Ka1=-3.04,lg Ka2=-4.37)混合体系中部分物种的c pH图(浓度:总As为5.0×10-4 mol·L-1,总T为1.0×10-3 mol·L-1)。下列说法错误的是 ( )
A.As(OH)3的lg Ka1为-9.1
B.[As(OH)2T]-的酸性比As(OH)3的强
C.pH=3.1时,As(OH)3的浓度比[As(OH)2T]-
的高
D.pH=7.0时,溶液中浓度最高的物种为 As(OH)3
由图可知As(OH)3的浓度为左坐标,浓度的数量级为10-3 mol·L-1,[As(OH)2T]-的浓度为右坐标,浓度的数量级为10-6 mol·L-1,所以pH=3.1时,As(OH)3的浓度比[As(OH)2T]-的高,C正确;
由已知条件,酒石酸的第一步电离常数远大于亚砷酸的第一步电离常数,所以酒石酸的酸性远强于As(OH)3,另外总As的浓度也小于总T的浓度,所以当pH=7.0时,溶液中浓度最高的物种不是As(OH)3,D错误。
答案:D
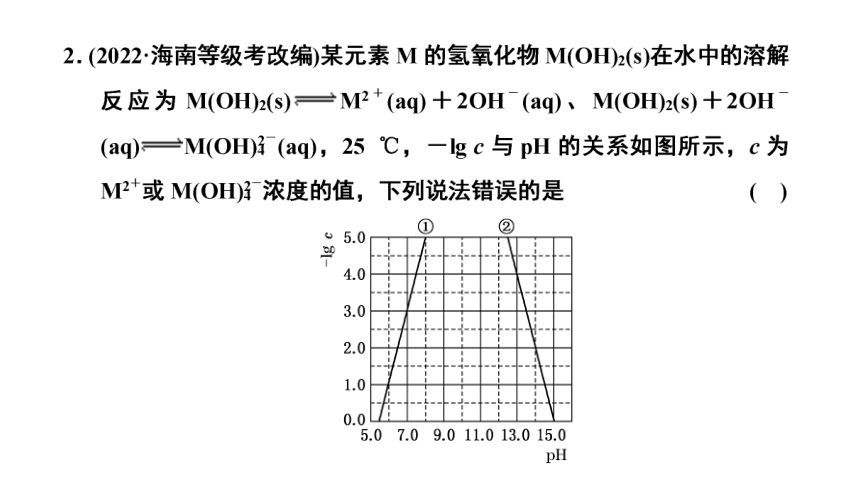
由图像,pH=7.0时,-lg c(M2+)=3.0,则M(OH)2的Ksp=c(M2+)·c2(OH-)=1×10-17,B正确;
答案:D
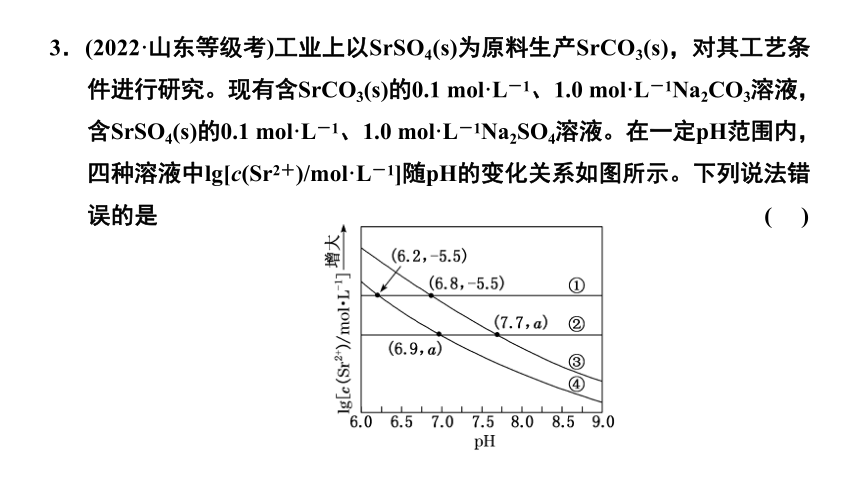
3.(2022·山东等级考)工业上以SrSO4(s)为原料生产SrCO3(s),对其工艺条件进行研究。现有含SrCO3(s)的0.1 mol·L-1、1.0 mol·L-1Na2CO3溶液,含SrSO4(s)的0.1 mol·L-1、1.0 mol·L-1Na2SO4溶液。在一定pH范围内,四种溶液中lg[c(Sr2+)/mol·L-1]随pH的变化关系如图所示。下列说法错误的是 ( )
曲线④表示含碳酸锶固体的1 mol·L-1碳酸钠溶液的变化曲线,故C正确;
pH≥6.9时,1.0 mol·L-1 Na2CO3溶液中c(Sr2+)≤10a mol·L-1,即发生沉淀转化,故D错误。
答案:D
解析: Ksp(BaSO4)答案:B
四类图像的信息解读
(一)与水电离平衡相关的图像
1.不同温度下水溶液中c(H+)与c(OH-)的变化曲线
A、C、B三点所示溶液[c(H+)=c(OH-)]均呈中性,
升高温度,Kw依次增大。直线AB的左上方区域所示
的溶液[c(H+)<c(OH-)]均为碱性溶液,右下方区域
所示的溶液[c(H+)>c(OH-)]均为酸性溶液
2.滴定过程中c水(H+)或c水(OH-)的变化曲线
25 ℃时,以盐酸滴定20 mL 0.1 mol·L-1氨水过程中由水电离出的氢离子浓度[c水(H+)]随加入盐酸体积的变化关系图为例进行分析。
(二)分布系数图像
分布系数图像一般是以pH为横轴、分布分数(组分的平衡浓度占总浓度的分数)为纵轴的关系曲线,以草酸H2C2O4为例,含碳元素的各组分分布系数(δ)与pH的关系如图所示。
(三)对数图像
以常温下向二元弱酸H2Y溶液中滴加NaOH溶液为例,所得溶液的pH与离子浓度的变化关系如图所示。
续
表
(四)沉淀溶解平衡图像
以AgCl的沉淀溶解平衡图像(图1)、CaSO4与CaCO3的沉淀溶解平衡图像(图2)、用0.1 mol·L-1 Na2SO4溶液滴定20 mL 0.1 mol·L-1 BaCl2溶液的沉淀滴定图像(图3)为例进行分析。已知Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.6×10-9。
续
表
[解析] NH2CH2COOH中存在—NH2和—COOH,所以溶液既有酸性又有碱性,故A正确;
[答案] D
[思维建模] 解分布系数图像题的“四步曲”
第一步:坐标轴数据的含义 坐标轴数据是研究本类题目的基础。只要明确了坐标轴的意义,就能明白整个图像的含义,也为下一步打下了良好的基础
第二步:曲线变化的趋势 曲线变化的趋势代表了某一类物质的某一参数在坐标图中的变化情况,指出的是在坐标数据变化下,该参数整体性的变化原则,有助于分析某成分的变化是由什么因素引起的
第三步:交点分析 这是这类问题最重要的一个解题依据,交点代表的是某两个值是相等的,而这两个值将会在解题之中起到至关重要的作用,所以交点的分析是解决这类问题的关键
第四步:结合已知的数据和信息分析 这里会需要用到电离平衡常数、水解平衡常数甚至是Kw的值来进行数据分析,分析这些数据的时候,尽可能依靠已知数据去分析交点的数据信息,才能得到正确的结论
续表
A. 曲线a表示的是HA-的变化
B.Ka2(H2A)的数量级为10-3
C.假设Q点溶液中无A2-,则图中x=2.41
D.pH<7时溶液中可能存在:c(Na+)>c(HA-)+2c(A2-)
解析:根据图像横坐标的变化判断,加入氢氧化钠溶液后,pH在增大,溶液中发生酸碱中和,根据二元酸的电离方程式判断微粒的变化,酸式根离子先增大后减小,酸分子的浓度减小,根据交点的特点微粒的浓度相等进行计算电离平衡常数。pH越小,氢离子浓度越大,H2A越多,所以曲线a代表H2A的变化,A项错误;
P点处c(A2-)=c(HA-),故Ka2=c(H+)=10-5.51 mol·L-1,数量级为10-6,B项错误;
根据电荷守恒,c(Na+)+c(H+)=c(OH-)+2c(A2-)+c(HA-),推出c(Na+)-c(HA-)-2c(A2-)=c(OH-)-c(H+),因c(H+)>c(OH-),故c(Na+)<c(HA-)+2c(A2-),D项错误。
答案:C
根据电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(H2A-)+2c(HA2-),则pH=7时,c(Na+)=c(H2A-)+2c(HA2-)即2c(HA2-)<c(Na+),B错误;
由A项分析可知,Ka1=10-1.3,Ka2=10-6.7,则lg Ka1+lg Ka2=-8,C错误;
由题干图示信息可知,含A的微粒只有三种即H3A、H2A-、HA2-,说明H3A为二元弱酸,则H3A与足量NaOH溶液反应:H3A+2OH-===HA2-+2H2O,D正确。
答案:D
下列叙述正确的是 ( )
A.曲线①代表δ(H2A),曲线②代表δ(HA-)
B.H2A溶液的浓度为0.200 0 mol·L-1
C.HA-的电离常数Ka=1.0×10-2
D.滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-)
解析:左纵坐标表示分布系数的变化,右纵坐标表示溶液pH的变化。曲线①代表粒子的分布系数随着NaOH溶液的不断滴入逐渐减小,而曲线②代表粒子的分布系数随着NaOH溶液的不断滴入逐渐增大。当加入40 mL NaOH溶液时,由曲线③可知溶液的pH发生突变,说明酸碱溶液恰好完全反应,其方程式为2NaOH+H2A===Na2A+2H2O。由c(H2A)×2×20 mL=c(NaOH)×40 mL可得c(H2A)=0.100 0 mol·L-1。此时曲线①粒子的分布系数接近为0,而曲线②粒子的分布系数接近为1,可推断曲线①代表δ(HA-),曲线②代表δ(A2-),故A、B两项错误;
滴定终点时溶液中存在的离子有Na+、H+、A2-、HA-、OH-,根据电荷守恒有c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),此时c(H+)2c(A2-)+c(HA-),D项错误。
答案:C
类型(二) 线性函数关系图像
为直观简明地反映水溶液中离子浓度的变化规律,近年来高考命题常通过函数变换将离子浓度及其影响因素间的非线性函数关系转换为线性函数关系,并以其对应的化学曲线为载体评价学生对化学核心概念和基本原理的理解程度、信息素养和化学学科核心素养的发展水平。
a点对应溶液中c(Ag+)比Ag2C2O4溶解平衡曲线上的c(Ag+)小,表示Ag2C2O4的不饱和溶液,B正确;
答案:C
解析:从M点到Q点溶液pH增大,反应“CH3COOH+NaOH===CH3COONa+H2O”将弱电解质CH3COOH转变为强电解质CH3COONa,导致溶液中的离子浓度增大,溶液导电能力增强,A选项错误;
N点pOH<pH,即c(OH-)>c(H+),依据电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),可知c(CH3COO-)<c(Na+),B选项错误;
M点为CH3COOH和CH3COONa的混合溶液,OH-均来自H2O的电离,N点为CH3COONa和NaOH的混合溶液,H+均来自H2O的电离,现M点pOH与N点pH相等,表明M点c(OH-)等于N点c(H+),两溶液中水的电离程度相同,C选项正确;
Q点pH=pOH,表明溶液呈中性,若NaOH溶液的体积等于醋酸溶液的体积,由于生成的CH3COONa水解将导致溶液呈碱性,据此判断Q点NaOH溶液的体积小于醋酸溶液的体积,D选项错误。
答案:C
3.一元弱碱稀释过程中氢离子浓度与溶液体积变化关系曲线
解析:由稀释前MOH与ROH的pH可知,MOH为强碱、ROH为弱碱,A选项正确;
弱碱溶液稀释过程中电离平衡正向移动,导致电离程度增大,b点ROH电离程度大于a点,B选项正确;
无限稀释后溶液均趋向中性,导致溶液c(OH-)相等,C选项正确;
答案:D
c(X2-)=c(HX-)时,pH=5.4,可推出混合溶液呈中性时,c(X2-)>c(HX-),D选项错误。
答案:D
谢
谢
观
看
第5讲 水溶液中的新型图像分析(综合应用课)
有关水溶液中的离子平衡图像题,已成为近年来高考考查的一类重要题型。此类题情境新颖、综合性强,突出对学生迁移运用能力和综合素养的考查。突破此类题型,准确分析图像,捕捉有效信息是解题的关键。
1.(2022·湖北等级考)下图是亚砷酸As(OH)3和酒石酸(H2T,lg Ka1=-3.04,lg Ka2=-4.37)混合体系中部分物种的c pH图(浓度:总As为5.0×10-4 mol·L-1,总T为1.0×10-3 mol·L-1)。下列说法错误的是 ( )
A.As(OH)3的lg Ka1为-9.1
B.[As(OH)2T]-的酸性比As(OH)3的强
C.pH=3.1时,As(OH)3的浓度比[As(OH)2T]-
的高
D.pH=7.0时,溶液中浓度最高的物种为 As(OH)3
由图可知As(OH)3的浓度为左坐标,浓度的数量级为10-3 mol·L-1,[As(OH)2T]-的浓度为右坐标,浓度的数量级为10-6 mol·L-1,所以pH=3.1时,As(OH)3的浓度比[As(OH)2T]-的高,C正确;
由已知条件,酒石酸的第一步电离常数远大于亚砷酸的第一步电离常数,所以酒石酸的酸性远强于As(OH)3,另外总As的浓度也小于总T的浓度,所以当pH=7.0时,溶液中浓度最高的物种不是As(OH)3,D错误。
答案:D
由图像,pH=7.0时,-lg c(M2+)=3.0,则M(OH)2的Ksp=c(M2+)·c2(OH-)=1×10-17,B正确;
答案:D
3.(2022·山东等级考)工业上以SrSO4(s)为原料生产SrCO3(s),对其工艺条件进行研究。现有含SrCO3(s)的0.1 mol·L-1、1.0 mol·L-1Na2CO3溶液,含SrSO4(s)的0.1 mol·L-1、1.0 mol·L-1Na2SO4溶液。在一定pH范围内,四种溶液中lg[c(Sr2+)/mol·L-1]随pH的变化关系如图所示。下列说法错误的是 ( )
曲线④表示含碳酸锶固体的1 mol·L-1碳酸钠溶液的变化曲线,故C正确;
pH≥6.9时,1.0 mol·L-1 Na2CO3溶液中c(Sr2+)≤10a mol·L-1,即发生沉淀转化,故D错误。
答案:D
解析: Ksp(BaSO4)
四类图像的信息解读
(一)与水电离平衡相关的图像
1.不同温度下水溶液中c(H+)与c(OH-)的变化曲线
A、C、B三点所示溶液[c(H+)=c(OH-)]均呈中性,
升高温度,Kw依次增大。直线AB的左上方区域所示
的溶液[c(H+)<c(OH-)]均为碱性溶液,右下方区域
所示的溶液[c(H+)>c(OH-)]均为酸性溶液
2.滴定过程中c水(H+)或c水(OH-)的变化曲线
25 ℃时,以盐酸滴定20 mL 0.1 mol·L-1氨水过程中由水电离出的氢离子浓度[c水(H+)]随加入盐酸体积的变化关系图为例进行分析。
(二)分布系数图像
分布系数图像一般是以pH为横轴、分布分数(组分的平衡浓度占总浓度的分数)为纵轴的关系曲线,以草酸H2C2O4为例,含碳元素的各组分分布系数(δ)与pH的关系如图所示。
(三)对数图像
以常温下向二元弱酸H2Y溶液中滴加NaOH溶液为例,所得溶液的pH与离子浓度的变化关系如图所示。
续
表
(四)沉淀溶解平衡图像
以AgCl的沉淀溶解平衡图像(图1)、CaSO4与CaCO3的沉淀溶解平衡图像(图2)、用0.1 mol·L-1 Na2SO4溶液滴定20 mL 0.1 mol·L-1 BaCl2溶液的沉淀滴定图像(图3)为例进行分析。已知Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.6×10-9。
续
表
[解析] NH2CH2COOH中存在—NH2和—COOH,所以溶液既有酸性又有碱性,故A正确;
[答案] D
[思维建模] 解分布系数图像题的“四步曲”
第一步:坐标轴数据的含义 坐标轴数据是研究本类题目的基础。只要明确了坐标轴的意义,就能明白整个图像的含义,也为下一步打下了良好的基础
第二步:曲线变化的趋势 曲线变化的趋势代表了某一类物质的某一参数在坐标图中的变化情况,指出的是在坐标数据变化下,该参数整体性的变化原则,有助于分析某成分的变化是由什么因素引起的
第三步:交点分析 这是这类问题最重要的一个解题依据,交点代表的是某两个值是相等的,而这两个值将会在解题之中起到至关重要的作用,所以交点的分析是解决这类问题的关键
第四步:结合已知的数据和信息分析 这里会需要用到电离平衡常数、水解平衡常数甚至是Kw的值来进行数据分析,分析这些数据的时候,尽可能依靠已知数据去分析交点的数据信息,才能得到正确的结论
续表
A. 曲线a表示的是HA-的变化
B.Ka2(H2A)的数量级为10-3
C.假设Q点溶液中无A2-,则图中x=2.41
D.pH<7时溶液中可能存在:c(Na+)>c(HA-)+2c(A2-)
解析:根据图像横坐标的变化判断,加入氢氧化钠溶液后,pH在增大,溶液中发生酸碱中和,根据二元酸的电离方程式判断微粒的变化,酸式根离子先增大后减小,酸分子的浓度减小,根据交点的特点微粒的浓度相等进行计算电离平衡常数。pH越小,氢离子浓度越大,H2A越多,所以曲线a代表H2A的变化,A项错误;
P点处c(A2-)=c(HA-),故Ka2=c(H+)=10-5.51 mol·L-1,数量级为10-6,B项错误;
根据电荷守恒,c(Na+)+c(H+)=c(OH-)+2c(A2-)+c(HA-),推出c(Na+)-c(HA-)-2c(A2-)=c(OH-)-c(H+),因c(H+)>c(OH-),故c(Na+)<c(HA-)+2c(A2-),D项错误。
答案:C
根据电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(H2A-)+2c(HA2-),则pH=7时,c(Na+)=c(H2A-)+2c(HA2-)即2c(HA2-)<c(Na+),B错误;
由A项分析可知,Ka1=10-1.3,Ka2=10-6.7,则lg Ka1+lg Ka2=-8,C错误;
由题干图示信息可知,含A的微粒只有三种即H3A、H2A-、HA2-,说明H3A为二元弱酸,则H3A与足量NaOH溶液反应:H3A+2OH-===HA2-+2H2O,D正确。
答案:D
下列叙述正确的是 ( )
A.曲线①代表δ(H2A),曲线②代表δ(HA-)
B.H2A溶液的浓度为0.200 0 mol·L-1
C.HA-的电离常数Ka=1.0×10-2
D.滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-)
解析:左纵坐标表示分布系数的变化,右纵坐标表示溶液pH的变化。曲线①代表粒子的分布系数随着NaOH溶液的不断滴入逐渐减小,而曲线②代表粒子的分布系数随着NaOH溶液的不断滴入逐渐增大。当加入40 mL NaOH溶液时,由曲线③可知溶液的pH发生突变,说明酸碱溶液恰好完全反应,其方程式为2NaOH+H2A===Na2A+2H2O。由c(H2A)×2×20 mL=c(NaOH)×40 mL可得c(H2A)=0.100 0 mol·L-1。此时曲线①粒子的分布系数接近为0,而曲线②粒子的分布系数接近为1,可推断曲线①代表δ(HA-),曲线②代表δ(A2-),故A、B两项错误;
滴定终点时溶液中存在的离子有Na+、H+、A2-、HA-、OH-,根据电荷守恒有c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),此时c(H+)
答案:C
类型(二) 线性函数关系图像
为直观简明地反映水溶液中离子浓度的变化规律,近年来高考命题常通过函数变换将离子浓度及其影响因素间的非线性函数关系转换为线性函数关系,并以其对应的化学曲线为载体评价学生对化学核心概念和基本原理的理解程度、信息素养和化学学科核心素养的发展水平。
a点对应溶液中c(Ag+)比Ag2C2O4溶解平衡曲线上的c(Ag+)小,表示Ag2C2O4的不饱和溶液,B正确;
答案:C
解析:从M点到Q点溶液pH增大,反应“CH3COOH+NaOH===CH3COONa+H2O”将弱电解质CH3COOH转变为强电解质CH3COONa,导致溶液中的离子浓度增大,溶液导电能力增强,A选项错误;
N点pOH<pH,即c(OH-)>c(H+),依据电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),可知c(CH3COO-)<c(Na+),B选项错误;
M点为CH3COOH和CH3COONa的混合溶液,OH-均来自H2O的电离,N点为CH3COONa和NaOH的混合溶液,H+均来自H2O的电离,现M点pOH与N点pH相等,表明M点c(OH-)等于N点c(H+),两溶液中水的电离程度相同,C选项正确;
Q点pH=pOH,表明溶液呈中性,若NaOH溶液的体积等于醋酸溶液的体积,由于生成的CH3COONa水解将导致溶液呈碱性,据此判断Q点NaOH溶液的体积小于醋酸溶液的体积,D选项错误。
答案:C
3.一元弱碱稀释过程中氢离子浓度与溶液体积变化关系曲线
解析:由稀释前MOH与ROH的pH可知,MOH为强碱、ROH为弱碱,A选项正确;
弱碱溶液稀释过程中电离平衡正向移动,导致电离程度增大,b点ROH电离程度大于a点,B选项正确;
无限稀释后溶液均趋向中性,导致溶液c(OH-)相等,C选项正确;
答案:D
c(X2-)=c(HX-)时,pH=5.4,可推出混合溶液呈中性时,c(X2-)>c(HX-),D选项错误。
答案:D
谢
谢
观
看
同课章节目录
