2024届高考一轮复习 第八章 水溶液中的离子反应与平衡 第6讲 四大平衡常数的相关计算 课件(共55张PPT)
文档属性
| 名称 | 2024届高考一轮复习 第八章 水溶液中的离子反应与平衡 第6讲 四大平衡常数的相关计算 课件(共55张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-17 21:36:35 | ||
图片预览










文档简介
(共55张PPT)
第6讲 四大平衡常数的相关计算(综合应用课)
电解质溶液中的电离常数、水的离子积常数、水解常数及溶度积常数是在化学平衡常数基础上的延深和拓展,它是定量研究平衡移动的重要手段。各平衡常数的应用和计算是高考的热点和难点。要想掌握此点,在复习时就要以化学平衡原理为指导,以判断平衡移动的方向为线索,以勒夏特列原理和相关守恒定律为计算依据,以各平衡常数之间的联系为突破口,联系元素及化合物知识,串点成线,结线成网,形成完整的知识结构体系,运用综合思维,才能顺利解题。
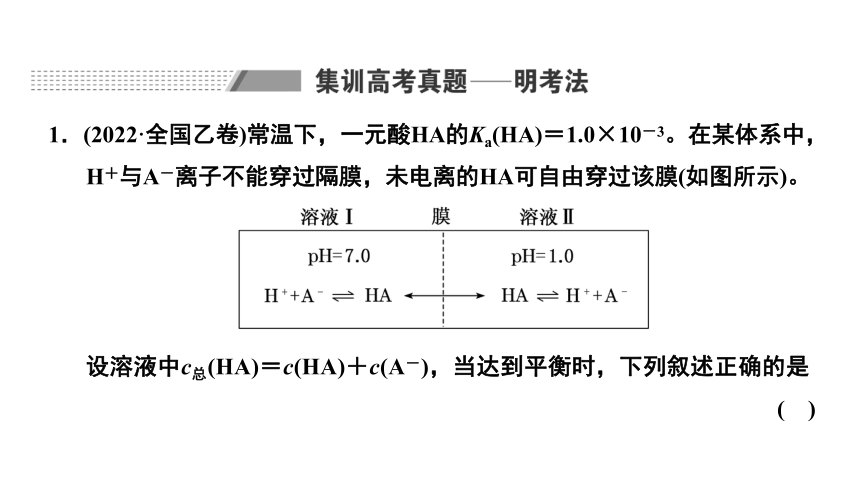
1.(2022·全国乙卷)常温下,一元酸HA的Ka(HA)=1.0×10-3。在某体系中,H+与A-离子不能穿过隔膜,未电离的HA可自由穿过该膜(如图所示)。
设溶液中c总(HA)=c(HA)+c(A-),当达到平衡时,下列叙述正确的是 ( )
解析:常温下溶液Ⅰ的pH=7.0,则溶液Ⅰ中c(H+)=c(OH-)=1×10-7 mol·L-1,c(H+)<c(OH-)+c(A-),A错误;
根据题意,未电离的HA可自由穿过隔膜,故溶液Ⅰ和Ⅱ中的c(HA)相等,C错误;
答案:B
2.(1)(2022·浙江选考·节选)一氧化碳变换反应:CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ·mol-1。
一定温度下,反应后测得各组分的平衡压强(即组分的物质的量分数×总压):p(CO)=0.25 MPa、p(H2O)=0.25 MPa、p(CO2)=0.75 MPa和p(H2)=0.75 MPa,则反应的平衡常数K的数值为_____________。
(2)(2022·湖北等级考·节选)温度为T时,Ksp[Ca(OH)2]=x,则Ca(OH)2饱和溶液中c(OH-)=___________(用含x的代数式表示)。
解析:(1)向溶液中加入少量硫酸,溶液中c(H+)增大,(ⅱ)平衡逆向移动,根据勒夏特列原理可知,平衡移动只是减弱改变量,平衡后,溶液中c(H+)依然增大,因此溶液的pH将减小,故A错误;
加水稀释过程中,根据“越稀越水解”“越稀越电离”可知,(ⅰ)和(ⅱ)的平衡都正向移动,两个平衡正向都是离子数增大的反应,因此稀释后,溶液中离子总数将增大,故B正确;
1.四大平衡常数的比较
续表
2.四大平衡常数的关系
(1)Ka(或Kb)、Kw、Kh的关系式
3.四大平衡常数的应用
(1)判断平衡移动的方向
Q与Ksp的关系 平衡移动方向 结论
Q>Ksp 逆向 溶液过饱和,有沉淀析出
Q=Ksp 不移动 溶液饱和,处于平衡状态
Q<Ksp 正向 溶液未饱和,无沉淀析出
[综合应用训练]
题点(一) 四大平衡常数在平衡移动中的应用
1.室温下,通过下列实验探究0.010 0 mol·L-1Na2C2O4溶液的性质。
实验1:实验测得0.010 0 mol·L-1Na2C2O4溶液pH为8.6。
实验2:向溶液中滴加等体积0.010 0 mol·L-1HCl溶液,pH由8.6降为4.8。
实验3:向溶液中加入等体积0.020 0 mol·L-1CaCl2溶液,出现白色沉淀。
实验4:向稀硫酸酸化的KMnO4溶液中滴加Na2C2O4溶液至溶液褪色。
答案:A
如图所示的“吸收”“转化”过程中,发生反应分别为CO2+2KOH===K2CO3+H2O、K2CO3+CaO+H2O===CaCO3↓+2KOH(若生成KHCO3或K2CO3与KHCO3的混合物,则原理相同),二式相加得:CO2+CaO===CaCO3↓,该反应放热,溶液的温度升高,D不正确。
答案:C
解析:题干信息标明为“常温下”,故温度不变,沉淀溶解平衡常数不变,A项错误;
用相同浓度、相同体积的MgCl2溶液替代BaCl2溶液,恰好完全反应时,二者消耗的Na2CO3溶液体积相等,但由于碳酸钡的溶度积小于碳酸镁,所以滴定终点时pMg<pBa,故F点向下方迁移,B项错误;
答案:D
A.D点存在2c(M2+)=3c(HA)
B.E点的pH≈5.6
C.25 ℃时,Ksp(MA2)的数量级为10-10
D.25 ℃时,HA的电离常数Ka为2.5×10-5
答案:B
题点(三) 四大平衡常数的综合应用
5.已知K、Ka、Kw、Kh、Ksp分别表示化学平衡常数、弱酸的电离常数、水的离子积常数、盐的水解常数、难溶电解质的溶度积常数。
(1)有关上述常数的说法正确的是________。
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
d.一定温度下,在CH3COONa溶液中,Kw=Ka·Kh
解析:(1)对于正反应为放热反应的化学平衡,升高温度,平衡逆向移动,平衡常数减小,b选项错误;温度不变,CH3COOH的电离常数不变,c选项错误。
6.锂离子电池是目前具有最高比能量的二次电池。LiFePO4可极大地改善电池体系的安全性能,且具有资源丰富、循环寿命长、环境友好等特点,是锂离子电池正极材料的理想选择。生产LiFePO4的一种工艺流程如图:
已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp(FePO4·xH2O)=1.0×10-15。
回答下列问题:
(1)在合成磷酸铁时,步骤Ⅰ中pH的控制是关键。如果pH<1.9,Fe3+沉淀不完全,影响产量;如果pH>3.0,则可能存在的问题是____________________________________。
(2)步骤Ⅱ中,洗涤是为了除去FePO4·xH2O表面附着的_________等离子。
(3)取三组FePO4·xH2O样品,经过高温充分煅烧测其结晶水含量,实验数据如下表:
实验序号 1 2 3
固体失重质量分数/% 19.9 20.1 20.0
(4)步骤Ⅲ中研磨的作用是 __________________________________。
(5)在步骤Ⅳ中生成了LiFePO4、CO2和H2O,则氧化剂与还原剂的物质的量之比为________________。
解析:(1)合成磷酸铁时,pH<1.9,Fe3+沉淀不完全;pH>3.0,由Ksp[Fe(OH)3]=4.0×10-38可知,易生成Fe(OH)3沉淀,影响磷酸铁的纯度。
(4)步骤ⅢFePO4·xH2O中加入葡萄糖和Li2CO3研磨、干燥,使反应物混合均匀,加快反应速率,提高反应产率。
(5)步骤Ⅳ在Ar气保护、600 ℃煅烧,生成了LiFePO4、CO2和H2O,其中Fe元素由+3价降低到+2价,葡萄糖则被氧化为CO2和H2O,则氧化剂为FePO4·xH2O,还原剂是葡萄糖(C6H12O6),据得失电子守恒可得:n(FePO4·xH2O)×(3-2)=n(C6H12O6)×(4-0)×6,则有n(FePO4·xH2O)∶n(C6H12O6)=24∶1。
谢
谢
观
看
第6讲 四大平衡常数的相关计算(综合应用课)
电解质溶液中的电离常数、水的离子积常数、水解常数及溶度积常数是在化学平衡常数基础上的延深和拓展,它是定量研究平衡移动的重要手段。各平衡常数的应用和计算是高考的热点和难点。要想掌握此点,在复习时就要以化学平衡原理为指导,以判断平衡移动的方向为线索,以勒夏特列原理和相关守恒定律为计算依据,以各平衡常数之间的联系为突破口,联系元素及化合物知识,串点成线,结线成网,形成完整的知识结构体系,运用综合思维,才能顺利解题。
1.(2022·全国乙卷)常温下,一元酸HA的Ka(HA)=1.0×10-3。在某体系中,H+与A-离子不能穿过隔膜,未电离的HA可自由穿过该膜(如图所示)。
设溶液中c总(HA)=c(HA)+c(A-),当达到平衡时,下列叙述正确的是 ( )
解析:常温下溶液Ⅰ的pH=7.0,则溶液Ⅰ中c(H+)=c(OH-)=1×10-7 mol·L-1,c(H+)<c(OH-)+c(A-),A错误;
根据题意,未电离的HA可自由穿过隔膜,故溶液Ⅰ和Ⅱ中的c(HA)相等,C错误;
答案:B
2.(1)(2022·浙江选考·节选)一氧化碳变换反应:CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ·mol-1。
一定温度下,反应后测得各组分的平衡压强(即组分的物质的量分数×总压):p(CO)=0.25 MPa、p(H2O)=0.25 MPa、p(CO2)=0.75 MPa和p(H2)=0.75 MPa,则反应的平衡常数K的数值为_____________。
(2)(2022·湖北等级考·节选)温度为T时,Ksp[Ca(OH)2]=x,则Ca(OH)2饱和溶液中c(OH-)=___________(用含x的代数式表示)。
解析:(1)向溶液中加入少量硫酸,溶液中c(H+)增大,(ⅱ)平衡逆向移动,根据勒夏特列原理可知,平衡移动只是减弱改变量,平衡后,溶液中c(H+)依然增大,因此溶液的pH将减小,故A错误;
加水稀释过程中,根据“越稀越水解”“越稀越电离”可知,(ⅰ)和(ⅱ)的平衡都正向移动,两个平衡正向都是离子数增大的反应,因此稀释后,溶液中离子总数将增大,故B正确;
1.四大平衡常数的比较
续表
2.四大平衡常数的关系
(1)Ka(或Kb)、Kw、Kh的关系式
3.四大平衡常数的应用
(1)判断平衡移动的方向
Q与Ksp的关系 平衡移动方向 结论
Q>Ksp 逆向 溶液过饱和,有沉淀析出
Q=Ksp 不移动 溶液饱和,处于平衡状态
Q<Ksp 正向 溶液未饱和,无沉淀析出
[综合应用训练]
题点(一) 四大平衡常数在平衡移动中的应用
1.室温下,通过下列实验探究0.010 0 mol·L-1Na2C2O4溶液的性质。
实验1:实验测得0.010 0 mol·L-1Na2C2O4溶液pH为8.6。
实验2:向溶液中滴加等体积0.010 0 mol·L-1HCl溶液,pH由8.6降为4.8。
实验3:向溶液中加入等体积0.020 0 mol·L-1CaCl2溶液,出现白色沉淀。
实验4:向稀硫酸酸化的KMnO4溶液中滴加Na2C2O4溶液至溶液褪色。
答案:A
如图所示的“吸收”“转化”过程中,发生反应分别为CO2+2KOH===K2CO3+H2O、K2CO3+CaO+H2O===CaCO3↓+2KOH(若生成KHCO3或K2CO3与KHCO3的混合物,则原理相同),二式相加得:CO2+CaO===CaCO3↓,该反应放热,溶液的温度升高,D不正确。
答案:C
解析:题干信息标明为“常温下”,故温度不变,沉淀溶解平衡常数不变,A项错误;
用相同浓度、相同体积的MgCl2溶液替代BaCl2溶液,恰好完全反应时,二者消耗的Na2CO3溶液体积相等,但由于碳酸钡的溶度积小于碳酸镁,所以滴定终点时pMg<pBa,故F点向下方迁移,B项错误;
答案:D
A.D点存在2c(M2+)=3c(HA)
B.E点的pH≈5.6
C.25 ℃时,Ksp(MA2)的数量级为10-10
D.25 ℃时,HA的电离常数Ka为2.5×10-5
答案:B
题点(三) 四大平衡常数的综合应用
5.已知K、Ka、Kw、Kh、Ksp分别表示化学平衡常数、弱酸的电离常数、水的离子积常数、盐的水解常数、难溶电解质的溶度积常数。
(1)有关上述常数的说法正确的是________。
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
d.一定温度下,在CH3COONa溶液中,Kw=Ka·Kh
解析:(1)对于正反应为放热反应的化学平衡,升高温度,平衡逆向移动,平衡常数减小,b选项错误;温度不变,CH3COOH的电离常数不变,c选项错误。
6.锂离子电池是目前具有最高比能量的二次电池。LiFePO4可极大地改善电池体系的安全性能,且具有资源丰富、循环寿命长、环境友好等特点,是锂离子电池正极材料的理想选择。生产LiFePO4的一种工艺流程如图:
已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp(FePO4·xH2O)=1.0×10-15。
回答下列问题:
(1)在合成磷酸铁时,步骤Ⅰ中pH的控制是关键。如果pH<1.9,Fe3+沉淀不完全,影响产量;如果pH>3.0,则可能存在的问题是____________________________________。
(2)步骤Ⅱ中,洗涤是为了除去FePO4·xH2O表面附着的_________等离子。
(3)取三组FePO4·xH2O样品,经过高温充分煅烧测其结晶水含量,实验数据如下表:
实验序号 1 2 3
固体失重质量分数/% 19.9 20.1 20.0
(4)步骤Ⅲ中研磨的作用是 __________________________________。
(5)在步骤Ⅳ中生成了LiFePO4、CO2和H2O,则氧化剂与还原剂的物质的量之比为________________。
解析:(1)合成磷酸铁时,pH<1.9,Fe3+沉淀不完全;pH>3.0,由Ksp[Fe(OH)3]=4.0×10-38可知,易生成Fe(OH)3沉淀,影响磷酸铁的纯度。
(4)步骤ⅢFePO4·xH2O中加入葡萄糖和Li2CO3研磨、干燥,使反应物混合均匀,加快反应速率,提高反应产率。
(5)步骤Ⅳ在Ar气保护、600 ℃煅烧,生成了LiFePO4、CO2和H2O,其中Fe元素由+3价降低到+2价,葡萄糖则被氧化为CO2和H2O,则氧化剂为FePO4·xH2O,还原剂是葡萄糖(C6H12O6),据得失电子守恒可得:n(FePO4·xH2O)×(3-2)=n(C6H12O6)×(4-0)×6,则有n(FePO4·xH2O)∶n(C6H12O6)=24∶1。
谢
谢
观
看
同课章节目录
