2024届高考一轮复习 第八章 水溶液中的离子反应与平衡 第1讲 电离平衡和溶液的酸碱性 课件(共87张PPT)
文档属性
| 名称 | 2024届高考一轮复习 第八章 水溶液中的离子反应与平衡 第1讲 电离平衡和溶液的酸碱性 课件(共87张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-17 21:38:21 | ||
图片预览











文档简介
(共87张PPT)
第1讲 电离平衡和溶液的酸碱性(基础落实课)
逐点清(一) 弱电解质的电离及电离常数
(一)弱电解质的电离平衡
1.电离平衡的建立
在一定条件下(如温度、压强等),当弱电解质分子电离成离子的速率和离子结合成弱电解质分子的速率相等时,电离过程达到了平衡。电离平衡建立过程如图所示:
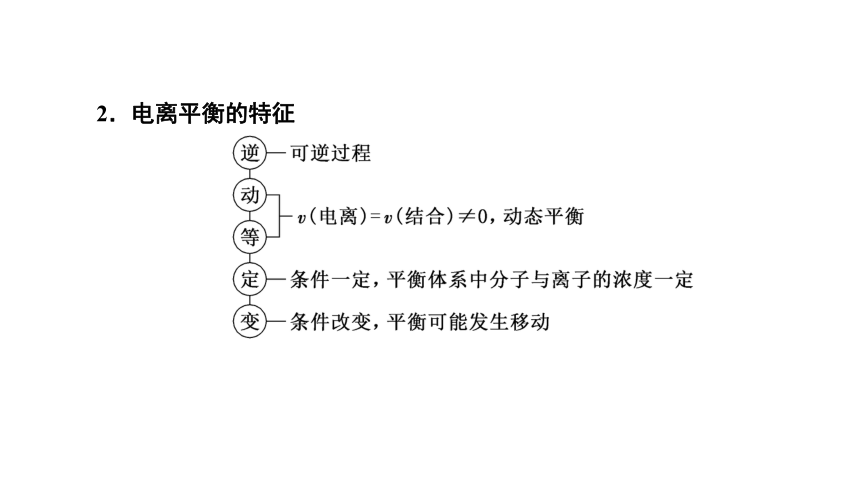
2.电离平衡的特征
温度 温度升高,电离平衡_____移动,电离程度_____
浓度 稀释溶液,电离平衡_____移动,电离程度_____
同离子效应 加入与弱电解质具有相同离子的强电解质,电离平衡_____移动,电离程度_____
加入能反应的物质 电离平衡_____移动,电离程度_____
3.电离平衡的外界影响因素
向右
增大
向右
增大
向左
减小
向右
增大
[注意] ①溶液中加水和加弱电解质,电离平衡均向电离方向移动,但溶液越稀,离子结合成分子的机会越少,电离程度越大。
②电离平衡向右移动,电解质的分子浓度不一定减小,电解质的离子浓度也可能减小。
(二)电离平衡常数
1.定义:一定温度下,对一元弱酸或一元弱碱来说,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之比是一个常数,这个常数叫做电离平衡常数,用K(弱酸用Ka,弱碱用Kb)表示。
2.表达式
3.特点
(1)电离平衡常数与温度有关,与浓度无关,升高温度,K值增大。
(2)电离平衡常数反映弱电解质的相对强弱,K越大,表示弱电解质越易电离,酸性或碱性越强。
(3)多元弱酸的各级电离常数的大小关系是K1 K2 K3……,故其酸性取决于第一步电离。
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)弱酸的电离程度越大,溶液的导电能力越强 ( )
(2)氨水的浓度越小,一水合氨的电离程度越大 ( )
(3)CH3COOH溶液加水稀释,电离平衡右移,c(H+)增大 ( )
×
√
×
×
×
×
2.在某温度时,溶质的物质的量浓度为0.20 mol·L-1的氨水中,达到电离平衡时,已电离的NH3·H2O为1.7×10-3 mol·L-1。试计算该温度下NH3·H2O的电离常数(Kb)为___________________________。
答案:1.4×10-5
[题点考法·全面练通]
题点(一) 弱电解质的电离和影响因素
1. 常温下,对于0.1 mol·L-1的醋酸溶液,下列说法正确的是 ( )
A.加水稀释后,溶液中c(H+)和c(OH-)都减小
B.加入少量冰醋酸后,溶液中c(H+)增大
C.加入少量Na2CO3固体,醋酸电离平衡向左移动
D.适当升高温度,醋酸的电离平衡常数减小
解析:加水稀释醋酸,促进醋酸电离,但醋酸增大的电离程度小于溶液体积增大程度,所以溶液中氢离子浓度减小,温度不变,水的离子积常数不变,导致溶液中氢氧根离子浓度增大,故A错误;
适当升高温度,促进醋酸的电离,醋酸的电离平衡常数增大,故D错误。
答案:B
解析:湿润pH试纸,相当于加水稀释,从图像来看,导电能力加强,c(H+)增大,pH减小。
答案:C
加水稀释,电离平衡正向移动,OH-的物质的量增大,B错误;
答案:D
CH3COOH HClO H2CO3
Ka=1.8×10-5 Ka=3.0×10-8 Ka1=4.3×10-7
Ka2=5.6×10-11
温度恒定则式子的值恒定,C项正确;CH3COOH的酸性强于HClO,故稀释相同pH的两种酸溶液,CH3COOH溶液的pH变化更大,即曲线Ⅰ代表稀释CH3COOH的稀溶液,曲线Ⅱ代表稀释HClO的稀溶液,a点pH大于b点,即c(H+)a<c(H+)b,而CH3COOH酸性又强于HClO,故图像中a点酸的总浓度小于b点酸的总浓度,D项错误。
答案:C
(3)常温下,将a mol·L-1 CH3COONa溶于水配成溶液,向其中滴加等体积的b mol·L-1的盐酸使溶液呈中性(不考虑盐酸和醋酸的挥发),用含a和b的代数式表示醋酸的电离常数Ka=_______。
答案:(1)10-1.2 (2)10-4.2 (3)1 000
1×10-7
2.水的离子积常数
3.水的电离平衡影响因素的定性判断
项目 平衡移动 溶液中c(H+) 溶液中c(OH-) pH 溶液的酸碱性 Kw
升高温度 右移 增大 增大 减小 中性 增大
加入酸碱 加酸 左移
加碱 左移
增大
减小
减小
酸性
不变
减小
增大
增大
碱性
不变
加入盐 Na2CO3 右移 ______ _____ ______ ______ _____
NH4Cl 右移 ______ _____ ______ ______ _____
加入金属Na 右移 ______ _____ ______ ______ _____
减小
增大
增大
碱性
不变
增大
减小
减小
酸性
不变
减小
增大
增大
碱性
不变
续表
(二)溶液的酸碱性和pH
1.溶液的酸碱性
溶液的酸碱性取决于溶液中c(H+)和c(OH-)的相对大小 酸性溶液 c(H+)___ c(OH-),常温下,pH___7
中性溶液 c(H+)___ c(OH-),常温下,pH___7
碱性溶液 c(H+)___ c(OH-),常温下,pH___7
>
<
=
=
<
>
2.溶液的pH
(1)定义式:pH=_____________。
(2)溶液的酸碱性跟pH的关系(室温下):
-lg c(H+)
(3)pH适用范围:pH的取值范围为0~14,即只适用于c(H+)和c(OH-)都较小的稀溶液(<1 mol·L-1)。
3.pH的测定
用pH试纸测定 使用方法:把一小片试纸放在表面皿上,用玻璃棒蘸取待测液点在干燥的pH试纸上,试纸变色后,与标准比色卡对比,即可确定溶液的pH
注意事项:pH试纸使用前不能用蒸馏水润湿,否则待测液因被稀释可能产生误差。广泛pH试纸只能测出整数值
用pH计测定 可精确测定溶液的pH
4.溶液pH的有关计算
(1)单一溶液的pH计算
(2)混合溶液的pH计算
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)水的电离平衡常数与水的离子积相等 ( )
(2)100 ℃的纯水中c(H+)=1×10-6 mol·L-1,此时水呈酸性 ( )
(3)水溶液中存在Kw=c(H+)·c(OH-),该式中c(H+)、c(OH-)一定是水电离出的 ( )
(4)25 ℃,pH=3的盐酸、NH4Cl溶液中,水电离出的c(H+)前者小 ( )
(5)纯水中c(H+)随着温度的升高而降低 ( )
×
×
×
√
×
(6)25 ℃时,0.10 mol·L-1 NaHCO3溶液加水稀释后,c(H+)与c(OH-)的乘积变大 ( )
(7)在蒸馏水中滴加浓H2SO4,Kw不变 ( )
(8)向水中加入少量硫酸氢钠固体,促进了水的电离,c(H+)增大,Kw不变 ( )
(9)向水中加入AlCl3溶液对水的电离不产生影响 ( )
(10)用湿润的pH试纸测溶液的pH一定有误差 ( )
(11)用广泛pH试纸测某溶液的pH为3.5 ( )
×
×
×
×
×
×
2.25 ℃的下列溶液中,碱性最强的是 ( )
A.pH=11的溶液
B.c(OH-)=0.12 mol·L-1
C.1 L中含有4 g NaOH的溶液
D.c(H+)=1×10-10 mol·L-1的溶液
解析:常温下,可以根据pH或c(H+)比较溶液的酸碱性,同样也可以根据c(OH-)的大小来比较。A、C、D三个选项中溶液的c(OH-)依次为 1×10-3 mol·L-1、0.1 mol·L-1、1×10-4 mol·L-1,所以B中溶液的c(OH-)最大,碱性最强。
答案:B
解析:向水中通入NH3,c(OH-)增大,平衡左移,A正确;向水中加入少量稀硫酸,c(H+)增大,但温度不变,Kw不变,B正确;将水加热,水的电离平衡正向移动,Kw变大,C正确;升高温度,能促进水的电离,c(H+)增大,pH减小,D错误。
答案:D
2.一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是 ( )
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-14
C.该温度下,加入FeCl3可能引起由a向b的变化
D.该温度下,稀释溶液可能引起由c向d的变化
解析: A项,c点溶液中c(OH-)>c(H+),溶液呈碱性,升温,溶液中c(OH-)不可能减小,错误。
B项,由b点对应c(H+)与c(OH-)可知,Kw=c(H+)·c(OH-)=1.0×
10-7×1.0×10-7=1.0×10-14,正确。
C项,FeCl3溶液水解显酸性,溶液中c(H+)增大,因一定温度下水的离子积是常数,故溶液中c(OH-)减小,因此加入FeCl3溶液可能引起由b向a的变化,错误。
D项,c点溶液呈碱性,稀释时c(OH-)减小,同时c(H+)应增大,故稀释溶液时不可能引起由c向d的转化,错误。
答案:B
3.某温度下,纯水中的c(H+)=2×10-7 mol·L-1,则此时c(OH-)=_____________。若温度不变,滴入稀H2SO4使c(H+)=5×10-6 mol·L-1,则c(OH-)=_____________,由水电离出的c(H+)为_____________。
答案:2×10-7 mol·L-1 8×10-9 mol·L-1 8×10-9 mol·L-1
答案:B
5.现有室温下四种溶液,有关叙述不正确的是 ( )
A.③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B.②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C.分别加水稀释10倍,四种溶液的pH:①>②>④>③
D.V1 L ④与V2 L ①混合,若混合后溶液pH=7,则V1<V2
序号 ① ② ③ ④
pH 11 11 3 3
溶液 氨水 氢氧化钠溶液 醋酸 盐酸
解析:当V1 L ④与V2 L ①混合,因氨水浓度远大于盐酸,若pH=7,则V1>V2。
答案:D
[思维建模] 溶液混合后酸碱性的判断方法
(1)等浓度等体积的一元酸与一元碱混合的溶液——“谁强显谁性,同强显中性”。
(2)室温下c酸(H+)=c碱(OH-),即pH之和等于14时,一强一弱等体积混合——“谁弱谁过量,谁弱显谁性”。
(3)室温下,已知酸和碱pH之和的溶液等体积混合酸碱性分析(两强混合)
①若pH之和等于14,则混合后溶液显中性,pH=7。
②若pH之和大于14,则混合后溶液显碱性,pH>7。
③若pH之和小于14,则混合后溶液显酸性,pH<7。
题点(三) 溶液pH计算
6.常温下,下列叙述正确的是 ( )
A.将pH=a的氨水稀释10倍后,其pH=b,则a=b+1
B.将pH=3.0的盐酸稀释105倍后,溶液的pH=8.0
C.将pH=9.0的NaOH溶液与pH=11.0的NaOH溶液等体积混合,所得溶液的pH=10.7
D.若将1 mL pH=1.0的盐酸与100 mL NaOH溶液混合后,溶液的pH=7.0,则NaOH溶液的pH=10.0
解析:一水合氨为弱电解质,加水稀释,促进其电离,溶液pH变化比强碱的小,故将pH=a的氨水稀释10倍后,其pH=b,则a对于强酸溶液,每稀释10倍,pH增大1个单位,但不能超过7,只能接近7,B项错误;
设NaOH溶液的pH=b,两溶液混合后溶液的pH=7.0,则1×10-3 L×10-1 mol·L-1=100×10-3 L×10b-14 mol·L-1,解得b=11.0,D项叙述错误。
答案:C
答案:(1)1∶10 (2)0.05 mol·L-1 (3)1∶4 (4)10
[思维建模] 溶液pH计算的一般思维模型
逐点清(三) 强酸(碱)与弱酸(碱)的比较
1.一元强酸(HCl)与一元弱酸(CH3COOH)的比较
(1)相同浓度、相同体积的盐酸与醋酸溶液的比较
(2)相同pH、相同体积的盐酸与醋酸溶液的比较
2.一元强酸(HCl)与一元弱酸(CH3COOH)稀释图像比较
(1)相同体积、相同浓度的盐酸、醋酸
加水稀释相同的倍数,醋酸的pH大
加水稀释到相同的pH,盐酸加入的水多
(2)相同体积、相同pH的盐酸、醋酸
加水稀释相同的倍数,盐酸的pH大
加水稀释到相同的pH,醋酸加入的水多
[题点考法·全面练通]
题点(一) 弱电解质的判断
1.下列事实中一定不能证明CH3COOH是弱酸的是 ( )
①常温下某CH3COONa溶液的pH=8
②用CH3COOH溶液做导电实验,灯泡很暗
③等pH等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多
④pH=1的CH3COOH溶液和pH=13的KOH溶液等体积混合,溶液呈酸性
⑤CH3COONa和稀H3PO4反应,生成CH3COOH
⑥pH=1的CH3COOH溶液稀释至100倍,pH<3
⑦10 mL 0.1 mol·L-1 CH3COOH恰好与10 mL 0.1 mol·L-1 NaOH溶液完全反应
A.②⑦ B.②⑤ C.①③⑤ D.②④⑤⑥
解析:①说明溶液水解呈碱性,应为强碱弱酸盐,可证明CH3COOH是弱酸;②只能说明溶液离子浓度较小;③说明醋酸还可电离出氢离子,可证明CH3COOH是弱酸;④说明醋酸有剩余,即醋酸没有完全电离,可以证明CH3COOH是弱酸;⑤说明醋酸的酸性比磷酸弱,而磷酸为中强酸,则醋酸为弱酸;⑥说明存在电离平衡,证明CH3COOH是弱酸;⑦只能说明一元酸碱恰好反应,不能说明醋酸是弱酸。
答案:A
2.(2021·浙江选考)某同学拟用pH计测定溶液pH以探究某酸HR是否为弱电解质。下列说法正确的是 ( )
A.25 ℃时,若测得0.01 mol·L-1NaR溶液pH=7,则HR是弱酸
B.25 ℃时,若测得0.01 mol·L-1HR溶液pH>2且pH<7,则HR是弱酸
C.25 ℃时,若测得HR溶液pH=a,取该溶液10.0 mL,加蒸馏水稀释至100.0 mL,测得pH=b,b-a<1,则HR是弱酸
D.25 ℃时,若测得NaR溶液pH=a,取该溶液10.0 mL,升温至50 ℃,测得pH=b,a>b,则HR是弱酸
解析:由题意知NaR为强酸强碱盐,则HR为强酸,A错误;可知溶液中c(H+)<0.01 mol·L-1,所以HR为弱酸,B正确;假设HR为强酸,取pH=6的该溶液10.0 mL,加蒸馏水稀释至100.0 mL,测得此时溶液pH<7,C错误;假设HR为强酸,则NaR为强酸强碱盐,溶液呈中性,升温至50 ℃,促进水的电离,水的离子积常数增大,pH减小,D错误。
答案:B
A.酸性:HA>HB
B.a点对应的溶液中:c(HA)=0.1 mol·L-1,c(H+)=0.01 mol·L-1
C.T ℃时,弱酸HB的pKa≈5
D.弱酸的Ka随溶液浓度的降低而增大
解析:从图中得到,浓度相等的时候,HB溶液的pH更高,说明HB的酸性更弱,A项错误;
a点溶液的纵坐标为4,即溶液的pH为2,所以c(H+)=0.01 mol·L-1,a点溶液的横坐标为-1,即lg c(HA)=-1,所以c(HA)=0.1 mol·L-1,B项正确;
Ka是电离常数,其数值只与温度有关,温度不变,Ka不变,D项正确。
答案:D
解析:由Ka(HNO2)>Ka(CH3COOH)可知,酸性HNO2>CH3COOH。A错:
pH相同的两种酸稀释相同倍数时,酸性强的酸pH变化大,所以曲线 Ⅱ 为HNO2。B错:
b、c两点处,b点酸性强,对水的电离抑制程度大,所以水的电离程度:c点>b点。C对:
答案:C
谢
谢
观
看
第1讲 电离平衡和溶液的酸碱性(基础落实课)
逐点清(一) 弱电解质的电离及电离常数
(一)弱电解质的电离平衡
1.电离平衡的建立
在一定条件下(如温度、压强等),当弱电解质分子电离成离子的速率和离子结合成弱电解质分子的速率相等时,电离过程达到了平衡。电离平衡建立过程如图所示:
2.电离平衡的特征
温度 温度升高,电离平衡_____移动,电离程度_____
浓度 稀释溶液,电离平衡_____移动,电离程度_____
同离子效应 加入与弱电解质具有相同离子的强电解质,电离平衡_____移动,电离程度_____
加入能反应的物质 电离平衡_____移动,电离程度_____
3.电离平衡的外界影响因素
向右
增大
向右
增大
向左
减小
向右
增大
[注意] ①溶液中加水和加弱电解质,电离平衡均向电离方向移动,但溶液越稀,离子结合成分子的机会越少,电离程度越大。
②电离平衡向右移动,电解质的分子浓度不一定减小,电解质的离子浓度也可能减小。
(二)电离平衡常数
1.定义:一定温度下,对一元弱酸或一元弱碱来说,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之比是一个常数,这个常数叫做电离平衡常数,用K(弱酸用Ka,弱碱用Kb)表示。
2.表达式
3.特点
(1)电离平衡常数与温度有关,与浓度无关,升高温度,K值增大。
(2)电离平衡常数反映弱电解质的相对强弱,K越大,表示弱电解质越易电离,酸性或碱性越强。
(3)多元弱酸的各级电离常数的大小关系是K1 K2 K3……,故其酸性取决于第一步电离。
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)弱酸的电离程度越大,溶液的导电能力越强 ( )
(2)氨水的浓度越小,一水合氨的电离程度越大 ( )
(3)CH3COOH溶液加水稀释,电离平衡右移,c(H+)增大 ( )
×
√
×
×
×
×
2.在某温度时,溶质的物质的量浓度为0.20 mol·L-1的氨水中,达到电离平衡时,已电离的NH3·H2O为1.7×10-3 mol·L-1。试计算该温度下NH3·H2O的电离常数(Kb)为___________________________。
答案:1.4×10-5
[题点考法·全面练通]
题点(一) 弱电解质的电离和影响因素
1. 常温下,对于0.1 mol·L-1的醋酸溶液,下列说法正确的是 ( )
A.加水稀释后,溶液中c(H+)和c(OH-)都减小
B.加入少量冰醋酸后,溶液中c(H+)增大
C.加入少量Na2CO3固体,醋酸电离平衡向左移动
D.适当升高温度,醋酸的电离平衡常数减小
解析:加水稀释醋酸,促进醋酸电离,但醋酸增大的电离程度小于溶液体积增大程度,所以溶液中氢离子浓度减小,温度不变,水的离子积常数不变,导致溶液中氢氧根离子浓度增大,故A错误;
适当升高温度,促进醋酸的电离,醋酸的电离平衡常数增大,故D错误。
答案:B
解析:湿润pH试纸,相当于加水稀释,从图像来看,导电能力加强,c(H+)增大,pH减小。
答案:C
加水稀释,电离平衡正向移动,OH-的物质的量增大,B错误;
答案:D
CH3COOH HClO H2CO3
Ka=1.8×10-5 Ka=3.0×10-8 Ka1=4.3×10-7
Ka2=5.6×10-11
温度恒定则式子的值恒定,C项正确;CH3COOH的酸性强于HClO,故稀释相同pH的两种酸溶液,CH3COOH溶液的pH变化更大,即曲线Ⅰ代表稀释CH3COOH的稀溶液,曲线Ⅱ代表稀释HClO的稀溶液,a点pH大于b点,即c(H+)a<c(H+)b,而CH3COOH酸性又强于HClO,故图像中a点酸的总浓度小于b点酸的总浓度,D项错误。
答案:C
(3)常温下,将a mol·L-1 CH3COONa溶于水配成溶液,向其中滴加等体积的b mol·L-1的盐酸使溶液呈中性(不考虑盐酸和醋酸的挥发),用含a和b的代数式表示醋酸的电离常数Ka=_______。
答案:(1)10-1.2 (2)10-4.2 (3)1 000
1×10-7
2.水的离子积常数
3.水的电离平衡影响因素的定性判断
项目 平衡移动 溶液中c(H+) 溶液中c(OH-) pH 溶液的酸碱性 Kw
升高温度 右移 增大 增大 减小 中性 增大
加入酸碱 加酸 左移
加碱 左移
增大
减小
减小
酸性
不变
减小
增大
增大
碱性
不变
加入盐 Na2CO3 右移 ______ _____ ______ ______ _____
NH4Cl 右移 ______ _____ ______ ______ _____
加入金属Na 右移 ______ _____ ______ ______ _____
减小
增大
增大
碱性
不变
增大
减小
减小
酸性
不变
减小
增大
增大
碱性
不变
续表
(二)溶液的酸碱性和pH
1.溶液的酸碱性
溶液的酸碱性取决于溶液中c(H+)和c(OH-)的相对大小 酸性溶液 c(H+)___ c(OH-),常温下,pH___7
中性溶液 c(H+)___ c(OH-),常温下,pH___7
碱性溶液 c(H+)___ c(OH-),常温下,pH___7
>
<
=
=
<
>
2.溶液的pH
(1)定义式:pH=_____________。
(2)溶液的酸碱性跟pH的关系(室温下):
-lg c(H+)
(3)pH适用范围:pH的取值范围为0~14,即只适用于c(H+)和c(OH-)都较小的稀溶液(<1 mol·L-1)。
3.pH的测定
用pH试纸测定 使用方法:把一小片试纸放在表面皿上,用玻璃棒蘸取待测液点在干燥的pH试纸上,试纸变色后,与标准比色卡对比,即可确定溶液的pH
注意事项:pH试纸使用前不能用蒸馏水润湿,否则待测液因被稀释可能产生误差。广泛pH试纸只能测出整数值
用pH计测定 可精确测定溶液的pH
4.溶液pH的有关计算
(1)单一溶液的pH计算
(2)混合溶液的pH计算
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)水的电离平衡常数与水的离子积相等 ( )
(2)100 ℃的纯水中c(H+)=1×10-6 mol·L-1,此时水呈酸性 ( )
(3)水溶液中存在Kw=c(H+)·c(OH-),该式中c(H+)、c(OH-)一定是水电离出的 ( )
(4)25 ℃,pH=3的盐酸、NH4Cl溶液中,水电离出的c(H+)前者小 ( )
(5)纯水中c(H+)随着温度的升高而降低 ( )
×
×
×
√
×
(6)25 ℃时,0.10 mol·L-1 NaHCO3溶液加水稀释后,c(H+)与c(OH-)的乘积变大 ( )
(7)在蒸馏水中滴加浓H2SO4,Kw不变 ( )
(8)向水中加入少量硫酸氢钠固体,促进了水的电离,c(H+)增大,Kw不变 ( )
(9)向水中加入AlCl3溶液对水的电离不产生影响 ( )
(10)用湿润的pH试纸测溶液的pH一定有误差 ( )
(11)用广泛pH试纸测某溶液的pH为3.5 ( )
×
×
×
×
×
×
2.25 ℃的下列溶液中,碱性最强的是 ( )
A.pH=11的溶液
B.c(OH-)=0.12 mol·L-1
C.1 L中含有4 g NaOH的溶液
D.c(H+)=1×10-10 mol·L-1的溶液
解析:常温下,可以根据pH或c(H+)比较溶液的酸碱性,同样也可以根据c(OH-)的大小来比较。A、C、D三个选项中溶液的c(OH-)依次为 1×10-3 mol·L-1、0.1 mol·L-1、1×10-4 mol·L-1,所以B中溶液的c(OH-)最大,碱性最强。
答案:B
解析:向水中通入NH3,c(OH-)增大,平衡左移,A正确;向水中加入少量稀硫酸,c(H+)增大,但温度不变,Kw不变,B正确;将水加热,水的电离平衡正向移动,Kw变大,C正确;升高温度,能促进水的电离,c(H+)增大,pH减小,D错误。
答案:D
2.一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是 ( )
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-14
C.该温度下,加入FeCl3可能引起由a向b的变化
D.该温度下,稀释溶液可能引起由c向d的变化
解析: A项,c点溶液中c(OH-)>c(H+),溶液呈碱性,升温,溶液中c(OH-)不可能减小,错误。
B项,由b点对应c(H+)与c(OH-)可知,Kw=c(H+)·c(OH-)=1.0×
10-7×1.0×10-7=1.0×10-14,正确。
C项,FeCl3溶液水解显酸性,溶液中c(H+)增大,因一定温度下水的离子积是常数,故溶液中c(OH-)减小,因此加入FeCl3溶液可能引起由b向a的变化,错误。
D项,c点溶液呈碱性,稀释时c(OH-)减小,同时c(H+)应增大,故稀释溶液时不可能引起由c向d的转化,错误。
答案:B
3.某温度下,纯水中的c(H+)=2×10-7 mol·L-1,则此时c(OH-)=_____________。若温度不变,滴入稀H2SO4使c(H+)=5×10-6 mol·L-1,则c(OH-)=_____________,由水电离出的c(H+)为_____________。
答案:2×10-7 mol·L-1 8×10-9 mol·L-1 8×10-9 mol·L-1
答案:B
5.现有室温下四种溶液,有关叙述不正确的是 ( )
A.③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B.②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C.分别加水稀释10倍,四种溶液的pH:①>②>④>③
D.V1 L ④与V2 L ①混合,若混合后溶液pH=7,则V1<V2
序号 ① ② ③ ④
pH 11 11 3 3
溶液 氨水 氢氧化钠溶液 醋酸 盐酸
解析:当V1 L ④与V2 L ①混合,因氨水浓度远大于盐酸,若pH=7,则V1>V2。
答案:D
[思维建模] 溶液混合后酸碱性的判断方法
(1)等浓度等体积的一元酸与一元碱混合的溶液——“谁强显谁性,同强显中性”。
(2)室温下c酸(H+)=c碱(OH-),即pH之和等于14时,一强一弱等体积混合——“谁弱谁过量,谁弱显谁性”。
(3)室温下,已知酸和碱pH之和的溶液等体积混合酸碱性分析(两强混合)
①若pH之和等于14,则混合后溶液显中性,pH=7。
②若pH之和大于14,则混合后溶液显碱性,pH>7。
③若pH之和小于14,则混合后溶液显酸性,pH<7。
题点(三) 溶液pH计算
6.常温下,下列叙述正确的是 ( )
A.将pH=a的氨水稀释10倍后,其pH=b,则a=b+1
B.将pH=3.0的盐酸稀释105倍后,溶液的pH=8.0
C.将pH=9.0的NaOH溶液与pH=11.0的NaOH溶液等体积混合,所得溶液的pH=10.7
D.若将1 mL pH=1.0的盐酸与100 mL NaOH溶液混合后,溶液的pH=7.0,则NaOH溶液的pH=10.0
解析:一水合氨为弱电解质,加水稀释,促进其电离,溶液pH变化比强碱的小,故将pH=a的氨水稀释10倍后,其pH=b,则a
设NaOH溶液的pH=b,两溶液混合后溶液的pH=7.0,则1×10-3 L×10-1 mol·L-1=100×10-3 L×10b-14 mol·L-1,解得b=11.0,D项叙述错误。
答案:C
答案:(1)1∶10 (2)0.05 mol·L-1 (3)1∶4 (4)10
[思维建模] 溶液pH计算的一般思维模型
逐点清(三) 强酸(碱)与弱酸(碱)的比较
1.一元强酸(HCl)与一元弱酸(CH3COOH)的比较
(1)相同浓度、相同体积的盐酸与醋酸溶液的比较
(2)相同pH、相同体积的盐酸与醋酸溶液的比较
2.一元强酸(HCl)与一元弱酸(CH3COOH)稀释图像比较
(1)相同体积、相同浓度的盐酸、醋酸
加水稀释相同的倍数,醋酸的pH大
加水稀释到相同的pH,盐酸加入的水多
(2)相同体积、相同pH的盐酸、醋酸
加水稀释相同的倍数,盐酸的pH大
加水稀释到相同的pH,醋酸加入的水多
[题点考法·全面练通]
题点(一) 弱电解质的判断
1.下列事实中一定不能证明CH3COOH是弱酸的是 ( )
①常温下某CH3COONa溶液的pH=8
②用CH3COOH溶液做导电实验,灯泡很暗
③等pH等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多
④pH=1的CH3COOH溶液和pH=13的KOH溶液等体积混合,溶液呈酸性
⑤CH3COONa和稀H3PO4反应,生成CH3COOH
⑥pH=1的CH3COOH溶液稀释至100倍,pH<3
⑦10 mL 0.1 mol·L-1 CH3COOH恰好与10 mL 0.1 mol·L-1 NaOH溶液完全反应
A.②⑦ B.②⑤ C.①③⑤ D.②④⑤⑥
解析:①说明溶液水解呈碱性,应为强碱弱酸盐,可证明CH3COOH是弱酸;②只能说明溶液离子浓度较小;③说明醋酸还可电离出氢离子,可证明CH3COOH是弱酸;④说明醋酸有剩余,即醋酸没有完全电离,可以证明CH3COOH是弱酸;⑤说明醋酸的酸性比磷酸弱,而磷酸为中强酸,则醋酸为弱酸;⑥说明存在电离平衡,证明CH3COOH是弱酸;⑦只能说明一元酸碱恰好反应,不能说明醋酸是弱酸。
答案:A
2.(2021·浙江选考)某同学拟用pH计测定溶液pH以探究某酸HR是否为弱电解质。下列说法正确的是 ( )
A.25 ℃时,若测得0.01 mol·L-1NaR溶液pH=7,则HR是弱酸
B.25 ℃时,若测得0.01 mol·L-1HR溶液pH>2且pH<7,则HR是弱酸
C.25 ℃时,若测得HR溶液pH=a,取该溶液10.0 mL,加蒸馏水稀释至100.0 mL,测得pH=b,b-a<1,则HR是弱酸
D.25 ℃时,若测得NaR溶液pH=a,取该溶液10.0 mL,升温至50 ℃,测得pH=b,a>b,则HR是弱酸
解析:由题意知NaR为强酸强碱盐,则HR为强酸,A错误;可知溶液中c(H+)<0.01 mol·L-1,所以HR为弱酸,B正确;假设HR为强酸,取pH=6的该溶液10.0 mL,加蒸馏水稀释至100.0 mL,测得此时溶液pH<7,C错误;假设HR为强酸,则NaR为强酸强碱盐,溶液呈中性,升温至50 ℃,促进水的电离,水的离子积常数增大,pH减小,D错误。
答案:B
A.酸性:HA>HB
B.a点对应的溶液中:c(HA)=0.1 mol·L-1,c(H+)=0.01 mol·L-1
C.T ℃时,弱酸HB的pKa≈5
D.弱酸的Ka随溶液浓度的降低而增大
解析:从图中得到,浓度相等的时候,HB溶液的pH更高,说明HB的酸性更弱,A项错误;
a点溶液的纵坐标为4,即溶液的pH为2,所以c(H+)=0.01 mol·L-1,a点溶液的横坐标为-1,即lg c(HA)=-1,所以c(HA)=0.1 mol·L-1,B项正确;
Ka是电离常数,其数值只与温度有关,温度不变,Ka不变,D项正确。
答案:D
解析:由Ka(HNO2)>Ka(CH3COOH)可知,酸性HNO2>CH3COOH。A错:
pH相同的两种酸稀释相同倍数时,酸性强的酸pH变化大,所以曲线 Ⅱ 为HNO2。B错:
b、c两点处,b点酸性强,对水的电离抑制程度大,所以水的电离程度:c点>b点。C对:
答案:C
谢
谢
观
看
同课章节目录
