化学人教版(2019)选择性必修1 2.4化学反应的调控 课件(共16张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 2.4化学反应的调控 课件(共16张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-17 21:41:05 | ||
图片预览





文档简介
(共16张PPT)
C
下列说法中正确的是( )
A.能自发进行的反应一定能迅速发生反应
B.非自发进行的反应一定不可能发生反应
C.能自发进行的反应实际可能没有发生反应
D.常温下,2H2O = 2H2 +O2↑,即常温下水的分解反应是自发反应
电解
↑
课
前
检
查
G = H – T S<0 自发反应
复合判据?
工业生产需要考虑的问题
速率
产率
经济
成本
设备
条件
安全条件
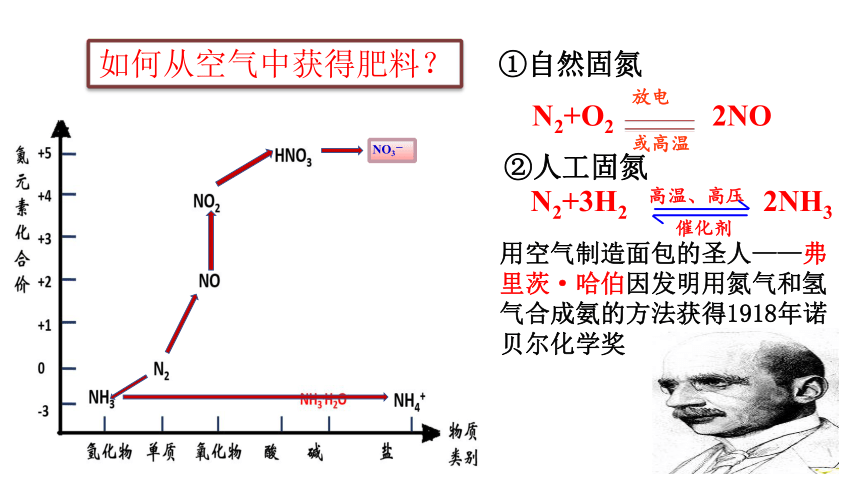
①自然固氮
②人工固氮
N2+3H2 2NH3
高温、高压
催化剂
NO3-
用空气制造面包的圣人——弗里茨·哈伯因发明用氮气和氢气合成氨的方法获得1918年诺贝尔化学奖
如何从空气中获得肥料?
N2+O2 2NO
放电
或高温
第四节 化学反应的调控
第二章 化学反应速率与化学平衡
教
学
目
标
认识化学反应速率和化学平衡的综合调控在生产、生活和科学研究中的重要意义,能讨论化学反应条件的选择和优化。
2. 能从限度、速率等角度对化学反应和化工生产条件
进行综合分析。
一、合成氨反应条件的原理分析
1.反应原理:
2.反应特点:
【课本P46思考与讨论】
①可逆反应;
②气体体积减小的放热反应;
③熵减小反应。
N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ mol-1 S=-198.2J K-1 mol-1
请根据反应的焓变和熵变分析在298K时合成氨反应能否正向自发进行?
△G = △H-T△S = -33.34 kJ·mol-1<0,可以自发进行
3、反应条件的选择
对合成氨反应的影响 影响因素 浓度 温度 压强 催化剂
增大合成氨的反应速率
提高平衡混合物中氨的含量
增大反应物浓度
增大反应物浓度
升高温度
降低温度
增大压强
增大压强
使用催化剂
无影响
增大合成氨的反应速率、提高平衡混合物中氨的含量
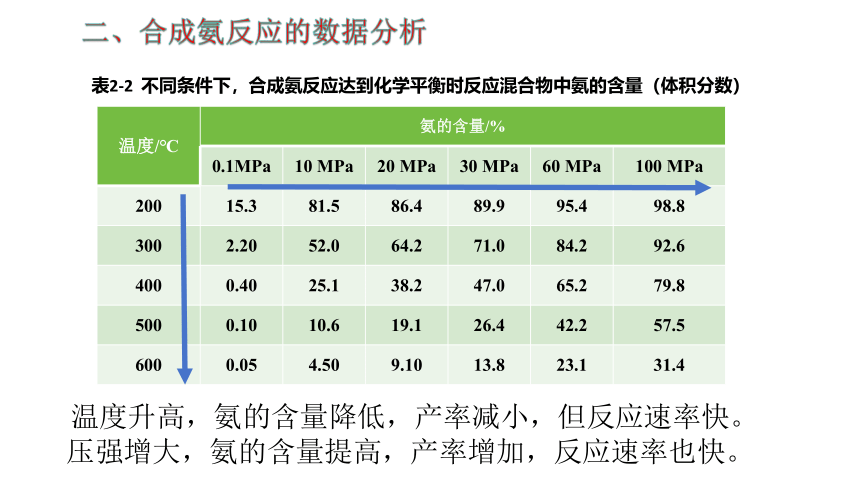
温度/℃ 氨的含量/% 0.1MPa 10 MPa 20 MPa 30 MPa 60 MPa 100 MPa
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.20 52.0 64.2 71.0 84.2 92.6
400 0.40 25.1 38.2 47.0 65.2 79.8
500 0.10 10.6 19.1 26.4 42.2 57.5
600 0.05 4.50 9.10 13.8 23.1 31.4
二、合成氨反应的数据分析
温度升高,氨的含量降低,产率减小,但反应速率快。
压强增大,氨的含量提高,产率增加,反应速率也快。
表2-2 不同条件下,合成氨反应达到化学平衡时反应混合物中氨的含量(体积分数)
三、合成氨反应条件的控制
1、压强
但是对材料的强度和设备的
制造要求也越高,
需要的动力也越大,
这将会大大增加生产投资,
并可能降低综合经济效益。
目前,我国的合成氨厂
一般采用的压强为10~30MPa
压强越大,速率、转化率都大
综合分析
2、温度
综合分析
低温能提高平衡转化率,但速率慢,到达平衡时间长,经济效益差,
高温温能提高速率,但转化率小,且催化剂在500 ℃时活性最大
目前,一般采用的温度为400 ~ 500 ℃
3、催化剂
催化剂,改变反应历程,降低反应的活化能,使反应物在较低温度时能较快地进行反应。
弗里茨·哈伯:锇或用铀—碳化铀作催化剂
锇:效果好,但储量极少且锇蒸汽有剧毒。
铀:价格昂贵 ,性质过于敏感
卡尔 ·博施:寻找廉价、安全、稳定的催化剂。
6500次试验,2500种不同配方,最终选用活化温度500℃左右的含铅镁促进剂的铁触媒。
②为防止混有的杂质使催化剂“中毒”(催化剂因吸附或沉积而使催化剂活性降低或丧失的过程),原料气必须经过净化。
【注意】
①催化剂铁触媒在500 ℃左右时的活性最大。
哈伯
(1918年)
合成氨的基础开发工作
合成氨与三次诺贝尔化学奖
博施
(1931年)
实现了合成氨的工业化
埃特尔
(2007年)
揭开了合成氨的“天机”
“合成氨”里的中国人:2016年中科院大连化学物理研究所研究团队研制合成了一种新型催化剂,将合成氨的温度、压强分别降到了350 ℃、1 MPa 。
更加节能、降低成本
科学 技术 社会
4、浓度
图:NH3的平衡体积分数随投料比变化的曲线
①从化学平衡的角度分析,在氮气和氢气的物质的量比为1:3时,平衡转化率最大,但是实验测得适当提高N2的浓度,即N2和H2的物质的量比为1:2.8时,更能促进氨的合成。
②不断地补充反应物或者及时的分离生成物有利于工业生产
a、迅速冷却氨气成液态并及时分离
b 、将氨分离后的原料气循环使用,并及时补充氮气和氢气,
使反应物保持一定的浓度。
由表2-2可以看出,即使在500℃和30MPa时,合成氨平衡混合物中氨的体积分数仍不高,只有26.4%。
【小结】合成氨常用的生产条件:
使用催化剂
温度:400~500 ℃
压强: 10 MPa~30 MPa
将氨及时分离出来,原料气循环使用
合成氨工业流程
(1)从理论上分析,为了使SO2尽可能多转化为SO3,应选择的条件是_____
(2)在实际生产中,选定的温度为400~500℃,原因是_________
(3)在实际生产中,采用的压强为常压,原因是__________
(4)在实际生产中,通入过量空气,原因是__________
(5)尾气中的SO2必须回收,原因是__________
在硫酸工业中,通过下列反应使SO2氧化成SO3:
2SO2(g)+O2(g) 2SO3(g) △H=-196.6kJ/mol。
下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
温度/℃ 平衡时SO2的转化率/% 0.1MPa 0.5MPa 1MPa 5MPa 10MPa
450 97.5 98.9 99.2 99.6 99.7
550 85.6 92.9 94.9 97.7 98.3
课
堂
练
习
(3)因为在常压下,400~500℃时,SO2的转化率已经很高了,若再加压
对设备及动力系统要求高,加大了成本和能量消耗,不适宜。
(4)增大氧气的浓度,使平衡向生成SO3的方向移动,提高SO2的转化率。
(5)减少对环境的污染。
(1)低温、高压
(2)该温度是催化剂的活性温度,选择此温度可提高反应速率,缩短反应
达到平衡所需要的时间。
答案
(2)原理分析。根据反应特点,利用影响反应速率的因素和勒夏特列原理分
析增大反应速率、提高原料转化率的反应条件。
(1)分析反应特点。主要分析反应的方向性、可逆性、反应热和熵变等。
(4)根据工业生产的实际情况、经济效益及环保要求等最终确定适宜的条件。
(3)根据实验数据进一步分析反应条件,确定适宜条件的范围及催化剂的
筛选。
选择合适的反应条件思维流程
课
堂
小
结
C
下列说法中正确的是( )
A.能自发进行的反应一定能迅速发生反应
B.非自发进行的反应一定不可能发生反应
C.能自发进行的反应实际可能没有发生反应
D.常温下,2H2O = 2H2 +O2↑,即常温下水的分解反应是自发反应
电解
↑
课
前
检
查
G = H – T S<0 自发反应
复合判据?
工业生产需要考虑的问题
速率
产率
经济
成本
设备
条件
安全条件
①自然固氮
②人工固氮
N2+3H2 2NH3
高温、高压
催化剂
NO3-
用空气制造面包的圣人——弗里茨·哈伯因发明用氮气和氢气合成氨的方法获得1918年诺贝尔化学奖
如何从空气中获得肥料?
N2+O2 2NO
放电
或高温
第四节 化学反应的调控
第二章 化学反应速率与化学平衡
教
学
目
标
认识化学反应速率和化学平衡的综合调控在生产、生活和科学研究中的重要意义,能讨论化学反应条件的选择和优化。
2. 能从限度、速率等角度对化学反应和化工生产条件
进行综合分析。
一、合成氨反应条件的原理分析
1.反应原理:
2.反应特点:
【课本P46思考与讨论】
①可逆反应;
②气体体积减小的放热反应;
③熵减小反应。
N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ mol-1 S=-198.2J K-1 mol-1
请根据反应的焓变和熵变分析在298K时合成氨反应能否正向自发进行?
△G = △H-T△S = -33.34 kJ·mol-1<0,可以自发进行
3、反应条件的选择
对合成氨反应的影响 影响因素 浓度 温度 压强 催化剂
增大合成氨的反应速率
提高平衡混合物中氨的含量
增大反应物浓度
增大反应物浓度
升高温度
降低温度
增大压强
增大压强
使用催化剂
无影响
增大合成氨的反应速率、提高平衡混合物中氨的含量
温度/℃ 氨的含量/% 0.1MPa 10 MPa 20 MPa 30 MPa 60 MPa 100 MPa
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.20 52.0 64.2 71.0 84.2 92.6
400 0.40 25.1 38.2 47.0 65.2 79.8
500 0.10 10.6 19.1 26.4 42.2 57.5
600 0.05 4.50 9.10 13.8 23.1 31.4
二、合成氨反应的数据分析
温度升高,氨的含量降低,产率减小,但反应速率快。
压强增大,氨的含量提高,产率增加,反应速率也快。
表2-2 不同条件下,合成氨反应达到化学平衡时反应混合物中氨的含量(体积分数)
三、合成氨反应条件的控制
1、压强
但是对材料的强度和设备的
制造要求也越高,
需要的动力也越大,
这将会大大增加生产投资,
并可能降低综合经济效益。
目前,我国的合成氨厂
一般采用的压强为10~30MPa
压强越大,速率、转化率都大
综合分析
2、温度
综合分析
低温能提高平衡转化率,但速率慢,到达平衡时间长,经济效益差,
高温温能提高速率,但转化率小,且催化剂在500 ℃时活性最大
目前,一般采用的温度为400 ~ 500 ℃
3、催化剂
催化剂,改变反应历程,降低反应的活化能,使反应物在较低温度时能较快地进行反应。
弗里茨·哈伯:锇或用铀—碳化铀作催化剂
锇:效果好,但储量极少且锇蒸汽有剧毒。
铀:价格昂贵 ,性质过于敏感
卡尔 ·博施:寻找廉价、安全、稳定的催化剂。
6500次试验,2500种不同配方,最终选用活化温度500℃左右的含铅镁促进剂的铁触媒。
②为防止混有的杂质使催化剂“中毒”(催化剂因吸附或沉积而使催化剂活性降低或丧失的过程),原料气必须经过净化。
【注意】
①催化剂铁触媒在500 ℃左右时的活性最大。
哈伯
(1918年)
合成氨的基础开发工作
合成氨与三次诺贝尔化学奖
博施
(1931年)
实现了合成氨的工业化
埃特尔
(2007年)
揭开了合成氨的“天机”
“合成氨”里的中国人:2016年中科院大连化学物理研究所研究团队研制合成了一种新型催化剂,将合成氨的温度、压强分别降到了350 ℃、1 MPa 。
更加节能、降低成本
科学 技术 社会
4、浓度
图:NH3的平衡体积分数随投料比变化的曲线
①从化学平衡的角度分析,在氮气和氢气的物质的量比为1:3时,平衡转化率最大,但是实验测得适当提高N2的浓度,即N2和H2的物质的量比为1:2.8时,更能促进氨的合成。
②不断地补充反应物或者及时的分离生成物有利于工业生产
a、迅速冷却氨气成液态并及时分离
b 、将氨分离后的原料气循环使用,并及时补充氮气和氢气,
使反应物保持一定的浓度。
由表2-2可以看出,即使在500℃和30MPa时,合成氨平衡混合物中氨的体积分数仍不高,只有26.4%。
【小结】合成氨常用的生产条件:
使用催化剂
温度:400~500 ℃
压强: 10 MPa~30 MPa
将氨及时分离出来,原料气循环使用
合成氨工业流程
(1)从理论上分析,为了使SO2尽可能多转化为SO3,应选择的条件是_____
(2)在实际生产中,选定的温度为400~500℃,原因是_________
(3)在实际生产中,采用的压强为常压,原因是__________
(4)在实际生产中,通入过量空气,原因是__________
(5)尾气中的SO2必须回收,原因是__________
在硫酸工业中,通过下列反应使SO2氧化成SO3:
2SO2(g)+O2(g) 2SO3(g) △H=-196.6kJ/mol。
下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
温度/℃ 平衡时SO2的转化率/% 0.1MPa 0.5MPa 1MPa 5MPa 10MPa
450 97.5 98.9 99.2 99.6 99.7
550 85.6 92.9 94.9 97.7 98.3
课
堂
练
习
(3)因为在常压下,400~500℃时,SO2的转化率已经很高了,若再加压
对设备及动力系统要求高,加大了成本和能量消耗,不适宜。
(4)增大氧气的浓度,使平衡向生成SO3的方向移动,提高SO2的转化率。
(5)减少对环境的污染。
(1)低温、高压
(2)该温度是催化剂的活性温度,选择此温度可提高反应速率,缩短反应
达到平衡所需要的时间。
答案
(2)原理分析。根据反应特点,利用影响反应速率的因素和勒夏特列原理分
析增大反应速率、提高原料转化率的反应条件。
(1)分析反应特点。主要分析反应的方向性、可逆性、反应热和熵变等。
(4)根据工业生产的实际情况、经济效益及环保要求等最终确定适宜的条件。
(3)根据实验数据进一步分析反应条件,确定适宜条件的范围及催化剂的
筛选。
选择合适的反应条件思维流程
课
堂
小
结
