2024届高考一轮复习 第十章 化学实验 第2讲 物质的检验、分离与提纯 课件(共46张PPT)
文档属性
| 名称 | 2024届高考一轮复习 第十章 化学实验 第2讲 物质的检验、分离与提纯 课件(共46张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 955.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-17 22:01:11 | ||
图片预览








文档简介
(共46张PPT)
第2讲 物质的检验、分离与提纯(基础落实课)
逐点清(一) 物质的检验与鉴别
(一)常见离子的检验
1.常见阳离子检验
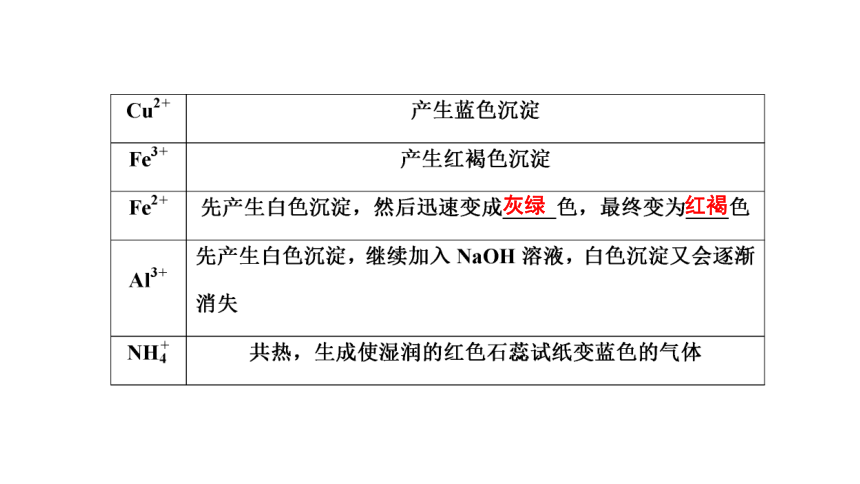
(1)用常规检验法
灰绿
红褐
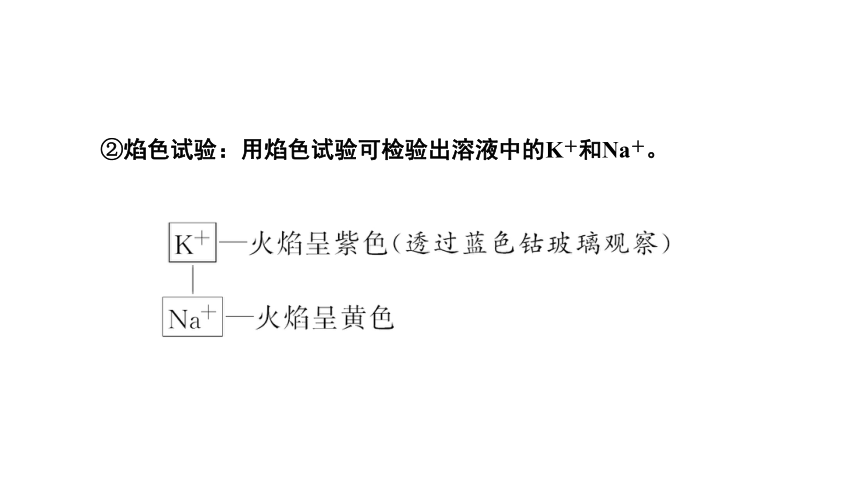
②焰色试验:用焰色试验可检验出溶液中的K+和Na+。
(2)特殊检验法
[注意] ①检验Fe2+和Fe3+时一般应用特殊检验法。
②注意不能利用酸性KMnO4溶液检验FeCl2溶液中的Fe2+,因为KMnO4(H+)会氧化Fe2+也会氧化Cl-。
Fe3+ 加入KSCN溶液呈红色
Fe2+ 加入KSCN溶液无现象,滴加新制氯水后溶液呈红色;或加入K3[Fe(CN)6](铁氰化钾)溶液,产生带有特征蓝色的铁氰化亚铁Fe3[Fe(CN)6]2沉淀
2.常见阴离子检验
(1)利用酸碱指示剂检验
(2)利用盐酸和其他试剂检验
无色无味
刺激性
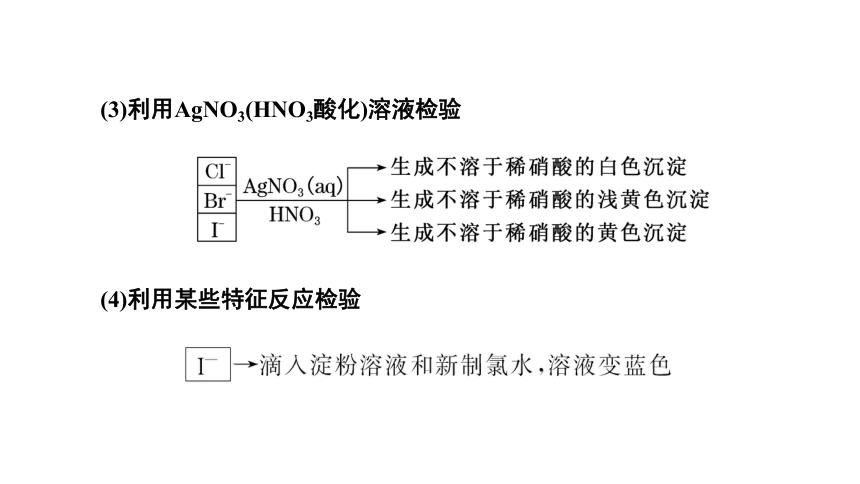
(3)利用AgNO3(HNO3酸化)溶液检验
(4)利用某些特征反应检验
(二)常见气体的检验
1.可燃性气体的检验
CO 火焰呈蓝色,产物只有二氧化碳
CH4 火焰呈淡蓝色,产物有二氧化碳和水
H2 火焰呈淡蓝色,产物只有水
CH2==CH2 火焰明亮,有黑烟
可使溴水及酸性高锰酸钾溶液褪色
通常情况下,检验可燃性气体之前要进行验纯 2.酸性气体的检验
CO2 无色无味气体通入澄清石灰水,澄清石灰水________________
SO2 通入品红溶液,红色褪去,再加热又________
HCl ①可使湿润的蓝色石蕊试纸(或湿润的pH试纸)变红;②可使蘸有浓氨水的玻璃棒产生白烟;③通入用硝酸酸化的硝酸银溶液产生白色沉淀
先变浑浊后变澄清
出现红色
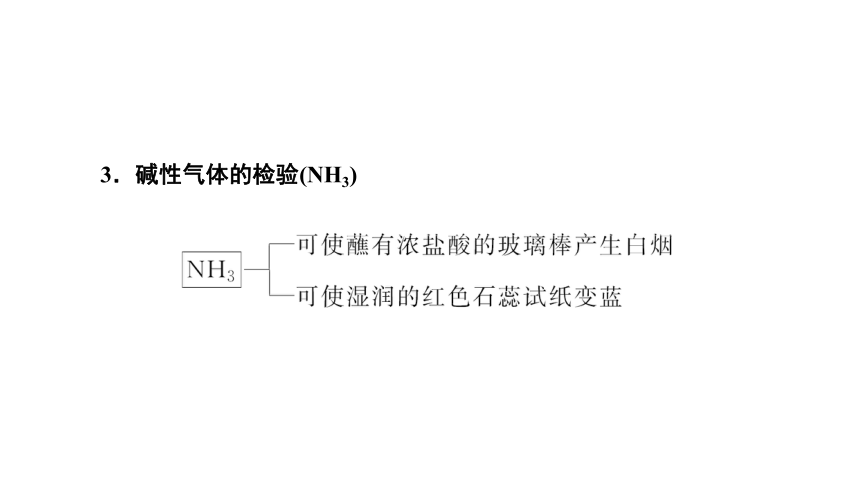
3.碱性气体的检验(NH3)
4.还原性气体的检验
H2 通过灼热氧化铜,固体由黑色变为红色,气体通过无水硫酸铜,粉末变蓝
CO 通过灼热氧化铜,固体由黑色变为红色,气体通过澄清石灰水,溶液________
NO 与O2(或空气)反应,气体由无色变为_______
变浑浊
红棕色
5.氧化性气体的检验
O2 可使带火星的木条复燃
Cl2 ①黄绿色、有刺激性气味;②可使湿润的有色布条褪色;③可使湿润的淀粉-KI试纸变蓝
NO2 ①红棕色、有刺激性气味;②溶于水,溶液无色但能使紫色石蕊溶液_____;③可使湿润的淀粉-KI试纸_____
变红
变蓝
(三)物质的鉴别
1.限用一种试剂的物质鉴别方法
(1)先分析被鉴别物质的水溶性、密度、溶液的酸碱性,确定能否选用水或指示剂进行鉴别。
(2)在鉴别多种酸、碱、盐的溶液时,可依据“相反原理”确定试剂进行鉴别。即被鉴别的溶液多数呈酸性时,可选用碱或水解呈碱性的盐溶液作试剂;若被鉴别的溶液多数呈碱性时,可选用酸或水解呈酸性的盐溶液作试剂。
(3)常用溴水、新制氢氧化铜悬浊液等作试剂鉴别多种有机物。
2.不另加试剂鉴别的一般分析思路
(1)先依据外观特征,鉴别出其中的一种或几种,然后再利用它们去鉴别其他物质。
(2)若均无明显外观特征,可考虑能否用加热或焰色试验区别开来。
(3)若以上两种方法都不能鉴别时,可考虑两两混合或相互滴加,记录混合后的反应现象,分析确定。
×
×
×
(4)无色溶液加入CCl4无现象,滴加氯水后CCl4层呈紫红色,则溶液中一定存在I- ( )
(5)使溴水褪色的无色气体可能是SO2、CH2===CH2、CH≡CH ( )
(6)NH4Cl、Na2SO4、(NH4)2SO4三种未知溶液可以用Ba(OH)2溶液鉴别 ( )
(7)向溶液中加入氯水和KSCN溶液,溶液变红,说明溶液中含Fe2+ ( )
√
√
×
√
2.根据下列实验事实得出的结论正确的是 ( )
解析:A项,O3、Cl2、NO2等都能使品红溶液褪色;B项,H2S、CxHy、HCHO都可出现此现象;C项,浓HNO3也有此现象。
答案:D
[题点考法·全面练通]
1.下列鉴别物质的方法能达到目的的是 ( )
解析:CH2==CH2和HC≡CH与溴都能发生加成反应,溴的四氯化碳溶液均褪色,现象相同,不能鉴别,故A错误;原溶液中可能存在碳酸根离子、碳酸氢根离子、亚硫酸根离子、亚硫酸氢根离子,故C错误;检验K元素,需要透过蓝色钴玻璃观察才能判断,故D错误。答案:B
2.下列实验操作及现象与结论均一定正确的是 ( )
选项 实验操作及现象 结论
A 用铂丝蘸取某无色溶液,灼烧,产生黄色火焰 该溶液中含有钠盐
B 乙烯通入酸性高锰酸钾溶液中,紫色褪去 乙烯具有一定的漂白性
C 硫酸滴加到纯碱中,产生的气体通入到水玻璃中,产生白色沉淀 非金属性:C>Si
D 向某溶液中滴加氯水,再滴加KSCN溶液,溶液变红 原溶液中含有Fe2+
解析:焰色为黄色,说明含有钠元素,可能为NaOH,A项错误;乙烯使酸性高锰酸钾溶液褪色,体现的是还原性,B项错误;硫酸滴加到纯碱中,产生的气体通入到水玻璃中,产生白色沉淀,说明酸性:H2SO4>H2CO3>H2SiO3,即非金属性:S>C>Si,C项正确;原溶液中本来就含有Fe3+也产生同样现象,D项错误。
答案:C
3.乙醚是常用的有机试剂,久置容易产生过氧化物,带来安全隐患。以下不可用来定性检出过氧化物的试剂是( )
A.K3[Fe(CN)6]溶液
B.弱酸性淀粉-KI溶液
C.Na2Cr2O7和稀H2SO4溶液
D.(NH4)2Fe(SO4)2的稀H2SO4溶液和KSCN溶液
解析:过氧化物与K3[Fe(CN)6]溶液不能发生反应,因此不能用于检验其存在,A符合题意;弱酸性淀粉-KI溶液与过氧化物反应产生I2,I2遇淀粉溶液变为蓝色,B不符合题意;Na2Cr2O7和稀H2SO4溶液具有强氧化性,会将过氧化物氧化,而Na2Cr2O7被还原为Cr3+,使溶液变为绿色,C不符合题意;过氧化物具有强氧化性,会将(NH4)2Fe(SO4)2电离产生的Fe2+氧化为Fe3+,和KSCN溶液混合,溶液显红色,D不符合题意。
答案:A
[思维建模]
无色溶液中离子检验的一般思路
逐点清(二) 物质的分离与提纯
(一)分离、提纯的含义
物质的分离 将混合物的各组分分离开来,获得几种纯净物的过程
物质的提纯 将混合物中的杂质除去而得到纯净物的过程,又叫物质的净化或除杂
(二)分离、提纯物质遵循的“四原则”“三必须”
四原则 不增(不增加新的杂质)
不减(不减少被提纯的物质)
易分离(被提纯物质与杂质容易分离)
易复原(被提纯物质要易复原)
三必须 除杂试剂必须过量
过量试剂必须除尽
除杂途径必须选最佳
(三)物质分离与提纯常用的物理方法
1.常见实验装置分析
(1)过滤
适用范围 把不溶性固体与_____进行分离 注意事项 一贴 滤纸紧贴漏斗内壁
二低 滤纸上缘低于______
液面低于________
三靠 烧杯紧靠______
玻璃棒下端紧靠___________
漏斗下端紧靠________
液体
漏斗口
滤纸上缘
玻璃棒
三层滤纸处
烧杯内壁
(2)蒸发
适用范围 分离易溶性固体的溶质和溶剂
注意事项 玻璃棒的作用:搅拌,防止液体局部过热而飞溅
停止加热的标准:当有大量晶体析出时停止加热,利用余热蒸干
(3)萃取和分液
适用范围 萃取:利用溶质在互不相溶的溶剂里的________不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液里提取出来;
分液:分离两种________且易分层的液体
注意事项 ①溶质在萃取剂中的溶解度比在原溶剂中大;②萃取剂与原溶剂不反应、不相溶;③萃取剂与溶质不反应;④常用的萃取剂是苯或CCl4,不用酒精作萃取剂;⑤分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出
溶解度
互不相溶
(4)蒸馏
适用范围 分离_____相差较大且互溶的液体混合物
注意事项 ①温度计的水银球在蒸馏烧瓶的_______处;②蒸馏烧瓶中要加沸石或碎瓷片,目的是________;③冷凝管水流方向为下口进,上口出
沸点
支管口
防止暴沸
(5)升华
适用范围 分离某种组分易升华的固体混合物
注意事项 如NaCl固体中的I2可用该方法分离,但NH4Cl固体中的I2不能用升华的方法分离
(6)洗气
适用范围 除去气体中的杂质
注意事项 长管进气,短管出气
2.依据物理性质选择分离、提纯的方法
(1)“固+固”混合物
(2)“固+液”混合物
(3)“液+液”混合物
(四)物质分离、提纯常用的化学方法
氧化还原法 用氧化剂(还原剂)除去具有还原性(氧化性)的杂质 如用酸性KMnO4溶液除去CO2中的SO2,用灼热的铜网除去N2中的O2
热分解法 加热使不稳定的物质分解除去 如除去NaCl中的NH4Cl等
酸碱溶解法 利用物质与酸或碱溶液混合后的差异进行分离 如用过量的NaOH溶液可除去Fe2O3中的Al2O3
调pH法 加入试剂调节溶液的pH,使溶液中某种成分生成沉淀而除去 如向含有Cu2+和Fe3+的溶液中加入CuO、Cu(OH)2或Cu2(OH)2CO3等调节pH,使Fe3+转化为Fe(OH)3而除去
电解法 利用电解原理除去杂质 如精炼Cu
续表
[题点考法·全面练通]
题点(一) 物质的分离与提纯
1.下列图示不能用于固液分离操作的是 ( )
解析:A项是抽滤装置,能用于固液分离;B项是倾析法,能简单地将固液进行分离;C项是蒸发装置,能用于固液分离;D项是用于配制一定物质的量浓度的溶液,不能用于固液分离。
答案:D
A.Na2CO3、NaOH、HCl
B.Na2CO3、HCl、KOH
C.K2CO3、HNO3、NaOH
D.Na2CO3、NaOH、HNO3
题点(二) 化工流程中的分离与提纯
3.(2023·青岛模拟)一种含碘废水(I2和I-)制取单质碘的工艺流程如下:
下列有关分析错误的是( )
A.通入SO2的目的是将I2和Cu2+还原
B.利用磁石可以将滤渣Ⅰ进一步分离
C.滤渣Ⅱ放在潮湿的空气中能被氧化为红褐色物质
D.操作X是萃取、分液
4.工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等)湿法制取金属锌的流程如图所示。
下列说法错误的是( )
A.ZnFe2O4溶于硫酸的离子方程式:
ZnFe2O4+8H+===Zn2++2Fe3++4H2O
B.加入ZnO的目的是调节溶液的pH以除去溶液中的Fe3+
C.加过量ZnS可除去溶液中的Cu2+是利用了Ksp(ZnS)>Ksp(CuS)
D.为加快反应速率,净化Ⅰ和净化Ⅱ均应在较高的温度下进行
解析:净化 Ⅰ 过程中加入了H2O2,H2O2在温度较高时会分解,该过程需要控制温度不能太高,D错误。
答案:D
第2讲 物质的检验、分离与提纯(基础落实课)
逐点清(一) 物质的检验与鉴别
(一)常见离子的检验
1.常见阳离子检验
(1)用常规检验法
灰绿
红褐
②焰色试验:用焰色试验可检验出溶液中的K+和Na+。
(2)特殊检验法
[注意] ①检验Fe2+和Fe3+时一般应用特殊检验法。
②注意不能利用酸性KMnO4溶液检验FeCl2溶液中的Fe2+,因为KMnO4(H+)会氧化Fe2+也会氧化Cl-。
Fe3+ 加入KSCN溶液呈红色
Fe2+ 加入KSCN溶液无现象,滴加新制氯水后溶液呈红色;或加入K3[Fe(CN)6](铁氰化钾)溶液,产生带有特征蓝色的铁氰化亚铁Fe3[Fe(CN)6]2沉淀
2.常见阴离子检验
(1)利用酸碱指示剂检验
(2)利用盐酸和其他试剂检验
无色无味
刺激性
(3)利用AgNO3(HNO3酸化)溶液检验
(4)利用某些特征反应检验
(二)常见气体的检验
1.可燃性气体的检验
CO 火焰呈蓝色,产物只有二氧化碳
CH4 火焰呈淡蓝色,产物有二氧化碳和水
H2 火焰呈淡蓝色,产物只有水
CH2==CH2 火焰明亮,有黑烟
可使溴水及酸性高锰酸钾溶液褪色
通常情况下,检验可燃性气体之前要进行验纯 2.酸性气体的检验
CO2 无色无味气体通入澄清石灰水,澄清石灰水________________
SO2 通入品红溶液,红色褪去,再加热又________
HCl ①可使湿润的蓝色石蕊试纸(或湿润的pH试纸)变红;②可使蘸有浓氨水的玻璃棒产生白烟;③通入用硝酸酸化的硝酸银溶液产生白色沉淀
先变浑浊后变澄清
出现红色
3.碱性气体的检验(NH3)
4.还原性气体的检验
H2 通过灼热氧化铜,固体由黑色变为红色,气体通过无水硫酸铜,粉末变蓝
CO 通过灼热氧化铜,固体由黑色变为红色,气体通过澄清石灰水,溶液________
NO 与O2(或空气)反应,气体由无色变为_______
变浑浊
红棕色
5.氧化性气体的检验
O2 可使带火星的木条复燃
Cl2 ①黄绿色、有刺激性气味;②可使湿润的有色布条褪色;③可使湿润的淀粉-KI试纸变蓝
NO2 ①红棕色、有刺激性气味;②溶于水,溶液无色但能使紫色石蕊溶液_____;③可使湿润的淀粉-KI试纸_____
变红
变蓝
(三)物质的鉴别
1.限用一种试剂的物质鉴别方法
(1)先分析被鉴别物质的水溶性、密度、溶液的酸碱性,确定能否选用水或指示剂进行鉴别。
(2)在鉴别多种酸、碱、盐的溶液时,可依据“相反原理”确定试剂进行鉴别。即被鉴别的溶液多数呈酸性时,可选用碱或水解呈碱性的盐溶液作试剂;若被鉴别的溶液多数呈碱性时,可选用酸或水解呈酸性的盐溶液作试剂。
(3)常用溴水、新制氢氧化铜悬浊液等作试剂鉴别多种有机物。
2.不另加试剂鉴别的一般分析思路
(1)先依据外观特征,鉴别出其中的一种或几种,然后再利用它们去鉴别其他物质。
(2)若均无明显外观特征,可考虑能否用加热或焰色试验区别开来。
(3)若以上两种方法都不能鉴别时,可考虑两两混合或相互滴加,记录混合后的反应现象,分析确定。
×
×
×
(4)无色溶液加入CCl4无现象,滴加氯水后CCl4层呈紫红色,则溶液中一定存在I- ( )
(5)使溴水褪色的无色气体可能是SO2、CH2===CH2、CH≡CH ( )
(6)NH4Cl、Na2SO4、(NH4)2SO4三种未知溶液可以用Ba(OH)2溶液鉴别 ( )
(7)向溶液中加入氯水和KSCN溶液,溶液变红,说明溶液中含Fe2+ ( )
√
√
×
√
2.根据下列实验事实得出的结论正确的是 ( )
解析:A项,O3、Cl2、NO2等都能使品红溶液褪色;B项,H2S、CxHy、HCHO都可出现此现象;C项,浓HNO3也有此现象。
答案:D
[题点考法·全面练通]
1.下列鉴别物质的方法能达到目的的是 ( )
解析:CH2==CH2和HC≡CH与溴都能发生加成反应,溴的四氯化碳溶液均褪色,现象相同,不能鉴别,故A错误;原溶液中可能存在碳酸根离子、碳酸氢根离子、亚硫酸根离子、亚硫酸氢根离子,故C错误;检验K元素,需要透过蓝色钴玻璃观察才能判断,故D错误。答案:B
2.下列实验操作及现象与结论均一定正确的是 ( )
选项 实验操作及现象 结论
A 用铂丝蘸取某无色溶液,灼烧,产生黄色火焰 该溶液中含有钠盐
B 乙烯通入酸性高锰酸钾溶液中,紫色褪去 乙烯具有一定的漂白性
C 硫酸滴加到纯碱中,产生的气体通入到水玻璃中,产生白色沉淀 非金属性:C>Si
D 向某溶液中滴加氯水,再滴加KSCN溶液,溶液变红 原溶液中含有Fe2+
解析:焰色为黄色,说明含有钠元素,可能为NaOH,A项错误;乙烯使酸性高锰酸钾溶液褪色,体现的是还原性,B项错误;硫酸滴加到纯碱中,产生的气体通入到水玻璃中,产生白色沉淀,说明酸性:H2SO4>H2CO3>H2SiO3,即非金属性:S>C>Si,C项正确;原溶液中本来就含有Fe3+也产生同样现象,D项错误。
答案:C
3.乙醚是常用的有机试剂,久置容易产生过氧化物,带来安全隐患。以下不可用来定性检出过氧化物的试剂是( )
A.K3[Fe(CN)6]溶液
B.弱酸性淀粉-KI溶液
C.Na2Cr2O7和稀H2SO4溶液
D.(NH4)2Fe(SO4)2的稀H2SO4溶液和KSCN溶液
解析:过氧化物与K3[Fe(CN)6]溶液不能发生反应,因此不能用于检验其存在,A符合题意;弱酸性淀粉-KI溶液与过氧化物反应产生I2,I2遇淀粉溶液变为蓝色,B不符合题意;Na2Cr2O7和稀H2SO4溶液具有强氧化性,会将过氧化物氧化,而Na2Cr2O7被还原为Cr3+,使溶液变为绿色,C不符合题意;过氧化物具有强氧化性,会将(NH4)2Fe(SO4)2电离产生的Fe2+氧化为Fe3+,和KSCN溶液混合,溶液显红色,D不符合题意。
答案:A
[思维建模]
无色溶液中离子检验的一般思路
逐点清(二) 物质的分离与提纯
(一)分离、提纯的含义
物质的分离 将混合物的各组分分离开来,获得几种纯净物的过程
物质的提纯 将混合物中的杂质除去而得到纯净物的过程,又叫物质的净化或除杂
(二)分离、提纯物质遵循的“四原则”“三必须”
四原则 不增(不增加新的杂质)
不减(不减少被提纯的物质)
易分离(被提纯物质与杂质容易分离)
易复原(被提纯物质要易复原)
三必须 除杂试剂必须过量
过量试剂必须除尽
除杂途径必须选最佳
(三)物质分离与提纯常用的物理方法
1.常见实验装置分析
(1)过滤
适用范围 把不溶性固体与_____进行分离 注意事项 一贴 滤纸紧贴漏斗内壁
二低 滤纸上缘低于______
液面低于________
三靠 烧杯紧靠______
玻璃棒下端紧靠___________
漏斗下端紧靠________
液体
漏斗口
滤纸上缘
玻璃棒
三层滤纸处
烧杯内壁
(2)蒸发
适用范围 分离易溶性固体的溶质和溶剂
注意事项 玻璃棒的作用:搅拌,防止液体局部过热而飞溅
停止加热的标准:当有大量晶体析出时停止加热,利用余热蒸干
(3)萃取和分液
适用范围 萃取:利用溶质在互不相溶的溶剂里的________不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液里提取出来;
分液:分离两种________且易分层的液体
注意事项 ①溶质在萃取剂中的溶解度比在原溶剂中大;②萃取剂与原溶剂不反应、不相溶;③萃取剂与溶质不反应;④常用的萃取剂是苯或CCl4,不用酒精作萃取剂;⑤分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出
溶解度
互不相溶
(4)蒸馏
适用范围 分离_____相差较大且互溶的液体混合物
注意事项 ①温度计的水银球在蒸馏烧瓶的_______处;②蒸馏烧瓶中要加沸石或碎瓷片,目的是________;③冷凝管水流方向为下口进,上口出
沸点
支管口
防止暴沸
(5)升华
适用范围 分离某种组分易升华的固体混合物
注意事项 如NaCl固体中的I2可用该方法分离,但NH4Cl固体中的I2不能用升华的方法分离
(6)洗气
适用范围 除去气体中的杂质
注意事项 长管进气,短管出气
2.依据物理性质选择分离、提纯的方法
(1)“固+固”混合物
(2)“固+液”混合物
(3)“液+液”混合物
(四)物质分离、提纯常用的化学方法
氧化还原法 用氧化剂(还原剂)除去具有还原性(氧化性)的杂质 如用酸性KMnO4溶液除去CO2中的SO2,用灼热的铜网除去N2中的O2
热分解法 加热使不稳定的物质分解除去 如除去NaCl中的NH4Cl等
酸碱溶解法 利用物质与酸或碱溶液混合后的差异进行分离 如用过量的NaOH溶液可除去Fe2O3中的Al2O3
调pH法 加入试剂调节溶液的pH,使溶液中某种成分生成沉淀而除去 如向含有Cu2+和Fe3+的溶液中加入CuO、Cu(OH)2或Cu2(OH)2CO3等调节pH,使Fe3+转化为Fe(OH)3而除去
电解法 利用电解原理除去杂质 如精炼Cu
续表
[题点考法·全面练通]
题点(一) 物质的分离与提纯
1.下列图示不能用于固液分离操作的是 ( )
解析:A项是抽滤装置,能用于固液分离;B项是倾析法,能简单地将固液进行分离;C项是蒸发装置,能用于固液分离;D项是用于配制一定物质的量浓度的溶液,不能用于固液分离。
答案:D
A.Na2CO3、NaOH、HCl
B.Na2CO3、HCl、KOH
C.K2CO3、HNO3、NaOH
D.Na2CO3、NaOH、HNO3
题点(二) 化工流程中的分离与提纯
3.(2023·青岛模拟)一种含碘废水(I2和I-)制取单质碘的工艺流程如下:
下列有关分析错误的是( )
A.通入SO2的目的是将I2和Cu2+还原
B.利用磁石可以将滤渣Ⅰ进一步分离
C.滤渣Ⅱ放在潮湿的空气中能被氧化为红褐色物质
D.操作X是萃取、分液
4.工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等)湿法制取金属锌的流程如图所示。
下列说法错误的是( )
A.ZnFe2O4溶于硫酸的离子方程式:
ZnFe2O4+8H+===Zn2++2Fe3++4H2O
B.加入ZnO的目的是调节溶液的pH以除去溶液中的Fe3+
C.加过量ZnS可除去溶液中的Cu2+是利用了Ksp(ZnS)>Ksp(CuS)
D.为加快反应速率,净化Ⅰ和净化Ⅱ均应在较高的温度下进行
解析:净化 Ⅰ 过程中加入了H2O2,H2O2在温度较高时会分解,该过程需要控制温度不能太高,D错误。
答案:D
同课章节目录
