2024届高考一轮复习 第十章 化学实验 第5讲 探究类综合实验 课件(共84张PPT)
文档属性
| 名称 | 2024届高考一轮复习 第十章 化学实验 第5讲 探究类综合实验 课件(共84张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-17 22:07:43 | ||
图片预览








文档简介
(共84张PPT)
第5讲 探究类综合实验(综合应用课)
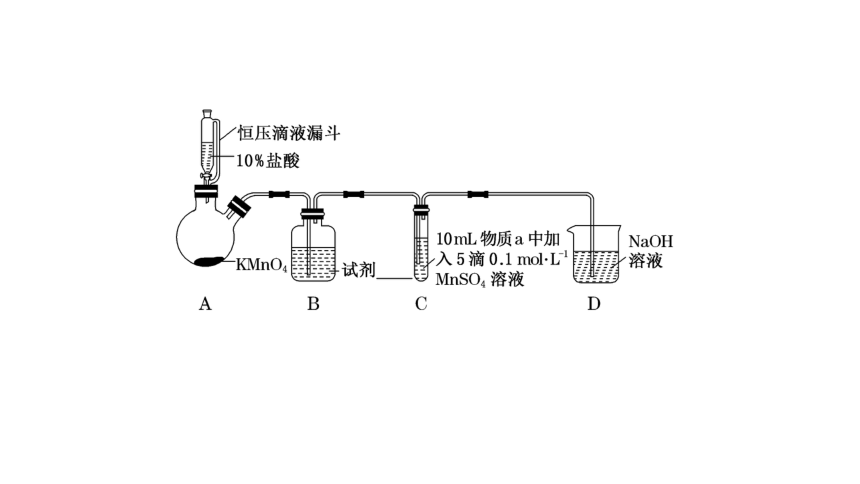
探究实验以其创新、灵活的特点成为每年高考的热点题型,试题将元素化合物知识与化学实验知识巧妙地融合在一起,增加了题目的新颖度和难度,能充分考查学生的发散思维能力和分析问题的能力。实验探究过程中往往通过对化学实验进行比较甄别,从而揭示反应原理、解释产生某些现象的原因等。学生只有灵活运用已有元素化合物的知识,深刻理解化学基本理论,才能使复杂问题简单化。
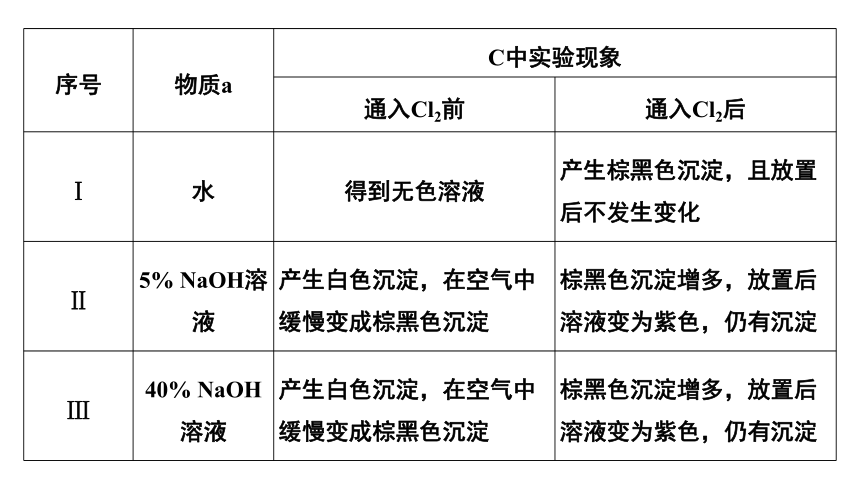
序号 物质a C中实验现象 通入Cl2前 通入Cl2后
Ⅰ 水 得到无色溶液 产生棕黑色沉淀,且放置后不发生变化
Ⅱ 5% NaOH溶液 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀
Ⅲ 40% NaOH溶液 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀
①化学方程式表示可能导致溶液碱性减弱的原因_____________________,但通过实验测定溶液的碱性变化很小。
②取Ⅲ中放置后的1 mL悬浊液,加入4 mL 40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为________________________,溶液绿色缓慢加深,原因是MnO2被__________(填“化学式”)氧化,可证明Ⅲ的悬浊液中氧化剂过量;
③取Ⅱ中放置后的1 mL悬浊液,加入4 mL水,溶液紫色缓慢加深,发生的反应是________________________________________________。
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因________________________。
解析:在装置A中HCl与KMnO4发生反应制取Cl2,由于盐酸具有挥发性,为排除HCl对Cl2性质的干扰,在装置B中盛有饱和NaCl溶液,除去Cl2中的杂质HCl,在装置C中通过改变溶液的pH,验证不同条件下Cl2与MnSO4反应,装置D是尾气处理装置,目的是除去多余Cl2,防止造成大气污染。(1)B中试剂是饱和NaCl溶液,作用是吸收Cl2中的杂质HCl气体;(2)通入Cl2前,Ⅱ、Ⅲ中Mn2+与碱性溶液中NaOH电离产生的OH-反应产生Mn(OH)2白色沉淀,该沉淀不稳定,会被溶解在溶液中的氧气氧化为棕黑色MnO2,则沉淀由白色变为黑色的化学方程式为2Mn(OH)2+O2===2MnO2+2H2O;(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是:Mn2+的还原性随溶液碱性的增强而增强;
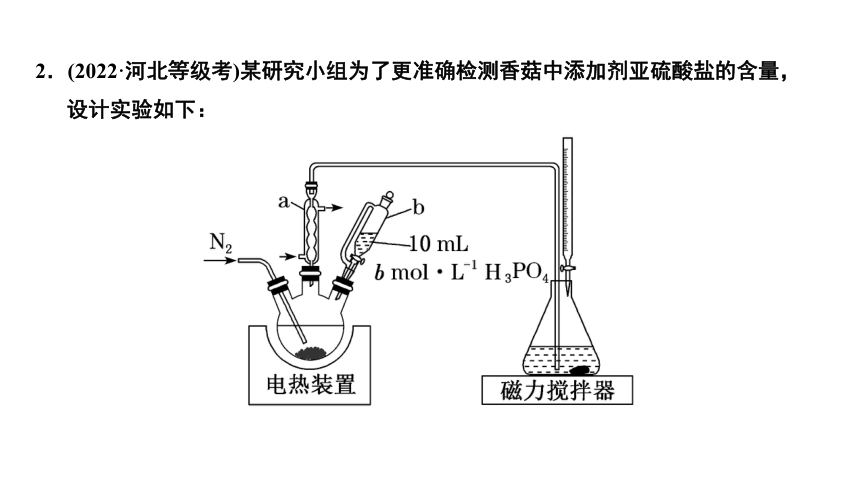
2.(2022·河北等级考)某研究小组为了更准确检测香菇中添加剂亚硫酸盐的含量,设计实验如下:
①三颈烧瓶中加入10.00 g香菇样品和400 mL水;锥形瓶中加入125 mL水、1 mL淀粉溶液,并预加0.30 mL 0.010 00 mol·L-1的碘标准溶液,搅拌。
②以0.2 L·min-1流速通氮气,再加入过量磷酸,加热并保持微沸,同时用碘标准溶液滴定,至终点时滴定消耗了1.00 mL碘标准溶液。
③做空白实验,消耗了0.10 mL碘标准溶液。
④用适量Na2SO3替代香菇样品,重复上述步骤,测得SO2的平均回收率为95%。
已知:Ka1(H3PO4)=7.1×10-3,Ka1(H2SO3)=1.3×10-2。
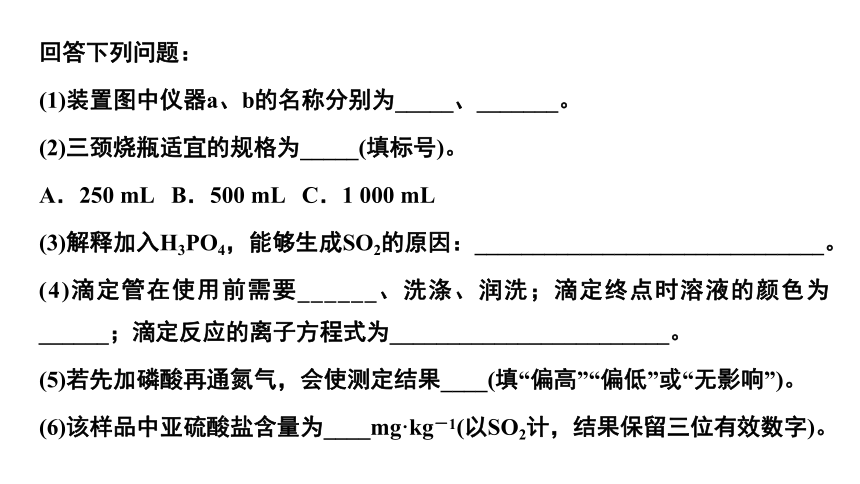
回答下列问题:
(1)装置图中仪器a、b的名称分别为_____、_______。
(2)三颈烧瓶适宜的规格为_____(填标号)。
A.250 mL B.500 mL C.1 000 mL
(3)解释加入H3PO4,能够生成SO2的原因:______________________________。
(4)滴定管在使用前需要______、洗涤、润洗;滴定终点时溶液的颜色为______;滴定反应的离子方程式为________________________。
(5)若先加磷酸再通氮气,会使测定结果____(填“偏高”“偏低”或“无影响”)。
(6)该样品中亚硫酸盐含量为____mg·kg-1(以SO2计,结果保留三位有效数字)。
3.(2022·广东等级考)食醋是烹饪美食的调味品,有效成分主要为醋酸(用HAc表示)。HAc的应用与其电离平衡密切相关。25 ℃时,HAc的Ka=1.75×10-5=10-4.76。
(1)配制250 mL 0.1 mol·L-1的HAc溶液,需5 mol·L-1HAc 溶液的体积为____ mL。
(2)下列关于250 mL容量瓶的操作,正确的是____。
(3)某小组研究25 ℃下HAc电离平衡的影响因素。
[提出假设] 稀释HAc溶液或改变Ac-浓度,HAc电离平衡会发生移动。
[设计方案并完成实验] 用浓度均为0.1 mol·L-1的HAc和NaAc溶液,按下表配制总体积相同的系列溶液;测定pH,记录数据。
序号 V(HAc)/mL V(NaAc)/mL V(H2O)/mL n(NaAc)∶ n(HAc) pH
Ⅰ 40.00 / / 0 2.86
Ⅱ 4.00 / 36.00 0 3.36
…
Ⅶ 4.00 a b 3∶4 4.53
Ⅷ 4.00 4.00 32.00 1∶1 4.65
①根据表中信息,补充数据:a=____,b=____。
②由实验Ⅰ和Ⅱ可知,稀释HAc溶液,电离平衡____(填“正”或“逆”)向移动;结合表中数据,给出判断理由:_______________。
③由实验Ⅱ~Ⅷ可知,增大Ac-浓度,HAc电离平衡逆向移动。
[实验结论] 假设成立。
对比数据发现,实验Ⅷ中pH=4.65与资料数据Ka=10-4.76存在一定差异;推测可能由物质浓度准确程度不够引起,故先准确测定HAc溶液的浓度再验证。
(ⅰ)移取20.00 mL HAc溶液,加入2滴酚酞溶液,用0.100 0 mol·L-1NaOH溶液滴定至终点,消耗体积为22.08 mL,则该HAc溶液的浓度为____ mol·L-1。画出上述过程的滴定曲线示意图并标注滴定终点。
(ⅱ)用上述HAc溶液和0.100 0 mol·L-1NaOH溶液,配制等物质的量的HAc与NaAc混合溶液,测定pH,结果与资料数据相符。
(5)小组进一步提出:如果只有浓度均约为0.1 mol·L-1的HAc和NaOH溶液,如何准确测定HAc的Ka?小组同学设计方案并进行实验。请完成下表中Ⅱ的内容。
[实验总结] 得到的结果与资料数据相符,方案可行。
(6)根据Ka可以判断弱酸的酸性强弱。写出一种无机弱酸及其用途_____________。
Ⅰ 移取20.00 mL HAc溶液,用NaOH溶液滴定至终点,消耗NaOH溶液V1 mL
Ⅱ ____,测得溶液的pH为4.76
解析:(1)溶液稀释过程中,溶质的物质的量不变,因此250 mL×0.1 mol·L-1=V×5 mol·L-1,解得V=5.0 mL。
(2)容量瓶使用过程中,不能用手等触碰瓶口,以免污染试剂,故A错误;定容时,视线应平视刻度线且与溶液凹液面相切,不能仰视或俯视,故B错误;向容量瓶中转移液体,需用玻璃棒引流,玻璃棒下端位于刻度线以下,同时玻璃棒不能接触容量瓶口,故C正确;定容完成后,盖上瓶塞,将容量瓶来回颠倒,将溶液摇匀,颠倒过程中,左手食指抵住瓶塞,防止瓶塞脱落,右手扶住容量瓶底部,防止容量瓶从左手掉落,故D错误。
(3)①实验Ⅶ的溶液中n(NaAc)∶n(HAc)=3∶4,V(HAc)=4.00 mL,因此V(NaAc)=3.00 mL,即a=3.00,由实验Ⅰ可知,溶液最终的体积为40.00 mL,因此V(H2O)=40.00 mL-4.00 mL-3.00 mL=33.00 mL,即b=33.00。
(4)ⅰ.滴定过程中发生反应:HAc+NaOH===NaAc+H2O,由反应方程式可知,滴定至终点时,n(HAc)=n(NaOH),因此22.08 mL×0.1 mol·L-1=20.00 mL×c(HAc),解得c(HAc)=0.110 4 mol·L-1。
(6)不同的无机弱酸在生活中应用广泛,如HClO具有强氧化性,在生活中可用于漂白和消毒,H2SO3具有还原性,可用作还原剂,在葡萄酒中添加适量H2SO3可用作防腐剂,H3PO4可用作食品添加剂,同时在制药、生产肥料等行业有广泛用途。
答案:(1)5.0 (2)C
(3)①3.00 33.00 ②正 实验Ⅱ相较于实验Ⅰ,醋酸溶液稀释了10倍,而实验Ⅱ的pH增大值小于1 (4)0.110 4
(5)向滴定后的混合液中加入20 mL HAc溶液
(6)HClO:漂白剂和消毒液(或H2SO3:还原剂、防腐剂或H3PO4:食品添加剂、制药、生产肥料)
题型(一) 物质性质的实验探究
1.物质性质的实验探究类型
(1)根据物质性质设计实验方案
(2)根据物质的结构(或官能团)设计性质实验方案
2.物质性质探究、验证实验的考查角度
物质氧化性、还原性的判断 如探究SO2具有还原性的方法是将气体通入酸性KMnO4溶液中,通过观察酸性KMnO4 溶液是否褪色来说明;如探究Fe3+的氧化性强于I2时,可利用FeCl3与淀粉-KI溶液反应,通过溶液变蓝色来说明Fe3+的氧化性强于I2
验证同周期、同主族元素性质的递变规律 一般通过设计比较元素金属性、非金属性强弱的实验来完成。如通过比较Mg、Al与同浓度盐酸反应产生H2的快慢来说明Mg、Al的活泼性顺序
电解质强弱的判断 如探究一元酸HA是弱酸的方法是常温下配制NaA溶液,测pH,若pH>7,则说明HA为弱酸
续表
物质酸性强弱的判断 如探究碳酸和硅酸的酸性强弱,可利用相对强的酸制备相对弱的酸的反应原理,将CO2气体通入Na2SiO3溶液,看是否有白色沉淀生成来判断
钢铁发生电化学腐蚀的规律探究 可以通过控制钢铁是否与空气接触、所接触的电解质溶液的酸碱度、钢铁在腐蚀过程中体系内的气压变化等设计实验,找出规律
续表
[典例] (2021·北京等级考)某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(1)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2。
①反应的离子方程式是___________________。
②电极反应式:
ⅰ.还原反应:MnO2+2e-+4H+===Mn2++2H2O
ⅱ.氧化反应:__________。
③根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
ⅰ.随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱。
ⅱ.随c(Cl-)降低,________________________。
④补充实验证实了③中的分析。
a是______,b是______。
序号 实验 加入试剂 产物
Ⅰ 较浓硫酸 有氯气
Ⅱ a 有氯气
Ⅲ a和b 无氯气
(2)利用c(H+)浓度对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是_______,从原子结构角度说明理由_______________________。
(3)根据(1)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是____。
(4)Ag分别与1 mol·L-1的盐酸、氢溴酸、氢碘酸混合,Ag只与氢碘酸发生置换反应,试解释原因:______________________________________。
(5)总结:物质氧化性和还原性变化的一般规律是_________________________________________________________________。
(2)非金属性越弱其阴离子的还原性越强,反应时所需的氢离子浓度越小,故顺序是KCl>KBr>KI;其原因是Cl、Br、I位于第ⅦA族,从上到下电子层数逐渐增加,原子半径逐渐增大,得电子能力逐渐减弱,阴离子的还原性逐渐增强。(4)若要使反应2Ag+2H+===2Ag++H2↑发生,根据本题的提示可以降低Ag+浓度,对比AgX的溶解度,AgI溶解度最小,故Ag只与氢碘酸发生置换反应。(5)通过本题可以发现,物质氧化性和还原性还与物质的浓度有关,浓度越大氧化性或者还原性越强。
[易错提醒] 物质性质探究验证实验的注意事项
(1)在离子检验、气体成分检验的过程中,要严格掌握检验的先后顺序,防止各成分检验过程中的相互干扰。
(2)若有水蒸气生成,先检验水蒸气,再检验其他成分,如C和浓H2SO4的反应,产物有SO2、CO2和H2O(g),通过实验可检验三种气体物质的存在,但SO2、CO2都要通过溶液进行检验,对检验H2O(g)有干扰,检验CO2用石灰水时SO2对CO2有干扰。
(4)要重视试剂名称的描述,如有些试剂的准确描述为:无水硫酸铜、澄清石灰水、酸性高锰酸钾溶液、浓硫酸、饱和NaHCO3溶液、NaOH溶液等。此外还应注意某些仪器的规格。
[对点训练]
某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一:制取氯酸钾和氯水。
利用如图所示的实验装置(部分夹持装置已省略)进行实验。
(1)将Cl2通入B装置中得到的含氯产物为KClO3和KCl,该反应的离子方程式为________________________________________________。
(2)制取实验结束后,取出B中试管冷却结晶、过滤、洗涤。过滤时需要用到的玻璃仪器有胶头滴管、烧杯、____、____。
(3)写出D装置中处理尾气的离子方程式:____________________________。
实验二:氯酸钾碘化钾反应的探究。
(4)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其实验的记录表(实验在室温下进行)如下:
试管编号 1 2 3 4
0.20 mol·L-1KI/mL 1.0 1.0 1.0 1.0
KClO3(s)/g 0.10 0.10 0.10 0.10
6.0 mol·L-1H2SO4/mL 0 3.0 6.0 9.0
蒸馏水/mL 9.0 6.0 3.0 0
实验现象
①系列实验的实验目的是________________________。
②设计1号试管实验的作用是______________________________________。
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为_________________________________。
实验三:比较Cl2、Br2、I2的氧化性强弱。
为比较Cl2、Br2、I2的氧化性强弱,设计了如图所示的实验步骤:
(5)加入10滴KI溶液时,溶液的颜色由橙黄色变为橙红色,说明氧化性:Br2____I2(填“强于”或“弱于”)。
(6)加入1 mL CCl4后,振荡静置,最终试管中的现象为_________________________________________________________________。
(5)加入10滴KI溶液时,溶液的颜色由橙黄色变为橙红色,说明Br2把I-氧化为I2,根据氧化还原反应的规律可知,Br2 的氧化性强于I2的氧化性;(6)四氯化碳溶液可以萃取碘水中的碘单质,加入1 mL CCl4后,振荡静置,最终试管中的现象为液体分层,上层液体呈无色,下层液体呈紫红色。
题型(二) 定量分析实验探究
1.实验数据或物理量的测定方法
沉淀法 先将某种成分转化为沉淀,然后称量纯净、干燥的沉淀的质量,再进行相关计算
测气体体积法 对于产生气体的反应,可以通过测定气体体积的方法测定样品纯度。
①常规的量气装置
②量气时应注意的问题
a.量气时应保持装置处于室温状态。
b.读数时,要特别注意消除“压强差”,
保持液面相平,还要注意视线与液面最低处水平相切
测气体质量法 将生成的气体通入足量的吸收剂中,通过称量实验前后吸收剂的质量,求得所吸收气体的质量,然后进行相关计算
滴定法 利用滴定操作原理,通过酸碱中和滴定、沉淀滴定和氧化还原滴定等获得相应数据后再进行相关计算
热重法 只要物质受热时发生质量变化,都可以用热重法来研究物质的组成。热重法是在控制温度的条件下,测量物质的质量与温度关系的方法。通过分析热重曲线,我们可以知道样品及其可能产生的中间产物的组成、热稳定性、热分解情况及生成产物等与质量相联系的信息
续表
2.定量测定中的相关计算方法
常用的计算方法 关系式法常应用于一步反应或分多步进行的连续反应中,利用该法可以减少不必要的中间运算过程,避免计算错误,并能迅速准确地获得结果。一步反应可以直接找出反应物与目标产物的关系;在多步反应中,若第一步反应的产物,是下一步反应的反应物,可以根据化学方程式,将该物质作为“中介”,找出已知物质和所求物质之间量的关系。利用这种方法解题的关键是建立已知物质和所求物质之间的关系式
续表
3.物质组成计算的常用方法
类型 解题方法
物质含量计算 根据关系式法、得失电子守恒法、滴定法等,求出混合物中某一成分的量,再除以样品的总量,即可得出其含量
确定物质化学式的计算 ①根据题给信息,计算出有关物质的物质的量;②根据电荷守恒,确定出未知离子的物质的量;③根据质量守恒,确定出结晶水的物质的量;④各粒子的物质的量之比即为物质化学式的下标比
续
表
[典例] (2021·全国甲卷)胆矾(CuSO4·5H2O)易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的CuO(杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:
(1)制备胆矾时,用到的实验仪器除量筒、酒精灯、玻璃棒、漏斗外,还必须使用的仪器有____(填标号)。
A.烧杯 B.容量瓶
C.蒸发皿 D.移液管
(2)将CuO加入到适量的稀硫酸中,加热,其主要反应的化学方程式为________________,与直接用废铜和浓硫酸反应相比,该方法的优点是_______________。
(3)待CuO完全反应后停止加热,边搅拌边加入适量H2O2,冷却后用NH3·H2O调pH为3.5~4,再煮沸10 min,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、____、乙醇洗涤、____,得到胆矾。其中,控制溶液pH为3.5~4的目的是_______________,煮沸10 min 的作用是________________________。
(4)结晶水测定:称量干燥坩埚的质量为m1,加入胆矾后总质量为m2。将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为m3。根据实验数据,胆矾分子中结晶水的个数为____(写表达式)。
(5)下列操作中,会导致结晶水数目测定值偏高的是____(填标号)。
①胆矾未充分干燥 ②坩埚未置于干燥器中冷却 ③加热时有少量胆矾迸溅 出来
[思维建模] 定量实验题的解题流程
(1)细审题—— 明确实验目的、原理
实验原理可从题给的化学情境(或题目所给的实验目的)并结合元素化合物的有关知识获取。在此基础上,依据可靠性、简捷性、安全性的原则,确定符合实验目的、要求的实验方案。
(2)想过程——理清操作先后顺序
根据由实验原理所确定的实验方案中的实验过程,确定实验操作的方法和步骤,把握各实验步骤的要点,理清实验操作的先后顺序。
(3)看准图——分析装置或流程作用
若题目中给出装置图,在分析解答过程中,要认真细致地分析图中的各部分装置,并结合实验目的和原理,确定它们在实验中的作用。
(4)细分析——得出正确的实验结论
在定性实验的基础上研究量的关系,根据实验现象和记录的数据,对实验数据进行筛选,通过分析、计算、推理等确定有关样品含量及化学式。
[对点训练]
(1)称取45.7 mg Zn3(PO4)2·4H2O进行热重分析,化合物的质量随温度的变化关系如图所示,为获得Zn3(PO4)2·2H2O和Zn3(PO4)2·H2O的混合产品,烘干时的温度范围为____。
a.90~145 ℃ b.145~195 ℃
c.195~273 ℃ d.>273 ℃
(2)为测定产品中Zn3(PO4)2·4H2O的含量,进行如下实验,已知滴定过程中Zn2+与H2Y2-按1∶1反应。
步骤Ⅰ:准确称取0.457 0 g产品于烧杯中,加入适量盐酸使其溶解,将溶液转移至100 mL容量瓶,定容。
步骤Ⅱ:移取20.00 mL上述溶液于锥形瓶中,加入指示剂,在pH=5~6的缓冲溶液中用0.020 00 mol·L-1 Na2H2Y标准溶液滴定至终点,测得Na2H2Y标准溶液的用量为27.60 mL。
步骤Ⅱ中移取溶液时所使用的玻璃仪器为_______;产品中Zn3(PO4)2·4H2O的质量分数为____。下列操作中,导致产品中Zn3(PO4)2·4H2O含量测定值偏低的是____。
a.步骤Ⅰ中定容时俯视刻度线
b.步骤Ⅰ中转移溶液时未洗涤烧杯
c.步骤Ⅱ中滴定管未用Na2H2Y标准溶液润洗
d.步骤Ⅱ中滴定前滴定管内无气泡,滴定结束后有气泡
题型(三) 综合实验方案的设计与评价
1.实验方案设计的一般思路
2.实验方案评价的主要形式
从评价的主要针对点来看,实验综合题可分为装置评价型和原理评价型两类。
实验装置的评价 对比各方案装置,从装置的合理性、操作的简便性和可行性等方面进行全面分析,选出最佳装置
实验原理的评价 紧扣实验目的,对各方案的原理综合考虑,从原理是否科学、原料是否节约、误差是否较小等方面进行全面分析,选出最佳方案
3.实验方案评价类试题的解题思路
从可行性方面进行评价 ①实验原理(如药品的选择)是否正确、可行;②实验操作(如仪器的选择、连接)是否安全、合理;③实验步骤是否简单、方便;④实验现象是否明显,实验结论是否正确
从规范性视角进行评价 ①仪器的安装与拆卸;②仪器的查漏、气密性检验;③试剂添加的顺序与用量;④加热的方式方法和时机;⑤温度计的规范使用、水银球的位置;⑥实验数据的读取;⑦冷却、冷凝的方法等
从“绿色化学”视角进行评价 ①反应原料是否易得、安全、无毒;②反应速率是否较快;③原料利用率以及合成物质的产率是否较高;④合成过程中是否造成环境污染
续
表
从经济效益和社会效益方面进行评价 ①经济效益指原料的获得成本,转化率、产率等;②社会效益指对环境的污染分析
从实验设计的安全性方面进行评价 ①净化、吸收气体及熄灭酒精灯时要防液体倒吸;②进行某些易燃易爆实验时要防爆炸(如H2还原CuO应先通H2,气体点燃前先验纯等);③防氧化(如H2还原CuO后要“先灭灯再停氢”,白磷切割宜在水中进行等);④防吸水(如实验取用、制取易吸水、潮解、水解的试剂,宜采取必要措施,以保证达到实验目的);⑤冷凝回流(有些反应中,为减少易挥发液体反应物的损耗和充分利用原料,需在反应装置上加装冷凝回流装置,如长玻璃管、冷凝管等);⑥易挥发液体产物导出时若为蒸气的要及时冷却;⑦其他(如实验操作顺序、试剂加入顺序、实验方法使用顺序等)
[典例] (2021·广东等级考)含氯物质在生产生活中有重要作用。1774年,舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。
(1)实验室沿用舍勒的方法制取Cl2的化学方程式为________________________。
(2)实验室制取干燥Cl2时,净化与收集Cl2所需装置的接口连接顺序为____。
(3)某氯水久置后不能使品红溶液褪色,可推测氯水中____已分解。检验此久置氯水中Cl-存在的操作及现象是_____________。
(4)某合作学习小组进行以下实验探究。
①实验任务
通过测定溶液电导率,探究温度对AgCl溶解度的影响。
②查阅资料
电导率是表征电解质溶液导电能力的物理量。温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;离子浓度一定时,稀溶液电导率随温度的升高而增大。25 ℃时,Ksp(AgCl)=1.8×10-10。
③提出猜想
猜想a:较高温度的AgCl饱和溶液的电导率较大。
猜想b:AgCl在水中的溶解度S(45 ℃)>S(35 ℃)>S(25 ℃)。
④设计实验、验证猜想
取试样Ⅰ、Ⅱ、Ⅲ(不同温度下配制的AgCl饱和溶液),在设定的测试温度下,进行表1中实验1~3,记录数据。
表1
实验序号 试样 测试温度/℃ 电导率/(μS·cm-1)
1 Ⅰ:25 ℃的AgCl饱和溶液 25 A1
2 Ⅱ:35 ℃的AgCl饱和溶液 35 A2
3 Ⅲ:45 ℃的AgCl饱和溶液 45 A3
⑤数据分析、交流讨论
25 ℃的AgCl饱和溶液中,c(Cl-)=____mol·L-1。实验结果为A3>A2>A1。小组同学认为,此结果可以证明③中的猜想a成立,但不足以证明猜想b成立。结合②中信息,猜想b不足以成立的理由有________________________。
⑥优化实验
小组同学为进一步验证猜想b,在实验1~3的基础上完善方案,进行实验4和5。请完成表2中内容。
表2
⑦实验总结
根据实验1~5的结果,并结合②中信息,小组同学认为猜想b也成立。猜想b成立的判断依据是_____________________________________________。
实验序号 试样 测试温度/℃ 电导率/(μS·cm-1)
4 Ⅰ B1
5 B2
[思维建模] 实验方案的评价及改进的一般思路
[对点训练]
某化学研究性学习小组探究与铜有关的物质的性质,过程设计如下:
[提出猜想]
问题1:在周期表中,铜与铝的位置很接近,氢氧化铝具有两性,氢氧化铜有两性吗?
问题2:铁和铜都有变价,一般情况下,Fe2+的稳定性小于Fe3+,Cu+的稳定性也小于Cu2+吗?
问题3:硫酸铜溶液呈蓝色,铜与浓硝酸常温下反应生成的溶液也是蓝色吗?
[实验探究]
Ⅰ.解决问题1:
(1)实验需配制100 mL 0.50 mol·L-1 CuSO4溶液,必需的玻璃仪器有胶头滴管、烧杯、____、____。
(2)为达到目的,某同学认为只要进行两次实验即可得出结论。请写出实验②的具体内容。
①向盛有CuSO4溶液的试管中滴加NaOH溶液至过量,观察生成的Cu(OH)2沉淀是否溶解;
②________________________。
Ⅱ.解决问题2的实验步骤和现象如下:
①取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100 ℃得到黑色固体粉末;继续加热至1 000 ℃以上,黑色粉末全部变成红色粉末氧化亚铜;
②取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸,得到蓝色溶液,同时观察到试管底部还有红色固体存在。
(3)写出氧化亚铜与稀硫酸反应的离子方程式
_____________________________________________________________。
(4)从实验中可得出的结论是:当温度在1 000 ℃以上时_____(填“Cu2+”或“Cu+”,下同)稳定,在酸性溶液中_____稳定。
Ⅲ.解决问题3,某同学设计的实验如下:
取一铜片装入试管,加入适量的浓硝酸,观察溶液的颜色变化。
(5)另一同学认为此同学设计的实验有缺陷,原因是________________________。
(6)铜与浓硝酸反应溶液呈绿色,有同学认为这是生成的NO2溶于其中的原因。请设计实验说明此解释是否正确。(只需要写出一种方法即可)
实验步骤 实验结论
解析:(3)根据题干信息分析,氧化亚铜和稀硫酸反应生成硫酸铜和铜,离子方程式为Cu2O+2H+ ===Cu+Cu2++H2O。(4)继续加热至1 000 ℃以上,黑色粉末全部变成红色粉末氧化亚铜,说明当温度在1 000 ℃ 以上时Cu+稳定,但与硫酸反应生成铜离子,所以在酸性溶液中Cu2+稳定。(5)铜和浓硝酸反应生成二氧化氮气体,污染环境。(6)二氧化氮和氧气和水反应生成硝酸,若向反应后的溶液中通入足量空气,反应生成硝酸,二氧化氮消失,若溶液变蓝,则假设成立。
答案:(1)玻璃棒 100 mL容量瓶 (2)另取实验①中所得沉淀,滴加稀硫酸(或稀盐酸等)至过量,观察沉淀是否溶解 (3)Cu2O+2H+===Cu+Cu2++H2O (4)Cu+ Cu2+ (5)产生NO2气体,污染环境 (6)向反应后的溶液中通入足量空气 若溶液变蓝,则假设成立
第5讲 探究类综合实验(综合应用课)
探究实验以其创新、灵活的特点成为每年高考的热点题型,试题将元素化合物知识与化学实验知识巧妙地融合在一起,增加了题目的新颖度和难度,能充分考查学生的发散思维能力和分析问题的能力。实验探究过程中往往通过对化学实验进行比较甄别,从而揭示反应原理、解释产生某些现象的原因等。学生只有灵活运用已有元素化合物的知识,深刻理解化学基本理论,才能使复杂问题简单化。
序号 物质a C中实验现象 通入Cl2前 通入Cl2后
Ⅰ 水 得到无色溶液 产生棕黑色沉淀,且放置后不发生变化
Ⅱ 5% NaOH溶液 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀
Ⅲ 40% NaOH溶液 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀
①化学方程式表示可能导致溶液碱性减弱的原因_____________________,但通过实验测定溶液的碱性变化很小。
②取Ⅲ中放置后的1 mL悬浊液,加入4 mL 40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为________________________,溶液绿色缓慢加深,原因是MnO2被__________(填“化学式”)氧化,可证明Ⅲ的悬浊液中氧化剂过量;
③取Ⅱ中放置后的1 mL悬浊液,加入4 mL水,溶液紫色缓慢加深,发生的反应是________________________________________________。
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因________________________。
解析:在装置A中HCl与KMnO4发生反应制取Cl2,由于盐酸具有挥发性,为排除HCl对Cl2性质的干扰,在装置B中盛有饱和NaCl溶液,除去Cl2中的杂质HCl,在装置C中通过改变溶液的pH,验证不同条件下Cl2与MnSO4反应,装置D是尾气处理装置,目的是除去多余Cl2,防止造成大气污染。(1)B中试剂是饱和NaCl溶液,作用是吸收Cl2中的杂质HCl气体;(2)通入Cl2前,Ⅱ、Ⅲ中Mn2+与碱性溶液中NaOH电离产生的OH-反应产生Mn(OH)2白色沉淀,该沉淀不稳定,会被溶解在溶液中的氧气氧化为棕黑色MnO2,则沉淀由白色变为黑色的化学方程式为2Mn(OH)2+O2===2MnO2+2H2O;(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是:Mn2+的还原性随溶液碱性的增强而增强;
2.(2022·河北等级考)某研究小组为了更准确检测香菇中添加剂亚硫酸盐的含量,设计实验如下:
①三颈烧瓶中加入10.00 g香菇样品和400 mL水;锥形瓶中加入125 mL水、1 mL淀粉溶液,并预加0.30 mL 0.010 00 mol·L-1的碘标准溶液,搅拌。
②以0.2 L·min-1流速通氮气,再加入过量磷酸,加热并保持微沸,同时用碘标准溶液滴定,至终点时滴定消耗了1.00 mL碘标准溶液。
③做空白实验,消耗了0.10 mL碘标准溶液。
④用适量Na2SO3替代香菇样品,重复上述步骤,测得SO2的平均回收率为95%。
已知:Ka1(H3PO4)=7.1×10-3,Ka1(H2SO3)=1.3×10-2。
回答下列问题:
(1)装置图中仪器a、b的名称分别为_____、_______。
(2)三颈烧瓶适宜的规格为_____(填标号)。
A.250 mL B.500 mL C.1 000 mL
(3)解释加入H3PO4,能够生成SO2的原因:______________________________。
(4)滴定管在使用前需要______、洗涤、润洗;滴定终点时溶液的颜色为______;滴定反应的离子方程式为________________________。
(5)若先加磷酸再通氮气,会使测定结果____(填“偏高”“偏低”或“无影响”)。
(6)该样品中亚硫酸盐含量为____mg·kg-1(以SO2计,结果保留三位有效数字)。
3.(2022·广东等级考)食醋是烹饪美食的调味品,有效成分主要为醋酸(用HAc表示)。HAc的应用与其电离平衡密切相关。25 ℃时,HAc的Ka=1.75×10-5=10-4.76。
(1)配制250 mL 0.1 mol·L-1的HAc溶液,需5 mol·L-1HAc 溶液的体积为____ mL。
(2)下列关于250 mL容量瓶的操作,正确的是____。
(3)某小组研究25 ℃下HAc电离平衡的影响因素。
[提出假设] 稀释HAc溶液或改变Ac-浓度,HAc电离平衡会发生移动。
[设计方案并完成实验] 用浓度均为0.1 mol·L-1的HAc和NaAc溶液,按下表配制总体积相同的系列溶液;测定pH,记录数据。
序号 V(HAc)/mL V(NaAc)/mL V(H2O)/mL n(NaAc)∶ n(HAc) pH
Ⅰ 40.00 / / 0 2.86
Ⅱ 4.00 / 36.00 0 3.36
…
Ⅶ 4.00 a b 3∶4 4.53
Ⅷ 4.00 4.00 32.00 1∶1 4.65
①根据表中信息,补充数据:a=____,b=____。
②由实验Ⅰ和Ⅱ可知,稀释HAc溶液,电离平衡____(填“正”或“逆”)向移动;结合表中数据,给出判断理由:_______________。
③由实验Ⅱ~Ⅷ可知,增大Ac-浓度,HAc电离平衡逆向移动。
[实验结论] 假设成立。
对比数据发现,实验Ⅷ中pH=4.65与资料数据Ka=10-4.76存在一定差异;推测可能由物质浓度准确程度不够引起,故先准确测定HAc溶液的浓度再验证。
(ⅰ)移取20.00 mL HAc溶液,加入2滴酚酞溶液,用0.100 0 mol·L-1NaOH溶液滴定至终点,消耗体积为22.08 mL,则该HAc溶液的浓度为____ mol·L-1。画出上述过程的滴定曲线示意图并标注滴定终点。
(ⅱ)用上述HAc溶液和0.100 0 mol·L-1NaOH溶液,配制等物质的量的HAc与NaAc混合溶液,测定pH,结果与资料数据相符。
(5)小组进一步提出:如果只有浓度均约为0.1 mol·L-1的HAc和NaOH溶液,如何准确测定HAc的Ka?小组同学设计方案并进行实验。请完成下表中Ⅱ的内容。
[实验总结] 得到的结果与资料数据相符,方案可行。
(6)根据Ka可以判断弱酸的酸性强弱。写出一种无机弱酸及其用途_____________。
Ⅰ 移取20.00 mL HAc溶液,用NaOH溶液滴定至终点,消耗NaOH溶液V1 mL
Ⅱ ____,测得溶液的pH为4.76
解析:(1)溶液稀释过程中,溶质的物质的量不变,因此250 mL×0.1 mol·L-1=V×5 mol·L-1,解得V=5.0 mL。
(2)容量瓶使用过程中,不能用手等触碰瓶口,以免污染试剂,故A错误;定容时,视线应平视刻度线且与溶液凹液面相切,不能仰视或俯视,故B错误;向容量瓶中转移液体,需用玻璃棒引流,玻璃棒下端位于刻度线以下,同时玻璃棒不能接触容量瓶口,故C正确;定容完成后,盖上瓶塞,将容量瓶来回颠倒,将溶液摇匀,颠倒过程中,左手食指抵住瓶塞,防止瓶塞脱落,右手扶住容量瓶底部,防止容量瓶从左手掉落,故D错误。
(3)①实验Ⅶ的溶液中n(NaAc)∶n(HAc)=3∶4,V(HAc)=4.00 mL,因此V(NaAc)=3.00 mL,即a=3.00,由实验Ⅰ可知,溶液最终的体积为40.00 mL,因此V(H2O)=40.00 mL-4.00 mL-3.00 mL=33.00 mL,即b=33.00。
(4)ⅰ.滴定过程中发生反应:HAc+NaOH===NaAc+H2O,由反应方程式可知,滴定至终点时,n(HAc)=n(NaOH),因此22.08 mL×0.1 mol·L-1=20.00 mL×c(HAc),解得c(HAc)=0.110 4 mol·L-1。
(6)不同的无机弱酸在生活中应用广泛,如HClO具有强氧化性,在生活中可用于漂白和消毒,H2SO3具有还原性,可用作还原剂,在葡萄酒中添加适量H2SO3可用作防腐剂,H3PO4可用作食品添加剂,同时在制药、生产肥料等行业有广泛用途。
答案:(1)5.0 (2)C
(3)①3.00 33.00 ②正 实验Ⅱ相较于实验Ⅰ,醋酸溶液稀释了10倍,而实验Ⅱ的pH增大值小于1 (4)0.110 4
(5)向滴定后的混合液中加入20 mL HAc溶液
(6)HClO:漂白剂和消毒液(或H2SO3:还原剂、防腐剂或H3PO4:食品添加剂、制药、生产肥料)
题型(一) 物质性质的实验探究
1.物质性质的实验探究类型
(1)根据物质性质设计实验方案
(2)根据物质的结构(或官能团)设计性质实验方案
2.物质性质探究、验证实验的考查角度
物质氧化性、还原性的判断 如探究SO2具有还原性的方法是将气体通入酸性KMnO4溶液中,通过观察酸性KMnO4 溶液是否褪色来说明;如探究Fe3+的氧化性强于I2时,可利用FeCl3与淀粉-KI溶液反应,通过溶液变蓝色来说明Fe3+的氧化性强于I2
验证同周期、同主族元素性质的递变规律 一般通过设计比较元素金属性、非金属性强弱的实验来完成。如通过比较Mg、Al与同浓度盐酸反应产生H2的快慢来说明Mg、Al的活泼性顺序
电解质强弱的判断 如探究一元酸HA是弱酸的方法是常温下配制NaA溶液,测pH,若pH>7,则说明HA为弱酸
续表
物质酸性强弱的判断 如探究碳酸和硅酸的酸性强弱,可利用相对强的酸制备相对弱的酸的反应原理,将CO2气体通入Na2SiO3溶液,看是否有白色沉淀生成来判断
钢铁发生电化学腐蚀的规律探究 可以通过控制钢铁是否与空气接触、所接触的电解质溶液的酸碱度、钢铁在腐蚀过程中体系内的气压变化等设计实验,找出规律
续表
[典例] (2021·北京等级考)某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(1)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2。
①反应的离子方程式是___________________。
②电极反应式:
ⅰ.还原反应:MnO2+2e-+4H+===Mn2++2H2O
ⅱ.氧化反应:__________。
③根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
ⅰ.随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱。
ⅱ.随c(Cl-)降低,________________________。
④补充实验证实了③中的分析。
a是______,b是______。
序号 实验 加入试剂 产物
Ⅰ 较浓硫酸 有氯气
Ⅱ a 有氯气
Ⅲ a和b 无氯气
(2)利用c(H+)浓度对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是_______,从原子结构角度说明理由_______________________。
(3)根据(1)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是____。
(4)Ag分别与1 mol·L-1的盐酸、氢溴酸、氢碘酸混合,Ag只与氢碘酸发生置换反应,试解释原因:______________________________________。
(5)总结:物质氧化性和还原性变化的一般规律是_________________________________________________________________。
(2)非金属性越弱其阴离子的还原性越强,反应时所需的氢离子浓度越小,故顺序是KCl>KBr>KI;其原因是Cl、Br、I位于第ⅦA族,从上到下电子层数逐渐增加,原子半径逐渐增大,得电子能力逐渐减弱,阴离子的还原性逐渐增强。(4)若要使反应2Ag+2H+===2Ag++H2↑发生,根据本题的提示可以降低Ag+浓度,对比AgX的溶解度,AgI溶解度最小,故Ag只与氢碘酸发生置换反应。(5)通过本题可以发现,物质氧化性和还原性还与物质的浓度有关,浓度越大氧化性或者还原性越强。
[易错提醒] 物质性质探究验证实验的注意事项
(1)在离子检验、气体成分检验的过程中,要严格掌握检验的先后顺序,防止各成分检验过程中的相互干扰。
(2)若有水蒸气生成,先检验水蒸气,再检验其他成分,如C和浓H2SO4的反应,产物有SO2、CO2和H2O(g),通过实验可检验三种气体物质的存在,但SO2、CO2都要通过溶液进行检验,对检验H2O(g)有干扰,检验CO2用石灰水时SO2对CO2有干扰。
(4)要重视试剂名称的描述,如有些试剂的准确描述为:无水硫酸铜、澄清石灰水、酸性高锰酸钾溶液、浓硫酸、饱和NaHCO3溶液、NaOH溶液等。此外还应注意某些仪器的规格。
[对点训练]
某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一:制取氯酸钾和氯水。
利用如图所示的实验装置(部分夹持装置已省略)进行实验。
(1)将Cl2通入B装置中得到的含氯产物为KClO3和KCl,该反应的离子方程式为________________________________________________。
(2)制取实验结束后,取出B中试管冷却结晶、过滤、洗涤。过滤时需要用到的玻璃仪器有胶头滴管、烧杯、____、____。
(3)写出D装置中处理尾气的离子方程式:____________________________。
实验二:氯酸钾碘化钾反应的探究。
(4)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其实验的记录表(实验在室温下进行)如下:
试管编号 1 2 3 4
0.20 mol·L-1KI/mL 1.0 1.0 1.0 1.0
KClO3(s)/g 0.10 0.10 0.10 0.10
6.0 mol·L-1H2SO4/mL 0 3.0 6.0 9.0
蒸馏水/mL 9.0 6.0 3.0 0
实验现象
①系列实验的实验目的是________________________。
②设计1号试管实验的作用是______________________________________。
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为_________________________________。
实验三:比较Cl2、Br2、I2的氧化性强弱。
为比较Cl2、Br2、I2的氧化性强弱,设计了如图所示的实验步骤:
(5)加入10滴KI溶液时,溶液的颜色由橙黄色变为橙红色,说明氧化性:Br2____I2(填“强于”或“弱于”)。
(6)加入1 mL CCl4后,振荡静置,最终试管中的现象为_________________________________________________________________。
(5)加入10滴KI溶液时,溶液的颜色由橙黄色变为橙红色,说明Br2把I-氧化为I2,根据氧化还原反应的规律可知,Br2 的氧化性强于I2的氧化性;(6)四氯化碳溶液可以萃取碘水中的碘单质,加入1 mL CCl4后,振荡静置,最终试管中的现象为液体分层,上层液体呈无色,下层液体呈紫红色。
题型(二) 定量分析实验探究
1.实验数据或物理量的测定方法
沉淀法 先将某种成分转化为沉淀,然后称量纯净、干燥的沉淀的质量,再进行相关计算
测气体体积法 对于产生气体的反应,可以通过测定气体体积的方法测定样品纯度。
①常规的量气装置
②量气时应注意的问题
a.量气时应保持装置处于室温状态。
b.读数时,要特别注意消除“压强差”,
保持液面相平,还要注意视线与液面最低处水平相切
测气体质量法 将生成的气体通入足量的吸收剂中,通过称量实验前后吸收剂的质量,求得所吸收气体的质量,然后进行相关计算
滴定法 利用滴定操作原理,通过酸碱中和滴定、沉淀滴定和氧化还原滴定等获得相应数据后再进行相关计算
热重法 只要物质受热时发生质量变化,都可以用热重法来研究物质的组成。热重法是在控制温度的条件下,测量物质的质量与温度关系的方法。通过分析热重曲线,我们可以知道样品及其可能产生的中间产物的组成、热稳定性、热分解情况及生成产物等与质量相联系的信息
续表
2.定量测定中的相关计算方法
常用的计算方法 关系式法常应用于一步反应或分多步进行的连续反应中,利用该法可以减少不必要的中间运算过程,避免计算错误,并能迅速准确地获得结果。一步反应可以直接找出反应物与目标产物的关系;在多步反应中,若第一步反应的产物,是下一步反应的反应物,可以根据化学方程式,将该物质作为“中介”,找出已知物质和所求物质之间量的关系。利用这种方法解题的关键是建立已知物质和所求物质之间的关系式
续表
3.物质组成计算的常用方法
类型 解题方法
物质含量计算 根据关系式法、得失电子守恒法、滴定法等,求出混合物中某一成分的量,再除以样品的总量,即可得出其含量
确定物质化学式的计算 ①根据题给信息,计算出有关物质的物质的量;②根据电荷守恒,确定出未知离子的物质的量;③根据质量守恒,确定出结晶水的物质的量;④各粒子的物质的量之比即为物质化学式的下标比
续
表
[典例] (2021·全国甲卷)胆矾(CuSO4·5H2O)易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的CuO(杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:
(1)制备胆矾时,用到的实验仪器除量筒、酒精灯、玻璃棒、漏斗外,还必须使用的仪器有____(填标号)。
A.烧杯 B.容量瓶
C.蒸发皿 D.移液管
(2)将CuO加入到适量的稀硫酸中,加热,其主要反应的化学方程式为________________,与直接用废铜和浓硫酸反应相比,该方法的优点是_______________。
(3)待CuO完全反应后停止加热,边搅拌边加入适量H2O2,冷却后用NH3·H2O调pH为3.5~4,再煮沸10 min,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、____、乙醇洗涤、____,得到胆矾。其中,控制溶液pH为3.5~4的目的是_______________,煮沸10 min 的作用是________________________。
(4)结晶水测定:称量干燥坩埚的质量为m1,加入胆矾后总质量为m2。将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为m3。根据实验数据,胆矾分子中结晶水的个数为____(写表达式)。
(5)下列操作中,会导致结晶水数目测定值偏高的是____(填标号)。
①胆矾未充分干燥 ②坩埚未置于干燥器中冷却 ③加热时有少量胆矾迸溅 出来
[思维建模] 定量实验题的解题流程
(1)细审题—— 明确实验目的、原理
实验原理可从题给的化学情境(或题目所给的实验目的)并结合元素化合物的有关知识获取。在此基础上,依据可靠性、简捷性、安全性的原则,确定符合实验目的、要求的实验方案。
(2)想过程——理清操作先后顺序
根据由实验原理所确定的实验方案中的实验过程,确定实验操作的方法和步骤,把握各实验步骤的要点,理清实验操作的先后顺序。
(3)看准图——分析装置或流程作用
若题目中给出装置图,在分析解答过程中,要认真细致地分析图中的各部分装置,并结合实验目的和原理,确定它们在实验中的作用。
(4)细分析——得出正确的实验结论
在定性实验的基础上研究量的关系,根据实验现象和记录的数据,对实验数据进行筛选,通过分析、计算、推理等确定有关样品含量及化学式。
[对点训练]
(1)称取45.7 mg Zn3(PO4)2·4H2O进行热重分析,化合物的质量随温度的变化关系如图所示,为获得Zn3(PO4)2·2H2O和Zn3(PO4)2·H2O的混合产品,烘干时的温度范围为____。
a.90~145 ℃ b.145~195 ℃
c.195~273 ℃ d.>273 ℃
(2)为测定产品中Zn3(PO4)2·4H2O的含量,进行如下实验,已知滴定过程中Zn2+与H2Y2-按1∶1反应。
步骤Ⅰ:准确称取0.457 0 g产品于烧杯中,加入适量盐酸使其溶解,将溶液转移至100 mL容量瓶,定容。
步骤Ⅱ:移取20.00 mL上述溶液于锥形瓶中,加入指示剂,在pH=5~6的缓冲溶液中用0.020 00 mol·L-1 Na2H2Y标准溶液滴定至终点,测得Na2H2Y标准溶液的用量为27.60 mL。
步骤Ⅱ中移取溶液时所使用的玻璃仪器为_______;产品中Zn3(PO4)2·4H2O的质量分数为____。下列操作中,导致产品中Zn3(PO4)2·4H2O含量测定值偏低的是____。
a.步骤Ⅰ中定容时俯视刻度线
b.步骤Ⅰ中转移溶液时未洗涤烧杯
c.步骤Ⅱ中滴定管未用Na2H2Y标准溶液润洗
d.步骤Ⅱ中滴定前滴定管内无气泡,滴定结束后有气泡
题型(三) 综合实验方案的设计与评价
1.实验方案设计的一般思路
2.实验方案评价的主要形式
从评价的主要针对点来看,实验综合题可分为装置评价型和原理评价型两类。
实验装置的评价 对比各方案装置,从装置的合理性、操作的简便性和可行性等方面进行全面分析,选出最佳装置
实验原理的评价 紧扣实验目的,对各方案的原理综合考虑,从原理是否科学、原料是否节约、误差是否较小等方面进行全面分析,选出最佳方案
3.实验方案评价类试题的解题思路
从可行性方面进行评价 ①实验原理(如药品的选择)是否正确、可行;②实验操作(如仪器的选择、连接)是否安全、合理;③实验步骤是否简单、方便;④实验现象是否明显,实验结论是否正确
从规范性视角进行评价 ①仪器的安装与拆卸;②仪器的查漏、气密性检验;③试剂添加的顺序与用量;④加热的方式方法和时机;⑤温度计的规范使用、水银球的位置;⑥实验数据的读取;⑦冷却、冷凝的方法等
从“绿色化学”视角进行评价 ①反应原料是否易得、安全、无毒;②反应速率是否较快;③原料利用率以及合成物质的产率是否较高;④合成过程中是否造成环境污染
续
表
从经济效益和社会效益方面进行评价 ①经济效益指原料的获得成本,转化率、产率等;②社会效益指对环境的污染分析
从实验设计的安全性方面进行评价 ①净化、吸收气体及熄灭酒精灯时要防液体倒吸;②进行某些易燃易爆实验时要防爆炸(如H2还原CuO应先通H2,气体点燃前先验纯等);③防氧化(如H2还原CuO后要“先灭灯再停氢”,白磷切割宜在水中进行等);④防吸水(如实验取用、制取易吸水、潮解、水解的试剂,宜采取必要措施,以保证达到实验目的);⑤冷凝回流(有些反应中,为减少易挥发液体反应物的损耗和充分利用原料,需在反应装置上加装冷凝回流装置,如长玻璃管、冷凝管等);⑥易挥发液体产物导出时若为蒸气的要及时冷却;⑦其他(如实验操作顺序、试剂加入顺序、实验方法使用顺序等)
[典例] (2021·广东等级考)含氯物质在生产生活中有重要作用。1774年,舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。
(1)实验室沿用舍勒的方法制取Cl2的化学方程式为________________________。
(2)实验室制取干燥Cl2时,净化与收集Cl2所需装置的接口连接顺序为____。
(3)某氯水久置后不能使品红溶液褪色,可推测氯水中____已分解。检验此久置氯水中Cl-存在的操作及现象是_____________。
(4)某合作学习小组进行以下实验探究。
①实验任务
通过测定溶液电导率,探究温度对AgCl溶解度的影响。
②查阅资料
电导率是表征电解质溶液导电能力的物理量。温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;离子浓度一定时,稀溶液电导率随温度的升高而增大。25 ℃时,Ksp(AgCl)=1.8×10-10。
③提出猜想
猜想a:较高温度的AgCl饱和溶液的电导率较大。
猜想b:AgCl在水中的溶解度S(45 ℃)>S(35 ℃)>S(25 ℃)。
④设计实验、验证猜想
取试样Ⅰ、Ⅱ、Ⅲ(不同温度下配制的AgCl饱和溶液),在设定的测试温度下,进行表1中实验1~3,记录数据。
表1
实验序号 试样 测试温度/℃ 电导率/(μS·cm-1)
1 Ⅰ:25 ℃的AgCl饱和溶液 25 A1
2 Ⅱ:35 ℃的AgCl饱和溶液 35 A2
3 Ⅲ:45 ℃的AgCl饱和溶液 45 A3
⑤数据分析、交流讨论
25 ℃的AgCl饱和溶液中,c(Cl-)=____mol·L-1。实验结果为A3>A2>A1。小组同学认为,此结果可以证明③中的猜想a成立,但不足以证明猜想b成立。结合②中信息,猜想b不足以成立的理由有________________________。
⑥优化实验
小组同学为进一步验证猜想b,在实验1~3的基础上完善方案,进行实验4和5。请完成表2中内容。
表2
⑦实验总结
根据实验1~5的结果,并结合②中信息,小组同学认为猜想b也成立。猜想b成立的判断依据是_____________________________________________。
实验序号 试样 测试温度/℃ 电导率/(μS·cm-1)
4 Ⅰ B1
5 B2
[思维建模] 实验方案的评价及改进的一般思路
[对点训练]
某化学研究性学习小组探究与铜有关的物质的性质,过程设计如下:
[提出猜想]
问题1:在周期表中,铜与铝的位置很接近,氢氧化铝具有两性,氢氧化铜有两性吗?
问题2:铁和铜都有变价,一般情况下,Fe2+的稳定性小于Fe3+,Cu+的稳定性也小于Cu2+吗?
问题3:硫酸铜溶液呈蓝色,铜与浓硝酸常温下反应生成的溶液也是蓝色吗?
[实验探究]
Ⅰ.解决问题1:
(1)实验需配制100 mL 0.50 mol·L-1 CuSO4溶液,必需的玻璃仪器有胶头滴管、烧杯、____、____。
(2)为达到目的,某同学认为只要进行两次实验即可得出结论。请写出实验②的具体内容。
①向盛有CuSO4溶液的试管中滴加NaOH溶液至过量,观察生成的Cu(OH)2沉淀是否溶解;
②________________________。
Ⅱ.解决问题2的实验步骤和现象如下:
①取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100 ℃得到黑色固体粉末;继续加热至1 000 ℃以上,黑色粉末全部变成红色粉末氧化亚铜;
②取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸,得到蓝色溶液,同时观察到试管底部还有红色固体存在。
(3)写出氧化亚铜与稀硫酸反应的离子方程式
_____________________________________________________________。
(4)从实验中可得出的结论是:当温度在1 000 ℃以上时_____(填“Cu2+”或“Cu+”,下同)稳定,在酸性溶液中_____稳定。
Ⅲ.解决问题3,某同学设计的实验如下:
取一铜片装入试管,加入适量的浓硝酸,观察溶液的颜色变化。
(5)另一同学认为此同学设计的实验有缺陷,原因是________________________。
(6)铜与浓硝酸反应溶液呈绿色,有同学认为这是生成的NO2溶于其中的原因。请设计实验说明此解释是否正确。(只需要写出一种方法即可)
实验步骤 实验结论
解析:(3)根据题干信息分析,氧化亚铜和稀硫酸反应生成硫酸铜和铜,离子方程式为Cu2O+2H+ ===Cu+Cu2++H2O。(4)继续加热至1 000 ℃以上,黑色粉末全部变成红色粉末氧化亚铜,说明当温度在1 000 ℃ 以上时Cu+稳定,但与硫酸反应生成铜离子,所以在酸性溶液中Cu2+稳定。(5)铜和浓硝酸反应生成二氧化氮气体,污染环境。(6)二氧化氮和氧气和水反应生成硝酸,若向反应后的溶液中通入足量空气,反应生成硝酸,二氧化氮消失,若溶液变蓝,则假设成立。
答案:(1)玻璃棒 100 mL容量瓶 (2)另取实验①中所得沉淀,滴加稀硫酸(或稀盐酸等)至过量,观察沉淀是否溶解 (3)Cu2O+2H+===Cu+Cu2++H2O (4)Cu+ Cu2+ (5)产生NO2气体,污染环境 (6)向反应后的溶液中通入足量空气 若溶液变蓝,则假设成立
同课章节目录
