2024届高考一轮复习 第六章 化学反应与能量 第2讲 原电池 课件(共55张PPT)
文档属性
| 名称 | 2024届高考一轮复习 第六章 化学反应与能量 第2讲 原电池 课件(共55张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-17 22:15:43 | ||
图片预览









文档简介
(共55张PPT)
第2讲 原电池(基础落实课)
逐点清(一) 原电池的工作原理
1.原电池的工作原理
(1)原电池的构成
反应 能_________的氧化还原反应(一般是活泼性强的金属与电解质溶液反应)
电极 一般是活泼性不同的两电极(金属或石墨)
介质 电解质溶液或熔融电解质或某离子导体等
闭合回路 两电极连接或接触插入介质
自发进行
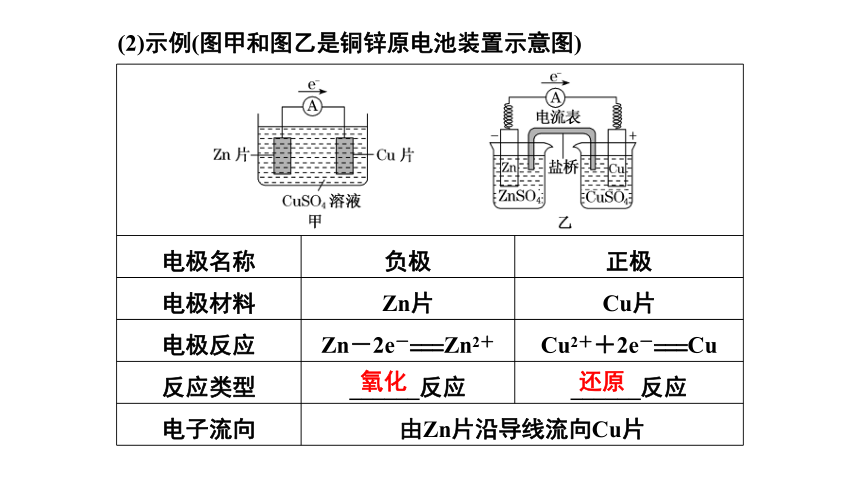
(2)示例(图甲和图乙是铜锌原电池装置示意图)
电极名称 负极 正极
电极材料 Zn片 Cu片
电极反应 Zn-2e-===Zn2+ Cu2++2e-===Cu
反应类型 ______反应 ______反应
电子流向 由Zn片沿导线流向Cu片 氧化
还原
[注意] 盐桥的作用是使整个装置构成闭合回路,代替两溶液直接接触;平衡电荷;提高电池效率。
2.原电池原理的应用
加快化学反应速率 一个自发进行的氧化还原反应,形成原电池时会使反应速率加快。如在Zn与稀硫酸反应时加入少量CuSO4溶液构成原电池,反应速率加快
金属的防护 使被保护的金属制品作原电池正极而得到保护。如要保护一个铁质的输水管道或钢铁桥梁等,可用导线将其与一块锌块相连,使锌作原电池的负极
比较金属活动性强弱 两种金属分别作原电池的两极时,一般作负极的金属比作正极的金属活泼
设计制作化学电源 ①首先将氧化还原反应分成两个半反应。 ②根据原电池的反应特点,结合两个半反应找出正、负极材料和电解质溶液。 如根据反应2FeCl3+Cu===2FeCl2+CuCl2设计的原电池如下 负极 Cu Cu-2e-===Cu2+
电解质溶液 FeCl3溶液 正极 C(Fe3+) 2Fe3++2e-===2Fe2+
续表
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)任何氧化还原反应均可设计成原电池 ( )
(2)任何原电池一定是活泼性不同的两金属电极 ( )
(3)任何原电池的电子流向一定从负极流出,流入正极 ( )
(4)一般来说,带有“盐桥”的原电池比不带“盐桥”的原电池效率高 ( )
(5)在锌铜原电池中,因为有电子通过电解质溶液形成闭合回路,所以有电流产生 ( )
×
×
√
√
×
(6)原电池工作时,溶液中的阳离子向负极移动,盐桥中的阳离子向正极移动 ( )
(7)任何原电池工作时,正极本身一定不参加反应,负极本身一定参加反应 ( )
(8)对于Cu+2Fe3+===2Fe2++Cu2+反应,设计原电池时两极材料可以是Cu与Fe ( )
×
×
×
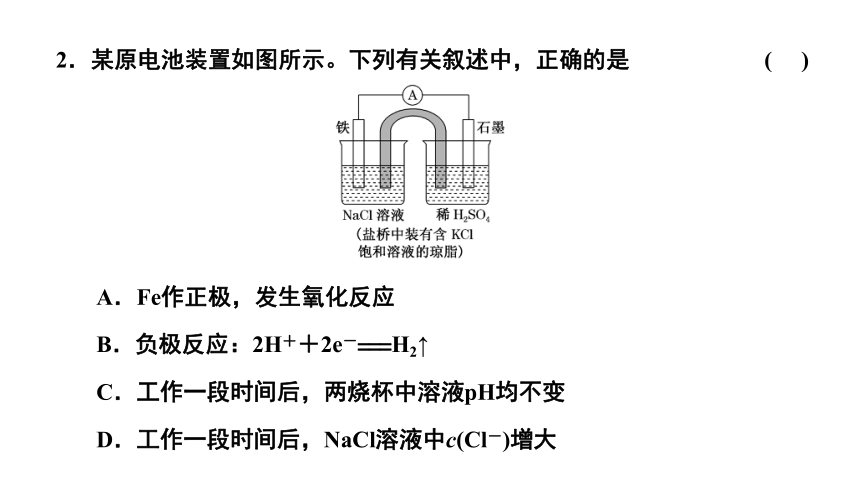
2.某原电池装置如图所示。下列有关叙述中,正确的是 ( )
A.Fe作正极,发生氧化反应
B.负极反应:2H++2e-===H2↑
C.工作一段时间后,两烧杯中溶液pH均不变
D.工作一段时间后,NaCl溶液中c(Cl-)增大
解析:负极是铁发生氧化反应,A错误;正极是石墨,H+在此发生还原反应,B错误;工作一段时间后,右池中H+在石墨棒上被还原为H2,溶液的pH增大,Ca错误;盐桥中的Cl-移向负极,NaCl溶液中c(Cl-)增大,D正确。
答案:D
[题点考法·全面练通]
题点(一) 原电池的工作原理
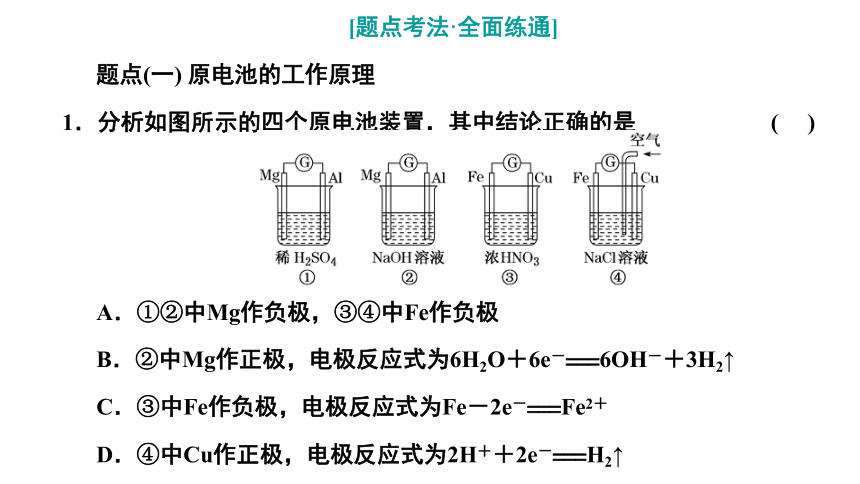
1.分析如图所示的四个原电池装置,其中结论正确的是 ( )
A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C.③中Fe作负极,电极反应式为Fe-2e-===Fe2+
D.④中Cu作正极,电极反应式为2H++2e-===H2↑
解析:②中Mg作正极,③中的Fe作正极,A错误;③中的Cu作负极,电极反应式为Cu-2e-===Cu2+,C错误;④中的Cu作正极,电极反应式为O2+4e-+2H2O===4OH-,D错误。
答案:B
答案:C
3.如图中四种电池装置是依据原电池原理设计的,下列有关叙述错误的是 ( )
A.①中锌电极发生氧化反应
B.②中电子由a电极经导线流向b电极
C.③中外电路中电流由A电极流向B电极
D.④中LixC6作负极
解析:在原电池中阴离子移向负极,所以③中A电极为负极,则外 电路中电流应由B电极流向A电极。
答案:C
[思维建模]
正、负极的判断方法
题点(二) 原电池原理的应用
4.有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装置
部分实验现象 a极质量减少;b极质量增加 b极有气体产生;c极无变化 d极溶解;c极有气体产生 电流从a极流向d极
由此可判断这四种金属的活动性顺序是 ( )
A.a>b>c>d B.b>c>d>a
C.d>a>b>c D.a>b>d>c
解析:把四个实验从左到右分别编号为①、②、③、④,则由实验①可知,a作原电池负极,b作原电池正极,金属活动性:a>b;由实验②可知,b极有气体产生,c极无变化,则活动性:b>c;由实验③可知,d极溶解,则d作原电池负极,c作正极,活动性:d>c;由实验④可知,电流从a极流向d极,则d极为原电池负极,a极为原电池正极,活动性:d>a。综上所述可知活动性:d>a>b>c。
答案:C
5.将两份过量的锌粉a、b分别加入一定量的稀硫酸中,同时向a中加入少量的CuSO4溶液,产生H2的体积V(L)与时间t(min)的关系正确的是 ( )
解析:加入CuSO4溶液,Zn置换出Cu,形成原电池,加快反应速率,由于H2SO4定量,产生H2的体积一样多。
答案:B
6.依据氧化还原反应:2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电池如图所示
(盐桥为盛有KNO3琼脂的U形管)。
请回答下列问题:
(1)电极X的材料是_________________;电解质溶液Y是_________________ (填化学式)。
(2)银电极为电池的________极,其电极反应式为_________________。
答案:(1)Cu AgNO3 (2)正 Ag++e-===Ag (3)Cu(NO3)2
[思维建模] 根据电池反应设计原电池的模板
拆分反应 将氧化还原反应分成两个半反应(电极反应)
选择电极材料 将还原剂(一般为比较活泼金属)作负极,活泼性比负极弱的金属或非金属导体作正极
构成闭合回路 如果两个半反应分别在两个容器中进行(中间连接盐桥),则两个容器中的电解质溶液应含有与电极材料相同的金属阳离子
画出装置图 结合要求及反应特点,画出原电池装置图,标出电极材料名称、正负极、电解质溶液等
逐点清(二) 常见化学电源的工作原理
1.电池优劣的标准
一是看电池单位质量或单位体积所输出___________ (比能量)或者输出___________ (比功率),二是电池储存时间的长短。
电能的多少
功率的大小
2.一次电池——干电池
碱性锌锰电池 碱性锌锰电池的负极是Zn,正极是MnO2,电解质是KOH,其电极反应如下:
负极:Zn-2e-+2OH-===Zn(OH)2
正极:2MnO2+2e-+2H2O===2MnO(OH)+2OH-
总反应:Zn+2MnO2+2H2O===2MnO(OH)+Zn(OH)2
银锌电池 银锌电池的负极是Zn,正极是Ag2O,电解质是KOH,其电极反应如下:
负极:Zn-2e-+2OH-===Zn(OH)2
正极:Ag2O+2e-+H2O===2Ag+2OH-
总反应:Zn+Ag2O+H2O===Zn(OH)2+2Ag
[注意] 充电时的电极反应与放电时的电极反应过程相反,充电时的阳极反应与放电时的正极反应相反,充电时的阴极反应与放电时的负极反应相反。
4.燃料电池
(1)特点:连续地将燃料和氧化剂的化学能直接转化为电能。常见燃料有H2、烃、肼、烃的衍生物、NH3、煤气等。化学能转化为电能的转化率超过80%。
(2)氢氧燃料电池
5.化学电源中电极反应式书写的一般方法
(1)明确两极的反应物。
(2)明确直接产物:根据负极氧化、正极还原,明确两极的直接产物。
(3)确定最终产物:根据介质环境和共存原则,找出参与反应的介质粒子,确定最终产物。
(4)配平:根据电荷守恒、原子守恒配平电极反应式。
[注意] ①H+在碱性环境中不存在;②O2-在水溶液中不存在,在酸性环境中结合H+,生成H2O,在中性或碱性环境结合H2O,生成OH-;③若已知总反应式时,可先写出较易书写的一极的电极反应式,然后在电子守恒的基础上,总反应式减去较易写出的一极的电极反应式,即得到较难写出的另一极的电极反应式。
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)碱性锌锰干电池是一次电池,其中MnO2是催化剂,可使锌锰干电池的比能量高、可储存时间长 ( )
(2)铅酸蓄电池中的反应是可逆反应 ( )
(3)燃料电池中的燃料在负极上发生还原反应 ( )
(4)氢氧燃料电池在碱性电解质溶液中负极反应为2H2-4e-===4H+ ( )
×
×
×
×
2.以甲醇为燃料,写出下列介质中的电极反应式。
(1)酸性溶液(或含质子交换膜)
正极:_______________________;
负极:_______________________。
(2)碱性溶液
正极:_______________________;
负极:_______________________。
[题点考法·全面练通]
题点(一) 一次电池
1.(2022·湖南等级考)海水电池在海洋能源领域备受关注,一种锂 海水电池构造示意图如图。下列说法错误的是 ( )
A.海水起电解质溶液作用
B.N极仅发生的电极反应:2H2O+2e-===2OH-+H2↑
C.玻璃陶瓷具有传导离子和防水的功能
D.该锂 海水电池属于一次电池
解析:海水中含有丰富的电解质,故A正确;Li是活泼金属,作负极,则N为正极,电极反应为O2+2H2O+4e-===4OH-,故B错误;Li易与水反应,玻璃陶瓷的作用是防止水和Li反应,并能传导离子,故C正确;该电池不可充电,属于一次电池,故D正确。
答案:B
2.纸电池是一种有广泛应用的“软电池”,某种碱性纸电池采用薄层纸片作为载体和传导体,纸的两面分别附着锌和二氧化锰。下列有关该纸电池的说法不合理的是 ( )
A.Zn为负极,发生氧化反应
B.电池工作时,电子由MnO2流向Zn
C.正极反应:MnO2+e-+H2O===MnO(OH)+OH-
D.电池总反应:Zn+2MnO2+2H2O===Zn(OH)2+2MnO(OH)
解析:类似于碱性锌锰电池,MnO2在正极上得电子被还原生成MnO(OH),则正极的电极反应式为MnO2+H2O+e-===MnO(OH)+OH-,C正确;负极反应式为Zn+2OH--2e-===Zn(OH)2,结合正、负极反应式及得失电子守恒可知,该电池的总反应式为Zn+2MnO2+2H2O===Zn(OH)2+2MnO(OH),D正确。
答案:B
题点(二) 二次电池
3.某科研团队发明了一种新型的锌离子热充电电池,
可以利用人体产生的低热量充电。该电池以Zn
和VO2 PC为电极材料,实现了低热量发电。
放电时,VO2结合Zn2+生成ZnxVO2·yH2O,原理如
图。下列说法正确的是 ( )
A.分离器可以为阴离子交换膜
B.充电时,阳极电极反应式为ZnxVO2·yH2O+2xe-===VO2+xZn2++yH2O
C.放电时,电流从Zn极流向VO2 PC极
D.充电时,锌离子从较高温一侧移至低温一侧
解析:由分析可知,分离器为阳离子交换膜,A错误;充电时,阳极电极反应式为ZnxVO2·yH2O-2xe-===VO2+xZn2++yH2O,B错误;放电时,Zn为负极,VO2 PC极为正极,电流从VO2 PC极流向Zn极,C错误;充电时,阳离子由阳极区移向阴极区,则锌离子从较高温一侧移至低温一侧,D正确。
答案:D
4.我国科研工作者研制出基于PANa(聚丙烯酸钠)电解质的Zn/NiCo LDMH可充电电池,该电池具有高容量和超长循环稳定性。电池反应为5Zn+6CoOOH+4NiOOH+5H2O 5ZnO+6Co(OH)2+4Ni(OH)2。PANa是一种超强吸水聚合物,吸收大量Zn(CH3COO)2和KOH溶液作为水和离子含量调节剂形成水凝胶电解质,示意图如图。下列说法错误的是( )
A.PANa是一种有机高分子聚合物,在水溶液中不会发生电离
B.PANa具有超强吸水性可避免电池充放电过程中因失水使离子导电率下降
C.放电时,负极附近pH减少
D.充电时,阳极反应为3Co(OH)2+2Ni(OH)2-5e-+5OH-===3CoOOH+2NiOOH+5H2O
解析:PANa在水溶液中电离出聚丙烯酸根离子和Na+,应为离子化合物,A项错误;
PANa是一种超强吸水聚合物,具有超强吸水性,可避免电池充放电过程中因失水使离子导电率下降,B项正确;
分析题给电池反应,放电时,Zn的化合价升高,失去电子,作负极,电极反应为Zn-2e-+2OH-===ZnO+H2O,负极附近OH-浓度降低,pH减小,C项正确;
充电时,Co(OH)2和Ni(OH)2在阳极失去电子得到CoOOH和NiOOH,D项
正确。
答案:A
[思维建模] 二次电池充电时的电极连接
即正极接正极,负极接负极。
题点(三) 常见燃料电池
5.如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700~900 ℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是 ( )
A.电池内的O2-由电极甲移向电极乙
B.电池总反应为N2H4+2O2===2NO+2H2O
C.当甲电极上有1 mol N2H4消耗时,标准状况下乙电极
上有22.4 L O2参与反应
D.电池外电路的电子由电极乙移向电极甲
解析:该燃料电池中,负极上燃料失电子发生氧化反应,为N2H4+2O2--4e-===N2+2H2O,故电极甲作负极,电极乙作正极,正极上氧气得电子发生还原反应,电极反应式为O2+4e-===2O2-,电池总反应为N2H4+O2===N2+2H2O。
答案:C
6.研究发现,在酸性乙醇燃料电池中加入硝酸,可使电池持续大电流放电,其工作原理如图所示。
下列说法错误的是 ( )
A.加入HNO3降低了正极反应的活化能
B.电池工作时正极区溶液的pH增大
C.1 mol CH3CH2OH被完全氧化时有6 mol O2被还原
D.负极反应为CH3CH2OH+3H2O-12e-===2CO2+12H+
解析:由分析知,HNO3在正极起催化作用,作催化剂,则加入HNO3降低了正极反应的活化能,故A正确;
电池工作时正极区的总反应为O2+4e-+4H+===2H2O,则溶液中氢离子浓度减小,pH增大,故B正确;
根据得失电子守恒可知,1 mol CH3CH2OH被完全氧化时,转移12 mol电子,则有3 mol O2被还原,故C错误、D正确。
答案:C
[思维建模]
燃料电池的一般思维模型及正极反应式的书写
(1)燃料电池的一般思维模型
①要注意介质是什么,是电解质溶液还是熔融盐或氧化物。
②通入负极的物质为燃料,通入正极的物质为氧气。
③通过介质中离子的移动方向,可判断电池的正负极,同时考虑该离子参与靠近一极的电极反应。
谢
谢
观
看
第2讲 原电池(基础落实课)
逐点清(一) 原电池的工作原理
1.原电池的工作原理
(1)原电池的构成
反应 能_________的氧化还原反应(一般是活泼性强的金属与电解质溶液反应)
电极 一般是活泼性不同的两电极(金属或石墨)
介质 电解质溶液或熔融电解质或某离子导体等
闭合回路 两电极连接或接触插入介质
自发进行
(2)示例(图甲和图乙是铜锌原电池装置示意图)
电极名称 负极 正极
电极材料 Zn片 Cu片
电极反应 Zn-2e-===Zn2+ Cu2++2e-===Cu
反应类型 ______反应 ______反应
电子流向 由Zn片沿导线流向Cu片 氧化
还原
[注意] 盐桥的作用是使整个装置构成闭合回路,代替两溶液直接接触;平衡电荷;提高电池效率。
2.原电池原理的应用
加快化学反应速率 一个自发进行的氧化还原反应,形成原电池时会使反应速率加快。如在Zn与稀硫酸反应时加入少量CuSO4溶液构成原电池,反应速率加快
金属的防护 使被保护的金属制品作原电池正极而得到保护。如要保护一个铁质的输水管道或钢铁桥梁等,可用导线将其与一块锌块相连,使锌作原电池的负极
比较金属活动性强弱 两种金属分别作原电池的两极时,一般作负极的金属比作正极的金属活泼
设计制作化学电源 ①首先将氧化还原反应分成两个半反应。 ②根据原电池的反应特点,结合两个半反应找出正、负极材料和电解质溶液。 如根据反应2FeCl3+Cu===2FeCl2+CuCl2设计的原电池如下 负极 Cu Cu-2e-===Cu2+
电解质溶液 FeCl3溶液 正极 C(Fe3+) 2Fe3++2e-===2Fe2+
续表
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)任何氧化还原反应均可设计成原电池 ( )
(2)任何原电池一定是活泼性不同的两金属电极 ( )
(3)任何原电池的电子流向一定从负极流出,流入正极 ( )
(4)一般来说,带有“盐桥”的原电池比不带“盐桥”的原电池效率高 ( )
(5)在锌铜原电池中,因为有电子通过电解质溶液形成闭合回路,所以有电流产生 ( )
×
×
√
√
×
(6)原电池工作时,溶液中的阳离子向负极移动,盐桥中的阳离子向正极移动 ( )
(7)任何原电池工作时,正极本身一定不参加反应,负极本身一定参加反应 ( )
(8)对于Cu+2Fe3+===2Fe2++Cu2+反应,设计原电池时两极材料可以是Cu与Fe ( )
×
×
×
2.某原电池装置如图所示。下列有关叙述中,正确的是 ( )
A.Fe作正极,发生氧化反应
B.负极反应:2H++2e-===H2↑
C.工作一段时间后,两烧杯中溶液pH均不变
D.工作一段时间后,NaCl溶液中c(Cl-)增大
解析:负极是铁发生氧化反应,A错误;正极是石墨,H+在此发生还原反应,B错误;工作一段时间后,右池中H+在石墨棒上被还原为H2,溶液的pH增大,Ca错误;盐桥中的Cl-移向负极,NaCl溶液中c(Cl-)增大,D正确。
答案:D
[题点考法·全面练通]
题点(一) 原电池的工作原理
1.分析如图所示的四个原电池装置,其中结论正确的是 ( )
A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C.③中Fe作负极,电极反应式为Fe-2e-===Fe2+
D.④中Cu作正极,电极反应式为2H++2e-===H2↑
解析:②中Mg作正极,③中的Fe作正极,A错误;③中的Cu作负极,电极反应式为Cu-2e-===Cu2+,C错误;④中的Cu作正极,电极反应式为O2+4e-+2H2O===4OH-,D错误。
答案:B
答案:C
3.如图中四种电池装置是依据原电池原理设计的,下列有关叙述错误的是 ( )
A.①中锌电极发生氧化反应
B.②中电子由a电极经导线流向b电极
C.③中外电路中电流由A电极流向B电极
D.④中LixC6作负极
解析:在原电池中阴离子移向负极,所以③中A电极为负极,则外 电路中电流应由B电极流向A电极。
答案:C
[思维建模]
正、负极的判断方法
题点(二) 原电池原理的应用
4.有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装置
部分实验现象 a极质量减少;b极质量增加 b极有气体产生;c极无变化 d极溶解;c极有气体产生 电流从a极流向d极
由此可判断这四种金属的活动性顺序是 ( )
A.a>b>c>d B.b>c>d>a
C.d>a>b>c D.a>b>d>c
解析:把四个实验从左到右分别编号为①、②、③、④,则由实验①可知,a作原电池负极,b作原电池正极,金属活动性:a>b;由实验②可知,b极有气体产生,c极无变化,则活动性:b>c;由实验③可知,d极溶解,则d作原电池负极,c作正极,活动性:d>c;由实验④可知,电流从a极流向d极,则d极为原电池负极,a极为原电池正极,活动性:d>a。综上所述可知活动性:d>a>b>c。
答案:C
5.将两份过量的锌粉a、b分别加入一定量的稀硫酸中,同时向a中加入少量的CuSO4溶液,产生H2的体积V(L)与时间t(min)的关系正确的是 ( )
解析:加入CuSO4溶液,Zn置换出Cu,形成原电池,加快反应速率,由于H2SO4定量,产生H2的体积一样多。
答案:B
6.依据氧化还原反应:2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电池如图所示
(盐桥为盛有KNO3琼脂的U形管)。
请回答下列问题:
(1)电极X的材料是_________________;电解质溶液Y是_________________ (填化学式)。
(2)银电极为电池的________极,其电极反应式为_________________。
答案:(1)Cu AgNO3 (2)正 Ag++e-===Ag (3)Cu(NO3)2
[思维建模] 根据电池反应设计原电池的模板
拆分反应 将氧化还原反应分成两个半反应(电极反应)
选择电极材料 将还原剂(一般为比较活泼金属)作负极,活泼性比负极弱的金属或非金属导体作正极
构成闭合回路 如果两个半反应分别在两个容器中进行(中间连接盐桥),则两个容器中的电解质溶液应含有与电极材料相同的金属阳离子
画出装置图 结合要求及反应特点,画出原电池装置图,标出电极材料名称、正负极、电解质溶液等
逐点清(二) 常见化学电源的工作原理
1.电池优劣的标准
一是看电池单位质量或单位体积所输出___________ (比能量)或者输出___________ (比功率),二是电池储存时间的长短。
电能的多少
功率的大小
2.一次电池——干电池
碱性锌锰电池 碱性锌锰电池的负极是Zn,正极是MnO2,电解质是KOH,其电极反应如下:
负极:Zn-2e-+2OH-===Zn(OH)2
正极:2MnO2+2e-+2H2O===2MnO(OH)+2OH-
总反应:Zn+2MnO2+2H2O===2MnO(OH)+Zn(OH)2
银锌电池 银锌电池的负极是Zn,正极是Ag2O,电解质是KOH,其电极反应如下:
负极:Zn-2e-+2OH-===Zn(OH)2
正极:Ag2O+2e-+H2O===2Ag+2OH-
总反应:Zn+Ag2O+H2O===Zn(OH)2+2Ag
[注意] 充电时的电极反应与放电时的电极反应过程相反,充电时的阳极反应与放电时的正极反应相反,充电时的阴极反应与放电时的负极反应相反。
4.燃料电池
(1)特点:连续地将燃料和氧化剂的化学能直接转化为电能。常见燃料有H2、烃、肼、烃的衍生物、NH3、煤气等。化学能转化为电能的转化率超过80%。
(2)氢氧燃料电池
5.化学电源中电极反应式书写的一般方法
(1)明确两极的反应物。
(2)明确直接产物:根据负极氧化、正极还原,明确两极的直接产物。
(3)确定最终产物:根据介质环境和共存原则,找出参与反应的介质粒子,确定最终产物。
(4)配平:根据电荷守恒、原子守恒配平电极反应式。
[注意] ①H+在碱性环境中不存在;②O2-在水溶液中不存在,在酸性环境中结合H+,生成H2O,在中性或碱性环境结合H2O,生成OH-;③若已知总反应式时,可先写出较易书写的一极的电极反应式,然后在电子守恒的基础上,总反应式减去较易写出的一极的电极反应式,即得到较难写出的另一极的电极反应式。
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)碱性锌锰干电池是一次电池,其中MnO2是催化剂,可使锌锰干电池的比能量高、可储存时间长 ( )
(2)铅酸蓄电池中的反应是可逆反应 ( )
(3)燃料电池中的燃料在负极上发生还原反应 ( )
(4)氢氧燃料电池在碱性电解质溶液中负极反应为2H2-4e-===4H+ ( )
×
×
×
×
2.以甲醇为燃料,写出下列介质中的电极反应式。
(1)酸性溶液(或含质子交换膜)
正极:_______________________;
负极:_______________________。
(2)碱性溶液
正极:_______________________;
负极:_______________________。
[题点考法·全面练通]
题点(一) 一次电池
1.(2022·湖南等级考)海水电池在海洋能源领域备受关注,一种锂 海水电池构造示意图如图。下列说法错误的是 ( )
A.海水起电解质溶液作用
B.N极仅发生的电极反应:2H2O+2e-===2OH-+H2↑
C.玻璃陶瓷具有传导离子和防水的功能
D.该锂 海水电池属于一次电池
解析:海水中含有丰富的电解质,故A正确;Li是活泼金属,作负极,则N为正极,电极反应为O2+2H2O+4e-===4OH-,故B错误;Li易与水反应,玻璃陶瓷的作用是防止水和Li反应,并能传导离子,故C正确;该电池不可充电,属于一次电池,故D正确。
答案:B
2.纸电池是一种有广泛应用的“软电池”,某种碱性纸电池采用薄层纸片作为载体和传导体,纸的两面分别附着锌和二氧化锰。下列有关该纸电池的说法不合理的是 ( )
A.Zn为负极,发生氧化反应
B.电池工作时,电子由MnO2流向Zn
C.正极反应:MnO2+e-+H2O===MnO(OH)+OH-
D.电池总反应:Zn+2MnO2+2H2O===Zn(OH)2+2MnO(OH)
解析:类似于碱性锌锰电池,MnO2在正极上得电子被还原生成MnO(OH),则正极的电极反应式为MnO2+H2O+e-===MnO(OH)+OH-,C正确;负极反应式为Zn+2OH--2e-===Zn(OH)2,结合正、负极反应式及得失电子守恒可知,该电池的总反应式为Zn+2MnO2+2H2O===Zn(OH)2+2MnO(OH),D正确。
答案:B
题点(二) 二次电池
3.某科研团队发明了一种新型的锌离子热充电电池,
可以利用人体产生的低热量充电。该电池以Zn
和VO2 PC为电极材料,实现了低热量发电。
放电时,VO2结合Zn2+生成ZnxVO2·yH2O,原理如
图。下列说法正确的是 ( )
A.分离器可以为阴离子交换膜
B.充电时,阳极电极反应式为ZnxVO2·yH2O+2xe-===VO2+xZn2++yH2O
C.放电时,电流从Zn极流向VO2 PC极
D.充电时,锌离子从较高温一侧移至低温一侧
解析:由分析可知,分离器为阳离子交换膜,A错误;充电时,阳极电极反应式为ZnxVO2·yH2O-2xe-===VO2+xZn2++yH2O,B错误;放电时,Zn为负极,VO2 PC极为正极,电流从VO2 PC极流向Zn极,C错误;充电时,阳离子由阳极区移向阴极区,则锌离子从较高温一侧移至低温一侧,D正确。
答案:D
4.我国科研工作者研制出基于PANa(聚丙烯酸钠)电解质的Zn/NiCo LDMH可充电电池,该电池具有高容量和超长循环稳定性。电池反应为5Zn+6CoOOH+4NiOOH+5H2O 5ZnO+6Co(OH)2+4Ni(OH)2。PANa是一种超强吸水聚合物,吸收大量Zn(CH3COO)2和KOH溶液作为水和离子含量调节剂形成水凝胶电解质,示意图如图。下列说法错误的是( )
A.PANa是一种有机高分子聚合物,在水溶液中不会发生电离
B.PANa具有超强吸水性可避免电池充放电过程中因失水使离子导电率下降
C.放电时,负极附近pH减少
D.充电时,阳极反应为3Co(OH)2+2Ni(OH)2-5e-+5OH-===3CoOOH+2NiOOH+5H2O
解析:PANa在水溶液中电离出聚丙烯酸根离子和Na+,应为离子化合物,A项错误;
PANa是一种超强吸水聚合物,具有超强吸水性,可避免电池充放电过程中因失水使离子导电率下降,B项正确;
分析题给电池反应,放电时,Zn的化合价升高,失去电子,作负极,电极反应为Zn-2e-+2OH-===ZnO+H2O,负极附近OH-浓度降低,pH减小,C项正确;
充电时,Co(OH)2和Ni(OH)2在阳极失去电子得到CoOOH和NiOOH,D项
正确。
答案:A
[思维建模] 二次电池充电时的电极连接
即正极接正极,负极接负极。
题点(三) 常见燃料电池
5.如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700~900 ℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是 ( )
A.电池内的O2-由电极甲移向电极乙
B.电池总反应为N2H4+2O2===2NO+2H2O
C.当甲电极上有1 mol N2H4消耗时,标准状况下乙电极
上有22.4 L O2参与反应
D.电池外电路的电子由电极乙移向电极甲
解析:该燃料电池中,负极上燃料失电子发生氧化反应,为N2H4+2O2--4e-===N2+2H2O,故电极甲作负极,电极乙作正极,正极上氧气得电子发生还原反应,电极反应式为O2+4e-===2O2-,电池总反应为N2H4+O2===N2+2H2O。
答案:C
6.研究发现,在酸性乙醇燃料电池中加入硝酸,可使电池持续大电流放电,其工作原理如图所示。
下列说法错误的是 ( )
A.加入HNO3降低了正极反应的活化能
B.电池工作时正极区溶液的pH增大
C.1 mol CH3CH2OH被完全氧化时有6 mol O2被还原
D.负极反应为CH3CH2OH+3H2O-12e-===2CO2+12H+
解析:由分析知,HNO3在正极起催化作用,作催化剂,则加入HNO3降低了正极反应的活化能,故A正确;
电池工作时正极区的总反应为O2+4e-+4H+===2H2O,则溶液中氢离子浓度减小,pH增大,故B正确;
根据得失电子守恒可知,1 mol CH3CH2OH被完全氧化时,转移12 mol电子,则有3 mol O2被还原,故C错误、D正确。
答案:C
[思维建模]
燃料电池的一般思维模型及正极反应式的书写
(1)燃料电池的一般思维模型
①要注意介质是什么,是电解质溶液还是熔融盐或氧化物。
②通入负极的物质为燃料,通入正极的物质为氧气。
③通过介质中离子的移动方向,可判断电池的正负极,同时考虑该离子参与靠近一极的电极反应。
谢
谢
观
看
同课章节目录
