2024届高考一轮复习 第六章 化学反应与能量 第3讲 电解池 金属的腐蚀与防护 课件(共79张PPT)
文档属性
| 名称 | 2024届高考一轮复习 第六章 化学反应与能量 第3讲 电解池 金属的腐蚀与防护 课件(共79张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-17 22:16:24 | ||
图片预览








文档简介
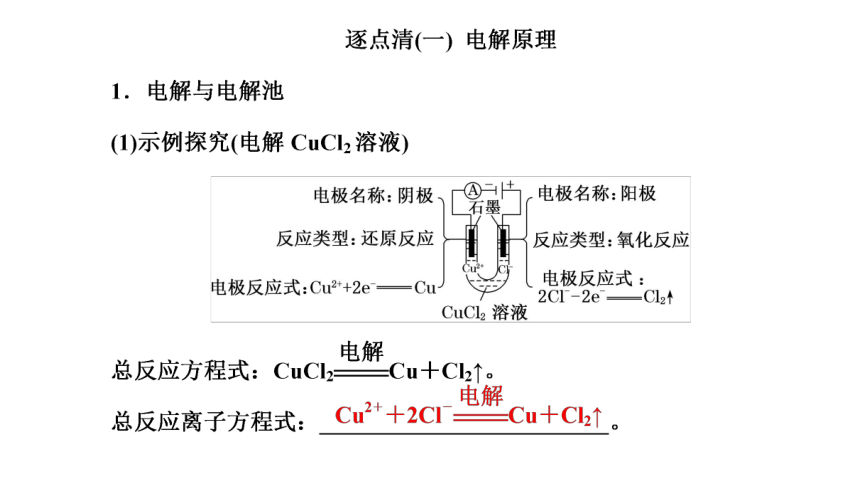
(共79张PPT)
第3讲 电解池 金属的腐蚀与防护(基础落实课)
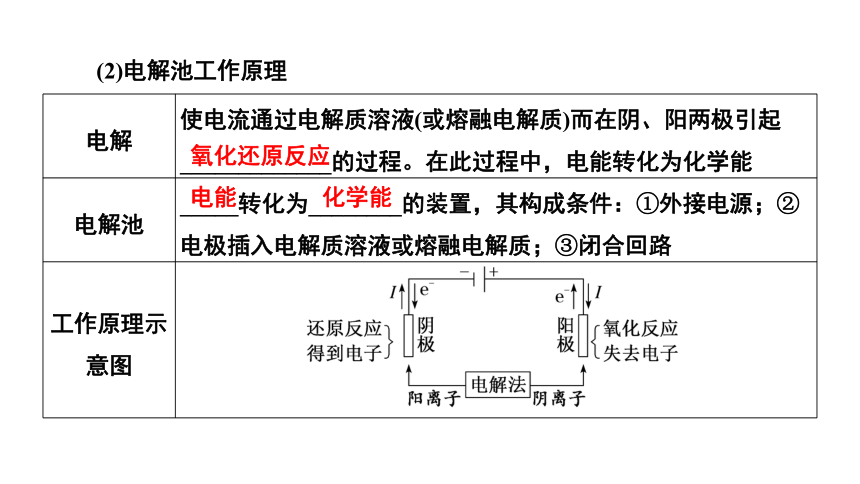
(2)电解池工作原理
电解 使电流通过电解质溶液(或熔融电解质)而在阴、阳两极引起_____________的过程。在此过程中,电能转化为化学能
电解池 _____转化为________的装置,其构成条件:①外接电源;②电极插入电解质溶液或熔融电解质;③闭合回路
工作原理示意图
氧化还原反应
电能
化学能
[注意] ①电子流向:电源负极→阴极,阳极→电源正极;②离子移动方向:阳离子移向阴极,阴离子移向阳极;③电流闭合:电源正极→阳极→溶液→阴极→电源负极。
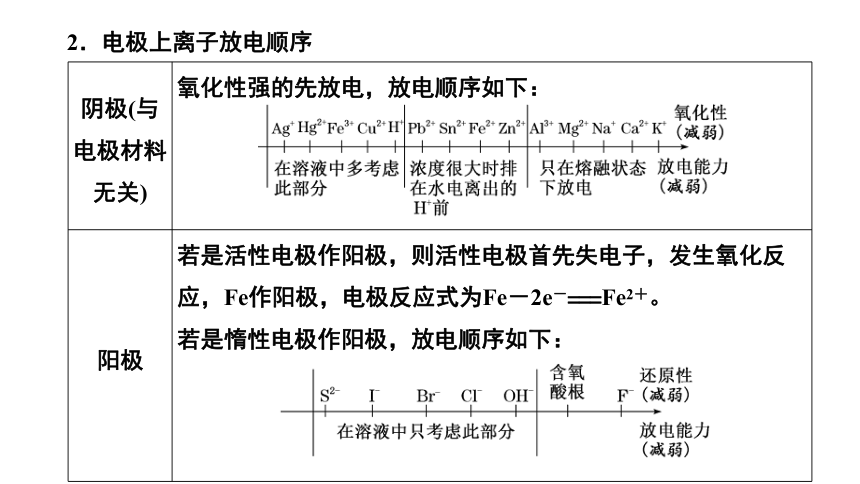
2.电极上离子放电顺序
阴极(与电极材料无关) 氧化性强的先放电,放电顺序如下:
阳极 若是活性电极作阳极,则活性电极首先失电子,发生氧化反应,Fe作阳极,电极反应式为Fe-2e-===Fe2+。
若是惰性电极作阳极,放电顺序如下:
[注意] ①放电指的是电极上的得、失电子。②活性电极指的是除去Au、Pt以外的金属,惰性电极指的是Pt、Au、C电极,不参与电极反应。③阴极材料若为金属电极,一般是增强导电性但不参与反应。
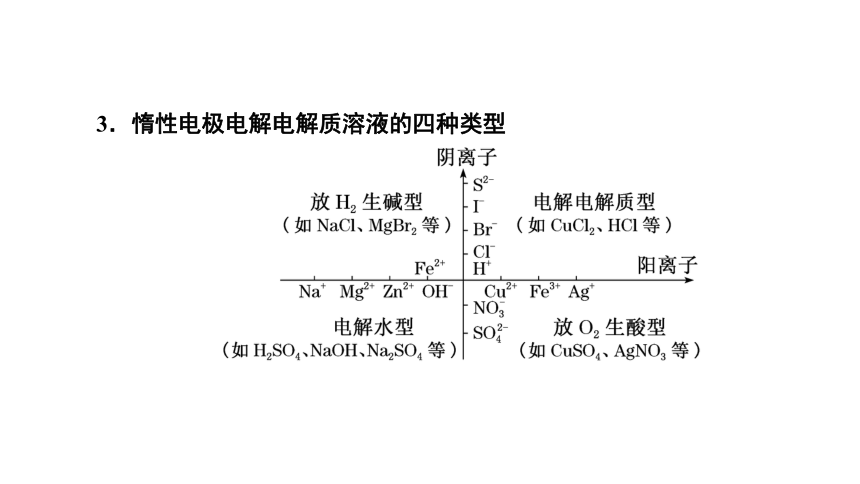
3.惰性电极电解电解质溶液的四种类型
放H2生碱型 (以NaCl为例) 阳极反应式:____________________
阴极反应式:_________________________
电解电解质型 (以HCl为例) 阳极反应式:__________________
阴极反应式:________________
电解水型 (以H2SO4为例) 阳极反应式:_______________________
阴极反应式:_________________
放O2生酸型 (以CuSO4为例) 阳极反应式:_______________________
阴极反应式:__________________
总离子方程式:________________________________
2Cl--2e-===Cl2↑
2H2O+2e-===H2↑+2OH-
2Cl--2e-===Cl2↑
2H++2e-===H2↑
2H2O-4e-===O2↑+4H+
4H++4e-===2H2↑
2H2O-4e-===O2↑+4H+
2Cu2++4e-===2Cu
[注意] 电解后电解质溶液复原遵循“少什么补什么”原则,如电解NaCl溶液少的H和Cl,通入HCl复原,电解CuSO4溶液少的是Cu和O,补CuO复原等。
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)电解质溶液的导电过程就是电解质溶液被电解的过程,属于化学变化 ( )
(2)直流电源跟电解池连接后,电子从电源负极流向电解池阳极 ( )
(3)电解足量CuSO4溶液一段时间,可加入Cu(OH)2复原电解质溶液 ( )
(4)电解盐酸、硫酸等溶液,H+放电,溶液的pH逐渐增大 ( )
×
√
×
×
×
×
2.如图所示为一电解池装置, A、B都是惰性电极,电解质溶液c是
饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞
试剂,试判断:
(1)a电极是______极(填“正”或“负”),B电极是_______极(填“阴”或“阳”),_______极(填“A”或“B”)酚酞溶液显红色。
(2)A电极上的电极反应式为__________________, B电极上的电极反应式为___________________ 。
(3)检验A电极上产物的方法是__________________________________。
答案:(1)正 阴 B
(2)2Cl--2e-===Cl2↑
2H2O+2e-===H2↑+2OH-
(3)把湿润的淀粉碘化钾试纸放在A电极附近,试纸变蓝,则证明A电极上的产物为氯气
[题点考法·全面练通]
题点(一) 电极的判断与电极反应式书写
1.按要求书写电极反应式和总反应方程式。
(1)用惰性电极电解AgNO3溶液。
阳极反应式:__________________________;
阴极反应式:__________________________;
总反应的离子方程式:__________________________。
(2)用惰性电极电解MgCl2溶液。
阳极反应式:__________________________;
阴极反应式__________________________;
总反应的离子方程式:__________________________。
(3)用铁作电极电解NaCl溶液。
阳极反应式:__________________________;
阴极反应式:__________________________;
总反应的化学方程式:__________________________。
(4)用Al作电极电解NaOH溶液。
阳极反应式:__________________________;
阴极反应式: __________________________;
总反应的离子方程式:__________________________。
(5)用Al作阳极,电解H2SO4溶液,铝材表面形成氧化膜。
阳极反应式:__________________________;
阴极反应式:__________________________;
总反应的化学方程式:__________________________。
[归纳拓展] 电极反应式和电解方程式的书写要点
(1)做到“三看”,正确书写电极反应式
①一看电极材料,若是金属(Au、Pt除外)作阳极,金属一定被电解(注:Fe生成Fe2+)。
②二看电解质,电解质是否参与电极反应。
③三看电解质状态,是熔融状态,还是水溶液。
(2)规避“两个”失分点
①书写电解池中电极反应式时,可以以实际放电的离子表示,但书写总电解反应方程式时,弱电解质要写成分子式,且注明“电解”条件。
②电解水溶液时,应注意放电顺序中H+、OH-之后的离子一般不参与放电。
题点(二) 电解原理分析判断
2.用石墨作电极,电解稀Na2SO4溶液的装置如图所示,通电后在石墨电极A和B附近分别滴加一滴石蕊溶液。下列有关叙述正确的是 ( )
A.逸出气体的体积:A电极B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.A电极附近呈红色,B电极附近呈蓝色
D.电解一段时间后,将全部电解液转移到同一烧杯中,充分搅拌后溶液呈中性
答案:D
答案:B
题点(三) 电解原理的创新应用
4.一种电化学制备NH3的装置如图所示,图中陶瓷在高温时可以传输H+。下列叙述错误的是 ( )
A.Pd电极b为阴极
B.阴极的反应式为N2+6H++6e-===2NH3
C.H+由阳极向阴极迁移
D.陶瓷可以隔离N2和H2
解析:此装置为电解池,总反应是N2+3H2===2NH3,Pd电极b上是氢气发生反应,即氢气失去电子化合价升高,Pd电极b为阳极,故A说法错误;根据A选项分析,Pd电极a为阴极,反应式为N2+6H++6e-===2NH3,故B说法正确;根据电解池的原理,阳离子在阴极上放电,即由阳极移向阴极,故C说法正确;根据装置图,陶瓷可以隔离N2和H2,故D说法正确。
答案:A
①写出电解时阴极的电极反应式:__________________________。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成__________________________ 。
(2)电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是 ,说明理由: _______________________
________________________________。
逐点清(二) 电解原理的应用
1.电解饱和食盐水
(1)电极反应
阳极:__________________ (氧化反应),
阴极:__________________________ (还原反应)。
2Cl--2e-===Cl2↑
2H2O+2e-===H2↑+2OH-
(3)应用:氯碱工业——制Cl2、H2和NaOH
①阳离子交换膜的作用
阻止_____进入阳极室与Cl2发生副反应:_____________________________,阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸。
②a、b、c、d加入或排出的物质分别是_________________、_________________、_______、__________;X、Y分别是____、___。
OH-
Cl2+2OH-===Cl-+ClO-+H2O
精制饱和NaCl溶液
含少量NaOH的水
淡盐水
NaOH溶液
Cl2
H2
2.电镀和电解精炼铜
电镀(铁制品上镀Cu) 电解精炼铜
阳极 电极材料 镀层金属铜 粗铜(含Zn、Fe、Ni、Ag、Au等杂质)
电极反应 Cu-2e-===Cu2+ Cu-2e-===Cu2+、Zn-2e-===Zn2+、
Fe-2e-===Fe2+、Ni-2e-===Ni2+
阴极 电极材料 待镀铁制品 精铜
电极反应 Cu2++2e-===Cu 电解质溶液 含Cu2+的盐溶液 电解精炼铜时,粗铜中的Ag、Au等不反应,沉积在电解池底部形成阳极泥 [注意] 电镀Cu时,电镀液CuSO4浓度不变,电解精炼Cu时,电解液浓度变小。
3.电冶金
本质为Mn++ne-===M,利用电解熔融盐(或氧化物)的方法来冶炼活泼金属Na、Ca、Mg、Al等。
[注意] ①工业上不能电解熔融MgO、AlCl3制Mg和Al。②由于AlCl3为共价化合物,熔融状态下不导电,所以电解冶炼铝时,电解熔点很高的氧化铝,为降低熔点,加入了助熔剂冰晶石(Na3AlF6);而且电解过程中,阳极生成的氧气与石墨电极反应,所以石墨电极需定期检查并及时更换补充。
微点小练
判断正误(正确的打“√”,错误的打“×”)。
(1)电解饱和食盐水制碱时,用Fe作阴极可增强导电性 ( )
(2)电解熔融NaCl与电解饱和食盐水的反应原理相同 ( )
(3)工业上电解饱和食盐水中,Na+通过交换膜移向阳极 ( )
(4)电解饱和食盐水制碱时,食盐水中不能含有Ca2+、Mg2+等离子 ( )
√
×
×
√
(5)电解精炼铜时,杂质Zn、Au、Ag均不溶解,形成阳极泥而沉淀( )
(6)电镀铜和电解精炼铜时,电解质溶液中c(Cu2+)均保持不变 ( )
(7)电解精炼银时,粗银作阴极 ( )
(8)用电解法冶炼活泼金属时,不能电解相应化合物的水溶液 ( )
×
×
×
√
解析:阴极发生2H++2e-===H2↑,不是氯气,B错误。
答案:B
2.氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的电极反应式为____________,与电源负极相连的电极附近,溶液pH_______(填“不变”“升高”或“下降”)。
题点(二) 电镀、电冶金与精炼
3.(2022·广东等级考)以熔融盐为电解液,以含Cu、Mg和Si等的铝合金废料为阳极进行电解,实现Al的再生。该过程中 ( )
A.阴极发生的反应为Mg-2e-===Mg2+
B.阴极上Al被氧化
C.在电解槽底部产生含Cu的阳极泥
D.阳极和阴极的质量变化相等
解析:阴极应发生得电子的还原反应,实际上Mg在阳极失电子生成Mg2+,A错误;Al在阳极上被氧化生成Al3+,B错误;阳极材料中Cu和Si不参与氧化反应,在电解槽底部可形成阳极泥,C正确;因为阳极除了铝参与电子转移,镁也参与了电子转移,且还会形成阳极泥,而阴极只有铝离子得电子生成铝单质,根据电子转移数守恒及元素守恒可知,阳极与阴极的质量变化不相等,D错误。
答案:C
4.金属镍有广泛的用途,粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+A.阳极发生还原反应,其电极反应式为Ni2++2e-===Ni
B.电解过程中,阳极质量的减少量与阴极质量的增加量一定相等
C.电解后,电解槽底部的阳极泥中含有Cu和Pt
D.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
解析:电解法制备高纯度的镍,粗镍作为阳极,金属按还原性顺序Zn>Fe>Ni>Cu>Pt发生氧化反应,电极反应依次为Zn-2e-===Zn2+、Fe-2e-===Fe2+、Ni-2e-===Ni2+,A项错误;电解过程中,阳极Zn、Fe、Ni溶解,Cu、Pt沉积到电解槽底部,阴极只析出Ni,结合两极转移的电子数相等,阳极质量的减少量与阴极质量的增加量不相等,B项错误;Cu和Pt还原性比Ni弱,不能失去电子,以沉淀的形式沉积在电解槽底部,形成阳极泥,C项正确;电解后,溶液中存在的金属阳离子除了Fe2+、Zn2+外,还有Ni2+,D项错误。
答案:C
题点(三) 电解原理在环境治理方面的应用
5.我国科研工作者提出通过电解原理联合制备环氧乙烷同时处理酸性含铬废水,其工作原理示意图如图所示。其中双极膜由阳离子交换膜和阴离子交换膜组成,工作时内层H2O解离为H+和OH-,并分别向两极迁移。下列说法正确的是 ( )
答案:D
解析:从装置图中可知,X端连接的电极上发生反应是微生物作用下BOD、H2O反应生成CO2,Y端连接的电极上,微生物作用下,硝酸根离子生成了氮气,氮元素化合价降低,发生还原反应,为电解池的阴极,则Y为负极,X为正极,结合电极反应和电子守恒计算,质子膜允许氢离子通过。
答案:B
逐点清(三) 金属的腐蚀与防护
1.金属的腐蚀
(1)金属腐蚀的本质
金属原子失去电子变成___________,金属发生氧化反应。
金属阳离子
类型 化学腐蚀 电化学腐蚀
条件 金属与接触到的物质直接反应 不纯金属接触到___________发生原电池反应
本质 M-ne-===Mn+ 现象 金属被腐蚀 较活泼金属被腐蚀 区别 无电流产生 ________电流产生 联系 电化学腐蚀比化学腐蚀普遍得多,腐蚀速率更快,危害也更严重 (2)金属腐蚀的类型
①化学腐蚀与电化学腐蚀
电解质溶液
有微弱
②析氢腐蚀与吸氧腐蚀(以钢铁的腐蚀为例)
类型 析氢腐蚀 吸氧腐蚀
条件 水膜酸性较强(pH≤4.3) 水膜酸性很弱或呈中性
电极反应 负极 _________________ 正极 ______________ _______________________
总反应式 _____________________ _________________________
联系 ________腐蚀更普遍 2H++2e-===H2↑
O2+2H2O+4e-===4OH-
Fe+2H+=== Fe2++H2↑
2Fe+O2+2H2O===2Fe(OH)2
吸氧
[注意] 铁锈的形成:4Fe(OH)2+O2+2H2O===4Fe(OH)3,
2Fe(OH)3===Fe2O3·xH2O(铁锈)+(3-x)H2O。
Fe-2e-===Fe2+
2.金属的防护
(1)改变金属材料的组成:制成合金(如不锈钢)。
(2)在金属表面覆盖保护层:①喷涂油漆、矿物性油脂或覆盖搪瓷、塑料等;②电镀一层金属;③发蓝处理;④阳极氧化处理铝制品,形成钝化膜等。
(3)电化学保护法
牺牲阳极法 原电池原理,外接活泼金属作负极(阳极)使被保护钢铁设备作正极(阴极)
外加电流法 电解原理,被保护钢铁设备作阴极,用惰性电极作辅助阳极。通电后强制电子流向被保护的钢铁设备,使钢铁设备表面腐蚀电流降至零或接近零。从而使钢铁设备受到保护
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)纯银器在空气中因电化学腐蚀表面渐渐变暗 ( )
(2)金属的化学腐蚀比电化学腐蚀更普遍 ( )
(3)生铁浸泡在食盐水中发生析氢腐蚀 ( )
(4)当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 ( )
(5)牺牲阳极法是利用电解原理防腐蚀 ( )
(6)将水库中的水闸(钢板)与外加直流电源的负极相连,可防止水闸被腐蚀 ( )
×
×
×
×
×
√
2.下列说法不正确的是 ( )
A.图甲:钢铁表面水膜酸性很弱或呈中性,发生吸氧腐蚀
B.图乙:钢铁表面水膜酸性较强,发生析氢腐蚀
C.图丙:钢闸门作为阴极而受到保护
D.图丁:将锌板换成铜板对钢闸门保护效果更好
解析:金属的腐蚀分为吸氧腐蚀和析氢腐蚀,若钢铁表面水膜酸性很弱或呈中性,发生吸氧腐蚀,若钢铁表面水膜酸性较强,则发生析氢腐蚀,A、B正确;钢闸门连接外加电源的负极,作阴极,被保护,C正确;若将锌板换成铜板,则钢闸门与铜板形成原电池,钢闸门作负极,会加快腐蚀,D错误。
答案:D
[题点考法·全面练通]
题点(一) 金属的腐蚀原理及影响因素
1.如图,将一根纯铁棒垂直没入水中,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重。下列关于此现象的说法不正确的是 ( )
A.铁棒AB段的溶解氧浓度高于BC段
B.铁棒AB段电极反应为O2+2H2O+4e-===4OH-
C.铁棒AB段的Fe2+浓度高于BC段
D.该腐蚀过程属于电化学腐蚀
解析: AB段作原电池正极,BC段为原电池负极。BC段为Fe-2e-===Fe2+,AB段为O2+2H2O+4e-===4OH-,BC段溶解而被腐蚀,AB段形成铁锈。
答案:C
2.如图所示,各烧杯中盛海水,铁在其中被腐蚀的速度由快到慢的顺序为 ( )
A.②①③④⑤⑥ B.⑤④③①②⑥
C.⑤④②①③⑥ D.⑤③②④①⑥
解析:①是Fe为负极,杂质碳为正极的原电池腐蚀,是铁的吸氧腐蚀,腐蚀较慢;②③④均为原电池,③中Fe为正极,被保护,②④中Fe为负极,均被腐蚀,但Fe和Cu的金属活动性差别大于Fe和Sn的,故Fe Cu 原电池中Fe被腐蚀的较快;⑤是Fe接电源正极作阳极,Cu接电源负极作阴极的电解腐蚀,加快了Fe的腐蚀;⑥是Fe接电源负极作阴极、Cu接电源正极作阳极的电解池,防止了Fe的腐蚀。根据以上分析可知铁在其中被腐蚀由快到慢的顺序为⑤>④>②>①>③>⑥。
答案:C
3.(2022·广东等级考)为检验牺牲阳极的阴极保护法对钢铁防腐的效果,将镀层有破损的镀锌铁片放入酸化的3%NaCl溶液中。一段时间后,取溶液分别实验,能说明铁片没有被腐蚀的是 ( )
A.加入AgNO3溶液产生沉淀
B.加入淀粉碘化钾溶液无蓝色出现
C.加入KSCN溶液无红色出现
D.加入K3[Fe(CN)6]溶液无蓝色沉淀生成
解析: A项,氯化钠溶液中始终存在氯离子,所以加入硝酸银溶液后,不管铁片是否被腐蚀,均会出现白色沉淀;B项,淀粉碘化钾溶液可检验氧化性物质,但不论铁片是否被腐蚀,均无氧化性物质与淀粉碘化钾发生反应;C项中不会出现Fe3+,所以无论铁片是否被腐蚀,加入KSCN溶液后,均无红色出现;K3[Fe(CN)6]是用于检验Fe2+的试剂,若铁片没有被腐蚀,则溶液中不会生成亚铁离子,则加入K3[Fe(CN)6]溶液就不会出现蓝色沉淀,故D符合题意。
答案:D
[思维建模] 判断金属腐蚀快慢的方法
1 对同一电解质溶液来说,腐蚀的快慢:电解池原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀。
2 对同一金属来说,腐蚀的快慢:强电解质溶液中>弱电解质溶液中>非电解质溶液中。 浓度相同
3 活动性不同的两种金属,活动性差异越大,腐蚀越快。
4 对同一种电解质溶液来说,电解质浓度越大,金属腐蚀速率越快。
题点(二) 金属的防护原理
4.湖北省随州市出土的曾侯乙编钟,是战国早期的青铜编钟,主要由铜锡合金冶炼铸造而成,保存完好。下列有关说法错误的是 ( )
A.锡青铜的熔点比纯铜低
B.在自然环境中,锡青铜中的锡可对铜起保护作用
C.青铜文物在潮湿环境中的腐蚀比干燥环境中快
D.锡青铜表面生成Cu2(OH)3Cl覆盖物的过程属于化学腐蚀
解析:合金的熔点比各组分的熔点都低,所以锡青铜的熔点比纯铜低,故A正确;由于锡的金属性强于铜,在自然环境中发生电化学腐蚀时,锡做负极被损耗,铜做正极被保护,故B正确;青铜文物在潮湿环境中会构成锡铜原电池,原电池反应使反应速率加快,所以青铜文物在潮湿环境中的腐蚀比干燥环境中快,故C正确;铜锡合金在潮湿的环境下会与碳形成原电池,碳作原电池的正极,铜做负极,发生吸氧腐蚀生成Cu2(OH)3Cl,该过程是电化学腐蚀的过程,故D错误。
答案:D
5.验证牺牲阳极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
① 在Fe表面生成蓝色沉淀
② 试管内无明显变化
③ 试管内生成蓝色沉淀
下列说法不正确的是 ( )
A.对比②③,可以判定Zn保护了Fe
B.对比①②,K3[Fe(CN)6]可能将Fe氧化
C.验证Zn保护Fe时不能用①的方法
D.将Zn换成Cu,用①的方法可判断Fe比Cu活泼
解析:②中Zn作负极,发生氧化反应生成Zn2+,Fe作正极被保护,所以取出的少量Fe附近的溶液中滴入铁氰化钾溶液,试管内无明显变化。但③中没有Zn保护Fe,Fe在酸性环境中发生析氢腐蚀,Fe作负极被氧化生成Fe2+,所以取出的少量Fe附近的溶液中滴入铁氰化钾溶液,生成蓝色沉淀,对比②③可知Zn保护了Fe,A项正确;①与②的区别在于:前者是将铁氰化钾溶液直接滴入烧杯中,而后者是在取出的少量Fe附近的溶液中滴加铁氰化钾溶液,①中出现了蓝色沉淀,说明有Fe2+生成。对比分析可知,可能是铁氰化钾氧化Fe生成了Fe2+,B项正确;通过上述分析可知,验证Zn保护Fe时不能用①的方法,C项正确;若将Zn换成Cu,铁氰化钾仍会将Fe氧化为Fe2+,在铁的表面同样会生成蓝色沉淀,所以无法判断Fe2+是不是负极产物,即无法判断Fe与Cu的活动性,D项错误。
答案:D
6. 我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀,防护原理如图所示。
下列说法错误的是 ( )
A.通电时,锌环是阳极,发生氧化反应
B.通电时,阴极上的电极反应为
2H2O+2e-===H2↑+2OH-
C.断电时,锌环上的电极反应为Zn+2e-===Zn2+
D.断电时,仍能防止铁帽被腐蚀
解析:通电时,锌环与电源正极相连,锌环作阳极,锌失电子发生氧化反应,故A正确;铁帽为阴极,阴极上H2O得到电子生成氢气,阴极电极反应为2H2O+2e-===H2↑+2OH-,故B正确;断电时,锌铁形成原电池,锌失电子生成Zn2+,锌环上的电极反应为Zn-2e-===Zn2+,Fe作正极被保护,仍能防止铁帽被腐蚀,故C错误、D正确。
答案:C
谢
谢
观
看
第3讲 电解池 金属的腐蚀与防护(基础落实课)
(2)电解池工作原理
电解 使电流通过电解质溶液(或熔融电解质)而在阴、阳两极引起_____________的过程。在此过程中,电能转化为化学能
电解池 _____转化为________的装置,其构成条件:①外接电源;②电极插入电解质溶液或熔融电解质;③闭合回路
工作原理示意图
氧化还原反应
电能
化学能
[注意] ①电子流向:电源负极→阴极,阳极→电源正极;②离子移动方向:阳离子移向阴极,阴离子移向阳极;③电流闭合:电源正极→阳极→溶液→阴极→电源负极。
2.电极上离子放电顺序
阴极(与电极材料无关) 氧化性强的先放电,放电顺序如下:
阳极 若是活性电极作阳极,则活性电极首先失电子,发生氧化反应,Fe作阳极,电极反应式为Fe-2e-===Fe2+。
若是惰性电极作阳极,放电顺序如下:
[注意] ①放电指的是电极上的得、失电子。②活性电极指的是除去Au、Pt以外的金属,惰性电极指的是Pt、Au、C电极,不参与电极反应。③阴极材料若为金属电极,一般是增强导电性但不参与反应。
3.惰性电极电解电解质溶液的四种类型
放H2生碱型 (以NaCl为例) 阳极反应式:____________________
阴极反应式:_________________________
电解电解质型 (以HCl为例) 阳极反应式:__________________
阴极反应式:________________
电解水型 (以H2SO4为例) 阳极反应式:_______________________
阴极反应式:_________________
放O2生酸型 (以CuSO4为例) 阳极反应式:_______________________
阴极反应式:__________________
总离子方程式:________________________________
2Cl--2e-===Cl2↑
2H2O+2e-===H2↑+2OH-
2Cl--2e-===Cl2↑
2H++2e-===H2↑
2H2O-4e-===O2↑+4H+
4H++4e-===2H2↑
2H2O-4e-===O2↑+4H+
2Cu2++4e-===2Cu
[注意] 电解后电解质溶液复原遵循“少什么补什么”原则,如电解NaCl溶液少的H和Cl,通入HCl复原,电解CuSO4溶液少的是Cu和O,补CuO复原等。
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)电解质溶液的导电过程就是电解质溶液被电解的过程,属于化学变化 ( )
(2)直流电源跟电解池连接后,电子从电源负极流向电解池阳极 ( )
(3)电解足量CuSO4溶液一段时间,可加入Cu(OH)2复原电解质溶液 ( )
(4)电解盐酸、硫酸等溶液,H+放电,溶液的pH逐渐增大 ( )
×
√
×
×
×
×
2.如图所示为一电解池装置, A、B都是惰性电极,电解质溶液c是
饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞
试剂,试判断:
(1)a电极是______极(填“正”或“负”),B电极是_______极(填“阴”或“阳”),_______极(填“A”或“B”)酚酞溶液显红色。
(2)A电极上的电极反应式为__________________, B电极上的电极反应式为___________________ 。
(3)检验A电极上产物的方法是__________________________________。
答案:(1)正 阴 B
(2)2Cl--2e-===Cl2↑
2H2O+2e-===H2↑+2OH-
(3)把湿润的淀粉碘化钾试纸放在A电极附近,试纸变蓝,则证明A电极上的产物为氯气
[题点考法·全面练通]
题点(一) 电极的判断与电极反应式书写
1.按要求书写电极反应式和总反应方程式。
(1)用惰性电极电解AgNO3溶液。
阳极反应式:__________________________;
阴极反应式:__________________________;
总反应的离子方程式:__________________________。
(2)用惰性电极电解MgCl2溶液。
阳极反应式:__________________________;
阴极反应式__________________________;
总反应的离子方程式:__________________________。
(3)用铁作电极电解NaCl溶液。
阳极反应式:__________________________;
阴极反应式:__________________________;
总反应的化学方程式:__________________________。
(4)用Al作电极电解NaOH溶液。
阳极反应式:__________________________;
阴极反应式: __________________________;
总反应的离子方程式:__________________________。
(5)用Al作阳极,电解H2SO4溶液,铝材表面形成氧化膜。
阳极反应式:__________________________;
阴极反应式:__________________________;
总反应的化学方程式:__________________________。
[归纳拓展] 电极反应式和电解方程式的书写要点
(1)做到“三看”,正确书写电极反应式
①一看电极材料,若是金属(Au、Pt除外)作阳极,金属一定被电解(注:Fe生成Fe2+)。
②二看电解质,电解质是否参与电极反应。
③三看电解质状态,是熔融状态,还是水溶液。
(2)规避“两个”失分点
①书写电解池中电极反应式时,可以以实际放电的离子表示,但书写总电解反应方程式时,弱电解质要写成分子式,且注明“电解”条件。
②电解水溶液时,应注意放电顺序中H+、OH-之后的离子一般不参与放电。
题点(二) 电解原理分析判断
2.用石墨作电极,电解稀Na2SO4溶液的装置如图所示,通电后在石墨电极A和B附近分别滴加一滴石蕊溶液。下列有关叙述正确的是 ( )
A.逸出气体的体积:A电极
C.A电极附近呈红色,B电极附近呈蓝色
D.电解一段时间后,将全部电解液转移到同一烧杯中,充分搅拌后溶液呈中性
答案:D
答案:B
题点(三) 电解原理的创新应用
4.一种电化学制备NH3的装置如图所示,图中陶瓷在高温时可以传输H+。下列叙述错误的是 ( )
A.Pd电极b为阴极
B.阴极的反应式为N2+6H++6e-===2NH3
C.H+由阳极向阴极迁移
D.陶瓷可以隔离N2和H2
解析:此装置为电解池,总反应是N2+3H2===2NH3,Pd电极b上是氢气发生反应,即氢气失去电子化合价升高,Pd电极b为阳极,故A说法错误;根据A选项分析,Pd电极a为阴极,反应式为N2+6H++6e-===2NH3,故B说法正确;根据电解池的原理,阳离子在阴极上放电,即由阳极移向阴极,故C说法正确;根据装置图,陶瓷可以隔离N2和H2,故D说法正确。
答案:A
①写出电解时阴极的电极反应式:__________________________。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成__________________________ 。
(2)电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是 ,说明理由: _______________________
________________________________。
逐点清(二) 电解原理的应用
1.电解饱和食盐水
(1)电极反应
阳极:__________________ (氧化反应),
阴极:__________________________ (还原反应)。
2Cl--2e-===Cl2↑
2H2O+2e-===H2↑+2OH-
(3)应用:氯碱工业——制Cl2、H2和NaOH
①阳离子交换膜的作用
阻止_____进入阳极室与Cl2发生副反应:_____________________________,阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸。
②a、b、c、d加入或排出的物质分别是_________________、_________________、_______、__________;X、Y分别是____、___。
OH-
Cl2+2OH-===Cl-+ClO-+H2O
精制饱和NaCl溶液
含少量NaOH的水
淡盐水
NaOH溶液
Cl2
H2
2.电镀和电解精炼铜
电镀(铁制品上镀Cu) 电解精炼铜
阳极 电极材料 镀层金属铜 粗铜(含Zn、Fe、Ni、Ag、Au等杂质)
电极反应 Cu-2e-===Cu2+ Cu-2e-===Cu2+、Zn-2e-===Zn2+、
Fe-2e-===Fe2+、Ni-2e-===Ni2+
阴极 电极材料 待镀铁制品 精铜
电极反应 Cu2++2e-===Cu 电解质溶液 含Cu2+的盐溶液 电解精炼铜时,粗铜中的Ag、Au等不反应,沉积在电解池底部形成阳极泥 [注意] 电镀Cu时,电镀液CuSO4浓度不变,电解精炼Cu时,电解液浓度变小。
3.电冶金
本质为Mn++ne-===M,利用电解熔融盐(或氧化物)的方法来冶炼活泼金属Na、Ca、Mg、Al等。
[注意] ①工业上不能电解熔融MgO、AlCl3制Mg和Al。②由于AlCl3为共价化合物,熔融状态下不导电,所以电解冶炼铝时,电解熔点很高的氧化铝,为降低熔点,加入了助熔剂冰晶石(Na3AlF6);而且电解过程中,阳极生成的氧气与石墨电极反应,所以石墨电极需定期检查并及时更换补充。
微点小练
判断正误(正确的打“√”,错误的打“×”)。
(1)电解饱和食盐水制碱时,用Fe作阴极可增强导电性 ( )
(2)电解熔融NaCl与电解饱和食盐水的反应原理相同 ( )
(3)工业上电解饱和食盐水中,Na+通过交换膜移向阳极 ( )
(4)电解饱和食盐水制碱时,食盐水中不能含有Ca2+、Mg2+等离子 ( )
√
×
×
√
(5)电解精炼铜时,杂质Zn、Au、Ag均不溶解,形成阳极泥而沉淀( )
(6)电镀铜和电解精炼铜时,电解质溶液中c(Cu2+)均保持不变 ( )
(7)电解精炼银时,粗银作阴极 ( )
(8)用电解法冶炼活泼金属时,不能电解相应化合物的水溶液 ( )
×
×
×
√
解析:阴极发生2H++2e-===H2↑,不是氯气,B错误。
答案:B
2.氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的电极反应式为____________,与电源负极相连的电极附近,溶液pH_______(填“不变”“升高”或“下降”)。
题点(二) 电镀、电冶金与精炼
3.(2022·广东等级考)以熔融盐为电解液,以含Cu、Mg和Si等的铝合金废料为阳极进行电解,实现Al的再生。该过程中 ( )
A.阴极发生的反应为Mg-2e-===Mg2+
B.阴极上Al被氧化
C.在电解槽底部产生含Cu的阳极泥
D.阳极和阴极的质量变化相等
解析:阴极应发生得电子的还原反应,实际上Mg在阳极失电子生成Mg2+,A错误;Al在阳极上被氧化生成Al3+,B错误;阳极材料中Cu和Si不参与氧化反应,在电解槽底部可形成阳极泥,C正确;因为阳极除了铝参与电子转移,镁也参与了电子转移,且还会形成阳极泥,而阴极只有铝离子得电子生成铝单质,根据电子转移数守恒及元素守恒可知,阳极与阴极的质量变化不相等,D错误。
答案:C
4.金属镍有广泛的用途,粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+
B.电解过程中,阳极质量的减少量与阴极质量的增加量一定相等
C.电解后,电解槽底部的阳极泥中含有Cu和Pt
D.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
解析:电解法制备高纯度的镍,粗镍作为阳极,金属按还原性顺序Zn>Fe>Ni>Cu>Pt发生氧化反应,电极反应依次为Zn-2e-===Zn2+、Fe-2e-===Fe2+、Ni-2e-===Ni2+,A项错误;电解过程中,阳极Zn、Fe、Ni溶解,Cu、Pt沉积到电解槽底部,阴极只析出Ni,结合两极转移的电子数相等,阳极质量的减少量与阴极质量的增加量不相等,B项错误;Cu和Pt还原性比Ni弱,不能失去电子,以沉淀的形式沉积在电解槽底部,形成阳极泥,C项正确;电解后,溶液中存在的金属阳离子除了Fe2+、Zn2+外,还有Ni2+,D项错误。
答案:C
题点(三) 电解原理在环境治理方面的应用
5.我国科研工作者提出通过电解原理联合制备环氧乙烷同时处理酸性含铬废水,其工作原理示意图如图所示。其中双极膜由阳离子交换膜和阴离子交换膜组成,工作时内层H2O解离为H+和OH-,并分别向两极迁移。下列说法正确的是 ( )
答案:D
解析:从装置图中可知,X端连接的电极上发生反应是微生物作用下BOD、H2O反应生成CO2,Y端连接的电极上,微生物作用下,硝酸根离子生成了氮气,氮元素化合价降低,发生还原反应,为电解池的阴极,则Y为负极,X为正极,结合电极反应和电子守恒计算,质子膜允许氢离子通过。
答案:B
逐点清(三) 金属的腐蚀与防护
1.金属的腐蚀
(1)金属腐蚀的本质
金属原子失去电子变成___________,金属发生氧化反应。
金属阳离子
类型 化学腐蚀 电化学腐蚀
条件 金属与接触到的物质直接反应 不纯金属接触到___________发生原电池反应
本质 M-ne-===Mn+ 现象 金属被腐蚀 较活泼金属被腐蚀 区别 无电流产生 ________电流产生 联系 电化学腐蚀比化学腐蚀普遍得多,腐蚀速率更快,危害也更严重 (2)金属腐蚀的类型
①化学腐蚀与电化学腐蚀
电解质溶液
有微弱
②析氢腐蚀与吸氧腐蚀(以钢铁的腐蚀为例)
类型 析氢腐蚀 吸氧腐蚀
条件 水膜酸性较强(pH≤4.3) 水膜酸性很弱或呈中性
电极反应 负极 _________________ 正极 ______________ _______________________
总反应式 _____________________ _________________________
联系 ________腐蚀更普遍 2H++2e-===H2↑
O2+2H2O+4e-===4OH-
Fe+2H+=== Fe2++H2↑
2Fe+O2+2H2O===2Fe(OH)2
吸氧
[注意] 铁锈的形成:4Fe(OH)2+O2+2H2O===4Fe(OH)3,
2Fe(OH)3===Fe2O3·xH2O(铁锈)+(3-x)H2O。
Fe-2e-===Fe2+
2.金属的防护
(1)改变金属材料的组成:制成合金(如不锈钢)。
(2)在金属表面覆盖保护层:①喷涂油漆、矿物性油脂或覆盖搪瓷、塑料等;②电镀一层金属;③发蓝处理;④阳极氧化处理铝制品,形成钝化膜等。
(3)电化学保护法
牺牲阳极法 原电池原理,外接活泼金属作负极(阳极)使被保护钢铁设备作正极(阴极)
外加电流法 电解原理,被保护钢铁设备作阴极,用惰性电极作辅助阳极。通电后强制电子流向被保护的钢铁设备,使钢铁设备表面腐蚀电流降至零或接近零。从而使钢铁设备受到保护
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)纯银器在空气中因电化学腐蚀表面渐渐变暗 ( )
(2)金属的化学腐蚀比电化学腐蚀更普遍 ( )
(3)生铁浸泡在食盐水中发生析氢腐蚀 ( )
(4)当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 ( )
(5)牺牲阳极法是利用电解原理防腐蚀 ( )
(6)将水库中的水闸(钢板)与外加直流电源的负极相连,可防止水闸被腐蚀 ( )
×
×
×
×
×
√
2.下列说法不正确的是 ( )
A.图甲:钢铁表面水膜酸性很弱或呈中性,发生吸氧腐蚀
B.图乙:钢铁表面水膜酸性较强,发生析氢腐蚀
C.图丙:钢闸门作为阴极而受到保护
D.图丁:将锌板换成铜板对钢闸门保护效果更好
解析:金属的腐蚀分为吸氧腐蚀和析氢腐蚀,若钢铁表面水膜酸性很弱或呈中性,发生吸氧腐蚀,若钢铁表面水膜酸性较强,则发生析氢腐蚀,A、B正确;钢闸门连接外加电源的负极,作阴极,被保护,C正确;若将锌板换成铜板,则钢闸门与铜板形成原电池,钢闸门作负极,会加快腐蚀,D错误。
答案:D
[题点考法·全面练通]
题点(一) 金属的腐蚀原理及影响因素
1.如图,将一根纯铁棒垂直没入水中,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重。下列关于此现象的说法不正确的是 ( )
A.铁棒AB段的溶解氧浓度高于BC段
B.铁棒AB段电极反应为O2+2H2O+4e-===4OH-
C.铁棒AB段的Fe2+浓度高于BC段
D.该腐蚀过程属于电化学腐蚀
解析: AB段作原电池正极,BC段为原电池负极。BC段为Fe-2e-===Fe2+,AB段为O2+2H2O+4e-===4OH-,BC段溶解而被腐蚀,AB段形成铁锈。
答案:C
2.如图所示,各烧杯中盛海水,铁在其中被腐蚀的速度由快到慢的顺序为 ( )
A.②①③④⑤⑥ B.⑤④③①②⑥
C.⑤④②①③⑥ D.⑤③②④①⑥
解析:①是Fe为负极,杂质碳为正极的原电池腐蚀,是铁的吸氧腐蚀,腐蚀较慢;②③④均为原电池,③中Fe为正极,被保护,②④中Fe为负极,均被腐蚀,但Fe和Cu的金属活动性差别大于Fe和Sn的,故Fe Cu 原电池中Fe被腐蚀的较快;⑤是Fe接电源正极作阳极,Cu接电源负极作阴极的电解腐蚀,加快了Fe的腐蚀;⑥是Fe接电源负极作阴极、Cu接电源正极作阳极的电解池,防止了Fe的腐蚀。根据以上分析可知铁在其中被腐蚀由快到慢的顺序为⑤>④>②>①>③>⑥。
答案:C
3.(2022·广东等级考)为检验牺牲阳极的阴极保护法对钢铁防腐的效果,将镀层有破损的镀锌铁片放入酸化的3%NaCl溶液中。一段时间后,取溶液分别实验,能说明铁片没有被腐蚀的是 ( )
A.加入AgNO3溶液产生沉淀
B.加入淀粉碘化钾溶液无蓝色出现
C.加入KSCN溶液无红色出现
D.加入K3[Fe(CN)6]溶液无蓝色沉淀生成
解析: A项,氯化钠溶液中始终存在氯离子,所以加入硝酸银溶液后,不管铁片是否被腐蚀,均会出现白色沉淀;B项,淀粉碘化钾溶液可检验氧化性物质,但不论铁片是否被腐蚀,均无氧化性物质与淀粉碘化钾发生反应;C项中不会出现Fe3+,所以无论铁片是否被腐蚀,加入KSCN溶液后,均无红色出现;K3[Fe(CN)6]是用于检验Fe2+的试剂,若铁片没有被腐蚀,则溶液中不会生成亚铁离子,则加入K3[Fe(CN)6]溶液就不会出现蓝色沉淀,故D符合题意。
答案:D
[思维建模] 判断金属腐蚀快慢的方法
1 对同一电解质溶液来说,腐蚀的快慢:电解池原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀。
2 对同一金属来说,腐蚀的快慢:强电解质溶液中>弱电解质溶液中>非电解质溶液中。 浓度相同
3 活动性不同的两种金属,活动性差异越大,腐蚀越快。
4 对同一种电解质溶液来说,电解质浓度越大,金属腐蚀速率越快。
题点(二) 金属的防护原理
4.湖北省随州市出土的曾侯乙编钟,是战国早期的青铜编钟,主要由铜锡合金冶炼铸造而成,保存完好。下列有关说法错误的是 ( )
A.锡青铜的熔点比纯铜低
B.在自然环境中,锡青铜中的锡可对铜起保护作用
C.青铜文物在潮湿环境中的腐蚀比干燥环境中快
D.锡青铜表面生成Cu2(OH)3Cl覆盖物的过程属于化学腐蚀
解析:合金的熔点比各组分的熔点都低,所以锡青铜的熔点比纯铜低,故A正确;由于锡的金属性强于铜,在自然环境中发生电化学腐蚀时,锡做负极被损耗,铜做正极被保护,故B正确;青铜文物在潮湿环境中会构成锡铜原电池,原电池反应使反应速率加快,所以青铜文物在潮湿环境中的腐蚀比干燥环境中快,故C正确;铜锡合金在潮湿的环境下会与碳形成原电池,碳作原电池的正极,铜做负极,发生吸氧腐蚀生成Cu2(OH)3Cl,该过程是电化学腐蚀的过程,故D错误。
答案:D
5.验证牺牲阳极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
① 在Fe表面生成蓝色沉淀
② 试管内无明显变化
③ 试管内生成蓝色沉淀
下列说法不正确的是 ( )
A.对比②③,可以判定Zn保护了Fe
B.对比①②,K3[Fe(CN)6]可能将Fe氧化
C.验证Zn保护Fe时不能用①的方法
D.将Zn换成Cu,用①的方法可判断Fe比Cu活泼
解析:②中Zn作负极,发生氧化反应生成Zn2+,Fe作正极被保护,所以取出的少量Fe附近的溶液中滴入铁氰化钾溶液,试管内无明显变化。但③中没有Zn保护Fe,Fe在酸性环境中发生析氢腐蚀,Fe作负极被氧化生成Fe2+,所以取出的少量Fe附近的溶液中滴入铁氰化钾溶液,生成蓝色沉淀,对比②③可知Zn保护了Fe,A项正确;①与②的区别在于:前者是将铁氰化钾溶液直接滴入烧杯中,而后者是在取出的少量Fe附近的溶液中滴加铁氰化钾溶液,①中出现了蓝色沉淀,说明有Fe2+生成。对比分析可知,可能是铁氰化钾氧化Fe生成了Fe2+,B项正确;通过上述分析可知,验证Zn保护Fe时不能用①的方法,C项正确;若将Zn换成Cu,铁氰化钾仍会将Fe氧化为Fe2+,在铁的表面同样会生成蓝色沉淀,所以无法判断Fe2+是不是负极产物,即无法判断Fe与Cu的活动性,D项错误。
答案:D
6. 我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀,防护原理如图所示。
下列说法错误的是 ( )
A.通电时,锌环是阳极,发生氧化反应
B.通电时,阴极上的电极反应为
2H2O+2e-===H2↑+2OH-
C.断电时,锌环上的电极反应为Zn+2e-===Zn2+
D.断电时,仍能防止铁帽被腐蚀
解析:通电时,锌环与电源正极相连,锌环作阳极,锌失电子发生氧化反应,故A正确;铁帽为阴极,阴极上H2O得到电子生成氢气,阴极电极反应为2H2O+2e-===H2↑+2OH-,故B正确;断电时,锌铁形成原电池,锌失电子生成Zn2+,锌环上的电极反应为Zn-2e-===Zn2+,Fe作正极被保护,仍能防止铁帽被腐蚀,故C错误、D正确。
答案:C
谢
谢
观
看
同课章节目录
