2024届高考一轮复习 第五章 物质结构与性质 元素周期律 第2讲 元素周期表 元素周期律(58张PPT)
文档属性
| 名称 | 2024届高考一轮复习 第五章 物质结构与性质 元素周期律 第2讲 元素周期表 元素周期律(58张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 959.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-17 22:51:04 | ||
图片预览








文档简介
(共58张PPT)
第2讲 元素周期表 元素周期律(基础落实课)
逐点清(一) 元素周期表
(一)元素周期表的结构
1.原子序数
按照元素在周期表中的顺序给元素所编的序号,称之为原子序数,原子序数=____________=_______=______________。
2.编排原则
核电荷数
质子数
核外电子数
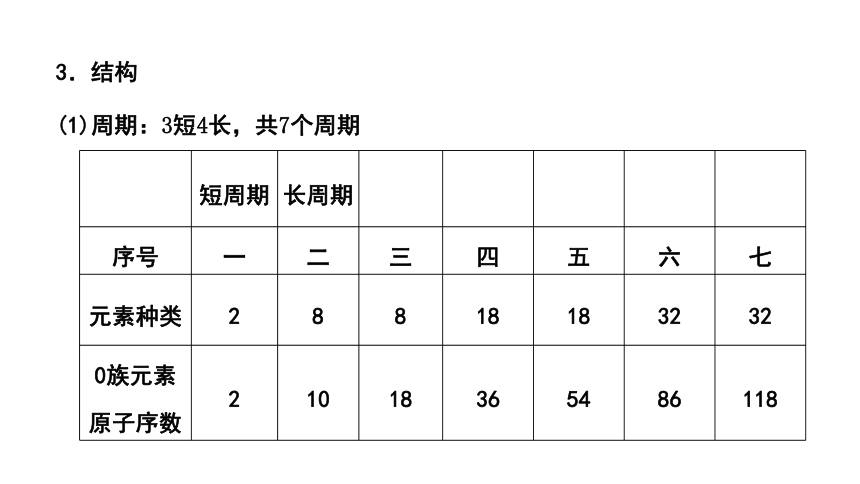
3.结构
(1)周期:3短4长,共7个周期
短周期 长周期
序号 一 二 三 四 五 六 七
元素种类 2 8 8 18 18 32 32
0族元素原子序数 2 10 18 36 54 86 118
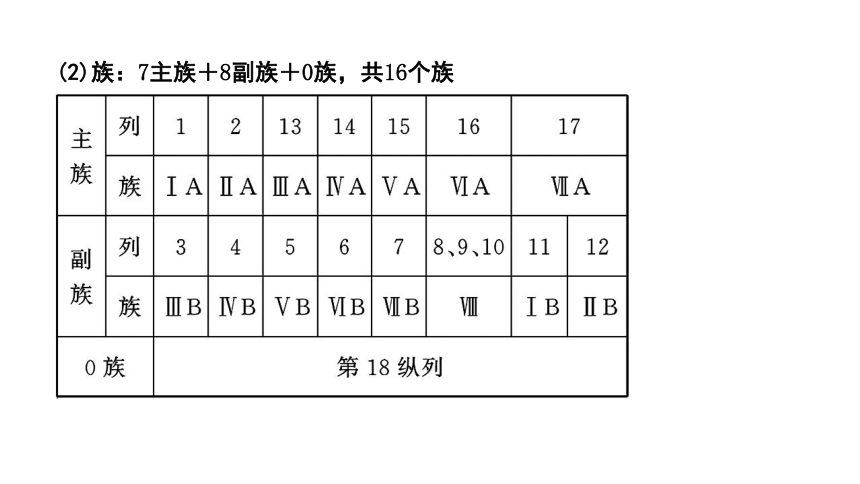
(2)族:7主族+8副族+0族,共16个族
[注意] ①所含元素种类最多的族为ⅢB族(含有锕系、镧系元素),共有32种元素。
②最外层电子数为3~7个的原子一定属于主族元素,且最外层电子数即为主族的族序数。
(二)原子结构与元素在周期表中的位置关系
1.原子结构与周期的关系
2.每族元素的价层电子排布特点
(1)主族
主族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
排布 特点 ns1 _____ ______ ______________ ________________ ________________
_________________
ns2
ns2np1
ns2np2
ns2np3
ns2np4
ns2np5
(三)元素周期表的分区
1.根据元素的金属性与
非金属性分区
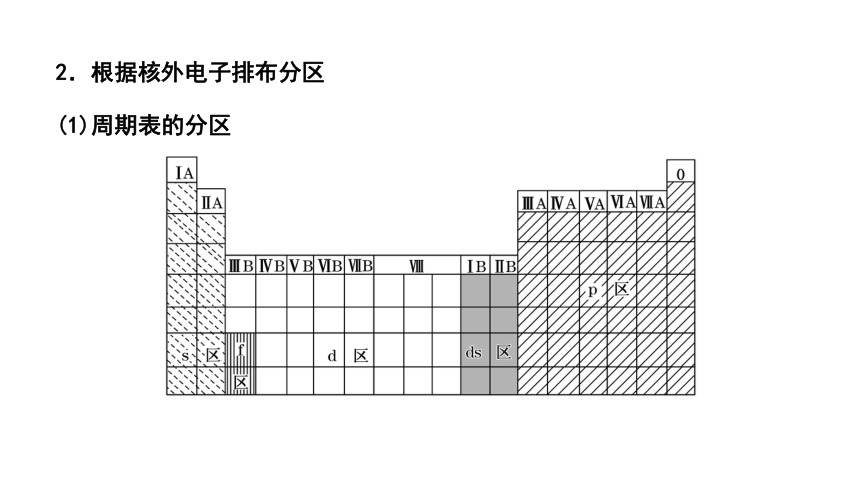
2.根据核外电子排布分区
(1)周期表的分区
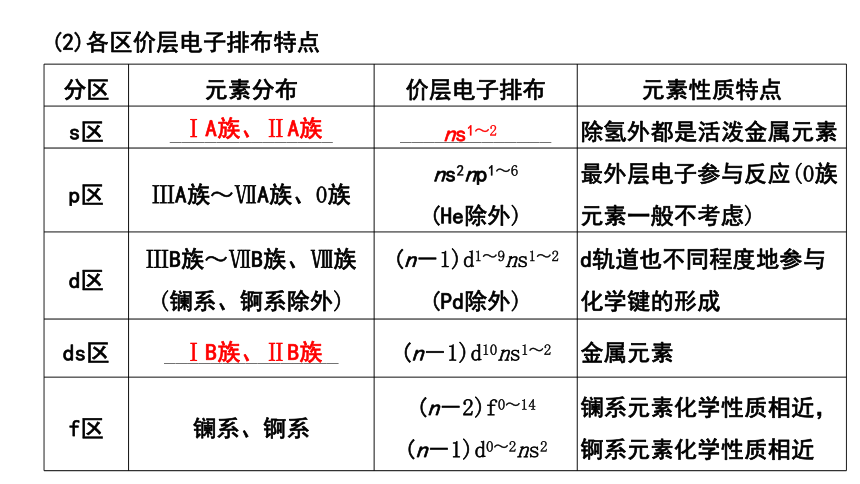
(2)各区价层电子排布特点
分区 元素分布 价层电子排布 元素性质特点
s区 ______________ _____________ 除氢外都是活泼金属元素
p区 ⅢA族~ⅦA族、0族 ns2np1~6 (He除外) 最外层电子参与反应(0族元素一般不考虑)
d区 ⅢB族~ⅦB族、Ⅷ族(镧系、锕系除外) (n-1)d1~9ns1~2 (Pd除外) d轨道也不同程度地参与化学键的形成
ds区 _______________ (n-1)d10ns1~2 金属元素
f区 镧系、锕系 (n-2)f0~14 (n-1)d0~2ns2 镧系元素化学性质相近,锕系元素化学性质相近
ⅠA族、ⅡA族
ns1~2
ⅠB族、ⅡB族
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)长周期中各周期中的元素均为18种 ( )
(2)同一周期相邻主族的原子序数差一定为1 ( )
(3)最外层电子排布为4s1的元素一定为 ⅠA族 ( )
(4)ⅢB族的元素均为d区,ⅡB族的元素均为ds区 ( )
(5)s区的元素均为金属元素,稀有气体元素为p区元素 ( )
×
×
×
×
×
(6)原子价层电子排布式为3d104s1的元素为s区元素 ( )
(7)价层电子数与最高化合价相等的元素一定是主族元素 ( )
(8)非金属元素都分布在p区 ( )
(9)元素周期表5个区中都有金属元素 ( )
×
×
×
√
2.下表为元素周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)表中属于d区的元素是________(填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状物名称为________。
(3)某元素的价层电子排布式为nsnnpn+1,该元素原子的最外层电子数为________。
解析: (1)⑨属于d区元素。
(2)元素①是氢元素,元素③是碳元素,依题意,形成的环状物是苯。
(3)从nsnnpn+1可知,n=2,该元素为N元素,最外层电子数为5。
答案:(1)⑨ (2)苯 (3)5
[题点考法·全面练通]
题点(一) 元素周期表的结构与分区
1.下列说法正确的是 ( )
A.原子序数为7的元素的最高化合价为+4价,位于p区
B.周期表中共有18个列,其中形成化合物种类最多的在第14列
C.位于同一主族的甲、乙两种元素,甲的原子序数为m,则乙的原子序数可能为m+4
D.位于同一周期的甲、乙两种元素,甲位于第ⅠA族,原子序数为m,乙位于第ⅢA族,则乙原子序数可能为m+19
解析:原子序数为7的元素为氮元素,其最高化合价为+5价,故A错误;
C元素形成有机物的种类繁多,C位于第14列,周期表中共有18个列,故B正确;
同一主族的元素相差2、8、18、32或上述数字间的和,故C错误;
同一周期第ⅠA族元素与第ⅢA族元素之间的差可能为2、12、26,故D
错误。
答案:B
2.长式周期表共有18个纵列,从左到右排为1~18列,即碱金属为第1列,稀有气体元素为第18列。按这种规定,下列说法正确的是 ( )
A.第9列元素中没有非金属元素
B.只有第2列的元素原子最外层电子排布式为ns2
C.第四周期第9列元素是铁元素
D.第10、11列为ds区
解析:He的最外层电子排布式为1s2,B错误;
第四周期第9列元素是Co,C错误;
第11、12列为ds区,D错误。
答案:A
3.如图A、B、C、D、E是元素周期表中的5种元素(不包括镧系
和锕系)。下列说法不正确的是 ( )
A.A、E原子序数之差可能为2
B.D、E原子序数之差可能是18或32
C.B、C原子序数之差一定是2
D.B、D原子序数之差不可能是7
解析:由题给5种元素的位置关系可以看出,A不是第一周期元素,因为A若为氢元素,则其位于最左边一族,就不会有B;A若为氦元素,则其位于最右边一族,那么不会有C。既然A不是氢元素或氦元素,则A、E原子序数之差不可能为2,A错误;
由表中位置关系可知,D、E原子序数之差可能是18或32,B正确;
B、C之间仅隔有E一种元素,故原子序数之差一定为2,C正确;
B、D原子序数之差应大于8,D正确。
答案:A
[归纳拓展]
(1)元素周期表中元素原子序数的序差规律
①同周期ⅡA族与ⅢA族元素的原子序数之差有以下三种情况:第二、三周期(短周期)相差1,第四、五周期相差11,第六、七周期相差25。
(2)由稀有气体元素的原子序数确定元素在周期表中位置
原子序数-最邻近的稀有气体元素的原子序数=ΔZ。
若ΔZ<0,则与稀有气体元素同周期,族序数为8-|ΔZ|;
若ΔZ>0,则在稀有气体元素下一周期,族序数为ΔZ。
题点(二) 周期表位置与原子结构的关系
4.元素周期表完美地将元素的结构、位置与性质结合在一起,根据元素的原子序数就能推断出该元素在周期表中的位置,进而推断出该元素原子的结构和性质。下列关于33号元素的说法正确的是 ( )
A.该元素位于d区
B.该元素为金属元素
C.该元素位于第四周期第ⅢA族
D.该元素基态原子的电子排布式为1s22s22p63s23p63d104s24p3
解析:该元素基态原子的电子排布式为1s22s22p63s23p63d104s24p3,该元素最后填入的电子在p层,该元素位于p区,故A错误,D正确;
一般情况下,金属元素最外层电子数少于4,该元素最外层5个电子,为非金属元素,故B错误;
价层电子排布为4s24p3,共有四层电子,最外层有5个电子,该元素位于第四周期第ⅤA族,故C错误。
答案:D
5.周期表中27号元素钴的方格中注明“3d74s2”,由此可以推断( )
A.它位于周期表的第四周期ⅡA族
B.它的基态核外电子排布式可简写为[Ar]4s2
C.Co2+的核外价层电子排布式为3d54s2
D.Co位于周期表中第9列,属于d区
解析:钴位于周期表的第四周期Ⅷ族,A项错误;
“3d74s2”为Co的价层电子排布,其简写式中也要注明3d轨道,B项错误;
失电子时,应先失去最外层的电子,即先失去4s上的电子,Co2+的价层电子排布式为3d7,C项错误;
“7+2=9”,说明它位于周期表的第9列,为d区,D项正确。
答案:D
[易错提醒] 对价层电子认识的误区
(1)价层电子不一定是最外层电子,只有主族元素的价层电子才是最外层电子。对于过渡元素还包括部分内层电子。
(2)同一族元素的价层电子排布不一定相同,如过渡元素中的镧系元素和锕系元素就不相同,在第Ⅷ族中部分元素的价层电子排布也不相同。
逐点清(二) 元素周期律及应用
(一)元素周期律
1.原子半径
影响 因素 能层数:能层数越多,原子半径越大
核电荷数:能层数相同,核电荷数越大,原子半径越小
变化 规律 元素周期表中的同周期主族元素从左到右,原子半径逐渐_____;同主族元素从上到下,原子半径逐渐______
减小
增大
2.电离能
(1)第一电离能:气态基态原子失去一个电子转化为气态基态正离子所需要的___________,符号:I1,单位:_____________。
(2)电离能的变化规律
同周期 第一种元素的第一电离能______,最后一种元素的第一电离能____,总体呈现从左到右______的变化趋势。ⅡA族元素的np轨道为全空,第一电离能大于ⅢA族元素,ⅤA族元素np轨道为半满,第一电离能大于ⅥA族元素
同主族 从上到下,第一电离能逐渐______
同一 元素 逐级电离能越来越______,即I1最低能量
kJ·mol-1
最小
最大
增大
减小
大
(3)电离能的三个重要应用
①判断元素的金属性和非金属性强弱。I1越大,元素的非金属性越强;I1越小,元素的金属性越强。
②判断元素在化合物中的化合价。如K:I1 I2③判断元素核外电子的分层排布情况。如Li:I1 I23.电负性
(1)含义及规律
含义 不同元素的原子对__________吸引力的大小。电负性越大的原子,对__________的吸引力越大
标准 以氟的电负性为______和锂的电负性为1.0作为相对标准,计算得出其他元素的电负性(稀有气体未计)
变化 规律 金属元素的电负性一般______1.8,非金属元素的电负性一般______1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右
在元素周期表中,同周期元素从左至右,元素的电负性逐渐______;同主族元素从上至下,元素的电负性逐渐_____
键合电子
键合电子
4.0
小于
大于
增大
(2)电负性的一般应用
①判断元素金属性、非金属性强弱:电负性越大,非金属性越强,金属性越弱。
②判断化学键的类型:一般认为,如果两种成键原子间的电负性差值大于1.7,通常形成_____键;若差值小于1.7,通常形成______键。如AlCl3的电负性差<1.7,Al—Cl为共价键。
③判断元素在化合物中化合价正负:电负性大的元素显负价,电负性小的元素显正价,如
离子
共价
4.主族元素的结构与性质递变规律
项目 同周期(左→右) 同主族(上→下)
原子 结构 核电荷数 逐渐增大 逐渐增大
电子层数 相同 逐渐增多
原子半径 呈逐渐减小趋势 呈逐渐增大趋势
离子半径 阳离子逐渐减小 阴离子逐渐减小 r(阴离子)>r(阳离子) 逐渐增大
性 质 化合价 最高正化合价由 +1→+7(O、F除外) 负化合价=-(8-主族序数) 相同,最高正化合价=主族序数(O、F除外)
元素的金属性和非金属性 金属性逐渐减弱 非金属性逐渐增强 金属性逐渐增强
非金属性逐渐减弱
离子的氧化性、还原性 阳离子氧化性逐渐增强 阴离子还原性逐渐减弱 阳离子氧化性逐渐减弱
阴离子还原性逐渐增强
气态氢化物的稳定性 逐渐增强 逐渐减弱
续表
性 质 最高价氧化物对应水化物的酸碱性 碱性逐渐减弱 酸性逐渐增强 碱性逐渐增强
酸性逐渐减弱
第一电离能 总体呈现___________的变化趋势(但ⅡA>ⅢA,ⅤA>ⅥA) 逐渐_____
电负性 逐渐_____ 逐渐_____
续表
逐渐增大
增大
减小
5.对角线规则
在元素周期表中,某些主族元素与_______的主族元素的有些性质是相似的,如 。
(二)元素周期律(表)的应用
1.科学预测
为新元素的发现以及预测它们的原子结构和性质提供了线索。
右下方
2.寻找新材料
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)同一周期主族元素,从左到右第一电离能和电负性均逐渐增大 ( )
(2)电子层越多,原子半径一定越大 ( )
(3)C、N、O、F的最高正价分别为+4、+5、+6、+7 ( )
(4)非金属性越强,第一电离能和电负性一定越大 ( )
(5)钠元素的第一、第二电离能分别小于镁元素的第一、第二电离能 ( )
(6)N、O、F三种元素第一电离能从大到小的顺序是N>O>F ( )
(7)主族元素的电负性越大,元素原子的第一电离能一定越大 ( )
(8)最外层有2个未成对电子的原子一定是ns2np2 ( )
×
×
×
×
×
×
×
×
2.下表列出了九种元素在元素周期表中的位置。
(1)这九种元素电负性最大的是__________,第一电离能最小的元素是____________,最不活泼的是__________(均用元素符号填空)。
(2)这九种元素中最外层电子排布为4s1的元素为__________(用元素符号填空)。
(3)c、d、e三种元素第一电离能由大到小的顺序是__________,电负性由大到小的顺序是__________(均用元素符号填空)。
(4)写出d元素原子的轨道表示式:_______________________________,
i元素原子基态电子排布式______________________________________。
[题点考法·全面练通]
题点(一) 粒子半径比较
1.下列各组粒子中按半径由大到小排列的是 ( )
A.O、Cl、S、P
B.Al3+、Mg2+、Ca2+、Ba2+
C.K+、Mg2+、Al3+、H+
D.Li、Na、K、Cs
解析:比较粒子半径大小有以下原则:①同周期从左到右逐渐减小,②同主族从上到下逐渐增大,D项,顺序为Cs>K>Na>Li,③同周期元素离子核外电子排布相同时,核电荷数越大,半径越小,Mg2+>Al3+,④各层电子排布饱和时,一般电子层越多,半径越大,B项,顺序为Ba2+>Ca2+>Mg2+>Al3+。
答案:C
2.已知短周期元素的四种离子A2+、B+、C3-、D-具有相同的电子层结构,则下列叙述正确的是 ( )
A.原子序数:D>C>B>A
B.原子半径:B>A>C>D
C.离子半径:C3->D->A2+>B+
D.氧化性:A2+>B+,还原性:C3-解析: A2+、B+、C3-、D-都具有相同电子层结构,则A、B在下一周期,为金属元素,且原子序数:A>B,C、D在上一周期,为非金属元素,且原子序数:D>C。由电子层数越多的原子序数越大,同周期从左向右原子序数增大,所以原子序数为A>B>D>C,故A错误;
电子层数越多,半径越大,同周期原子序数越大,半径越小,则原子半径为B>A>C>D,故B正确;
具有相同电子层结构的离子,原子序数大的离子半径小,原子序数为A>B>D>C,则离子半径为C3->D->B+>A2+,故C错误;
金属性越强,其阳离子的氧化性越弱,金属性为B>A,则氧化性:A2+>B+,非金属性:CD-,故D错误。
答案:B
一看电 子层数 当最外层电子数相同,电子层数不同时,电子层数越多,半径越大。
例:r(Li)<r(Na)<r(K)<r(Rb)<r(Cs);
r(O2-)<r(S2-)<r(Se2-)<r(Te2-)
二看核 电荷数 当电子层数相同时,核电荷数越大,半径越小。
例:r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl);r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)
三看核外 电子数 当电子层数和核电荷数均相同时,核外电子数越多,半径越大。例:r(Cl-)>r(Cl);r(Fe2+)>r(Fe3+)
[思维建模] “三看法”比较粒子半径大小
题点(二) 电离能及其变化规律
3.下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示,单位为kJ·mol-1)
元素 I1 I2 I3 I4 ……
R 740 1 500 7 700 10 500 ……
下列关于元素R的推断中一定正确的是 ( )
A.R的最高正价为+2价
B.R元素位于元素周期表中第ⅢA族
C.R元素的原子最外层共有4个电子
D.R元素基态原子的电子排布式为1s22s2
解析:比较元素R的各级电离能的数据可知,该元素的第二级电离能远小于第三级电离能,说明该元素的原子最外层上为2个电子,据此解题;R的最外层上有2个电子,故R的最高正价为+2价,A正确,C错误;
R的最外层上是2个电子,且R为短周期元素,故R元素位于元素周期表中第ⅡA族,B错误;
R元素基态原子的电子排布式为1s22s2或者1s22s22p63s2,D不一定正确。
答案:A
4.(1)As、Se、Br元素的电负性由大到小的顺序为______________,第一电离能由大到小的顺序为______________。
(2)铜、锌两种元素的第一电离能、第二电离能如表所示。
电离能/(kJ·mol-1) I1 I2
铜 746 1 958
锌 906 1 733
铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是_______________________________
______________________________________________________________。
答案:(1)Br>Se>As Br>As>Se
(2)Cu失去一个电子变成电子结构为[Ar]3d10的Cu+,能量较低,结构稳定,所以Cu的第二电离能相对较大(或Zn失去一个电子变成电子结构为[Ar]3d104s1的Zn+,易再失去一个电子,所以Zn的第二电离能相对较小或Cu原子失去一个电子后,核外电子排布式为[Ar]3d10,而锌原子失去1个电子后的核外电子排布式变为[Ar]3d104s1,铜达到了较稳定状态,所以Cu的第二电离能相对较大)
题点(三) 电负性及其变化规律
5.下表给出的是8种元素的电负性的值,运用表中数据解答下题。
元素 Na Mg Al Si P S Cl K
电负性 0.9 1.2 1.5 1.8 2.1 2.5 3.0 0.8
估计钙元素的电负性的取值范围 ( )
A.小于0.8 B.大于1.2
C.在0.8与1.2之间 D.在0.8与1.5之间
解析:同一周期元素从左至右,电负性增大;同一主族元素从上到下,电负性减小,钙元素的电负性应小于Mg的而大于K的,即Ca的电负性的取值范围在0.8与1.2之间,C项正确。
答案:C
6.已知下列元素的电负性数据,下列判断不正确的是 ( )
元素 Li Be C O F Na Al Cl Ge
电负性 1.0 1.5 2.5 3.5 4.0 0.9 1.5 3.0 1.8
解析:Mg元素的金属性小于Na,大于Be,故电负性的最小范围为0.9~1.5,A正确;
Ge的电负性为1.8,既具有金属性,又具有非金属性,B正确;
根据Ge和Cl的电负性差为1.2,两元素电负性差距不大,不能形成离子键,C不正确;
F的电负性大于O,故O和F形成的化合物中O显正价,D正确。
答案:C
解析:该反应之所以能够发生是因为生成的CO是气体,在高温条件下,能够及时脱离反应体系,促进了反应的进行,不能用该反应比较C、Si的非金属性强弱,故A错误;
同浓度下碱性:KOH>Mg(OH)2,碱性越强对应元素的金属性越强,所以金属性:K>Mg,故B正确;
元素的非金属性越强,其单质的氧化性越强,其单质与氢气化合越容易,所以氟气与氢气在暗处相遇就会爆炸,氯气与氢气混合在光照或点燃时发生爆炸,说明非金属性:F>Cl,故C正确;
金属离子的氧化性越强,则金属单质的还原性越弱,因为氧化性:Cu2+>Na+,则金属性:Na>Cu,故D正确。
答案:A
8.下列实验不能达到实验目的的是 ( )
选项 实验操作 实验目的
A Cl2、Br2分别与H2反应 比较氯、溴的非金属性强弱
B 向MgCl2、AlCl3溶液中分别通入氨 比较镁、铝的金属性强弱
C 测定相同物质的量浓度的Na2CO3、Na2SO4的溶液的pH 比较碳、硫的非金属性强弱
D Fe、Cu分别与稀盐酸反应 比较铁、铜的金属性强弱
解析:A项,Cl2、Br2分别与H2反应,根据反应条件的难易,即可判断出氯、溴的非金属性强弱;
B项,向MgCl2、AlCl3溶液中分别通入氨,MgCl2与NH3·H2O反应生成Mg(OH)2,AlCl3与NH3·H2O反应生成Al(OH)3,但无法比较二者的金属性强弱;
C项,测定相同物质的量浓度的Na2CO3、Na2SO4溶液的pH,根据pH可判断出Na2CO3与Na2SO4水解程度的大小,即判断出酸性:H2CO3<H2SO4,从而判断出碳、硫的非金属性强弱;D项,利用Fe、Cu与稀盐酸反应现象的不同即可判断出Fe、Cu的金属性强弱。
答案:B
[思维建模] 元素金属性和非金属性强弱的判断方法
1.金属性比较
本质 原子越易失电子,金属性越强(与原子失电子数目无关)
判断方法 ①在金属活动性顺序表中越靠前,金属性越强
②单质与水或非氧化性酸反应越剧烈,金属性越强
③单质还原性越强或阳离子氧化性越弱,金属性越强
④最高价氧化物对应水化物的碱性越强,金属性越强
⑤若Xn++Y―→X+Ym+,则Y比X的金属性强
⑥元素在周期表中的位置:左边或下方元素的金属性强
2.非金属性比较
本质 原子越易得电子,非金属性越强(与原子得电子数目无关)
判断方法 ①与H2化合越容易,气态氢化物越稳定,非金属性越强
②单质氧化性越强或阴离子还原性越弱,非金属性越强
③最高价氧化物对应水化物的酸性越强,非金属性越强
④元素在周期表中的位置:右边或上方元素的非金属性强
谢
谢
观
看
第2讲 元素周期表 元素周期律(基础落实课)
逐点清(一) 元素周期表
(一)元素周期表的结构
1.原子序数
按照元素在周期表中的顺序给元素所编的序号,称之为原子序数,原子序数=____________=_______=______________。
2.编排原则
核电荷数
质子数
核外电子数
3.结构
(1)周期:3短4长,共7个周期
短周期 长周期
序号 一 二 三 四 五 六 七
元素种类 2 8 8 18 18 32 32
0族元素原子序数 2 10 18 36 54 86 118
(2)族:7主族+8副族+0族,共16个族
[注意] ①所含元素种类最多的族为ⅢB族(含有锕系、镧系元素),共有32种元素。
②最外层电子数为3~7个的原子一定属于主族元素,且最外层电子数即为主族的族序数。
(二)原子结构与元素在周期表中的位置关系
1.原子结构与周期的关系
2.每族元素的价层电子排布特点
(1)主族
主族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
排布 特点 ns1 _____ ______ ______________ ________________ ________________
_________________
ns2
ns2np1
ns2np2
ns2np3
ns2np4
ns2np5
(三)元素周期表的分区
1.根据元素的金属性与
非金属性分区
2.根据核外电子排布分区
(1)周期表的分区
(2)各区价层电子排布特点
分区 元素分布 价层电子排布 元素性质特点
s区 ______________ _____________ 除氢外都是活泼金属元素
p区 ⅢA族~ⅦA族、0族 ns2np1~6 (He除外) 最外层电子参与反应(0族元素一般不考虑)
d区 ⅢB族~ⅦB族、Ⅷ族(镧系、锕系除外) (n-1)d1~9ns1~2 (Pd除外) d轨道也不同程度地参与化学键的形成
ds区 _______________ (n-1)d10ns1~2 金属元素
f区 镧系、锕系 (n-2)f0~14 (n-1)d0~2ns2 镧系元素化学性质相近,锕系元素化学性质相近
ⅠA族、ⅡA族
ns1~2
ⅠB族、ⅡB族
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)长周期中各周期中的元素均为18种 ( )
(2)同一周期相邻主族的原子序数差一定为1 ( )
(3)最外层电子排布为4s1的元素一定为 ⅠA族 ( )
(4)ⅢB族的元素均为d区,ⅡB族的元素均为ds区 ( )
(5)s区的元素均为金属元素,稀有气体元素为p区元素 ( )
×
×
×
×
×
(6)原子价层电子排布式为3d104s1的元素为s区元素 ( )
(7)价层电子数与最高化合价相等的元素一定是主族元素 ( )
(8)非金属元素都分布在p区 ( )
(9)元素周期表5个区中都有金属元素 ( )
×
×
×
√
2.下表为元素周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)表中属于d区的元素是________(填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状物名称为________。
(3)某元素的价层电子排布式为nsnnpn+1,该元素原子的最外层电子数为________。
解析: (1)⑨属于d区元素。
(2)元素①是氢元素,元素③是碳元素,依题意,形成的环状物是苯。
(3)从nsnnpn+1可知,n=2,该元素为N元素,最外层电子数为5。
答案:(1)⑨ (2)苯 (3)5
[题点考法·全面练通]
题点(一) 元素周期表的结构与分区
1.下列说法正确的是 ( )
A.原子序数为7的元素的最高化合价为+4价,位于p区
B.周期表中共有18个列,其中形成化合物种类最多的在第14列
C.位于同一主族的甲、乙两种元素,甲的原子序数为m,则乙的原子序数可能为m+4
D.位于同一周期的甲、乙两种元素,甲位于第ⅠA族,原子序数为m,乙位于第ⅢA族,则乙原子序数可能为m+19
解析:原子序数为7的元素为氮元素,其最高化合价为+5价,故A错误;
C元素形成有机物的种类繁多,C位于第14列,周期表中共有18个列,故B正确;
同一主族的元素相差2、8、18、32或上述数字间的和,故C错误;
同一周期第ⅠA族元素与第ⅢA族元素之间的差可能为2、12、26,故D
错误。
答案:B
2.长式周期表共有18个纵列,从左到右排为1~18列,即碱金属为第1列,稀有气体元素为第18列。按这种规定,下列说法正确的是 ( )
A.第9列元素中没有非金属元素
B.只有第2列的元素原子最外层电子排布式为ns2
C.第四周期第9列元素是铁元素
D.第10、11列为ds区
解析:He的最外层电子排布式为1s2,B错误;
第四周期第9列元素是Co,C错误;
第11、12列为ds区,D错误。
答案:A
3.如图A、B、C、D、E是元素周期表中的5种元素(不包括镧系
和锕系)。下列说法不正确的是 ( )
A.A、E原子序数之差可能为2
B.D、E原子序数之差可能是18或32
C.B、C原子序数之差一定是2
D.B、D原子序数之差不可能是7
解析:由题给5种元素的位置关系可以看出,A不是第一周期元素,因为A若为氢元素,则其位于最左边一族,就不会有B;A若为氦元素,则其位于最右边一族,那么不会有C。既然A不是氢元素或氦元素,则A、E原子序数之差不可能为2,A错误;
由表中位置关系可知,D、E原子序数之差可能是18或32,B正确;
B、C之间仅隔有E一种元素,故原子序数之差一定为2,C正确;
B、D原子序数之差应大于8,D正确。
答案:A
[归纳拓展]
(1)元素周期表中元素原子序数的序差规律
①同周期ⅡA族与ⅢA族元素的原子序数之差有以下三种情况:第二、三周期(短周期)相差1,第四、五周期相差11,第六、七周期相差25。
(2)由稀有气体元素的原子序数确定元素在周期表中位置
原子序数-最邻近的稀有气体元素的原子序数=ΔZ。
若ΔZ<0,则与稀有气体元素同周期,族序数为8-|ΔZ|;
若ΔZ>0,则在稀有气体元素下一周期,族序数为ΔZ。
题点(二) 周期表位置与原子结构的关系
4.元素周期表完美地将元素的结构、位置与性质结合在一起,根据元素的原子序数就能推断出该元素在周期表中的位置,进而推断出该元素原子的结构和性质。下列关于33号元素的说法正确的是 ( )
A.该元素位于d区
B.该元素为金属元素
C.该元素位于第四周期第ⅢA族
D.该元素基态原子的电子排布式为1s22s22p63s23p63d104s24p3
解析:该元素基态原子的电子排布式为1s22s22p63s23p63d104s24p3,该元素最后填入的电子在p层,该元素位于p区,故A错误,D正确;
一般情况下,金属元素最外层电子数少于4,该元素最外层5个电子,为非金属元素,故B错误;
价层电子排布为4s24p3,共有四层电子,最外层有5个电子,该元素位于第四周期第ⅤA族,故C错误。
答案:D
5.周期表中27号元素钴的方格中注明“3d74s2”,由此可以推断( )
A.它位于周期表的第四周期ⅡA族
B.它的基态核外电子排布式可简写为[Ar]4s2
C.Co2+的核外价层电子排布式为3d54s2
D.Co位于周期表中第9列,属于d区
解析:钴位于周期表的第四周期Ⅷ族,A项错误;
“3d74s2”为Co的价层电子排布,其简写式中也要注明3d轨道,B项错误;
失电子时,应先失去最外层的电子,即先失去4s上的电子,Co2+的价层电子排布式为3d7,C项错误;
“7+2=9”,说明它位于周期表的第9列,为d区,D项正确。
答案:D
[易错提醒] 对价层电子认识的误区
(1)价层电子不一定是最外层电子,只有主族元素的价层电子才是最外层电子。对于过渡元素还包括部分内层电子。
(2)同一族元素的价层电子排布不一定相同,如过渡元素中的镧系元素和锕系元素就不相同,在第Ⅷ族中部分元素的价层电子排布也不相同。
逐点清(二) 元素周期律及应用
(一)元素周期律
1.原子半径
影响 因素 能层数:能层数越多,原子半径越大
核电荷数:能层数相同,核电荷数越大,原子半径越小
变化 规律 元素周期表中的同周期主族元素从左到右,原子半径逐渐_____;同主族元素从上到下,原子半径逐渐______
减小
增大
2.电离能
(1)第一电离能:气态基态原子失去一个电子转化为气态基态正离子所需要的___________,符号:I1,单位:_____________。
(2)电离能的变化规律
同周期 第一种元素的第一电离能______,最后一种元素的第一电离能____,总体呈现从左到右______的变化趋势。ⅡA族元素的np轨道为全空,第一电离能大于ⅢA族元素,ⅤA族元素np轨道为半满,第一电离能大于ⅥA族元素
同主族 从上到下,第一电离能逐渐______
同一 元素 逐级电离能越来越______,即I1
kJ·mol-1
最小
最大
增大
减小
大
(3)电离能的三个重要应用
①判断元素的金属性和非金属性强弱。I1越大,元素的非金属性越强;I1越小,元素的金属性越强。
②判断元素在化合物中的化合价。如K:I1 I2
(1)含义及规律
含义 不同元素的原子对__________吸引力的大小。电负性越大的原子,对__________的吸引力越大
标准 以氟的电负性为______和锂的电负性为1.0作为相对标准,计算得出其他元素的电负性(稀有气体未计)
变化 规律 金属元素的电负性一般______1.8,非金属元素的电负性一般______1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右
在元素周期表中,同周期元素从左至右,元素的电负性逐渐______;同主族元素从上至下,元素的电负性逐渐_____
键合电子
键合电子
4.0
小于
大于
增大
(2)电负性的一般应用
①判断元素金属性、非金属性强弱:电负性越大,非金属性越强,金属性越弱。
②判断化学键的类型:一般认为,如果两种成键原子间的电负性差值大于1.7,通常形成_____键;若差值小于1.7,通常形成______键。如AlCl3的电负性差<1.7,Al—Cl为共价键。
③判断元素在化合物中化合价正负:电负性大的元素显负价,电负性小的元素显正价,如
离子
共价
4.主族元素的结构与性质递变规律
项目 同周期(左→右) 同主族(上→下)
原子 结构 核电荷数 逐渐增大 逐渐增大
电子层数 相同 逐渐增多
原子半径 呈逐渐减小趋势 呈逐渐增大趋势
离子半径 阳离子逐渐减小 阴离子逐渐减小 r(阴离子)>r(阳离子) 逐渐增大
性 质 化合价 最高正化合价由 +1→+7(O、F除外) 负化合价=-(8-主族序数) 相同,最高正化合价=主族序数(O、F除外)
元素的金属性和非金属性 金属性逐渐减弱 非金属性逐渐增强 金属性逐渐增强
非金属性逐渐减弱
离子的氧化性、还原性 阳离子氧化性逐渐增强 阴离子还原性逐渐减弱 阳离子氧化性逐渐减弱
阴离子还原性逐渐增强
气态氢化物的稳定性 逐渐增强 逐渐减弱
续表
性 质 最高价氧化物对应水化物的酸碱性 碱性逐渐减弱 酸性逐渐增强 碱性逐渐增强
酸性逐渐减弱
第一电离能 总体呈现___________的变化趋势(但ⅡA>ⅢA,ⅤA>ⅥA) 逐渐_____
电负性 逐渐_____ 逐渐_____
续表
逐渐增大
增大
减小
5.对角线规则
在元素周期表中,某些主族元素与_______的主族元素的有些性质是相似的,如 。
(二)元素周期律(表)的应用
1.科学预测
为新元素的发现以及预测它们的原子结构和性质提供了线索。
右下方
2.寻找新材料
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)同一周期主族元素,从左到右第一电离能和电负性均逐渐增大 ( )
(2)电子层越多,原子半径一定越大 ( )
(3)C、N、O、F的最高正价分别为+4、+5、+6、+7 ( )
(4)非金属性越强,第一电离能和电负性一定越大 ( )
(5)钠元素的第一、第二电离能分别小于镁元素的第一、第二电离能 ( )
(6)N、O、F三种元素第一电离能从大到小的顺序是N>O>F ( )
(7)主族元素的电负性越大,元素原子的第一电离能一定越大 ( )
(8)最外层有2个未成对电子的原子一定是ns2np2 ( )
×
×
×
×
×
×
×
×
2.下表列出了九种元素在元素周期表中的位置。
(1)这九种元素电负性最大的是__________,第一电离能最小的元素是____________,最不活泼的是__________(均用元素符号填空)。
(2)这九种元素中最外层电子排布为4s1的元素为__________(用元素符号填空)。
(3)c、d、e三种元素第一电离能由大到小的顺序是__________,电负性由大到小的顺序是__________(均用元素符号填空)。
(4)写出d元素原子的轨道表示式:_______________________________,
i元素原子基态电子排布式______________________________________。
[题点考法·全面练通]
题点(一) 粒子半径比较
1.下列各组粒子中按半径由大到小排列的是 ( )
A.O、Cl、S、P
B.Al3+、Mg2+、Ca2+、Ba2+
C.K+、Mg2+、Al3+、H+
D.Li、Na、K、Cs
解析:比较粒子半径大小有以下原则:①同周期从左到右逐渐减小,②同主族从上到下逐渐增大,D项,顺序为Cs>K>Na>Li,③同周期元素离子核外电子排布相同时,核电荷数越大,半径越小,Mg2+>Al3+,④各层电子排布饱和时,一般电子层越多,半径越大,B项,顺序为Ba2+>Ca2+>Mg2+>Al3+。
答案:C
2.已知短周期元素的四种离子A2+、B+、C3-、D-具有相同的电子层结构,则下列叙述正确的是 ( )
A.原子序数:D>C>B>A
B.原子半径:B>A>C>D
C.离子半径:C3->D->A2+>B+
D.氧化性:A2+>B+,还原性:C3-
电子层数越多,半径越大,同周期原子序数越大,半径越小,则原子半径为B>A>C>D,故B正确;
具有相同电子层结构的离子,原子序数大的离子半径小,原子序数为A>B>D>C,则离子半径为C3->D->B+>A2+,故C错误;
金属性越强,其阳离子的氧化性越弱,金属性为B>A,则氧化性:A2+>B+,非金属性:C
答案:B
一看电 子层数 当最外层电子数相同,电子层数不同时,电子层数越多,半径越大。
例:r(Li)<r(Na)<r(K)<r(Rb)<r(Cs);
r(O2-)<r(S2-)<r(Se2-)<r(Te2-)
二看核 电荷数 当电子层数相同时,核电荷数越大,半径越小。
例:r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl);r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)
三看核外 电子数 当电子层数和核电荷数均相同时,核外电子数越多,半径越大。例:r(Cl-)>r(Cl);r(Fe2+)>r(Fe3+)
[思维建模] “三看法”比较粒子半径大小
题点(二) 电离能及其变化规律
3.下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示,单位为kJ·mol-1)
元素 I1 I2 I3 I4 ……
R 740 1 500 7 700 10 500 ……
下列关于元素R的推断中一定正确的是 ( )
A.R的最高正价为+2价
B.R元素位于元素周期表中第ⅢA族
C.R元素的原子最外层共有4个电子
D.R元素基态原子的电子排布式为1s22s2
解析:比较元素R的各级电离能的数据可知,该元素的第二级电离能远小于第三级电离能,说明该元素的原子最外层上为2个电子,据此解题;R的最外层上有2个电子,故R的最高正价为+2价,A正确,C错误;
R的最外层上是2个电子,且R为短周期元素,故R元素位于元素周期表中第ⅡA族,B错误;
R元素基态原子的电子排布式为1s22s2或者1s22s22p63s2,D不一定正确。
答案:A
4.(1)As、Se、Br元素的电负性由大到小的顺序为______________,第一电离能由大到小的顺序为______________。
(2)铜、锌两种元素的第一电离能、第二电离能如表所示。
电离能/(kJ·mol-1) I1 I2
铜 746 1 958
锌 906 1 733
铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是_______________________________
______________________________________________________________。
答案:(1)Br>Se>As Br>As>Se
(2)Cu失去一个电子变成电子结构为[Ar]3d10的Cu+,能量较低,结构稳定,所以Cu的第二电离能相对较大(或Zn失去一个电子变成电子结构为[Ar]3d104s1的Zn+,易再失去一个电子,所以Zn的第二电离能相对较小或Cu原子失去一个电子后,核外电子排布式为[Ar]3d10,而锌原子失去1个电子后的核外电子排布式变为[Ar]3d104s1,铜达到了较稳定状态,所以Cu的第二电离能相对较大)
题点(三) 电负性及其变化规律
5.下表给出的是8种元素的电负性的值,运用表中数据解答下题。
元素 Na Mg Al Si P S Cl K
电负性 0.9 1.2 1.5 1.8 2.1 2.5 3.0 0.8
估计钙元素的电负性的取值范围 ( )
A.小于0.8 B.大于1.2
C.在0.8与1.2之间 D.在0.8与1.5之间
解析:同一周期元素从左至右,电负性增大;同一主族元素从上到下,电负性减小,钙元素的电负性应小于Mg的而大于K的,即Ca的电负性的取值范围在0.8与1.2之间,C项正确。
答案:C
6.已知下列元素的电负性数据,下列判断不正确的是 ( )
元素 Li Be C O F Na Al Cl Ge
电负性 1.0 1.5 2.5 3.5 4.0 0.9 1.5 3.0 1.8
解析:Mg元素的金属性小于Na,大于Be,故电负性的最小范围为0.9~1.5,A正确;
Ge的电负性为1.8,既具有金属性,又具有非金属性,B正确;
根据Ge和Cl的电负性差为1.2,两元素电负性差距不大,不能形成离子键,C不正确;
F的电负性大于O,故O和F形成的化合物中O显正价,D正确。
答案:C
解析:该反应之所以能够发生是因为生成的CO是气体,在高温条件下,能够及时脱离反应体系,促进了反应的进行,不能用该反应比较C、Si的非金属性强弱,故A错误;
同浓度下碱性:KOH>Mg(OH)2,碱性越强对应元素的金属性越强,所以金属性:K>Mg,故B正确;
元素的非金属性越强,其单质的氧化性越强,其单质与氢气化合越容易,所以氟气与氢气在暗处相遇就会爆炸,氯气与氢气混合在光照或点燃时发生爆炸,说明非金属性:F>Cl,故C正确;
金属离子的氧化性越强,则金属单质的还原性越弱,因为氧化性:Cu2+>Na+,则金属性:Na>Cu,故D正确。
答案:A
8.下列实验不能达到实验目的的是 ( )
选项 实验操作 实验目的
A Cl2、Br2分别与H2反应 比较氯、溴的非金属性强弱
B 向MgCl2、AlCl3溶液中分别通入氨 比较镁、铝的金属性强弱
C 测定相同物质的量浓度的Na2CO3、Na2SO4的溶液的pH 比较碳、硫的非金属性强弱
D Fe、Cu分别与稀盐酸反应 比较铁、铜的金属性强弱
解析:A项,Cl2、Br2分别与H2反应,根据反应条件的难易,即可判断出氯、溴的非金属性强弱;
B项,向MgCl2、AlCl3溶液中分别通入氨,MgCl2与NH3·H2O反应生成Mg(OH)2,AlCl3与NH3·H2O反应生成Al(OH)3,但无法比较二者的金属性强弱;
C项,测定相同物质的量浓度的Na2CO3、Na2SO4溶液的pH,根据pH可判断出Na2CO3与Na2SO4水解程度的大小,即判断出酸性:H2CO3<H2SO4,从而判断出碳、硫的非金属性强弱;D项,利用Fe、Cu与稀盐酸反应现象的不同即可判断出Fe、Cu的金属性强弱。
答案:B
[思维建模] 元素金属性和非金属性强弱的判断方法
1.金属性比较
本质 原子越易失电子,金属性越强(与原子失电子数目无关)
判断方法 ①在金属活动性顺序表中越靠前,金属性越强
②单质与水或非氧化性酸反应越剧烈,金属性越强
③单质还原性越强或阳离子氧化性越弱,金属性越强
④最高价氧化物对应水化物的碱性越强,金属性越强
⑤若Xn++Y―→X+Ym+,则Y比X的金属性强
⑥元素在周期表中的位置:左边或下方元素的金属性强
2.非金属性比较
本质 原子越易得电子,非金属性越强(与原子得电子数目无关)
判断方法 ①与H2化合越容易,气态氢化物越稳定,非金属性越强
②单质氧化性越强或阴离子还原性越弱,非金属性越强
③最高价氧化物对应水化物的酸性越强,非金属性越强
④元素在周期表中的位置:右边或上方元素的非金属性强
谢
谢
观
看
同课章节目录
