2024届高考一轮复习 第五章 物质结构与性质 元素周期律 第6讲 辨析比较原因类简答题的答题规范(34张PPT)
文档属性
| 名称 | 2024届高考一轮复习 第五章 物质结构与性质 元素周期律 第6讲 辨析比较原因类简答题的答题规范(34张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 659.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-17 22:29:35 | ||
图片预览









文档简介
(共34张PPT)
第6讲 辨析比较原因类简答题的答题规范(综合应用课)
在结构大题中以某一小问的形式呈现,能力要求较高,如阅读理解能力、信息加工能力、空间想象能力、数学思维能力等,它多以新材料为载体,试题以综合性简答题为主,考查学生逻辑思维能力。如何组织化学语言进行规范答题,是学生较为头痛的问题,今分类例析各种答题规范建立解题思维模型,变失分点为增分点。
(2)(2022·河北等级考·节选)Cu与Zn相比,第二电离能与第一电离能差值更大的是____________,原因是______________________________
____________________________________________________________。
(3)(2022·广东等级考·节选)H2Se的沸点低于H2O,其原因是_______________________________________________________________。
①____________________________________________________,
②_____________________________________________________。
解析:(1)三氧化硒分子中硒原子的价层电子对数为3,孤电子对数为0,分子的空间结构为平面三角形,键角为120°,亚硒酸根离子中硒原子的价层电子对数为4,孤电子对数为1,离子的空间结构为三角锥形,键角小于120°。
(3)H2Se的沸点低于H2O,其原因是两者都是分子晶体,由于水存在分子间氢键,沸点高。
(4)已知苯分子为非极性分子,H2O分子为极性分子,且吡啶中N原子上含有孤电子对能与H2O分子形成分子间氢键,从而导致在水中的溶解度,吡啶远大于苯。
(2)Cu Cu的第二电离能失去的是3d10的电子,第一电离能失去的是4s1电子,Zn的第二电离能失去的是4s1的电子,第一电离能失去的是4s2电子,3d10电子处于全充满状态,其与4s1电子能量差值更大
(3)两者都是分子晶体,由于水存在分子间氢键,沸点高
(4)吡啶能与H2O分子形成分子间氢键 吡啶和H2O均为极性分子相似相溶,而苯为非极性分子
2.(1)(2021·山东等级考·节选)OF2的熔、沸点______(填“高于”或“低于”)Cl2O,原因是_____________________________________
__________________________________________________________。
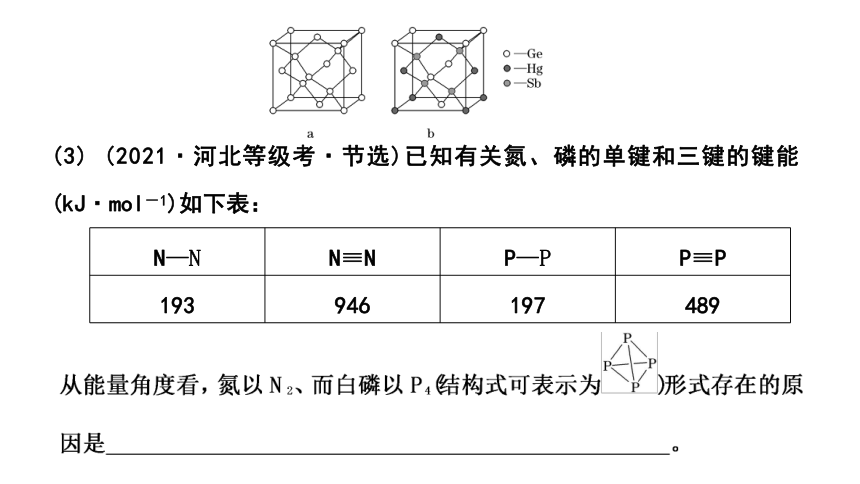
(2) (2021·广东等级考·节选)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是_________________________________________________
_________________________________________________________。
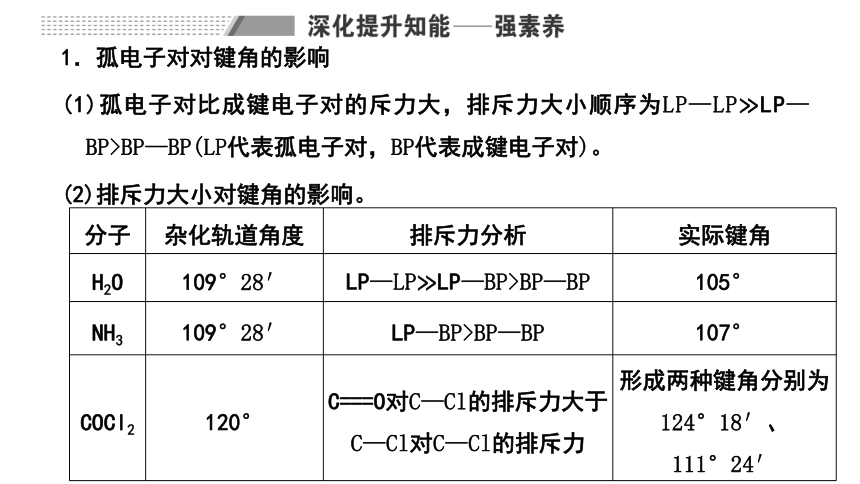
(3) (2021·河北等级考·节选)已知有关氮、磷的单键和三键的键能(kJ·mol-1)如下表:
N—N N≡N P—P P≡P
193 946 197 489
解析:(1)OF2和Cl2O都是分子晶体,结构相似,OF2的相对分子质量小,熔、沸点低。
(2)题图b中上、下两个面的面心原子分别为Hg和Ge,晶胞结构不对称,不符合晶胞平移后重合的特性,因此不是晶胞单元。
(3)由题表中键能关系可知3倍的N—N键的键能小于N≡N键的键能,而3倍的P—P键的键能大于P≡P键的键能,所以氮以N2中的N≡N形式存在更稳定,磷以P4中的P—P键形式存在更稳定。
答案:(1)低于 OF2和Cl2O都是分子晶体,结构相似,OF2的相对分子质量小
(2)图b中上、下两个面的原子不同,不符合晶胞平移后重合的特性
(3)在原子数目相同的条件下,N2比N4具有更低的能量,而P4比P2具有更低的能量,能量越低越稳定
1.孤电子对对键角的影响
(1)孤电子对比成键电子对的斥力大,排斥力大小顺序为LP—LP LP—BP>BP—BP(LP代表孤电子对,BP代表成键电子对)。
(2)排斥力大小对键角的影响。
分子 杂化轨道角度 排斥力分析 实际键角
H2O 109°28′ LP—LP LP—BP>BP—BP 105°
NH3 109°28′ LP—BP>BP—BP 107°
COCl2 120° C===O对C—Cl的排斥力大于C—Cl对C—Cl的排斥力 形成两种键角分别为124°18′、111°24′
2.范德华力、氢键、共价键对物质性质的影响
作用力类型 范德华力 氢键 共价键 作用微粒 分子 H与N、O、F 原子 强度比较 共价键>氢键>范德华力 影响因素 组成和结构相似的物质,相对分子质量越大,范德华力越大 形成氢键元素的电负性 原子半径
对性质的 影响 影响物质的熔点、沸点、溶解度等物理性质 分子间氢键使熔、沸点升高,溶解度增大 键能越大,稳定性越强
3.晶体熔、沸点高低的比较
(1)一般情况下,不同类型晶体的熔、沸点高低规律:共价晶体>离子晶体>分子晶体,如金刚石>NaCl>Cl2;金属晶体>分子晶体,如Na>Cl2(金属晶体熔、沸点有的很高,如钨、铂等,有的则很低,如汞等)。
(2)形成共价晶体的原子半径越小、键长越短,则键能越大,其熔、沸点就越高,如金刚石>石英>碳化硅>晶体硅。
(3)形成离子晶体的阴、阳离子的电荷数越多,离子半径越小,则离子键越强,熔、沸点就越高,如MgO>MgCl2,NaCl>CsCl。
(4)金属晶体中金属离子半径越小,离子所带电荷数越多,其形成的金属键越强,金属单质的熔、沸点就越高,如Al>Mg>Na。
(5)分子晶体的熔、沸点比较规律。
①组成和结构相似的分子,相对分子质量越大,其熔、沸点就越高。如HI>HBr>HCl。
②组成和结构不相似的分子,分子极性越大,其熔、沸点就越高。如CO>N2。
③同分异构体分子中,支链越少,其熔、沸点就越高。如正戊烷>异戊烷>新戊烷。
④同分异构体中的芳香烃及其衍生物,邻位取代物>间位取代物>对位取代物。如邻二甲苯>间二甲苯>对二甲苯。
题型(一) 原子结构中的原因解释
[例1] (1)N、O、S的第一电离能(I1)大小为I1(N)>I1(O)>I1(S),原因是__________________________________________________________
____________________________________。
①基态Fe2+与Fe3+离子中未成对的电子数之比为____________。
②Li及其周期表中相邻元素的第一电离能(I1)如表所示。I1(Li)>I1(Na),原因是__________________________。I1(Be)> I1(B)> I1(Li),原因是_______________________________________________。
I1/(kJ·mol-1) Li 520 Be 900 B 801
Na 496 Mg 738 Al 578
(4)第二周期元素的第一电离能(I1)随原子序数(Z)的变化情况如图。I1随Z的递增而呈增大趋势的原因是________________________,原子核对外层电子的引力增大。导致I1在a点出现齿峰的原因是_____________
____________________________________________。
②Na与Li同族,Na电子层数多,原子半径大,易失电子 Li、Be、B同周期,核电荷数依次增加。Be为1s22s2全满稳定结构,第一电离能最大。与Li相比,B核电荷数大,原子半径小,较难失去电子,第一电离能较大 (4)随原子序数增大,核电荷数增大,原子半径逐渐减小 N元素原子的2p能级轨道半满,更稳定
[思维建模]
电负性及电离能问题解题模型
[对点训练]
1.基态Co的价电子排布式为______________,Co和Fe的逐级电离能(kJ·mol-1)数据如表,Fe的I4大于Co的原因是__________________________________________。
元素 I1 I2 I3 I4 I5 ……
Fe 462.5 1 561.9 2 957 5 290 7 240
Co 760.4 1 648 3 232 4 950 7 670
解析:Co是27号,结合表中电离能,第I1、I2电离能明显小于I3,基态Co的价电子排布式为3d74s2,Fe的I4大于Co的原因是Co的第四电离能失去的是3d6的电子,Fe失去的是3d5的电子。
答案:3d74s2 Co的第四电离能失去的是3d6的电子,Fe失去的是3d5的电子
2.单质铜及镍都是由_________键形成的晶体;元素铜与镍的第二电离能分别为I(Cu)=1 958 kJ·mol-1、I(Ni)=1 753 kJ·mol-1,I(Cu)>I(Ni)的原因是__________________________________________。
解析:Ni和Cu都是由金属键形成的金属晶体,I(Cu)>I(Ni)的原因是铜失去的是全充满的3d10电子,镍失去的是4s1电子。
答案:金属 铜失去的是全充满的3d10电子,镍失去的是4s1电子
题型(二) 分子结构中的原因解释
[例2] (1)H2O的键角小于NH3的,分析原因____________________
______________________________________________________________。
(2)乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是________________________;其中与乙二胺形成的化合物稳定性相对较高的是________(填“Mg2+”或“Cu2+”)。
[思维建模]
键角问题解题模型
[对点训练]
3.(1)H2NCH2CH2NH2形成[ZrCl4(H2NCH2CH2NH2)]后,H—N—H键角将_________(填“变大”“变小”或“不变”),原因是______________________________________。
(2)H2SeO3 与 H2SO3中酸性更强的是________;原因是___________________________________________________________
_________________________________________________________。
答案:(1)变大 H2NCH2CH2NH2与Zr结合后,孤电子对变成了σ键电子对,排斥力减小,因此H—N—H键之间的夹角会增大
(2)H2SO3 H2SeO3与H2SO3 均可写为(HO)2RO,非羟基氧个数相同,由于S的电负性更强,对羟基氧电子对吸引能力较强,羟基氧上的氢较易电离,故酸性更强的是 H2SO3
4.MnO2作催化剂,氨催化还原脱除NO的一种催化机理示意图如下。
从化学键的角度解释MnO2能结合NH3的原因:_______________________
_________________________________________________。
答案:NH3中的N有孤电子对,MnO2中的Mn有空轨道能接受孤电子对,形成配位键
题型(三) 晶体结构中的原因解释
[例3] (1)(2021·湖南等级考)硅、锗(Ge)及其化合物广泛应用于光电材料领域。回答下列问题:
①晶体硅和碳化硅熔点较高的是____________(填化学式);
②硅和卤素单质反应可以得到SiX4,SiX4的熔沸点如下表:
化合物 SiF4 SiCl4 SiBr4 SiI4
熔点/K 183.0 203.2 278.6 393.7
沸点/K 187.2 330.8 427.2 560.7
(2)(2021·全国乙卷·节选)[Cr(NH3)3(H2O)2Cl]2+中配体分子NH3、H2O以及分子PH3的空间结构和相应的键角如图所示。
(3)(2021·全国甲卷·节选)甲醇的沸点(64.7 ℃)介于水(100 ℃)和甲硫醇(CH3SH,7.6 ℃)之间,其原因是____________________________。
[答案] (1)①SiC ②SiCl4 SiX4都是结构相似的分子晶体,相对分子质量依次增大,分子间作用力依次增大 (2)高 NH3分子间存在氢键 (3)甲硫醇不能形成分子间氢键,而水和甲醇均能,且水比甲醇的氢键多
[思维建模]
熔沸点比较问题解题模型
[对点训练]
5.(1)镍是一种硬而有延展性并具有铁磁性的金属,在许多领域应用广泛。Ni的熔点明显高于Ca,其原因是___________________________
_________________________________________________________。
(2)已知SbCl3的熔点是73 ℃,沸点是223.5 ℃,CoCl2的熔点是735 ℃,沸点是1 049 ℃。两者的熔沸点差异较大的原因是_____________________________________________________。预测SbCl3的空间结构为___________。
6.Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是__________________________
____________________________________________________。
化合物 TiF4 TiCl4 TiBr4 TiI4
熔点/℃ 377 -24.12 38.3 155
答案:TiF4为离子化合物,熔点高,其他三种均为共价化合物,随相对分子质量的增大分子间作用力增大,熔点逐渐升高
谢
谢
观
看
第6讲 辨析比较原因类简答题的答题规范(综合应用课)
在结构大题中以某一小问的形式呈现,能力要求较高,如阅读理解能力、信息加工能力、空间想象能力、数学思维能力等,它多以新材料为载体,试题以综合性简答题为主,考查学生逻辑思维能力。如何组织化学语言进行规范答题,是学生较为头痛的问题,今分类例析各种答题规范建立解题思维模型,变失分点为增分点。
(2)(2022·河北等级考·节选)Cu与Zn相比,第二电离能与第一电离能差值更大的是____________,原因是______________________________
____________________________________________________________。
(3)(2022·广东等级考·节选)H2Se的沸点低于H2O,其原因是_______________________________________________________________。
①____________________________________________________,
②_____________________________________________________。
解析:(1)三氧化硒分子中硒原子的价层电子对数为3,孤电子对数为0,分子的空间结构为平面三角形,键角为120°,亚硒酸根离子中硒原子的价层电子对数为4,孤电子对数为1,离子的空间结构为三角锥形,键角小于120°。
(3)H2Se的沸点低于H2O,其原因是两者都是分子晶体,由于水存在分子间氢键,沸点高。
(4)已知苯分子为非极性分子,H2O分子为极性分子,且吡啶中N原子上含有孤电子对能与H2O分子形成分子间氢键,从而导致在水中的溶解度,吡啶远大于苯。
(2)Cu Cu的第二电离能失去的是3d10的电子,第一电离能失去的是4s1电子,Zn的第二电离能失去的是4s1的电子,第一电离能失去的是4s2电子,3d10电子处于全充满状态,其与4s1电子能量差值更大
(3)两者都是分子晶体,由于水存在分子间氢键,沸点高
(4)吡啶能与H2O分子形成分子间氢键 吡啶和H2O均为极性分子相似相溶,而苯为非极性分子
2.(1)(2021·山东等级考·节选)OF2的熔、沸点______(填“高于”或“低于”)Cl2O,原因是_____________________________________
__________________________________________________________。
(2) (2021·广东等级考·节选)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是_________________________________________________
_________________________________________________________。
(3) (2021·河北等级考·节选)已知有关氮、磷的单键和三键的键能(kJ·mol-1)如下表:
N—N N≡N P—P P≡P
193 946 197 489
解析:(1)OF2和Cl2O都是分子晶体,结构相似,OF2的相对分子质量小,熔、沸点低。
(2)题图b中上、下两个面的面心原子分别为Hg和Ge,晶胞结构不对称,不符合晶胞平移后重合的特性,因此不是晶胞单元。
(3)由题表中键能关系可知3倍的N—N键的键能小于N≡N键的键能,而3倍的P—P键的键能大于P≡P键的键能,所以氮以N2中的N≡N形式存在更稳定,磷以P4中的P—P键形式存在更稳定。
答案:(1)低于 OF2和Cl2O都是分子晶体,结构相似,OF2的相对分子质量小
(2)图b中上、下两个面的原子不同,不符合晶胞平移后重合的特性
(3)在原子数目相同的条件下,N2比N4具有更低的能量,而P4比P2具有更低的能量,能量越低越稳定
1.孤电子对对键角的影响
(1)孤电子对比成键电子对的斥力大,排斥力大小顺序为LP—LP LP—BP>BP—BP(LP代表孤电子对,BP代表成键电子对)。
(2)排斥力大小对键角的影响。
分子 杂化轨道角度 排斥力分析 实际键角
H2O 109°28′ LP—LP LP—BP>BP—BP 105°
NH3 109°28′ LP—BP>BP—BP 107°
COCl2 120° C===O对C—Cl的排斥力大于C—Cl对C—Cl的排斥力 形成两种键角分别为124°18′、111°24′
2.范德华力、氢键、共价键对物质性质的影响
作用力类型 范德华力 氢键 共价键 作用微粒 分子 H与N、O、F 原子 强度比较 共价键>氢键>范德华力 影响因素 组成和结构相似的物质,相对分子质量越大,范德华力越大 形成氢键元素的电负性 原子半径
对性质的 影响 影响物质的熔点、沸点、溶解度等物理性质 分子间氢键使熔、沸点升高,溶解度增大 键能越大,稳定性越强
3.晶体熔、沸点高低的比较
(1)一般情况下,不同类型晶体的熔、沸点高低规律:共价晶体>离子晶体>分子晶体,如金刚石>NaCl>Cl2;金属晶体>分子晶体,如Na>Cl2(金属晶体熔、沸点有的很高,如钨、铂等,有的则很低,如汞等)。
(2)形成共价晶体的原子半径越小、键长越短,则键能越大,其熔、沸点就越高,如金刚石>石英>碳化硅>晶体硅。
(3)形成离子晶体的阴、阳离子的电荷数越多,离子半径越小,则离子键越强,熔、沸点就越高,如MgO>MgCl2,NaCl>CsCl。
(4)金属晶体中金属离子半径越小,离子所带电荷数越多,其形成的金属键越强,金属单质的熔、沸点就越高,如Al>Mg>Na。
(5)分子晶体的熔、沸点比较规律。
①组成和结构相似的分子,相对分子质量越大,其熔、沸点就越高。如HI>HBr>HCl。
②组成和结构不相似的分子,分子极性越大,其熔、沸点就越高。如CO>N2。
③同分异构体分子中,支链越少,其熔、沸点就越高。如正戊烷>异戊烷>新戊烷。
④同分异构体中的芳香烃及其衍生物,邻位取代物>间位取代物>对位取代物。如邻二甲苯>间二甲苯>对二甲苯。
题型(一) 原子结构中的原因解释
[例1] (1)N、O、S的第一电离能(I1)大小为I1(N)>I1(O)>I1(S),原因是__________________________________________________________
____________________________________。
①基态Fe2+与Fe3+离子中未成对的电子数之比为____________。
②Li及其周期表中相邻元素的第一电离能(I1)如表所示。I1(Li)>I1(Na),原因是__________________________。I1(Be)> I1(B)> I1(Li),原因是_______________________________________________。
I1/(kJ·mol-1) Li 520 Be 900 B 801
Na 496 Mg 738 Al 578
(4)第二周期元素的第一电离能(I1)随原子序数(Z)的变化情况如图。I1随Z的递增而呈增大趋势的原因是________________________,原子核对外层电子的引力增大。导致I1在a点出现齿峰的原因是_____________
____________________________________________。
②Na与Li同族,Na电子层数多,原子半径大,易失电子 Li、Be、B同周期,核电荷数依次增加。Be为1s22s2全满稳定结构,第一电离能最大。与Li相比,B核电荷数大,原子半径小,较难失去电子,第一电离能较大 (4)随原子序数增大,核电荷数增大,原子半径逐渐减小 N元素原子的2p能级轨道半满,更稳定
[思维建模]
电负性及电离能问题解题模型
[对点训练]
1.基态Co的价电子排布式为______________,Co和Fe的逐级电离能(kJ·mol-1)数据如表,Fe的I4大于Co的原因是__________________________________________。
元素 I1 I2 I3 I4 I5 ……
Fe 462.5 1 561.9 2 957 5 290 7 240
Co 760.4 1 648 3 232 4 950 7 670
解析:Co是27号,结合表中电离能,第I1、I2电离能明显小于I3,基态Co的价电子排布式为3d74s2,Fe的I4大于Co的原因是Co的第四电离能失去的是3d6的电子,Fe失去的是3d5的电子。
答案:3d74s2 Co的第四电离能失去的是3d6的电子,Fe失去的是3d5的电子
2.单质铜及镍都是由_________键形成的晶体;元素铜与镍的第二电离能分别为I(Cu)=1 958 kJ·mol-1、I(Ni)=1 753 kJ·mol-1,I(Cu)>I(Ni)的原因是__________________________________________。
解析:Ni和Cu都是由金属键形成的金属晶体,I(Cu)>I(Ni)的原因是铜失去的是全充满的3d10电子,镍失去的是4s1电子。
答案:金属 铜失去的是全充满的3d10电子,镍失去的是4s1电子
题型(二) 分子结构中的原因解释
[例2] (1)H2O的键角小于NH3的,分析原因____________________
______________________________________________________________。
(2)乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是________________________;其中与乙二胺形成的化合物稳定性相对较高的是________(填“Mg2+”或“Cu2+”)。
[思维建模]
键角问题解题模型
[对点训练]
3.(1)H2NCH2CH2NH2形成[ZrCl4(H2NCH2CH2NH2)]后,H—N—H键角将_________(填“变大”“变小”或“不变”),原因是______________________________________。
(2)H2SeO3 与 H2SO3中酸性更强的是________;原因是___________________________________________________________
_________________________________________________________。
答案:(1)变大 H2NCH2CH2NH2与Zr结合后,孤电子对变成了σ键电子对,排斥力减小,因此H—N—H键之间的夹角会增大
(2)H2SO3 H2SeO3与H2SO3 均可写为(HO)2RO,非羟基氧个数相同,由于S的电负性更强,对羟基氧电子对吸引能力较强,羟基氧上的氢较易电离,故酸性更强的是 H2SO3
4.MnO2作催化剂,氨催化还原脱除NO的一种催化机理示意图如下。
从化学键的角度解释MnO2能结合NH3的原因:_______________________
_________________________________________________。
答案:NH3中的N有孤电子对,MnO2中的Mn有空轨道能接受孤电子对,形成配位键
题型(三) 晶体结构中的原因解释
[例3] (1)(2021·湖南等级考)硅、锗(Ge)及其化合物广泛应用于光电材料领域。回答下列问题:
①晶体硅和碳化硅熔点较高的是____________(填化学式);
②硅和卤素单质反应可以得到SiX4,SiX4的熔沸点如下表:
化合物 SiF4 SiCl4 SiBr4 SiI4
熔点/K 183.0 203.2 278.6 393.7
沸点/K 187.2 330.8 427.2 560.7
(2)(2021·全国乙卷·节选)[Cr(NH3)3(H2O)2Cl]2+中配体分子NH3、H2O以及分子PH3的空间结构和相应的键角如图所示。
(3)(2021·全国甲卷·节选)甲醇的沸点(64.7 ℃)介于水(100 ℃)和甲硫醇(CH3SH,7.6 ℃)之间,其原因是____________________________。
[答案] (1)①SiC ②SiCl4 SiX4都是结构相似的分子晶体,相对分子质量依次增大,分子间作用力依次增大 (2)高 NH3分子间存在氢键 (3)甲硫醇不能形成分子间氢键,而水和甲醇均能,且水比甲醇的氢键多
[思维建模]
熔沸点比较问题解题模型
[对点训练]
5.(1)镍是一种硬而有延展性并具有铁磁性的金属,在许多领域应用广泛。Ni的熔点明显高于Ca,其原因是___________________________
_________________________________________________________。
(2)已知SbCl3的熔点是73 ℃,沸点是223.5 ℃,CoCl2的熔点是735 ℃,沸点是1 049 ℃。两者的熔沸点差异较大的原因是_____________________________________________________。预测SbCl3的空间结构为___________。
6.Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是__________________________
____________________________________________________。
化合物 TiF4 TiCl4 TiBr4 TiI4
熔点/℃ 377 -24.12 38.3 155
答案:TiF4为离子化合物,熔点高,其他三种均为共价化合物,随相对分子质量的增大分子间作用力增大,熔点逐渐升高
谢
谢
观
看
同课章节目录
