2024届高考一轮复习 第五章 物质结构与性质 元素周期律 第3讲 化学键 分子结构与性质(114张PPT)
文档属性
| 名称 | 2024届高考一轮复习 第五章 物质结构与性质 元素周期律 第3讲 化学键 分子结构与性质(114张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-17 22:54:16 | ||
图片预览







文档简介
(共114张PPT)
第3讲 化学键 分子结构与性质(基础落实课)
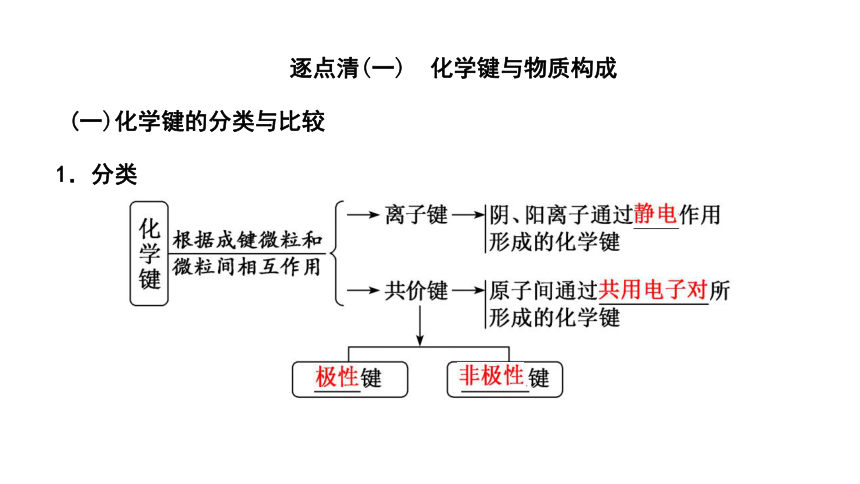
逐点清(一) 化学键与物质构成
(一)化学键的分类与比较
1.分类
2.比较
项目 离子键 共价键 非极性键 极性键 成键粒子 ___________ _______ 成键 实质 阴、阳离子间的静电作用 _____________不偏向任何一方 _____________偏向一方原子
形成条件 非金属性强的元素与金属性强的元素经得失电子,形成离子键 同种元素原子之间成键 不同种元素原子之间成键
阴、阳离子
原子
共用电子对
共用电子对
形成 的物质 离子化合物如NaCl、KCl、MgCl2、CaCl2、ZnSO4、NaOH等 非金属单质如H2、Cl2、N2等;某些共价化合物如H2O2或离子化合物如Na2O2 共价化合物如HCl、CO2、CH4或离子化合物如NaOH、NH4Cl
续表
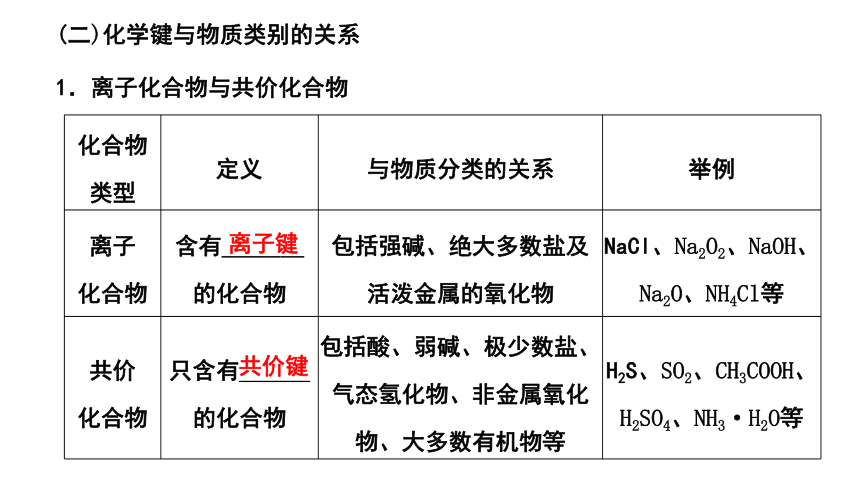
(二)化学键与物质类别的关系
1.离子化合物与共价化合物
化合物 类型 定义 与物质分类的关系 举例
离子 化合物 含有_______的化合物 包括强碱、绝大多数盐及活泼金属的氧化物 NaCl、Na2O2、NaOH、Na2O、NH4Cl等
共价 化合物 只含有______的化合物 包括酸、弱碱、极少数盐、气态氢化物、非金属氧化物、大多数有机物等 H2S、SO2、CH3COOH、H2SO4、NH3·H2O等
离子键
共价键
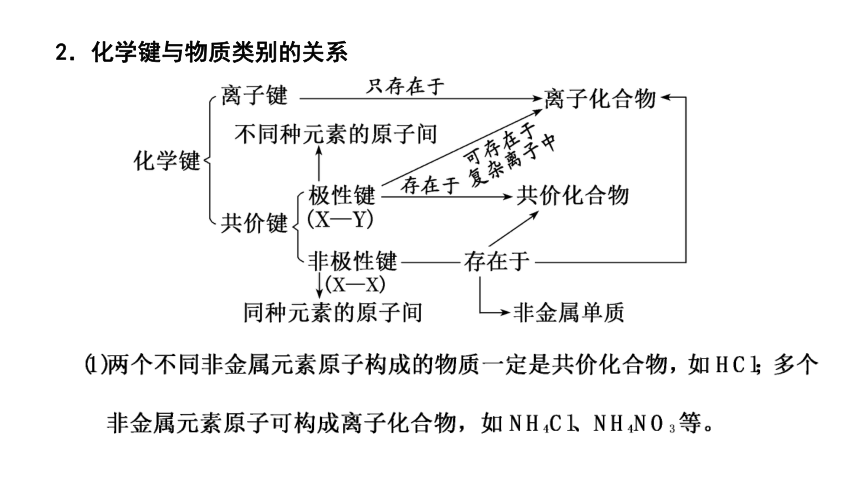
2.化学键与物质类别的关系
(2)离子化合物溶于水或熔化后均电离成自由移动的阴、阳离子,离子键被破坏;共价化合物在液态下不电离,所以熔化时导电的化合物一定是离子化合物。
(3)只含有极性共价键的物质一般是不同种非金属元素形成的共价化合物,如SiO2、HCl、CH4等。
(4)既有极性键又有非极性键的共价化合物一般由多个原子构成,如H2O2、C2H4等。
(5)既有离子键又有极性共价键的物质,如NaOH、K2SO4等;既有离子键又有非极性共价键的物质,如Na2O2等。
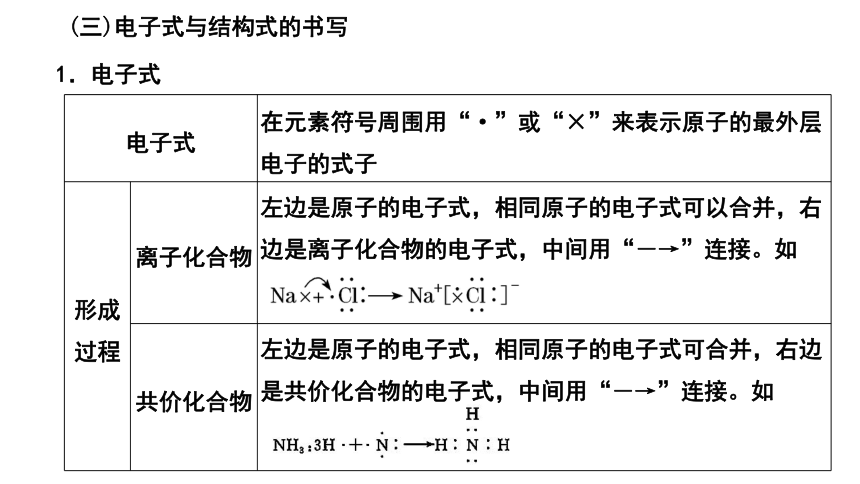
(三)电子式与结构式的书写
1.电子式
电子式 在元素符号周围用“·”或“×”来表示原子的最外层电子的式子
形成 过程 离子化合物 左边是原子的电子式,相同原子的电子式可以合并,右边是离子化合物的电子式,中间用“―→”连接。如
共价化合物 左边是原子的电子式,相同原子的电子式可合并,右边是共价化合物的电子式,中间用“―→”连接。如
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)任何原子或离子之间均可形成化学键 ( )
(2)离子键只存在于离子化合物中,共价键也只存在于共价化合物中 ( )
(3)金属与非金属形成的化合物一定是离子化合物,含离子键 ( )
(4)含共价键的化合物一定是共价化合物 ( )
(5)强碱和铵盐均含离子键和共价键 ( )
(6)原子最外层只有一个电子的元素原子跟卤素原子结合时,所形成的化学键一定是离子键 ( )
×
×
×
×
×
√
×
×
×
√
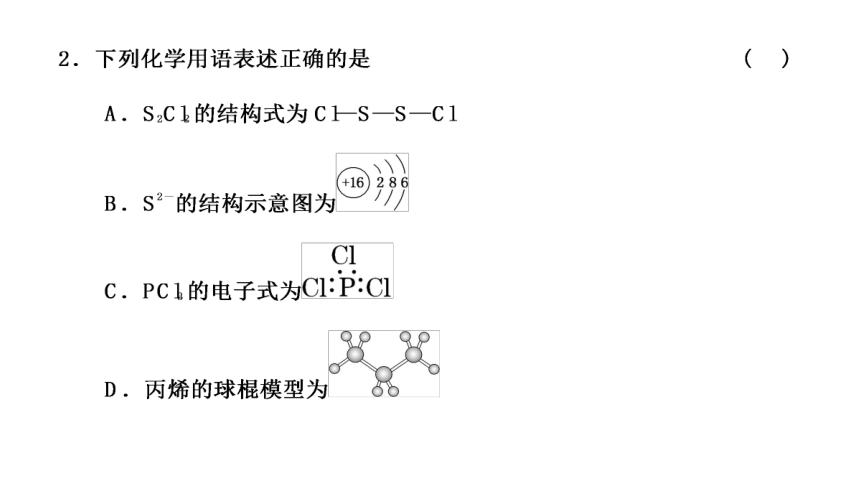
解析:S2-的结构示意图中最外层为8个电子,B错误;
PCl3中氯原子和磷原子周围都应有8个电子,C错误;
D中给的是丙烷的球棍模型,错误。
答案:A
3.有以下9种物质:①Ne ②HCl ③P4 ④C2H2
⑤Na2S ⑥NaOH ⑦Na2O2 ⑧NH4Cl ⑨AlCl3
请用上述物质的序号填空:
(1)不存在化学键的是________。
(2)只存在极性共价键的是________。
(3)含有非极性共价键的离子化合物是________。
(4)既存在非极性共价键又存在极性共价键的是________。
(5)只存在离子键的是________。
(6)既存在离子键又存在共价键、配位键的是____。
(7)属于离子化合物的是________。
答案:(1)① (2)②⑨ (3)⑦ (4)④ (5)⑤
(6)⑧ (7)⑤⑥⑦⑧
[题点考法·全面练通]
题点(一) 化学键与物质类别的关系
1.有如下四种物质,其中所含化学键类型、所属化合物类型完全正确的一组是 ( )
选项 A B C D
物质 MgCl2 HCl NH4NO3 N2H4
所含化学键 类型 离子键、 共价键 共价键 离子键 离子键、
共价键
所属化合物 类型 离子化 合物 共价化 合物 离子化 合物 共价化
合物
解析: MgCl2中只有离子键,属于离子化合物,故A错误;
HCl只有共价键,是共价化合物,故B正确;
硝酸铵含有离子键和共价键,是离子化合物,故C错误;
N2H4只含有共价键,是共价化合物,故D错误。
答案:B
3.(1)请用下列10种物质的序号填空。
①O2 ②H2 ③NH4NO3 ④K2O2 ⑤Ba(OH)2
⑥CH4 ⑦CO2 ⑧NaF ⑨NH3 ⑩I2
其中既含离子键又含非极性键的是________;既含离子键又含极性键的是________。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为____________________;若XY2为共价化合物时,其结构式为__________。
(3)氯化铝的物理性质非常特殊,如氯化铝的熔点为190 ℃,但在180 ℃就开始升华。据此判断,氯化铝是________(填“共价化合物”或“离子化合物”),可以证明你判断正确的实验依据是_____________________
_______________________________________________________________。
解析:(2)1∶2型离子化合物,通常X为+2价,Y为-1价,故X可能是Mg2+或Ca2+,Y可能是F-或Cl-,结合XY2中含有38个电子可推出XY2为CaF2。1∶2型共价化合物一般是碳族元素与氧族元素化合形成的,如CO2、CS2等,再由XY2中共有38个电子,可推出XY2为CS2。
化学键 类型 含离子键的化合物,一定是离子化合物
只含共价键的化合物,一定是共价化合物
化合物 类型 大多数金属氧化物、强碱、大多数盐是离子化合物
一般非金属氢化物、非金属氧化物、有机物(有机盐除外)为共价化合物
化合物 性质 熔融状态下能导电的化合物为离子化合物
熔融状态下不能导电的化合物为共价化合物
[思维建模] 离子化合物、共价化合物的判断
题点(二) 物质变化引起的化学键变化
4.下列说法正确的是 ( )
A.碘晶体受热转变为碘蒸气,吸收的热量用于克服碘原子间的作用力
B.硫酸钾和硫酸溶于水都电离出硫酸根离子,所以它们在熔融状态下都能导电
C.2Na2O2+2H2O===4NaOH+O2↑反应中既有离子键、非极性键、极性键的断裂又有离子键、极性键、非极性键的形成
D.金刚石与NaCl熔化克服相同类型的化学键
解析:A项,克服I2分子间作用力,错误;
B项,H2SO4熔融状态不电离,故不能导电,错误;
D项,金刚石熔化克服共价键,NaCl熔化克服离子键,错误。
答案:C
5.下列关于NaHSO4的说法正确的是 ( )
A.因为NaHSO4是离子化合物,所以NaHSO4固体能够导电
B.NaHSO4固体中阳离子和阴离子的个数比是2∶1
C.NaHSO4固体熔化时破坏的是离子键和共价键
D.NaHSO4固体溶于水时破坏的是离子键和共价键
答案:D
[归纳拓展] 物质熔化、溶解时化学键的变化
(1)离子化合物的溶解或熔化过程
离子化合物溶于水或熔化后均电离出自由移动的阴、阳离子,离子键被破坏。
(2)共价化合物的溶解过程
①有些共价化合物溶于水后,能与水反应,其分子内共价键被破坏,如CO2和SO2等。
②有些共价化合物溶于水后,与水分子作用形成水合离子,从而发生电离,形成阴、阳离子,其分子内的共价键被破坏,如HCl、H2SO4等。
③有些共价化合物溶于水后,其分子内的共价键不被破坏,如蔗糖(C12H22O11)、酒精(C2H5OH)等。
题点(三) 电子式与结构式的书写
6.(1)CH4、N2H4的结构式分别为______________、______________。
(2)乙烯、乙醇的结构简式分别为______________、____________。
(3)苯、硝基苯的结构简式分别为____________、____________。
(4)淀粉的分子通式为__________,聚乙烯的结构简式为__________。
8.用电子式表示下列物质的形成过程。
(1)MgBr2:_________________________________________________。
(2)H2O:____________________________________________________。
(3)H2:______________________________________________________。
(4)Na3N:_________________________________________________。
答案:
[易错提醒] 电子式书写常见的四大误区
续表
逐点清(二) 共价键与键参数
1.本质和特征
共价键的本质是在原子之间形成___________,其特征是具有_______和________。
共用电子对
饱和性
方向性
分类依据 类型
形成共价键的原 子轨道重叠方式 σ键 电子云“头碰头”重叠
π键 电子云“肩并肩”重叠
形成共价键的 电子对是否偏移, 极性键 共用电子对_____偏移
________键 共用电子对不发生偏移
原子间共用 电子对的数目 _________ 原子间有____共用电子对
双键 原子间有两对共用电子对
________ 原子间有_____共用电子对
2.分类
发生
非极性
单键
一对
三键
三对
4.大π键的简介
5.共价键的键参数
(1)定义
键能 气态分子中1 mol化学键解离成气态原子所吸收的能量
键长 构成化学键的两个原子的核间距
键角 在多原子分子中,两个相邻共价键之间的夹角
(2)键参数对分子性质的影响
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)共价键的成键原子只能是非金属原子 ( )
(2)在任何情况下,都是σ键比π键强度大 ( )
(3)H与O形成分子式是H2O而不是H3O的原因是共价键有饱和性 ( )
(4)气体单质中一定存在σ键,可能存在π键 ( )
(5)σ键能单独形成,而π键一定不能单独形成 ( )
(6)s-s σ键与s-p σ键的电子云形状对称性相同 ( )
×
×
×
√
√
√
(7)任何共价键形成时,原子轨道重叠都有方向性 ( )
(8)CO2、CCl4分子中均有π键 ( )
×
×
×
2.关于键长、键能和键角的说法中不正确的是 ( )
A.键角是描述分子空间结构的重要参数
B.键长的大小与成键原子的半径和成键数目有关
C.键能越大,键长就越长,共价化合物也就越稳定
D.键角的大小与键长、键能的大小无关
解析:C项应是键能越大,键长越短,共价化合物就越稳定。
答案:C
3.(1)Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是__________
__________________________________________________________。
[题点考法·全面练通]
题点(一) 共价键及其分类
1.下列关于σ键和π键的理解不正确的是 ( )
A.含有π键的分子在进行化学反应时,分子中的π键比σ键活泼
B.在有些分子中,共价键可能只含有π键而没有σ键
C.有些原子在与其他原子形成分子时只能形成σ键,不能形成π键
D.当原子形成分子时,首先形成σ键,可能形成π键
解析:同一分子中的π键不如σ键牢固,反应时比较容易断裂,A项正确;
在共价单键中只含有σ键,而含有π键的分子中一定含有σ键,B项错误、D项正确;
氢原子、氯原子等跟其他原子形成分子时只能形成σ键,C项正确。
答案:B
2.含碳元素的物质是化学世界中最庞大的家族,请填写下列空格。
(1)CH4中的化学键从形成过程来看,属于______(填“σ”或“π”)键,从其极性来看属于________键。
(2)已知CN-与N2结构相似,推算HCN分子中σ键与π键的数目之比为________。
(3)C60分子中每个碳原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子稳定结构,则C60分子中π键的数目为________。
轨道重叠 方式 形成σ键时,原子轨道以“头碰头”的方式重叠;形成π键时,原子轨道以“肩并肩”的方式重叠
电子云 的对称性 σ键的电子云是以形成化学键的两原子核的连线为轴旋转对称,为轴对称;π键的电子云是由两块组成,它们互为镜像,为镜面对称
原子间共 用电子对数目 单键均为σ键,双键含有1个σ键和1个π键,三键含有1个σ键和2个π键
共价键强度 σ键强度较大,较稳定;π键活泼,比较容易断裂。注意:N≡N中π键较稳定
[思维建模] σ键与π键的判断方法
题点(二) 共价键的键参数及应用
3.下列物质性质的变化规律,与共价键的键能大小有关的是 ( )
①F2、Cl2、Br2、I2的熔点、沸点逐渐升高
②HF、HCl、HBr、HI的热稳定性依次减弱
③金刚石的硬度、熔点、沸点都高于晶体硅
④H2O的沸点高于H2S的沸点
A.①② B.②③ C.①④ D.②④
解析: ①F2、Cl2、Br2、I2熔沸点与共价键无关,只与分子间作用力有关;④H2O的沸点高于H2S是因为H2O分子间形成氢键,与共价键无关。
答案:B
4.已知N—N、N===N和N≡N键能之比为1.00∶2.17∶4.90,而C—C、C===C、C≡C键能之比为1.00∶1.77∶2.34。下列说法正确的是( )
A.σ键一定比π键稳定
B.N2较易发生加成
C.乙烯、乙炔较易发生加成
D.乙烯、乙炔中的π键比σ键稳定
解析: N≡N、N===N中π键比σ键稳定,难发生加成,C===C、C≡C中π键比σ键弱,较易发生加成。
答案:C
5.已知几种共价键的键能如下:
化学键 H—N N≡N Cl—Cl H—Cl
键能/(kJ·mol-1) 391 946 243 431
解析:NH3的沸点比HCl的高,与共价键的键能无关,C项错误。
答案:C
逐点清(三) 分子的空间结构与杂化轨道
1.价层电子对互斥模型(VSEPR)及应用
(1)理论要点
①价层电子对在空间上彼此相距越远时,排斥力_______,体系的能量越低。
②孤电子对的排斥力较大,孤电子对越多,排斥力越强,键角____。如H2O的键角_____CH4的键角。
[注意] 价层电子对数与电子对空间结构的关系
2对—直线形,3对—平面三角形,4对—四面体形。
越小
越小
小于
(2)价层电子对的计算
(3)价层电子对互斥模型与分子的空间结构
2.杂化轨道理论
(1)杂化轨道理论概述
当原子成键时,原子的能量相近的轨道相互混杂,形成与原轨道数相等且能量相同的杂化轨道。杂化轨道数不同,轨道间的夹角不同,形成分子的空间结构不同。
(2)杂化轨道三种类型
sp杂化 sp杂化轨道由___________和__________杂化而成,杂化轨道间夹角为_______,呈_____形,如BeCl2
sp2杂化 sp2杂化轨道由__________和__________杂化而成,杂化轨道间夹角为______,呈__________形,如BF3
sp3杂化 sp3杂化轨道由__________和__________杂化而成,杂化轨道间夹角为___________,呈___________形,如CH4
1个s轨道
1个p轨道
180°
直线
1个s轨道
2个p轨道
120°
平面三角
1个s轨道
3个p轨道
109°28′
正四面体
(3) 杂化轨道的类型与分子的空间结构
sp2
3
4
平面三角形
(2)常见等电子体分类示例
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)中心原子的价层电子对数为3时,VSEPR模型为平面三角形 ( )
(2)VSEPR模型与粒子结构一定相同 ( )
(3)分子中中心原子若通过sp3杂化轨道成键,则该分子一定为正四面体
结构 ( )
(4)NH3分子为三角锥形,N原子发生sp2杂化 ( )
(5)中心原子是sp杂化的,其分子空间结构不一定为直线形 ( )
√
×
×
×
×
(6)杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对 ( )
(7)价层电子对互斥模型中,π键电子对数不计入中心原子的价层电子
对数 ( )
(8)H2O与H2S分子中的中心原子的价层电子对数均为4,其VSEPR模型
相同 ( )
√
√
√
2.BeCl2是共价分子,可以以单体、二聚体和多聚体形式存在。它们的结构简式如下,请写出单体、二聚体和多聚体中Be的杂化轨道类型:
[题点考法·全面练通]
题点(一) 粒子的空间结构
1.用价层电子对互斥模型(VSEPR)预测H2S和COCl2的空间结构,两个结论都正确的是 ( )
A.直线形;三角锥形 B.V形;三角锥形
C.直线形;平面三角形 D.V形;平面三角形
3.(1)(2022·河北等级考·节选)SnCl的空间结构为____________,其中心离子杂化方式为________________________________________。
(2)(2021·山东等级考·节选)OF2分子的空间结构为__________;
(3)(2021·湖南等级考·节选)气态SiX4分子的空间结构是________;
(4)(2020·全国卷Ⅰ·节选)磷酸根离子的空间结构为________,其中P的价层电子对数为________、杂化轨道类型为________。
答案:(1)三角锥形 sp3杂化
(2)V形
(3)正四面体
(4)正四面体形 4 sp3
[思维建模] 判断分子或离子空间结构“三步曲”
第一步:确定中心原子上的价层电子对数
第二步:确定价层电子对的空间结构
由于价层电子对之间的相互排斥作用,使它们尽可能地相互远离,这样已知价层电子对的数目,就可以确定它们的空间结构。
第三步:分子空间结构的确定
价层电子对有成键电子对和孤电子对之分,价层电子对的总数减去成键电子对数得孤电子对数。根据成键电子对数和孤电子对数,可以确定相应的较稳定的分子空间结构。
题点(二) 中心原子杂化类型的判断
4.下列关于磷酸氯喹(结构如图所示)的说法错误的是 ( )
A.分子式为C18H32ClN3O8P2
B.分子中含有2个sp3杂化的氮原子和1个sp2杂化的氮原子
C.分子中碳的杂化类型有2种
D.H3PO4中磷的杂化类型为sp2杂化
解析:A项,分子式应为C18H32ClN3O8P2,正确;
D项,H3PO4中磷的杂化类型为sp3杂化,错误。
答案:D
5.(1)(2022·全国甲卷·节选)2008年北京奥运会的“水立方”,在2022年冬奥会上华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯(CH2===CH2)与四氟乙烯(CF2===CF2)的共聚物(ETFE)制成。CF2===CF2和ETFE分子中C的杂化轨道类型分别为________和________。
(2)(2022·海南等级考·节选)酞菁分子结构如下图,
分子中所有原子共平面,所有N原子的杂化轨道
类型相同,均采取__________杂化。
[思维建模] “四方法”判断中心原子的杂化类型
(1)根据杂化轨道的空间结构
①直线形—sp,②平面三角形—sp2,③四面体形—sp3。
(2)根据杂化轨道间的夹角
①109°28′—sp3,②120°—sp2,③180°—sp。
(3)利用价层电子对数确定三种杂化类型(适用于中心原子)
2对—sp杂化,3对—sp2杂化,4对—sp3杂化。
(4)根据σ键数与孤电子对数(适用于结构式已知的粒子)
①含C有机物:2个σ —sp,3个σ —sp2,4个σ —sp3。
②含N化合物:2个σ —sp2,3个σ —sp3。
③含O(S)化合物:2个σ —sp3。
题点(三) 键角大小的判断
6.用价层电子对互斥模型(VSEPR)可以预测许多分子或离子的空间结构,有时也能用来推测键角大小,下列判断错误的是 ( )
A.SO2、CS2、HI都是直线形的分子
B.BF3键角为120°,SnBr2键角小于120°
C.CH2O、BF3、SO3都是平面三角形的分子
D.NCl3的键角大于PCl3的键角
解析:A项,SO2为V形分子,错误;
B项,SnBr2 中有一个孤电子对,键角小于120°,正确。
答案:A
8.(1)(2022·北京等级考·节选)比较SO和H2O分子中的键角大小并给出相应解释:_________________________________________________。
____________________________________________________________
(2)(2021·全国乙卷·节选)H2O的键角小于NH3的,分析原因: ____________________________________________________________
____________________________________________________________。
解析:(1)硫酸根离子中硫原子的价层电子对数为4、孤电子对数为0,离子的空间结构为正四面体形,水分子中氧原子的价层电子对数为4、孤电子对数为2,孤电子对与成键电子对间的斥力较大,分子的空间结构为V形,所以硫酸根离子的键角大于水分子。
(2)H2O、NH3均为sp3杂化,其中心原子的孤电子对数分别为2、1,由于孤电子对对成键电子对的斥力大于成键电子对对成键电子对的斥力,因此孤电子对数越多,键角越小。
[思维建模] 键角比较的三种思维模板
(1)杂化类型不同→sp>sp2>sp3。
(2)杂化类型相同
①孤电子对数越多,键角越小,如H2O<NH3。
②孤电子对数相同,中心原子电负性越大,键角越大,如H2O>H2S。
③孤电子对数相同,中心原子相同,配位原子电负性越大,键角越小,如NF3<NCl3。
(3)在同一分子中,π键电子斥力大,键角大。
题点(四) 等电子原理及应用
9.(1)写出两个与CS2具有相同空间结构和键合形式的分子或离子________。
(2)根据等电子原理,仅由第二周期元素形成的共价分子中,互为等电子体的是______和________、________和________。
(5)与OH-互为等电子体的一种分子为________(填化学式)。
(6)与SO3互为等电子体的阴离子为________。
(7)与N2互为等电子体的分子是________,阴离子是________,阳离子是________。
逐点清(四) 分子结构与物质的性质
(一)共价键的极性
1.键的极性与分子的极性
2.键的极性对化学性质的影响
键的极性对物质的化学性质有重要影响,如:
(1)CF3COOH的酸性____CCl3COOH______CHCl2COOH。是因为F3C—的极性______Cl3C—的极性,导致羧基中的—OH的极性更大,更易电离出氢离子。
(2)HCOOH的酸性_____CH3COOH_____C2H5COOH是因为烷基(R—)是
_______基团,烷基越长推电子效应______,使羧基中的羟基的极性
______,羧酸的酸性越弱。
大于
大于
大于
大于
大于
推电子
越大
越小
(二)分子间的作用力
1.分子间作用力的理解
概念 物质分子之间______存在的相互作用力,称为分子间作用力
分类 分子间作用力最常见的是范德华力和______
强弱 范德华力<氢键<化学键
普遍
氢键
2.范德华力与氢键
(1)范德华力
范德华力主要影响物质的熔点、沸点、硬度等物理性质。范德华力越强,物质的熔点、沸点越高,硬度越大。一般来说,组成和结构相似的物质,随着______________的增加,范德华力逐渐________
相对分子质量
增大
(2)氢键
形成 已经与_____________的原子形成共价键的________ (如水分子中的氢)与另一个______________的原子(如水分子中的氧)之间形成的作用力,称为氢键
表示 方法 X—H…Y—。
①X、Y为电负性很强的原子,一般为N、O、F三种元素的原子。
②X、Y可以相同,也可以不同
特征 具有一定的__________和方向性。如在冰中每个H2O分子周围以四面体的4个方向形成4个氢键
电负性很大
氢原子
电负性很大
饱和性
分类 氢键包括________氢键和分子间氢键两种。其中分子间氢键主要表现为使物质的熔、沸点______,对电离和溶解度等产生影响。
影响 X—H…Y— 中X、Y的电负性越强,氢键越强。如F—H…F>O—H…O>N—H…N
分子内
升高
较低
续表
3.溶解性
(1)“相似相溶”的规律:非极性溶质一般能溶于__________,极性溶质一般能溶于____________。若能形成氢键,则溶剂和溶质之间的氢键作用力越大,溶解性越好。
(2)“相似相溶”还适用于分子结构的相似性,如乙醇和水互溶(C2H5OH和H2O中的羟基相近),而戊醇在水中的溶解度明显减小。
(3)分子与H2O反应,也能促进分子在水中的溶解度,如SO2、NH3。
非极性溶剂
极性溶剂
4.分子的手性
手性 异构 具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为______,却在三维空间里不能重叠
手性 分子 有手性异构体的分子
手性 碳原子 在有机物分子中,连有_______不同基团的碳原子
镜像
四个
5.无机含氧酸分子的酸性
无机含氧酸的通式可写成(HO)mROn,如果成酸元素R相同,则n值越大,R的正电性越大,导致R—O—H中O的电子向R偏移,在水分子的作用下越易电离出H+,酸性越强,如酸性:HClO微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)F2的熔沸点比Cl2的低是因为F2分子间作用力较小 ( )
(2)HCl易溶于水是因为HCl与H2O分子间形成氢键 ( )
(3)H2O分子间形成氢键,故H2O比H2S稳定 ( )
(4)范德华力是分子间作用力,而氢键是共价键 ( )
(5)可燃冰(CH4·nH2O,6≤n≤8)中甲烷分子与水分子间形成了氢键 ( )
(6)乙醇分子和水分子间只存在范德华力 ( )
√
×
×
×
×
×
(7)在相同条件下,NH3在水中的溶解度比HCl的大的原因是NH3与H2O形成分子间氢键 ( )
(8)氢键的存在一定能使物质的熔、沸点升高 ( )
(9)含—OH或—COOH的有机物一定均易溶于水,难溶于有机溶剂 ( )
( )
√
×
×
×
(2)葡萄糖分子的结构简式为CH2OH(CHOH)4CHO,该分子中含有________个手性碳原子。
答案:(1)< HIO4分子中非羟基氧较多 (2)4
[题点考法·全面练通]
题点(一) 分子极性的判断
1.下列各组分子中,都属于含极性键的非极性分子的是 ( )
A.CO2、H2S B.C2H4、CH4
C.Cl2、C2H2 D.NH3、HCl
解析:H2S和NH3、HCl都是含极性键的极性分子;Cl2是含有非极性键的非极性分子;CO2、CH4是只含有极性键的非极性分子;C2H4和C2H2是含有极性键和非极性键的非极性分子。
答案:B
2.下列关于CS2、SO2、NH3三种物质的说法正确的是 ( )
A.CS2在水中的溶解度很小,是由于其属于极性分子
B.SO2和NH3均易溶于水,原因之一是它们都是极性分子
C.CS2为非极性分子,在三种物质中熔沸点最低
D.NH3在水中溶解度很大只是因为NH3是极性分子
解析:根据“相似相溶”原理,CS2在水中的溶解度很小,水是极性分子,则CS2是非极性分子,故A错误;
由于SO2和NH3都是极性分子,水也是极性分子,根据“相似相溶”原理,二者均易溶于水,故B正确;
由于CS2常温下是液体,SO2和NH3常温下是气体,CS2的熔沸点最高,故C
错误;
NH3在水中溶解度很大,除了由于NH3分子有极性外,还因为NH3分子和H2O分子之间可以形成氢键,故D错误。
答案:B
[思维建模] 分子极性判断
(1)共价键的极性与分子极性的关系
(2)判断ABn型分子极性的经验规律
若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子,若不等则为极性分子。如SO2为极性分子,SO3为非极性分子。
题点(二) 范德华力、氢键对性质的影响
3.下列说法不正确的是 ( )
A.HCl、HBr、HI的熔、沸点依次升高与分子间作用力大小有关
B.H2O的熔、沸点高于H2S是由于H2O分子间存在氢键
C.甲烷可与水形成氢键
D.白酒中,乙醇分子和水分子间存在范德华力和氢键
解析:HCl、HBr、HI都是分子晶体,组成结构相似,相对分子质量越大,分子间作用力越大,熔、沸点越高,因此HCl、HBr、HI的熔、沸点依次升高与分子间作用力大小有关,故A正确;
H2O由于O原子的电负性强,半径小,所以分子之间存在氢键,熔化和气化都需要克服分子间作用力,氢键的存在使得熔点和沸点升高,所以H2O的熔沸点高于H2S,故B正确;
氢键是电负性较强的元素(通常是N、O、F)和H之间的一种分子间作用力,由于甲烷分子中C原子的电负性较弱,所以甲烷和水不能形成氢键,故C错误;
乙醇分子和水分子间存在氢键,也存在范德华力, 故D正确。
答案:C
4.按照要求填空。
(1)H2O在乙醇中的溶解度大于H2S,其原因是_________________________
_____________________________________________。
(3)化合物NH3的沸点比化合物CH4的高,其主要原因是________________
________________________________________________________。
解析:(1)水分子与乙醇分子之间能形成氢键。
答案:(1)水分子与乙醇分子之间能形成氢键
题点(三) 物质的溶解性与含氧酸的酸性判断
5.下列现象中,不能用“相似相溶”原理解释的是 ( )
A.酒精与水以任意比互溶
B.用纯碱洗涤油脂
C.氨易溶于水
D.用苯将溴水中的溴萃取出来
解析:乙醇和水都为极性分子,且两者之间可形成氢键,故乙醇与水可以互溶,故A项不符合题意;纯碱溶液呈碱性,能促进油脂的水解,所以不能用“相似相溶”原理解释,故B项符合题意;
氨和水都为极性分子,且两者之间可形成氢键,能用“相似相溶”原理解释,故C项不符合题意;
苯和溴都是非极性分子,所以用苯将溴水中的溴萃取出来,能用“相似相溶”原理解释,故D项不符合题意。
答案:B
6.已知含氧酸酸性强弱与非羟基氧原子数的关系如表所示:
(1)亚磷酸H3PO3和亚砷酸H3AsO3分子式相似,但它们的酸性差别很大,H3PO3是中强酸,H3AsO3既有弱酸性又有弱碱性。由此可推出它们的结构简式分别为①______________________,②__________________________。
(2)H3PO3和H3AsO3分别与过量的NaOH溶液反应的化学方程式:
①_____________________________________________________________,
②______________________________________________________。
解析:(1)已知H3PO3为中强酸,H3AsO3为弱酸,依据题给信息可知H3PO3中含1个非羟基氧原子,H3AsO3中不含非羟基氧原子。
(2)从题给信息可知,含氧酸分子结构中含几个羟基氢,则该酸为几元酸,故H3PO3为二元酸,H3AsO3为三元酸。
谢
谢
观
看
第3讲 化学键 分子结构与性质(基础落实课)
逐点清(一) 化学键与物质构成
(一)化学键的分类与比较
1.分类
2.比较
项目 离子键 共价键 非极性键 极性键 成键粒子 ___________ _______ 成键 实质 阴、阳离子间的静电作用 _____________不偏向任何一方 _____________偏向一方原子
形成条件 非金属性强的元素与金属性强的元素经得失电子,形成离子键 同种元素原子之间成键 不同种元素原子之间成键
阴、阳离子
原子
共用电子对
共用电子对
形成 的物质 离子化合物如NaCl、KCl、MgCl2、CaCl2、ZnSO4、NaOH等 非金属单质如H2、Cl2、N2等;某些共价化合物如H2O2或离子化合物如Na2O2 共价化合物如HCl、CO2、CH4或离子化合物如NaOH、NH4Cl
续表
(二)化学键与物质类别的关系
1.离子化合物与共价化合物
化合物 类型 定义 与物质分类的关系 举例
离子 化合物 含有_______的化合物 包括强碱、绝大多数盐及活泼金属的氧化物 NaCl、Na2O2、NaOH、Na2O、NH4Cl等
共价 化合物 只含有______的化合物 包括酸、弱碱、极少数盐、气态氢化物、非金属氧化物、大多数有机物等 H2S、SO2、CH3COOH、H2SO4、NH3·H2O等
离子键
共价键
2.化学键与物质类别的关系
(2)离子化合物溶于水或熔化后均电离成自由移动的阴、阳离子,离子键被破坏;共价化合物在液态下不电离,所以熔化时导电的化合物一定是离子化合物。
(3)只含有极性共价键的物质一般是不同种非金属元素形成的共价化合物,如SiO2、HCl、CH4等。
(4)既有极性键又有非极性键的共价化合物一般由多个原子构成,如H2O2、C2H4等。
(5)既有离子键又有极性共价键的物质,如NaOH、K2SO4等;既有离子键又有非极性共价键的物质,如Na2O2等。
(三)电子式与结构式的书写
1.电子式
电子式 在元素符号周围用“·”或“×”来表示原子的最外层电子的式子
形成 过程 离子化合物 左边是原子的电子式,相同原子的电子式可以合并,右边是离子化合物的电子式,中间用“―→”连接。如
共价化合物 左边是原子的电子式,相同原子的电子式可合并,右边是共价化合物的电子式,中间用“―→”连接。如
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)任何原子或离子之间均可形成化学键 ( )
(2)离子键只存在于离子化合物中,共价键也只存在于共价化合物中 ( )
(3)金属与非金属形成的化合物一定是离子化合物,含离子键 ( )
(4)含共价键的化合物一定是共价化合物 ( )
(5)强碱和铵盐均含离子键和共价键 ( )
(6)原子最外层只有一个电子的元素原子跟卤素原子结合时,所形成的化学键一定是离子键 ( )
×
×
×
×
×
√
×
×
×
√
解析:S2-的结构示意图中最外层为8个电子,B错误;
PCl3中氯原子和磷原子周围都应有8个电子,C错误;
D中给的是丙烷的球棍模型,错误。
答案:A
3.有以下9种物质:①Ne ②HCl ③P4 ④C2H2
⑤Na2S ⑥NaOH ⑦Na2O2 ⑧NH4Cl ⑨AlCl3
请用上述物质的序号填空:
(1)不存在化学键的是________。
(2)只存在极性共价键的是________。
(3)含有非极性共价键的离子化合物是________。
(4)既存在非极性共价键又存在极性共价键的是________。
(5)只存在离子键的是________。
(6)既存在离子键又存在共价键、配位键的是____。
(7)属于离子化合物的是________。
答案:(1)① (2)②⑨ (3)⑦ (4)④ (5)⑤
(6)⑧ (7)⑤⑥⑦⑧
[题点考法·全面练通]
题点(一) 化学键与物质类别的关系
1.有如下四种物质,其中所含化学键类型、所属化合物类型完全正确的一组是 ( )
选项 A B C D
物质 MgCl2 HCl NH4NO3 N2H4
所含化学键 类型 离子键、 共价键 共价键 离子键 离子键、
共价键
所属化合物 类型 离子化 合物 共价化 合物 离子化 合物 共价化
合物
解析: MgCl2中只有离子键,属于离子化合物,故A错误;
HCl只有共价键,是共价化合物,故B正确;
硝酸铵含有离子键和共价键,是离子化合物,故C错误;
N2H4只含有共价键,是共价化合物,故D错误。
答案:B
3.(1)请用下列10种物质的序号填空。
①O2 ②H2 ③NH4NO3 ④K2O2 ⑤Ba(OH)2
⑥CH4 ⑦CO2 ⑧NaF ⑨NH3 ⑩I2
其中既含离子键又含非极性键的是________;既含离子键又含极性键的是________。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为____________________;若XY2为共价化合物时,其结构式为__________。
(3)氯化铝的物理性质非常特殊,如氯化铝的熔点为190 ℃,但在180 ℃就开始升华。据此判断,氯化铝是________(填“共价化合物”或“离子化合物”),可以证明你判断正确的实验依据是_____________________
_______________________________________________________________。
解析:(2)1∶2型离子化合物,通常X为+2价,Y为-1价,故X可能是Mg2+或Ca2+,Y可能是F-或Cl-,结合XY2中含有38个电子可推出XY2为CaF2。1∶2型共价化合物一般是碳族元素与氧族元素化合形成的,如CO2、CS2等,再由XY2中共有38个电子,可推出XY2为CS2。
化学键 类型 含离子键的化合物,一定是离子化合物
只含共价键的化合物,一定是共价化合物
化合物 类型 大多数金属氧化物、强碱、大多数盐是离子化合物
一般非金属氢化物、非金属氧化物、有机物(有机盐除外)为共价化合物
化合物 性质 熔融状态下能导电的化合物为离子化合物
熔融状态下不能导电的化合物为共价化合物
[思维建模] 离子化合物、共价化合物的判断
题点(二) 物质变化引起的化学键变化
4.下列说法正确的是 ( )
A.碘晶体受热转变为碘蒸气,吸收的热量用于克服碘原子间的作用力
B.硫酸钾和硫酸溶于水都电离出硫酸根离子,所以它们在熔融状态下都能导电
C.2Na2O2+2H2O===4NaOH+O2↑反应中既有离子键、非极性键、极性键的断裂又有离子键、极性键、非极性键的形成
D.金刚石与NaCl熔化克服相同类型的化学键
解析:A项,克服I2分子间作用力,错误;
B项,H2SO4熔融状态不电离,故不能导电,错误;
D项,金刚石熔化克服共价键,NaCl熔化克服离子键,错误。
答案:C
5.下列关于NaHSO4的说法正确的是 ( )
A.因为NaHSO4是离子化合物,所以NaHSO4固体能够导电
B.NaHSO4固体中阳离子和阴离子的个数比是2∶1
C.NaHSO4固体熔化时破坏的是离子键和共价键
D.NaHSO4固体溶于水时破坏的是离子键和共价键
答案:D
[归纳拓展] 物质熔化、溶解时化学键的变化
(1)离子化合物的溶解或熔化过程
离子化合物溶于水或熔化后均电离出自由移动的阴、阳离子,离子键被破坏。
(2)共价化合物的溶解过程
①有些共价化合物溶于水后,能与水反应,其分子内共价键被破坏,如CO2和SO2等。
②有些共价化合物溶于水后,与水分子作用形成水合离子,从而发生电离,形成阴、阳离子,其分子内的共价键被破坏,如HCl、H2SO4等。
③有些共价化合物溶于水后,其分子内的共价键不被破坏,如蔗糖(C12H22O11)、酒精(C2H5OH)等。
题点(三) 电子式与结构式的书写
6.(1)CH4、N2H4的结构式分别为______________、______________。
(2)乙烯、乙醇的结构简式分别为______________、____________。
(3)苯、硝基苯的结构简式分别为____________、____________。
(4)淀粉的分子通式为__________,聚乙烯的结构简式为__________。
8.用电子式表示下列物质的形成过程。
(1)MgBr2:_________________________________________________。
(2)H2O:____________________________________________________。
(3)H2:______________________________________________________。
(4)Na3N:_________________________________________________。
答案:
[易错提醒] 电子式书写常见的四大误区
续表
逐点清(二) 共价键与键参数
1.本质和特征
共价键的本质是在原子之间形成___________,其特征是具有_______和________。
共用电子对
饱和性
方向性
分类依据 类型
形成共价键的原 子轨道重叠方式 σ键 电子云“头碰头”重叠
π键 电子云“肩并肩”重叠
形成共价键的 电子对是否偏移, 极性键 共用电子对_____偏移
________键 共用电子对不发生偏移
原子间共用 电子对的数目 _________ 原子间有____共用电子对
双键 原子间有两对共用电子对
________ 原子间有_____共用电子对
2.分类
发生
非极性
单键
一对
三键
三对
4.大π键的简介
5.共价键的键参数
(1)定义
键能 气态分子中1 mol化学键解离成气态原子所吸收的能量
键长 构成化学键的两个原子的核间距
键角 在多原子分子中,两个相邻共价键之间的夹角
(2)键参数对分子性质的影响
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)共价键的成键原子只能是非金属原子 ( )
(2)在任何情况下,都是σ键比π键强度大 ( )
(3)H与O形成分子式是H2O而不是H3O的原因是共价键有饱和性 ( )
(4)气体单质中一定存在σ键,可能存在π键 ( )
(5)σ键能单独形成,而π键一定不能单独形成 ( )
(6)s-s σ键与s-p σ键的电子云形状对称性相同 ( )
×
×
×
√
√
√
(7)任何共价键形成时,原子轨道重叠都有方向性 ( )
(8)CO2、CCl4分子中均有π键 ( )
×
×
×
2.关于键长、键能和键角的说法中不正确的是 ( )
A.键角是描述分子空间结构的重要参数
B.键长的大小与成键原子的半径和成键数目有关
C.键能越大,键长就越长,共价化合物也就越稳定
D.键角的大小与键长、键能的大小无关
解析:C项应是键能越大,键长越短,共价化合物就越稳定。
答案:C
3.(1)Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是__________
__________________________________________________________。
[题点考法·全面练通]
题点(一) 共价键及其分类
1.下列关于σ键和π键的理解不正确的是 ( )
A.含有π键的分子在进行化学反应时,分子中的π键比σ键活泼
B.在有些分子中,共价键可能只含有π键而没有σ键
C.有些原子在与其他原子形成分子时只能形成σ键,不能形成π键
D.当原子形成分子时,首先形成σ键,可能形成π键
解析:同一分子中的π键不如σ键牢固,反应时比较容易断裂,A项正确;
在共价单键中只含有σ键,而含有π键的分子中一定含有σ键,B项错误、D项正确;
氢原子、氯原子等跟其他原子形成分子时只能形成σ键,C项正确。
答案:B
2.含碳元素的物质是化学世界中最庞大的家族,请填写下列空格。
(1)CH4中的化学键从形成过程来看,属于______(填“σ”或“π”)键,从其极性来看属于________键。
(2)已知CN-与N2结构相似,推算HCN分子中σ键与π键的数目之比为________。
(3)C60分子中每个碳原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子稳定结构,则C60分子中π键的数目为________。
轨道重叠 方式 形成σ键时,原子轨道以“头碰头”的方式重叠;形成π键时,原子轨道以“肩并肩”的方式重叠
电子云 的对称性 σ键的电子云是以形成化学键的两原子核的连线为轴旋转对称,为轴对称;π键的电子云是由两块组成,它们互为镜像,为镜面对称
原子间共 用电子对数目 单键均为σ键,双键含有1个σ键和1个π键,三键含有1个σ键和2个π键
共价键强度 σ键强度较大,较稳定;π键活泼,比较容易断裂。注意:N≡N中π键较稳定
[思维建模] σ键与π键的判断方法
题点(二) 共价键的键参数及应用
3.下列物质性质的变化规律,与共价键的键能大小有关的是 ( )
①F2、Cl2、Br2、I2的熔点、沸点逐渐升高
②HF、HCl、HBr、HI的热稳定性依次减弱
③金刚石的硬度、熔点、沸点都高于晶体硅
④H2O的沸点高于H2S的沸点
A.①② B.②③ C.①④ D.②④
解析: ①F2、Cl2、Br2、I2熔沸点与共价键无关,只与分子间作用力有关;④H2O的沸点高于H2S是因为H2O分子间形成氢键,与共价键无关。
答案:B
4.已知N—N、N===N和N≡N键能之比为1.00∶2.17∶4.90,而C—C、C===C、C≡C键能之比为1.00∶1.77∶2.34。下列说法正确的是( )
A.σ键一定比π键稳定
B.N2较易发生加成
C.乙烯、乙炔较易发生加成
D.乙烯、乙炔中的π键比σ键稳定
解析: N≡N、N===N中π键比σ键稳定,难发生加成,C===C、C≡C中π键比σ键弱,较易发生加成。
答案:C
5.已知几种共价键的键能如下:
化学键 H—N N≡N Cl—Cl H—Cl
键能/(kJ·mol-1) 391 946 243 431
解析:NH3的沸点比HCl的高,与共价键的键能无关,C项错误。
答案:C
逐点清(三) 分子的空间结构与杂化轨道
1.价层电子对互斥模型(VSEPR)及应用
(1)理论要点
①价层电子对在空间上彼此相距越远时,排斥力_______,体系的能量越低。
②孤电子对的排斥力较大,孤电子对越多,排斥力越强,键角____。如H2O的键角_____CH4的键角。
[注意] 价层电子对数与电子对空间结构的关系
2对—直线形,3对—平面三角形,4对—四面体形。
越小
越小
小于
(2)价层电子对的计算
(3)价层电子对互斥模型与分子的空间结构
2.杂化轨道理论
(1)杂化轨道理论概述
当原子成键时,原子的能量相近的轨道相互混杂,形成与原轨道数相等且能量相同的杂化轨道。杂化轨道数不同,轨道间的夹角不同,形成分子的空间结构不同。
(2)杂化轨道三种类型
sp杂化 sp杂化轨道由___________和__________杂化而成,杂化轨道间夹角为_______,呈_____形,如BeCl2
sp2杂化 sp2杂化轨道由__________和__________杂化而成,杂化轨道间夹角为______,呈__________形,如BF3
sp3杂化 sp3杂化轨道由__________和__________杂化而成,杂化轨道间夹角为___________,呈___________形,如CH4
1个s轨道
1个p轨道
180°
直线
1个s轨道
2个p轨道
120°
平面三角
1个s轨道
3个p轨道
109°28′
正四面体
(3) 杂化轨道的类型与分子的空间结构
sp2
3
4
平面三角形
(2)常见等电子体分类示例
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)中心原子的价层电子对数为3时,VSEPR模型为平面三角形 ( )
(2)VSEPR模型与粒子结构一定相同 ( )
(3)分子中中心原子若通过sp3杂化轨道成键,则该分子一定为正四面体
结构 ( )
(4)NH3分子为三角锥形,N原子发生sp2杂化 ( )
(5)中心原子是sp杂化的,其分子空间结构不一定为直线形 ( )
√
×
×
×
×
(6)杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对 ( )
(7)价层电子对互斥模型中,π键电子对数不计入中心原子的价层电子
对数 ( )
(8)H2O与H2S分子中的中心原子的价层电子对数均为4,其VSEPR模型
相同 ( )
√
√
√
2.BeCl2是共价分子,可以以单体、二聚体和多聚体形式存在。它们的结构简式如下,请写出单体、二聚体和多聚体中Be的杂化轨道类型:
[题点考法·全面练通]
题点(一) 粒子的空间结构
1.用价层电子对互斥模型(VSEPR)预测H2S和COCl2的空间结构,两个结论都正确的是 ( )
A.直线形;三角锥形 B.V形;三角锥形
C.直线形;平面三角形 D.V形;平面三角形
3.(1)(2022·河北等级考·节选)SnCl的空间结构为____________,其中心离子杂化方式为________________________________________。
(2)(2021·山东等级考·节选)OF2分子的空间结构为__________;
(3)(2021·湖南等级考·节选)气态SiX4分子的空间结构是________;
(4)(2020·全国卷Ⅰ·节选)磷酸根离子的空间结构为________,其中P的价层电子对数为________、杂化轨道类型为________。
答案:(1)三角锥形 sp3杂化
(2)V形
(3)正四面体
(4)正四面体形 4 sp3
[思维建模] 判断分子或离子空间结构“三步曲”
第一步:确定中心原子上的价层电子对数
第二步:确定价层电子对的空间结构
由于价层电子对之间的相互排斥作用,使它们尽可能地相互远离,这样已知价层电子对的数目,就可以确定它们的空间结构。
第三步:分子空间结构的确定
价层电子对有成键电子对和孤电子对之分,价层电子对的总数减去成键电子对数得孤电子对数。根据成键电子对数和孤电子对数,可以确定相应的较稳定的分子空间结构。
题点(二) 中心原子杂化类型的判断
4.下列关于磷酸氯喹(结构如图所示)的说法错误的是 ( )
A.分子式为C18H32ClN3O8P2
B.分子中含有2个sp3杂化的氮原子和1个sp2杂化的氮原子
C.分子中碳的杂化类型有2种
D.H3PO4中磷的杂化类型为sp2杂化
解析:A项,分子式应为C18H32ClN3O8P2,正确;
D项,H3PO4中磷的杂化类型为sp3杂化,错误。
答案:D
5.(1)(2022·全国甲卷·节选)2008年北京奥运会的“水立方”,在2022年冬奥会上华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯(CH2===CH2)与四氟乙烯(CF2===CF2)的共聚物(ETFE)制成。CF2===CF2和ETFE分子中C的杂化轨道类型分别为________和________。
(2)(2022·海南等级考·节选)酞菁分子结构如下图,
分子中所有原子共平面,所有N原子的杂化轨道
类型相同,均采取__________杂化。
[思维建模] “四方法”判断中心原子的杂化类型
(1)根据杂化轨道的空间结构
①直线形—sp,②平面三角形—sp2,③四面体形—sp3。
(2)根据杂化轨道间的夹角
①109°28′—sp3,②120°—sp2,③180°—sp。
(3)利用价层电子对数确定三种杂化类型(适用于中心原子)
2对—sp杂化,3对—sp2杂化,4对—sp3杂化。
(4)根据σ键数与孤电子对数(适用于结构式已知的粒子)
①含C有机物:2个σ —sp,3个σ —sp2,4个σ —sp3。
②含N化合物:2个σ —sp2,3个σ —sp3。
③含O(S)化合物:2个σ —sp3。
题点(三) 键角大小的判断
6.用价层电子对互斥模型(VSEPR)可以预测许多分子或离子的空间结构,有时也能用来推测键角大小,下列判断错误的是 ( )
A.SO2、CS2、HI都是直线形的分子
B.BF3键角为120°,SnBr2键角小于120°
C.CH2O、BF3、SO3都是平面三角形的分子
D.NCl3的键角大于PCl3的键角
解析:A项,SO2为V形分子,错误;
B项,SnBr2 中有一个孤电子对,键角小于120°,正确。
答案:A
8.(1)(2022·北京等级考·节选)比较SO和H2O分子中的键角大小并给出相应解释:_________________________________________________。
____________________________________________________________
(2)(2021·全国乙卷·节选)H2O的键角小于NH3的,分析原因: ____________________________________________________________
____________________________________________________________。
解析:(1)硫酸根离子中硫原子的价层电子对数为4、孤电子对数为0,离子的空间结构为正四面体形,水分子中氧原子的价层电子对数为4、孤电子对数为2,孤电子对与成键电子对间的斥力较大,分子的空间结构为V形,所以硫酸根离子的键角大于水分子。
(2)H2O、NH3均为sp3杂化,其中心原子的孤电子对数分别为2、1,由于孤电子对对成键电子对的斥力大于成键电子对对成键电子对的斥力,因此孤电子对数越多,键角越小。
[思维建模] 键角比较的三种思维模板
(1)杂化类型不同→sp>sp2>sp3。
(2)杂化类型相同
①孤电子对数越多,键角越小,如H2O<NH3。
②孤电子对数相同,中心原子电负性越大,键角越大,如H2O>H2S。
③孤电子对数相同,中心原子相同,配位原子电负性越大,键角越小,如NF3<NCl3。
(3)在同一分子中,π键电子斥力大,键角大。
题点(四) 等电子原理及应用
9.(1)写出两个与CS2具有相同空间结构和键合形式的分子或离子________。
(2)根据等电子原理,仅由第二周期元素形成的共价分子中,互为等电子体的是______和________、________和________。
(5)与OH-互为等电子体的一种分子为________(填化学式)。
(6)与SO3互为等电子体的阴离子为________。
(7)与N2互为等电子体的分子是________,阴离子是________,阳离子是________。
逐点清(四) 分子结构与物质的性质
(一)共价键的极性
1.键的极性与分子的极性
2.键的极性对化学性质的影响
键的极性对物质的化学性质有重要影响,如:
(1)CF3COOH的酸性____CCl3COOH______CHCl2COOH。是因为F3C—的极性______Cl3C—的极性,导致羧基中的—OH的极性更大,更易电离出氢离子。
(2)HCOOH的酸性_____CH3COOH_____C2H5COOH是因为烷基(R—)是
_______基团,烷基越长推电子效应______,使羧基中的羟基的极性
______,羧酸的酸性越弱。
大于
大于
大于
大于
大于
推电子
越大
越小
(二)分子间的作用力
1.分子间作用力的理解
概念 物质分子之间______存在的相互作用力,称为分子间作用力
分类 分子间作用力最常见的是范德华力和______
强弱 范德华力<氢键<化学键
普遍
氢键
2.范德华力与氢键
(1)范德华力
范德华力主要影响物质的熔点、沸点、硬度等物理性质。范德华力越强,物质的熔点、沸点越高,硬度越大。一般来说,组成和结构相似的物质,随着______________的增加,范德华力逐渐________
相对分子质量
增大
(2)氢键
形成 已经与_____________的原子形成共价键的________ (如水分子中的氢)与另一个______________的原子(如水分子中的氧)之间形成的作用力,称为氢键
表示 方法 X—H…Y—。
①X、Y为电负性很强的原子,一般为N、O、F三种元素的原子。
②X、Y可以相同,也可以不同
特征 具有一定的__________和方向性。如在冰中每个H2O分子周围以四面体的4个方向形成4个氢键
电负性很大
氢原子
电负性很大
饱和性
分类 氢键包括________氢键和分子间氢键两种。其中分子间氢键主要表现为使物质的熔、沸点______,对电离和溶解度等产生影响。
影响 X—H…Y— 中X、Y的电负性越强,氢键越强。如F—H…F>O—H…O>N—H…N
分子内
升高
较低
续表
3.溶解性
(1)“相似相溶”的规律:非极性溶质一般能溶于__________,极性溶质一般能溶于____________。若能形成氢键,则溶剂和溶质之间的氢键作用力越大,溶解性越好。
(2)“相似相溶”还适用于分子结构的相似性,如乙醇和水互溶(C2H5OH和H2O中的羟基相近),而戊醇在水中的溶解度明显减小。
(3)分子与H2O反应,也能促进分子在水中的溶解度,如SO2、NH3。
非极性溶剂
极性溶剂
4.分子的手性
手性 异构 具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为______,却在三维空间里不能重叠
手性 分子 有手性异构体的分子
手性 碳原子 在有机物分子中,连有_______不同基团的碳原子
镜像
四个
5.无机含氧酸分子的酸性
无机含氧酸的通式可写成(HO)mROn,如果成酸元素R相同,则n值越大,R的正电性越大,导致R—O—H中O的电子向R偏移,在水分子的作用下越易电离出H+,酸性越强,如酸性:HClO
1.判断正误(正确的打“√”,错误的打“×”)。
(1)F2的熔沸点比Cl2的低是因为F2分子间作用力较小 ( )
(2)HCl易溶于水是因为HCl与H2O分子间形成氢键 ( )
(3)H2O分子间形成氢键,故H2O比H2S稳定 ( )
(4)范德华力是分子间作用力,而氢键是共价键 ( )
(5)可燃冰(CH4·nH2O,6≤n≤8)中甲烷分子与水分子间形成了氢键 ( )
(6)乙醇分子和水分子间只存在范德华力 ( )
√
×
×
×
×
×
(7)在相同条件下,NH3在水中的溶解度比HCl的大的原因是NH3与H2O形成分子间氢键 ( )
(8)氢键的存在一定能使物质的熔、沸点升高 ( )
(9)含—OH或—COOH的有机物一定均易溶于水,难溶于有机溶剂 ( )
( )
√
×
×
×
(2)葡萄糖分子的结构简式为CH2OH(CHOH)4CHO,该分子中含有________个手性碳原子。
答案:(1)< HIO4分子中非羟基氧较多 (2)4
[题点考法·全面练通]
题点(一) 分子极性的判断
1.下列各组分子中,都属于含极性键的非极性分子的是 ( )
A.CO2、H2S B.C2H4、CH4
C.Cl2、C2H2 D.NH3、HCl
解析:H2S和NH3、HCl都是含极性键的极性分子;Cl2是含有非极性键的非极性分子;CO2、CH4是只含有极性键的非极性分子;C2H4和C2H2是含有极性键和非极性键的非极性分子。
答案:B
2.下列关于CS2、SO2、NH3三种物质的说法正确的是 ( )
A.CS2在水中的溶解度很小,是由于其属于极性分子
B.SO2和NH3均易溶于水,原因之一是它们都是极性分子
C.CS2为非极性分子,在三种物质中熔沸点最低
D.NH3在水中溶解度很大只是因为NH3是极性分子
解析:根据“相似相溶”原理,CS2在水中的溶解度很小,水是极性分子,则CS2是非极性分子,故A错误;
由于SO2和NH3都是极性分子,水也是极性分子,根据“相似相溶”原理,二者均易溶于水,故B正确;
由于CS2常温下是液体,SO2和NH3常温下是气体,CS2的熔沸点最高,故C
错误;
NH3在水中溶解度很大,除了由于NH3分子有极性外,还因为NH3分子和H2O分子之间可以形成氢键,故D错误。
答案:B
[思维建模] 分子极性判断
(1)共价键的极性与分子极性的关系
(2)判断ABn型分子极性的经验规律
若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子,若不等则为极性分子。如SO2为极性分子,SO3为非极性分子。
题点(二) 范德华力、氢键对性质的影响
3.下列说法不正确的是 ( )
A.HCl、HBr、HI的熔、沸点依次升高与分子间作用力大小有关
B.H2O的熔、沸点高于H2S是由于H2O分子间存在氢键
C.甲烷可与水形成氢键
D.白酒中,乙醇分子和水分子间存在范德华力和氢键
解析:HCl、HBr、HI都是分子晶体,组成结构相似,相对分子质量越大,分子间作用力越大,熔、沸点越高,因此HCl、HBr、HI的熔、沸点依次升高与分子间作用力大小有关,故A正确;
H2O由于O原子的电负性强,半径小,所以分子之间存在氢键,熔化和气化都需要克服分子间作用力,氢键的存在使得熔点和沸点升高,所以H2O的熔沸点高于H2S,故B正确;
氢键是电负性较强的元素(通常是N、O、F)和H之间的一种分子间作用力,由于甲烷分子中C原子的电负性较弱,所以甲烷和水不能形成氢键,故C错误;
乙醇分子和水分子间存在氢键,也存在范德华力, 故D正确。
答案:C
4.按照要求填空。
(1)H2O在乙醇中的溶解度大于H2S,其原因是_________________________
_____________________________________________。
(3)化合物NH3的沸点比化合物CH4的高,其主要原因是________________
________________________________________________________。
解析:(1)水分子与乙醇分子之间能形成氢键。
答案:(1)水分子与乙醇分子之间能形成氢键
题点(三) 物质的溶解性与含氧酸的酸性判断
5.下列现象中,不能用“相似相溶”原理解释的是 ( )
A.酒精与水以任意比互溶
B.用纯碱洗涤油脂
C.氨易溶于水
D.用苯将溴水中的溴萃取出来
解析:乙醇和水都为极性分子,且两者之间可形成氢键,故乙醇与水可以互溶,故A项不符合题意;纯碱溶液呈碱性,能促进油脂的水解,所以不能用“相似相溶”原理解释,故B项符合题意;
氨和水都为极性分子,且两者之间可形成氢键,能用“相似相溶”原理解释,故C项不符合题意;
苯和溴都是非极性分子,所以用苯将溴水中的溴萃取出来,能用“相似相溶”原理解释,故D项不符合题意。
答案:B
6.已知含氧酸酸性强弱与非羟基氧原子数的关系如表所示:
(1)亚磷酸H3PO3和亚砷酸H3AsO3分子式相似,但它们的酸性差别很大,H3PO3是中强酸,H3AsO3既有弱酸性又有弱碱性。由此可推出它们的结构简式分别为①______________________,②__________________________。
(2)H3PO3和H3AsO3分别与过量的NaOH溶液反应的化学方程式:
①_____________________________________________________________,
②______________________________________________________。
解析:(1)已知H3PO3为中强酸,H3AsO3为弱酸,依据题给信息可知H3PO3中含1个非羟基氧原子,H3AsO3中不含非羟基氧原子。
(2)从题给信息可知,含氧酸分子结构中含几个羟基氢,则该酸为几元酸,故H3PO3为二元酸,H3AsO3为三元酸。
谢
谢
观
看
同课章节目录
