2024届高考一轮复习 第五章 物质结构与性质 元素周期律 第1讲 原子结构 核外电子排布(64张PPT)
文档属性
| 名称 | 2024届高考一轮复习 第五章 物质结构与性质 元素周期律 第1讲 原子结构 核外电子排布(64张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-17 22:57:38 | ||
图片预览









文档简介
(共64张PPT)
第1讲 原子结构 核外电子排布(基础落实课)
逐点清(一) 原子结构与核素
(一)原子构成
1.构成原子的微粒及作用
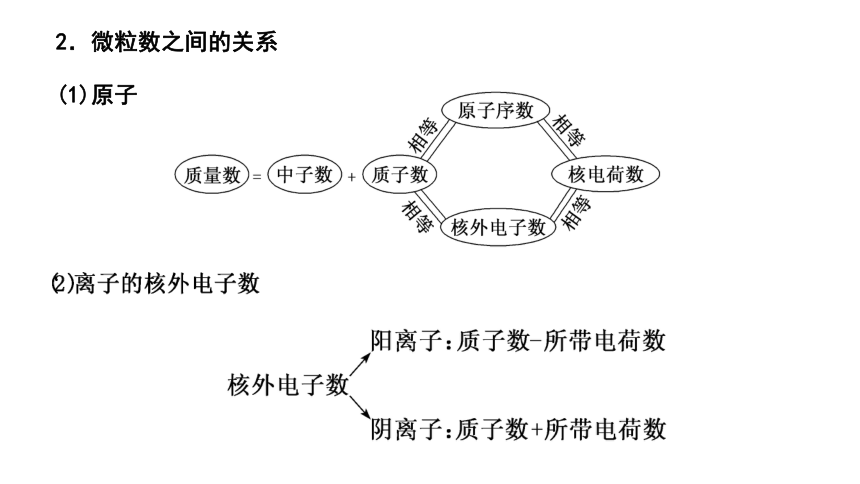
2.微粒数之间的关系
(1)原子
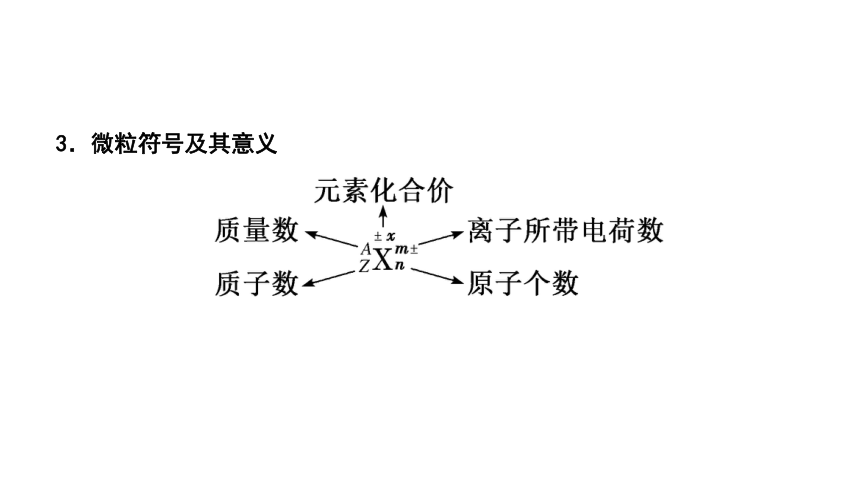
3.微粒符号及其意义
5.核反应遵循的两守恒
(1)反应前后质量数之和不变。
(2)反应前后质子数之和不变。
[注意] 核反应不属于化学变化讨论的范畴,原子是化学变化中的最小微粒,化学反应过程原子核不改变,也就是原子不改变。
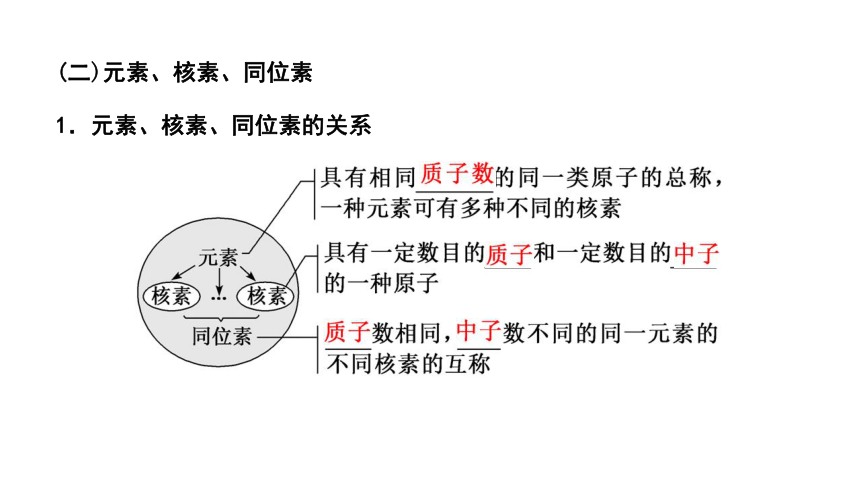
(二)元素、核素、同位素
1.元素、核素、同位素的关系
2.同位素的两大特征
特征一 相同存在形态的同位素,化学性质________________,物理性质______
特征二 天然存在的同一元素各核素所占的原子百分数(丰度)一般______
几乎完全相同
不同
不变
3.氢元素的三种核素
氕
D
4.几种重要核素的用途
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)任何原子均由质子、中子和核外电子构成 ( )
(2)质子数相同的微粒,相应的元素一定是同一种元素 ( )
(3)任何阴、阳离子中均含有电子 ( )
(4)一种元素可以有多种核素,也可能只有一种核素,有多少种核素就有多少种原子 ( )
×
×
×
√
×
×
√
√
3.某元素的一种同位素X原子的质量数为A,含N个中子,它与1H原子构成HmX分子,在a g HmX中所含原子的物质的量为________,所含中子的物质的量为________,所含质子数为____________,所含电子数为________。
[思维建模]
求一定质量的某物质中粒子数的思维模板
题点(三) 同位素、同素异形体、同分异构体辨析
6.(2021·浙江选考)下列说法正确的是 ( )
A.C60和C70互为同位素
B.C2H6和C6H14互为同系物
C.CO和CO2互为同素异形体
D.CH3COOH和CH3OOCH是同一种物质
解析:C60和C70为C元素的两种不同单质,不能互称同位素,A错误;
C2H6和C6H14均为链状烷烃,二者结构相似,分子组成上相差4个CH2原子团,二者互为同系物,B正确;
同种元素的不同单质互称同素异形体,CO和CO2为C元素的两种不同氧化物,二者不是单质,不能互称同素异形体,C错误;
两种物质的结构不同,不是同一种物质,二者互称为同分异构体,D错误。
答案:B
解析:中子数=89-39=50,中子数与质子数之差为(89-39)-39=11,故A错误;
答案:B
③HD、HT、DT、2H2和3H2既不是同位素,也不是同素异形体,而是同位素之间形成的不同单质,它们的物理性质(如密度)有所不同,但化学性质几乎完全相同。
(2)“三同”比较
同位素 同素异形体 同分异构体
研究对象 核素 单质 化合物
“同”含义 质子数相同 元素相同 分子式相同
“异”含义 中子数不同 性质不同 结构不同
逐点清(二) 核外电子排布
(一)能层、能级及其含有的原子轨道
能层 K L M N
能级 1s 2s、2p 3s、3p、3d 4s、4p、4d、4f
原子轨 道数目 1 1+3=4 1+3+5=9 1+3+5+7=16
最多容纳电子数目 ____ ____ ____ _______
2
8
18
32
(二)电子云与原子轨道
1.电子云
(1)由于核外电子的概率分布图看起来像一片云雾,因而被形象地称为电子云。
(2)电子云轮廓图称为原子轨道。不同能级上的电子原子轨道形状不同。
2.原子轨道的形状、数目及能量关系
(三)原子核外电子排布
1.核外电子在各能层(电子层)的排布规律
(1)每个电子层最多能容纳____个电子(n代表电子层数)。
(2)最外层电子数最多不超过8个。
(3)次外层电子数最多不超过_____个,倒数第三层不超过____个。
2n2
18
32
2.构造原理
3.基态原子核外电子排布原则
4.表示方法
续表
(四)电子的跃迁与原子光谱
1.电子的跃迁
2.原子光谱
不同元素原子的电子发生跃迁时会_____或______不同的光,可以用光谱仪摄取各种元素原子的吸收光谱或发射光谱,总称原子光谱。
吸收
释放
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)某原子M层上的电子数一定比L层上的电子数多 ( )
(2)p能级能量一定比s能级的能量高 ( )
(3)2p和3p轨道形状均为哑铃状,能量也相等 ( )
(4)电子发生跃迁可形成吸收光谱或发射光谱 ( )
(5)基态原子电子能量的高低顺序为
E(1s)(6)电子排布式(22Ti)1s22s22p63s23p10违反了能量最低原理 ( )
×
×
×
×
×
√
×
×
√
[题点考法·全面练通]
题点(一) 核外电子排布规律的应用与判断
1.(2023·烟台模拟)人们常将在同一原子轨道上运动的自旋状态相反的2个电子,称为“电子对”;将在同一原子轨道上运动的单个电子,称为“未成对电子”。以下有关主族元素原子的“未成对电子”的说法,正确的是 ( )
A.核外电子数为奇数的基态原子,其原子轨道中一定含有“未成对电子”
B.核外电子数为偶数的基态原子,其原子轨道中一定不含“未成对电子”
C.核外电子数为偶数的基态原子,其原子轨道中一定含有“未成对电子”
D.核外电子数为奇数的基态原子,其原子轨道中可能不含“未成对电子”
解析:核外电子数为偶数的基态原子,其某个能级上的轨道中不一定都是成对电子,例如第6号元素C,其2p能级上应该有2个单电子,选项B错误。
核外电子数为偶数的基态原子,其原子轨道中的电子可能都是成对的,例如He,选项C错误。
核外电子数为奇数的基态原子,其原子轨道中一定含有“未成对电子”,选项A正确,D错误。
答案:A
2.下列各组表述中,两个原子不属于同种元素原子的是 ( )
A.3p能级有一个空轨道的基态原子和核外电子的排布式为1s22s22p63s23p2的原子
B.2p能级无空轨道,且有一个未成对电子的基态原子和原子的最外层电子排布式为2s22p5的原子
C.M层全充满而N层为4s2的原子和核外电子排布式为1s22s22p63s23p64s2的原子
解析:A项,3p能级有一个空轨道的基态原子,按洪特规则可得其3p轨道上只能有两个电子,所以两个原子是同种元素的原子;
B项,2p能级无空轨道,且有一个未成对电子的基态原子,它的2p能级上只能是5个电子,所以两原子是同种元素的原子;
C项,M层全充满而N层为4s2的原子,其M层应为18个电子,而后者的M层上只有8个电子,所以两原子不是同种元素的原子;
答案:C
题点(二) 核外电子排布式与排布图
3.(2023·太原模拟)下列有关电子排布图的表述正确的是 ( )
答案:A
4.完成下列化学用语。
(1)Cr原子的核外电子排布式:______________,价层电子排布式:____________,原子结构示意图:______________,价层电子排布图:______________________。
(2)As的核外电子排布式:__________________,原子结构示意图:____________,价层电子排布图:______________。
(3)Co的价层电子排布式:__________________,价层电子排布图:__________________________________________________________。
答案:(1)1s22s22p63s23p63d54s1 3d54s1
5.(1)(2022·全国甲卷·节选)基态F原子的价电子排布图(轨道表示式)为_______________________________;
(2)(2022·湖南等级考·节选)基态Se原子的核外电子排布式为[Ar]__________________;
(3)(2022·山东等级考·节选)基态Ni原子的价电子排布式为______________;
(4)(2021·广东等级考·节选)基态硫原子价电子排布式为________;
(5)(2021·湖南等级考·节选)基态硅原子最外层的电子排布图为________________________。
(2)硒元素的原子序数为34,基态原子的电子排布式为[Ar] 3d104s24p4;
(3)已知Ni是28号元素,故基态Ni原子的价电子排布式为3d84s2;
(4)硫为16号元素,基态硫原子的价电子排布式为3s23p4;
(5)硅原子核外有14个电子,有1s、2s、2p、3s、3p五个能级,每个能级的电子数分别是2、2、6、2、2,则基态硅原子最外层的电子排布图为
[易错提醒] 电子排布式的常见错误与书写技巧
续表
题点(三) 根据核外电子排布推断元素
解析:Y元素原子的价层电子排布为nsn-1npn+1,s能级最多容纳2个电子,故n-1=2,解得n=3,故Y元素原子的价层电子排布为3s23p4,Y为S元素,由X、Y、Z在周期表中的位置可知,X为F元素,Z为As元素。Y为S元素,处于第三周期第ⅥA族,故A错误,B正确;
X为F元素,处于第二周期,只有2种金属元素,含有6种非金属元素,含非金属元素最多,故C正确;Z为As元素,是33号元素,其元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3,故D正确。
答案:A
7.(1)A元素基态原子的最外层有3个未成对电子,次外层有8个电子,其元素符号为____________;其价层电子排布图为____________。
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为______,C离子的结构示意图为____________。
(3)D元素的正三价离子的3d能级为半充满,D的元素符号为________,其基态原子的电子排布式为____________________,其原子的结构示意图为____________。
(4)E元素基态原子的M层全充满,N层没有成对电子且只有一个未成对电子,E的元素符号为________,其基态原子的电子排布式为______________________。
(5)F元素的原子最外层电子排布式为nsnnpn+2,则n=________;原子中能量最高的是__________电子,核外电子排布图为__________________。
(6)G基态原子L层中p轨道电子数是s轨道电子数的2倍,则G的价层电子排布式为________。
(7)H的基态原子4s和3d轨道电子半充满,则H的价层电子轨道表示式为__________________,未成对电子数为________。
谢
谢
观
看
第1讲 原子结构 核外电子排布(基础落实课)
逐点清(一) 原子结构与核素
(一)原子构成
1.构成原子的微粒及作用
2.微粒数之间的关系
(1)原子
3.微粒符号及其意义
5.核反应遵循的两守恒
(1)反应前后质量数之和不变。
(2)反应前后质子数之和不变。
[注意] 核反应不属于化学变化讨论的范畴,原子是化学变化中的最小微粒,化学反应过程原子核不改变,也就是原子不改变。
(二)元素、核素、同位素
1.元素、核素、同位素的关系
2.同位素的两大特征
特征一 相同存在形态的同位素,化学性质________________,物理性质______
特征二 天然存在的同一元素各核素所占的原子百分数(丰度)一般______
几乎完全相同
不同
不变
3.氢元素的三种核素
氕
D
4.几种重要核素的用途
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)任何原子均由质子、中子和核外电子构成 ( )
(2)质子数相同的微粒,相应的元素一定是同一种元素 ( )
(3)任何阴、阳离子中均含有电子 ( )
(4)一种元素可以有多种核素,也可能只有一种核素,有多少种核素就有多少种原子 ( )
×
×
×
√
×
×
√
√
3.某元素的一种同位素X原子的质量数为A,含N个中子,它与1H原子构成HmX分子,在a g HmX中所含原子的物质的量为________,所含中子的物质的量为________,所含质子数为____________,所含电子数为________。
[思维建模]
求一定质量的某物质中粒子数的思维模板
题点(三) 同位素、同素异形体、同分异构体辨析
6.(2021·浙江选考)下列说法正确的是 ( )
A.C60和C70互为同位素
B.C2H6和C6H14互为同系物
C.CO和CO2互为同素异形体
D.CH3COOH和CH3OOCH是同一种物质
解析:C60和C70为C元素的两种不同单质,不能互称同位素,A错误;
C2H6和C6H14均为链状烷烃,二者结构相似,分子组成上相差4个CH2原子团,二者互为同系物,B正确;
同种元素的不同单质互称同素异形体,CO和CO2为C元素的两种不同氧化物,二者不是单质,不能互称同素异形体,C错误;
两种物质的结构不同,不是同一种物质,二者互称为同分异构体,D错误。
答案:B
解析:中子数=89-39=50,中子数与质子数之差为(89-39)-39=11,故A错误;
答案:B
③HD、HT、DT、2H2和3H2既不是同位素,也不是同素异形体,而是同位素之间形成的不同单质,它们的物理性质(如密度)有所不同,但化学性质几乎完全相同。
(2)“三同”比较
同位素 同素异形体 同分异构体
研究对象 核素 单质 化合物
“同”含义 质子数相同 元素相同 分子式相同
“异”含义 中子数不同 性质不同 结构不同
逐点清(二) 核外电子排布
(一)能层、能级及其含有的原子轨道
能层 K L M N
能级 1s 2s、2p 3s、3p、3d 4s、4p、4d、4f
原子轨 道数目 1 1+3=4 1+3+5=9 1+3+5+7=16
最多容纳电子数目 ____ ____ ____ _______
2
8
18
32
(二)电子云与原子轨道
1.电子云
(1)由于核外电子的概率分布图看起来像一片云雾,因而被形象地称为电子云。
(2)电子云轮廓图称为原子轨道。不同能级上的电子原子轨道形状不同。
2.原子轨道的形状、数目及能量关系
(三)原子核外电子排布
1.核外电子在各能层(电子层)的排布规律
(1)每个电子层最多能容纳____个电子(n代表电子层数)。
(2)最外层电子数最多不超过8个。
(3)次外层电子数最多不超过_____个,倒数第三层不超过____个。
2n2
18
32
2.构造原理
3.基态原子核外电子排布原则
4.表示方法
续表
(四)电子的跃迁与原子光谱
1.电子的跃迁
2.原子光谱
不同元素原子的电子发生跃迁时会_____或______不同的光,可以用光谱仪摄取各种元素原子的吸收光谱或发射光谱,总称原子光谱。
吸收
释放
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)某原子M层上的电子数一定比L层上的电子数多 ( )
(2)p能级能量一定比s能级的能量高 ( )
(3)2p和3p轨道形状均为哑铃状,能量也相等 ( )
(4)电子发生跃迁可形成吸收光谱或发射光谱 ( )
(5)基态原子电子能量的高低顺序为
E(1s)
×
×
×
×
×
√
×
×
√
[题点考法·全面练通]
题点(一) 核外电子排布规律的应用与判断
1.(2023·烟台模拟)人们常将在同一原子轨道上运动的自旋状态相反的2个电子,称为“电子对”;将在同一原子轨道上运动的单个电子,称为“未成对电子”。以下有关主族元素原子的“未成对电子”的说法,正确的是 ( )
A.核外电子数为奇数的基态原子,其原子轨道中一定含有“未成对电子”
B.核外电子数为偶数的基态原子,其原子轨道中一定不含“未成对电子”
C.核外电子数为偶数的基态原子,其原子轨道中一定含有“未成对电子”
D.核外电子数为奇数的基态原子,其原子轨道中可能不含“未成对电子”
解析:核外电子数为偶数的基态原子,其某个能级上的轨道中不一定都是成对电子,例如第6号元素C,其2p能级上应该有2个单电子,选项B错误。
核外电子数为偶数的基态原子,其原子轨道中的电子可能都是成对的,例如He,选项C错误。
核外电子数为奇数的基态原子,其原子轨道中一定含有“未成对电子”,选项A正确,D错误。
答案:A
2.下列各组表述中,两个原子不属于同种元素原子的是 ( )
A.3p能级有一个空轨道的基态原子和核外电子的排布式为1s22s22p63s23p2的原子
B.2p能级无空轨道,且有一个未成对电子的基态原子和原子的最外层电子排布式为2s22p5的原子
C.M层全充满而N层为4s2的原子和核外电子排布式为1s22s22p63s23p64s2的原子
解析:A项,3p能级有一个空轨道的基态原子,按洪特规则可得其3p轨道上只能有两个电子,所以两个原子是同种元素的原子;
B项,2p能级无空轨道,且有一个未成对电子的基态原子,它的2p能级上只能是5个电子,所以两原子是同种元素的原子;
C项,M层全充满而N层为4s2的原子,其M层应为18个电子,而后者的M层上只有8个电子,所以两原子不是同种元素的原子;
答案:C
题点(二) 核外电子排布式与排布图
3.(2023·太原模拟)下列有关电子排布图的表述正确的是 ( )
答案:A
4.完成下列化学用语。
(1)Cr原子的核外电子排布式:______________,价层电子排布式:____________,原子结构示意图:______________,价层电子排布图:______________________。
(2)As的核外电子排布式:__________________,原子结构示意图:____________,价层电子排布图:______________。
(3)Co的价层电子排布式:__________________,价层电子排布图:__________________________________________________________。
答案:(1)1s22s22p63s23p63d54s1 3d54s1
5.(1)(2022·全国甲卷·节选)基态F原子的价电子排布图(轨道表示式)为_______________________________;
(2)(2022·湖南等级考·节选)基态Se原子的核外电子排布式为[Ar]__________________;
(3)(2022·山东等级考·节选)基态Ni原子的价电子排布式为______________;
(4)(2021·广东等级考·节选)基态硫原子价电子排布式为________;
(5)(2021·湖南等级考·节选)基态硅原子最外层的电子排布图为________________________。
(2)硒元素的原子序数为34,基态原子的电子排布式为[Ar] 3d104s24p4;
(3)已知Ni是28号元素,故基态Ni原子的价电子排布式为3d84s2;
(4)硫为16号元素,基态硫原子的价电子排布式为3s23p4;
(5)硅原子核外有14个电子,有1s、2s、2p、3s、3p五个能级,每个能级的电子数分别是2、2、6、2、2,则基态硅原子最外层的电子排布图为
[易错提醒] 电子排布式的常见错误与书写技巧
续表
题点(三) 根据核外电子排布推断元素
解析:Y元素原子的价层电子排布为nsn-1npn+1,s能级最多容纳2个电子,故n-1=2,解得n=3,故Y元素原子的价层电子排布为3s23p4,Y为S元素,由X、Y、Z在周期表中的位置可知,X为F元素,Z为As元素。Y为S元素,处于第三周期第ⅥA族,故A错误,B正确;
X为F元素,处于第二周期,只有2种金属元素,含有6种非金属元素,含非金属元素最多,故C正确;Z为As元素,是33号元素,其元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3,故D正确。
答案:A
7.(1)A元素基态原子的最外层有3个未成对电子,次外层有8个电子,其元素符号为____________;其价层电子排布图为____________。
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为______,C离子的结构示意图为____________。
(3)D元素的正三价离子的3d能级为半充满,D的元素符号为________,其基态原子的电子排布式为____________________,其原子的结构示意图为____________。
(4)E元素基态原子的M层全充满,N层没有成对电子且只有一个未成对电子,E的元素符号为________,其基态原子的电子排布式为______________________。
(5)F元素的原子最外层电子排布式为nsnnpn+2,则n=________;原子中能量最高的是__________电子,核外电子排布图为__________________。
(6)G基态原子L层中p轨道电子数是s轨道电子数的2倍,则G的价层电子排布式为________。
(7)H的基态原子4s和3d轨道电子半充满,则H的价层电子轨道表示式为__________________,未成对电子数为________。
谢
谢
观
看
同课章节目录
