2024届高考一轮复习 第四章 非金属及其化合物 第1讲 氯及其化合物(69张PPT)
文档属性
| 名称 | 2024届高考一轮复习 第四章 非金属及其化合物 第1讲 氯及其化合物(69张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-17 23:06:38 | ||
图片预览








文档简介
(共69张PPT)
第1讲 氯及其化合物(基础落实课)
逐点清(一) 氯及其化合物
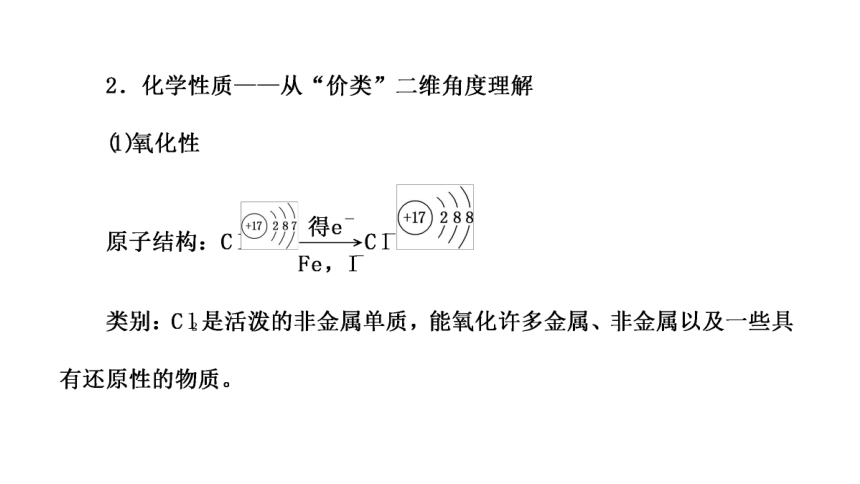
(一)氯气的性质
1.物理性质
颜色 气味 毒性 密度 特性
_____色 __________气味 有毒 比空气大 易液化
黄绿
强烈刺激性
苍白
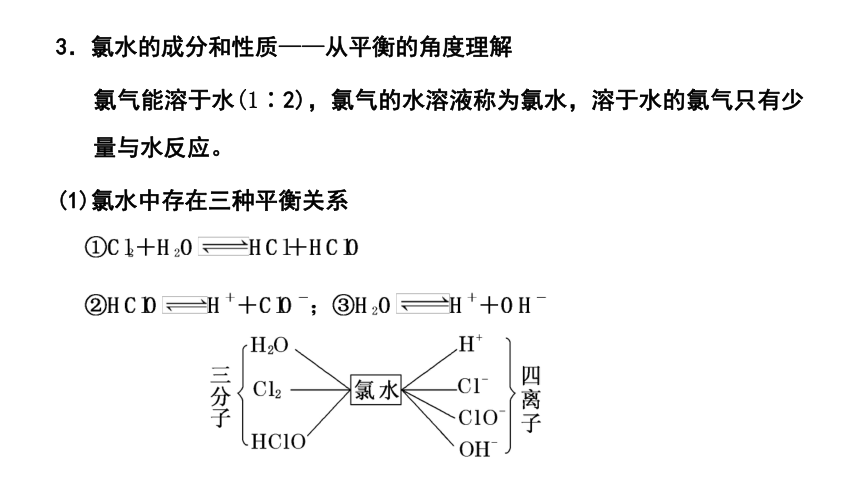
3.氯水的成分和性质——从平衡的角度理解
氯气能溶于水(1∶2),氯气的水溶液称为氯水,溶于水的氯气只有少量与水反应。
(1)氯水中存在三种平衡关系
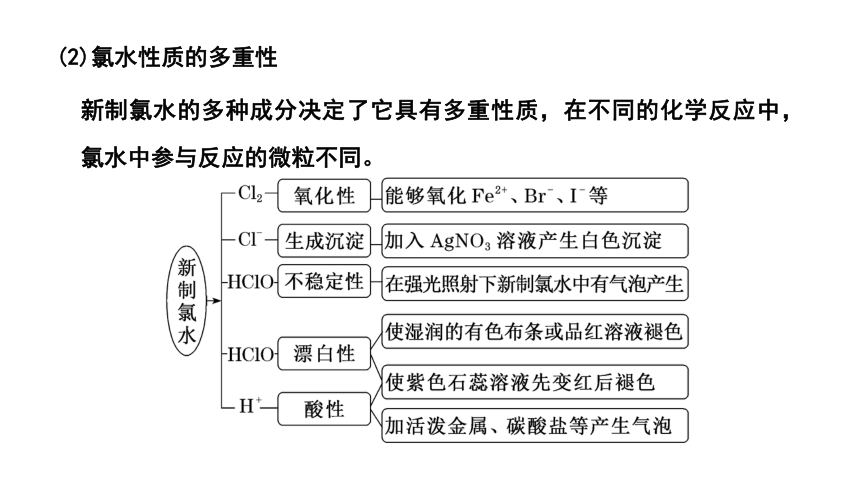
(2)氯水性质的多重性
新制氯水的多种成分决定了它具有多重性质,在不同的化学反应中,氯水中参与反应的微粒不同。
(二)从应用角度了解次氯酸、次氯酸盐
1.次氯酸
弱酸性 比碳酸____
不稳定性 ,氯水要现用现配,保存在
______试剂瓶中
强氧化性 使有色布条褪色,用作消毒剂、漂白剂
弱
棕色
成分 主要成分:Ca(ClO)2、CaCl2;
有效成分:Ca(ClO)2
化学性质 水解呈____性,具有强_____性
漂白原理 (写方程式) ____________________________________________
久置失效 原理(解释) ___________________________________________________,必须避光密封保存
2.漂白粉
碱
氧化
Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO
漂白粉在空气中生成CaCO3和HClO,HClO又分解生成HCl、O2
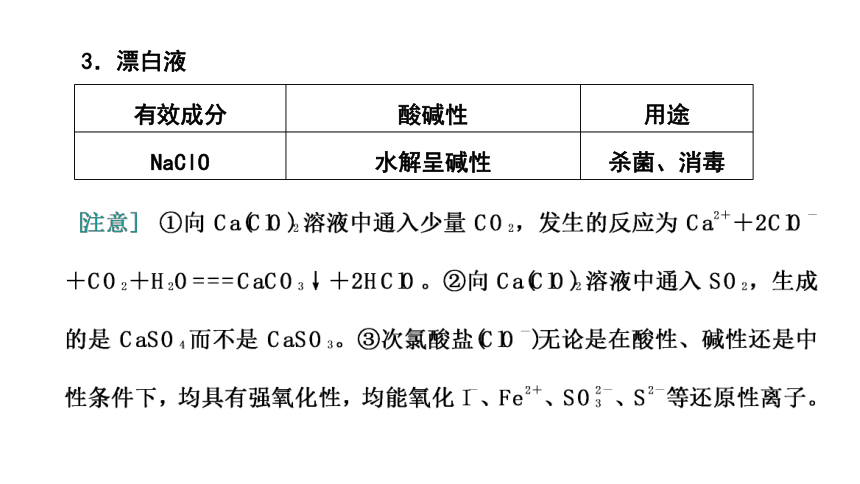
有效成分 酸碱性 用途
NaClO 水解呈碱性 杀菌、消毒
3.漂白液
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)Cl2是黄绿色气体,若泄漏于空气中,人们要向高处顺风方向撤离 ( )
(2)氯气可使湿润的红色布条褪色,所以氯气具有漂白性 ( )
(3)H2在Cl2中燃烧生成苍白色的烟雾 ( )
(4)Cl2与过量Fe发生反应时生成FeCl2 ( )
(5)漂白粉(液)应用于漂白的原因是其具有强氧化性 ( )
(6)氯水光照条件下生成气体为Cl2 ( )
(7)标准状况下,11.2 L Cl2与水充分反应转移电子数为0.5NA ( )
(8)利用ClO2、O3替代Cl2给自来水消毒更环保 ( )
×
×
×
×
×
×
×
√
2.写出下列反应的离子方程式。
(1)Cl2通入水中:____________________________________________;
(2)Cl2通入石灰水中:_________________________________________;
(3)NaClO溶液中通入少量CO2:___________________________________;
(4)Cl2通入FeCl2溶液中:__________________________________________;
(5)Cl2通入KI溶液中:___________________________________________。
[题点考法·全面练通]
题点(一) 氯气的性质及应用
1.如图所示,将浓盐酸滴在KClO3晶体上生成Cl2,立即用表面皿盖好。由实验现象得出的结论正确的是 ( )
选项 实验现象 结论
A 滴有酚酞的NaOH溶液褪色 Cl2具有酸性
B 滴有KSCN的FeCl2溶液变红 Cl2具有还原性
C KI-淀粉溶液变成蓝色 Cl2具有氧化性
D 紫色石蕊溶液先变红后褪色 Cl2具有漂白性
解析:A项,Cl2不具有酸性,可以与碱液反应,错误;
B项,Fe2+被Cl2氧化,Cl2具有氧化性,错误;
D项,Cl2不具有漂白性,Cl2与H2O反应生成的HClO具有漂白性,错误。
答案:C
2.如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀,打开Ⅰ阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂可能是 ( )
①浓硫酸 ②饱和氯化钠溶液 ③亚硫酸钠溶液
④饱和碳酸氢钠溶液
A.①②③ B.②③④
C.①②④ D.①③④
解析:Cl2与H2O反应生成的HClO具有漂白作用。气体通过甲瓶后不能使布条褪色,可能有两个原因:一是甲瓶溶液将Cl2干燥,二是甲瓶的溶液能吸收Cl2。浓H2SO4吸水,Na2SO3溶液能吸收Cl2发生氧化还原反应,饱和NaHCO3溶液能与Cl2发生反应生成CO2。
答案:D
题点(二) 氯水的成分及多重性
3.某同学向一pH试纸上滴几滴新制氯水,现象如图所示,下列有关该实验的说法中正确的是 ( )
A.该实验说明氯水具有漂白性
B.若用久置的氯水进行实验,现象相同
C.该实验说明H+扩散速度比HClO分子慢
D.将实验后的pH试纸在酒精灯上微热,试纸又恢复为原来的颜色
解析:A.该实验说明氯水具有漂白性,正确;
B.久置的氯水主要成分为稀盐酸,无漂白性,错误;
C.由实验可知,滴加氯水的区域变白,而周围变成浅红色,可说明
H+的扩散速度比HClO分子快,错误;
D.次氯酸的漂白性不具有可逆性,加热不能恢复原来的颜色,错误。
答案:A
4.氯水中含有多种成分,因而具有多种性质,根据氯水
分别与如图中四种物质发生的反应填空(a、b、c、d
重合部分代表物质间的反应,且氯水足量)。
(1)能证明氯水具有漂白性的是________(填“a”“b”“c”或“d”)。
(2)c过程的现象是_______________________________________,
b过程中反应的离子方程式为______________________________。
(3)a过程中反应的化学方程式为___________________________。
2.实验装置
装置特点
净化方法 用____________除去HCl气体,再用________除去水蒸气
收集方法 ①Cl2的密度比空气大,可用_____________收集;②Cl2能溶于水,但在饱和食盐水中的溶解度较小,可用排饱和食盐水法收集
验满方法 ①用湿润的淀粉-KI试纸,试纸变蓝;②用湿润的品红试纸,试纸褪色;③根据氯气的颜色
尾气处理 多余的Cl2须用强碱溶液(如NaOH溶液)吸收
3.制取过程
饱和食盐水
浓硫酸
向上排空气法
[注意] ①反应物的选择:必须用浓盐酸,稀盐酸与MnO2不反应,且随着反应的进行,浓盐酸变为稀盐酸时,反应停止,故盐酸中的HCl不可能全部参加反应。②加热温度:不宜过高,以减少HCl挥发。③实验结束后,先使反应停止并排出残留的Cl2后,再拆卸装置,避免污染空气。④尾气吸收时,用NaOH溶液吸收Cl2,不能用澄清石灰水吸收,因为溶液中含Ca(OH)2的量少,吸收不完全。
[题点考法·全面练通]
题点(一) 氯气的制备与性质实验
1.(2022·广东等级考)实验室用MnO2和浓盐酸反应生成Cl2后,按照净化、收集、性质检验及尾气处理的顺序进行实验。下列装置(“→”表示气流方向)不能达到实验目的的是 ( )
解析:浓盐酸易挥发,制备的氯气中含有HCl,可用饱和食盐水除去HCl,Cl2可用浓硫酸干燥,故A正确;
氯气的密度大于空气,用向上排空气法收集,B装置能收集氯气,故B正确;
湿润的红布条褪色,干燥的红布条不褪色,可验证干燥的氯气不具有漂白性,故C正确;
氯气在水中的溶解度较小,应用NaOH溶液吸收尾气,故D错误。
答案:D
(2)装置B中的现象是_____________________________________________。
(3)请写出装置D中反应的离子方程式:__________________________,装置E的作用是_______________________________________________。
(4)请帮助他们设计一个实验,证明洗气瓶C中的亚硫酸钠已被氧化(简述实验步骤): _________________________________________________
______________________________________________________________。
(5)制取Cl2的方法有多种,若A部分的装置是a,请再写出一种制备方法:__________________________________________(用化学方程式表示)。
解析:(1)从化学方程式可知反应物是固体和液体,反应条件是加热,所以应选固液混合加热型装置b。
(2)氯气具有强氧化性,与碘化钾反应:2KI+Cl2===2KCl+I2,生成的I2遇到淀粉变蓝色。
(3)装置D中反应的离子方程式:Cl2+2Fe2+===2Cl-+2Fe3+,装置E的作用是吸收多余的Cl2,防止污染空气。
答案:(1)b (2)溶液变蓝色 (3)Cl2+2Fe2+===2Cl-+2Fe3+ 吸收多余的Cl2,防止污染空气
(4)取少量C中溶液于小试管中,加入足量稀盐酸,充分振荡后滴加BaCl2溶液,若有白色沉淀生成且沉淀不消失,则证明C中亚硫酸钠已被氧化
(5)2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
[思维建模] Cl2性质探究模型
装置 试剂 实验现象 实验目的
A 浓硫酸 — 验证干燥的氯气无漂白作用,湿润的氯气(含HClO)有漂白作用
B 干燥红色布条 无明显变化 C 湿润红色布条 红色布条褪色 D FeCl2溶液 溶液由浅绿色变棕黄色 验证氯气具有强氧化性,可与金属及还原性化合物反应
E 淀粉-KI溶液 溶液变蓝色 F Mg或Na 产生白烟 G NaOH溶液 — 吸收多余的氯气
题点(二) 以含氯化合物制备为主体的综合实验
3.某研究性学习小组利用下列装置制备漂白粉。
(1)装置②的作用为_______________________________________________。
(2)装置③中多孔陶瓷的作用是______________________________________。
(3)装置④中的X试剂为______________,作用是____________________。
(4)装置③中发生反应的化学方程式为_____________________________,该反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减小副反应发生的方法是_______________________________________。
答案:(1)吸收Cl2中的HCl
(2)增大气体与石灰浆的接触面
(3)NaOH溶液 除去尾气Cl2
(4)2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O 将装置③放于冷水浴中进行实验
4.无水FeCl3是常用的芳香烃取代反应催化剂,它具有易水解、易升华的性质。铁粉与氯气反应制备无水FeCl3的实验装置如图所示:
E和G用来收集产物。回答下列问题:
(1)在E、G处收集产物是利用了FeCl3________的性质。
(2)实验过程中若F处出现堵塞,则在B处可观察到的现象是_____________________________________________________________。
可通过______(填简单操作),使实验能继续进行。
(3)I中反应的离子方程式为________________________________________
_____________________________________________________________。
(4)某同学用5.60 g干燥铁粉制得无水FeCl3样品13.00 g,该次实验的产率是____________。
(5)将H、I合并为H一个装置,H中应加入的试剂是____________。
答案:(1)易升华 (2)有气泡产生 适当加热F处
(3)Cl2+2OH-===Cl-+ClO-+H2O
(4)80.00% (5)碱石灰
逐点清(三) 卤素及卤素离子的检验
(一)卤素的性质及递变规律
1.卤素单质(X2)性质的相似性和递变性
(1)性质的相似性
①都能与大多数金属反应,如F2、Cl2、Br2与Fe反应:2Fe+3X2===2FeX3,但由于I2的氧化性较弱,I2与Fe反应生成_______。
②都能与H2反应生成HX:X2+H2===2HX。
③都能与水反应:X2+H2O HX+HXO(F2例外:2F2+2H2O===4HF+O2)。
④都能与碱溶液反应:_______________________________ (F2例外)。
FeI2
X2+2NaOH===NaX+NaXO+H2O
2.卤素及其化合物的特性
(1)氟及其化合物的特性
①氧化性最强,F-的还原性最弱;②与H2反应在暗处即爆炸,F2与盐溶液反应时,F2先与H2O反应;③HF是弱酸,能腐蚀玻璃,故应保存在铅制器皿或塑料瓶中;有毒。
(2)溴及其化合物的特性
①Br2是红棕色液体,易挥发;②Br2易溶于有机溶剂,CCl4、汽油可作Br2的萃取剂;③盛溴的试剂瓶中加水,进行水封,保存液溴时不能用橡胶塞;④AgBr具有感光性,见光易分解,可用于照相的底板。
(3)碘及其化合物的特性
①I2遇淀粉变蓝色;②I2加热时易升华;③I2易溶于有机溶剂;④食用盐中加入KIO3可用于补碘,防止甲状腺肿大;⑤AgI具有感光性,见光易分解,可用于人工降雨。
3.卤素离子的检验
(1)AgNO3溶液——沉淀法
(3)氧化——淀粉检验I-
类卤素 类卤素通常是指由不同卤族元素组成的化合物,如IBr、ICl等,因其化学性质与卤素单质相似,故在化学上常称为类卤素,也叫卤素互化物等。它们能与大多数金属和非金属反应生成相应的卤化物,也可跟水和碱溶液反应。应注意IBr、ICl等虽能与卤素单质一样与水、碱溶液反应,但其反应实质是不同的。卤素单质与水、碱溶液反应为氧化还原反应(歧化反应),而IBr、ICl与水和碱溶液反应为非氧化还原反应
(二)类卤素和拟卤素
续表
[题点考法·全面练通]
题点(一) 卤素的性质与卤离子检验
1.下列说法正确的是________(填序号)。
①F2、Cl2、Br2与NaOH溶液反应的原理相似
②卤素单质与H2化合的条件均为加热或光照
③由Fe与Cl2反应生成FeCl3可推测Fe与I2反应生成FeI3
④Cl2、F2与H2O反应的原理相同,不属于置换反应
⑤由HF、HCl、HBr、HI的稳定性逐渐减弱可推测F、Cl、Br、I的非金属性逐渐减弱
⑥只用AgNO3溶液可鉴别Na2CO3、NaCl和KBr
⑦F2、Cl2、Br2、I2的熔沸点逐渐升高
⑧为验证Br2的氧化性强于I2,将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色
答案:⑤⑦⑧
2.下列能够检验出KI中是否含有Br-的实验是 ( )
A.加入足量的新制氯水,溶液变色则有Br-
B.加入酸性KMnO4溶液,观察溶液颜色是否褪去
C.加入少量的碘水,再加入CCl4振荡,有机层有色,则有Br-
D.加入足量FeCl3溶液,用CCl4完全萃取后,取无色的水层并加入AgNO3溶液,有淡黄色沉淀生成,则含有Br-
解析:A项,在KI中加入足量新制氯水,会置换出单质碘而使溶液变色,故不能确定是否含有Br-;
B项,Br-和I-均能使酸性KMnO4溶液褪色;
C项,加入少量的碘水,再加入CCl4振荡,有机层是萃取I2而显色,并没有Br2产生。
答案:D
项目 实验1 实验2 实验3
装置
现象 溶液颜色无明显变化;把蘸浓氨水的玻璃棒靠近试管口,产生白烟 溶液变黄;把湿润的淀粉KI试纸靠近试管口,变蓝 溶液变成深紫色;经检验溶液含单质碘
3.某小组比较Cl-、Br-、I-的还原性,实验如下:
下列对实验的分析合理的是 ( )
A.实验1中,白烟是(NH4)2SO4
B.根据实验1和实验2判断还原性:Br->Cl-
C.根据实验3判断还原性:I->Br-
D.上述实验利用了浓H2SO4的强酸性、强氧化性等性质
解析:A项,实验1中,白烟为NH4Cl,错误;
B项,实验2发生的反应为浓H2SO4氧化Br-生成Br2,实验1中生成HCl,能判断还原性Br->Cl-,正确;
C项,浓硫酸也能氧化I-生成I2,错误;
D项,实验利用了浓H2SO4的难挥发性、酸性和强氧化性,错误。
答案:B
题点(二) 类卤素与拟卤素
4.(2023·潍坊模拟)溴化碘(IBr)的化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,和某些非金属单质反应生成相应的卤化物,跟水反应的化学方程式为IBr+H2O??HBr+HIO,下列有关IBr的叙述中,不正确的是 ( )
A.IBr是双原子分子
B.在很多反应中,IBr是强氧化剂
C.和NaOH溶液反应生成NaBr和NaIO
D.和水反应时,既是氧化剂又是还原剂
答案:D
5.氰(CN)2、硫氰(SCN)2的化学性质和卤素很相似,化学上称为“拟卤素”,它们阴离子的还原性强弱为Cl-<Br-<CN-<SCN-<I-。试写出:
(1)(CN)2与KOH反应的化学方程式为_____________________________。
(2)在NaBr和KSCN的混合溶液中加入(CN)2的离子方程式为___________
______________________________________________________。
(3)NaCN与AgNO3溶液反应的离子方程式为______________________。
答案:(1)(CN)2+2KOH===KCN+KCNO+H2O
(2)(CN)2+2SCN-===2CN-+(SCN)2
(3)CN-+Ag+===AgCN↓
3.海带中提取碘和检验碘
(1)流程
[题点考法·全面练通]
1.从淡化海水中提取溴的流程如下:
解析:Na2SO3+Br2+H2O===Na2SO4+2HBr,A正确;
步骤Ⅲ根据氯的非金属性比溴的强,利用置换反应制取Br2,B正确;
反应Ⅰ和反应Ⅲ均使用到Cl2,故制取1 mol Br2消耗2 mol 氯气,但未标明氯气所处的温度和压强,C错误;
从浓溴水中提取溴,可利用有机溶剂(如苯)萃取溴,然后分液得到溴的有机溶液,再经蒸馏可得纯净的溴,D正确。
答案:C
2.从海带中提取碘单质,成熟的工艺流程如下。下列关于海带制碘的说法不正确的是 ( )
答案:A
3.(2021·全国甲卷)碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
(1)I2的一种制备方法如下图所示:
①加入Fe粉进行转化反应的离子方程式为________________________,
生成的沉淀与硝酸反应,生成________后可循环使用。
②通入Cl2的过程中,若氧化产物只有一种,反应的化学方程式为____________________________;若反应物用量比n(Cl2)/n(FeI2)=1.5时,氧化产物为________;当n(Cl2)/n(FeI2)>1.5后,单质碘的收率会降低,原因是____________________________________________________。
(2)以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2。上述制备I2的总反应的离子方程式为_______________________________________。
谢
谢
观
看
第1讲 氯及其化合物(基础落实课)
逐点清(一) 氯及其化合物
(一)氯气的性质
1.物理性质
颜色 气味 毒性 密度 特性
_____色 __________气味 有毒 比空气大 易液化
黄绿
强烈刺激性
苍白
3.氯水的成分和性质——从平衡的角度理解
氯气能溶于水(1∶2),氯气的水溶液称为氯水,溶于水的氯气只有少量与水反应。
(1)氯水中存在三种平衡关系
(2)氯水性质的多重性
新制氯水的多种成分决定了它具有多重性质,在不同的化学反应中,氯水中参与反应的微粒不同。
(二)从应用角度了解次氯酸、次氯酸盐
1.次氯酸
弱酸性 比碳酸____
不稳定性 ,氯水要现用现配,保存在
______试剂瓶中
强氧化性 使有色布条褪色,用作消毒剂、漂白剂
弱
棕色
成分 主要成分:Ca(ClO)2、CaCl2;
有效成分:Ca(ClO)2
化学性质 水解呈____性,具有强_____性
漂白原理 (写方程式) ____________________________________________
久置失效 原理(解释) ___________________________________________________,必须避光密封保存
2.漂白粉
碱
氧化
Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO
漂白粉在空气中生成CaCO3和HClO,HClO又分解生成HCl、O2
有效成分 酸碱性 用途
NaClO 水解呈碱性 杀菌、消毒
3.漂白液
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)Cl2是黄绿色气体,若泄漏于空气中,人们要向高处顺风方向撤离 ( )
(2)氯气可使湿润的红色布条褪色,所以氯气具有漂白性 ( )
(3)H2在Cl2中燃烧生成苍白色的烟雾 ( )
(4)Cl2与过量Fe发生反应时生成FeCl2 ( )
(5)漂白粉(液)应用于漂白的原因是其具有强氧化性 ( )
(6)氯水光照条件下生成气体为Cl2 ( )
(7)标准状况下,11.2 L Cl2与水充分反应转移电子数为0.5NA ( )
(8)利用ClO2、O3替代Cl2给自来水消毒更环保 ( )
×
×
×
×
×
×
×
√
2.写出下列反应的离子方程式。
(1)Cl2通入水中:____________________________________________;
(2)Cl2通入石灰水中:_________________________________________;
(3)NaClO溶液中通入少量CO2:___________________________________;
(4)Cl2通入FeCl2溶液中:__________________________________________;
(5)Cl2通入KI溶液中:___________________________________________。
[题点考法·全面练通]
题点(一) 氯气的性质及应用
1.如图所示,将浓盐酸滴在KClO3晶体上生成Cl2,立即用表面皿盖好。由实验现象得出的结论正确的是 ( )
选项 实验现象 结论
A 滴有酚酞的NaOH溶液褪色 Cl2具有酸性
B 滴有KSCN的FeCl2溶液变红 Cl2具有还原性
C KI-淀粉溶液变成蓝色 Cl2具有氧化性
D 紫色石蕊溶液先变红后褪色 Cl2具有漂白性
解析:A项,Cl2不具有酸性,可以与碱液反应,错误;
B项,Fe2+被Cl2氧化,Cl2具有氧化性,错误;
D项,Cl2不具有漂白性,Cl2与H2O反应生成的HClO具有漂白性,错误。
答案:C
2.如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀,打开Ⅰ阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂可能是 ( )
①浓硫酸 ②饱和氯化钠溶液 ③亚硫酸钠溶液
④饱和碳酸氢钠溶液
A.①②③ B.②③④
C.①②④ D.①③④
解析:Cl2与H2O反应生成的HClO具有漂白作用。气体通过甲瓶后不能使布条褪色,可能有两个原因:一是甲瓶溶液将Cl2干燥,二是甲瓶的溶液能吸收Cl2。浓H2SO4吸水,Na2SO3溶液能吸收Cl2发生氧化还原反应,饱和NaHCO3溶液能与Cl2发生反应生成CO2。
答案:D
题点(二) 氯水的成分及多重性
3.某同学向一pH试纸上滴几滴新制氯水,现象如图所示,下列有关该实验的说法中正确的是 ( )
A.该实验说明氯水具有漂白性
B.若用久置的氯水进行实验,现象相同
C.该实验说明H+扩散速度比HClO分子慢
D.将实验后的pH试纸在酒精灯上微热,试纸又恢复为原来的颜色
解析:A.该实验说明氯水具有漂白性,正确;
B.久置的氯水主要成分为稀盐酸,无漂白性,错误;
C.由实验可知,滴加氯水的区域变白,而周围变成浅红色,可说明
H+的扩散速度比HClO分子快,错误;
D.次氯酸的漂白性不具有可逆性,加热不能恢复原来的颜色,错误。
答案:A
4.氯水中含有多种成分,因而具有多种性质,根据氯水
分别与如图中四种物质发生的反应填空(a、b、c、d
重合部分代表物质间的反应,且氯水足量)。
(1)能证明氯水具有漂白性的是________(填“a”“b”“c”或“d”)。
(2)c过程的现象是_______________________________________,
b过程中反应的离子方程式为______________________________。
(3)a过程中反应的化学方程式为___________________________。
2.实验装置
装置特点
净化方法 用____________除去HCl气体,再用________除去水蒸气
收集方法 ①Cl2的密度比空气大,可用_____________收集;②Cl2能溶于水,但在饱和食盐水中的溶解度较小,可用排饱和食盐水法收集
验满方法 ①用湿润的淀粉-KI试纸,试纸变蓝;②用湿润的品红试纸,试纸褪色;③根据氯气的颜色
尾气处理 多余的Cl2须用强碱溶液(如NaOH溶液)吸收
3.制取过程
饱和食盐水
浓硫酸
向上排空气法
[注意] ①反应物的选择:必须用浓盐酸,稀盐酸与MnO2不反应,且随着反应的进行,浓盐酸变为稀盐酸时,反应停止,故盐酸中的HCl不可能全部参加反应。②加热温度:不宜过高,以减少HCl挥发。③实验结束后,先使反应停止并排出残留的Cl2后,再拆卸装置,避免污染空气。④尾气吸收时,用NaOH溶液吸收Cl2,不能用澄清石灰水吸收,因为溶液中含Ca(OH)2的量少,吸收不完全。
[题点考法·全面练通]
题点(一) 氯气的制备与性质实验
1.(2022·广东等级考)实验室用MnO2和浓盐酸反应生成Cl2后,按照净化、收集、性质检验及尾气处理的顺序进行实验。下列装置(“→”表示气流方向)不能达到实验目的的是 ( )
解析:浓盐酸易挥发,制备的氯气中含有HCl,可用饱和食盐水除去HCl,Cl2可用浓硫酸干燥,故A正确;
氯气的密度大于空气,用向上排空气法收集,B装置能收集氯气,故B正确;
湿润的红布条褪色,干燥的红布条不褪色,可验证干燥的氯气不具有漂白性,故C正确;
氯气在水中的溶解度较小,应用NaOH溶液吸收尾气,故D错误。
答案:D
(2)装置B中的现象是_____________________________________________。
(3)请写出装置D中反应的离子方程式:__________________________,装置E的作用是_______________________________________________。
(4)请帮助他们设计一个实验,证明洗气瓶C中的亚硫酸钠已被氧化(简述实验步骤): _________________________________________________
______________________________________________________________。
(5)制取Cl2的方法有多种,若A部分的装置是a,请再写出一种制备方法:__________________________________________(用化学方程式表示)。
解析:(1)从化学方程式可知反应物是固体和液体,反应条件是加热,所以应选固液混合加热型装置b。
(2)氯气具有强氧化性,与碘化钾反应:2KI+Cl2===2KCl+I2,生成的I2遇到淀粉变蓝色。
(3)装置D中反应的离子方程式:Cl2+2Fe2+===2Cl-+2Fe3+,装置E的作用是吸收多余的Cl2,防止污染空气。
答案:(1)b (2)溶液变蓝色 (3)Cl2+2Fe2+===2Cl-+2Fe3+ 吸收多余的Cl2,防止污染空气
(4)取少量C中溶液于小试管中,加入足量稀盐酸,充分振荡后滴加BaCl2溶液,若有白色沉淀生成且沉淀不消失,则证明C中亚硫酸钠已被氧化
(5)2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
[思维建模] Cl2性质探究模型
装置 试剂 实验现象 实验目的
A 浓硫酸 — 验证干燥的氯气无漂白作用,湿润的氯气(含HClO)有漂白作用
B 干燥红色布条 无明显变化 C 湿润红色布条 红色布条褪色 D FeCl2溶液 溶液由浅绿色变棕黄色 验证氯气具有强氧化性,可与金属及还原性化合物反应
E 淀粉-KI溶液 溶液变蓝色 F Mg或Na 产生白烟 G NaOH溶液 — 吸收多余的氯气
题点(二) 以含氯化合物制备为主体的综合实验
3.某研究性学习小组利用下列装置制备漂白粉。
(1)装置②的作用为_______________________________________________。
(2)装置③中多孔陶瓷的作用是______________________________________。
(3)装置④中的X试剂为______________,作用是____________________。
(4)装置③中发生反应的化学方程式为_____________________________,该反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减小副反应发生的方法是_______________________________________。
答案:(1)吸收Cl2中的HCl
(2)增大气体与石灰浆的接触面
(3)NaOH溶液 除去尾气Cl2
(4)2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O 将装置③放于冷水浴中进行实验
4.无水FeCl3是常用的芳香烃取代反应催化剂,它具有易水解、易升华的性质。铁粉与氯气反应制备无水FeCl3的实验装置如图所示:
E和G用来收集产物。回答下列问题:
(1)在E、G处收集产物是利用了FeCl3________的性质。
(2)实验过程中若F处出现堵塞,则在B处可观察到的现象是_____________________________________________________________。
可通过______(填简单操作),使实验能继续进行。
(3)I中反应的离子方程式为________________________________________
_____________________________________________________________。
(4)某同学用5.60 g干燥铁粉制得无水FeCl3样品13.00 g,该次实验的产率是____________。
(5)将H、I合并为H一个装置,H中应加入的试剂是____________。
答案:(1)易升华 (2)有气泡产生 适当加热F处
(3)Cl2+2OH-===Cl-+ClO-+H2O
(4)80.00% (5)碱石灰
逐点清(三) 卤素及卤素离子的检验
(一)卤素的性质及递变规律
1.卤素单质(X2)性质的相似性和递变性
(1)性质的相似性
①都能与大多数金属反应,如F2、Cl2、Br2与Fe反应:2Fe+3X2===2FeX3,但由于I2的氧化性较弱,I2与Fe反应生成_______。
②都能与H2反应生成HX:X2+H2===2HX。
③都能与水反应:X2+H2O HX+HXO(F2例外:2F2+2H2O===4HF+O2)。
④都能与碱溶液反应:_______________________________ (F2例外)。
FeI2
X2+2NaOH===NaX+NaXO+H2O
2.卤素及其化合物的特性
(1)氟及其化合物的特性
①氧化性最强,F-的还原性最弱;②与H2反应在暗处即爆炸,F2与盐溶液反应时,F2先与H2O反应;③HF是弱酸,能腐蚀玻璃,故应保存在铅制器皿或塑料瓶中;有毒。
(2)溴及其化合物的特性
①Br2是红棕色液体,易挥发;②Br2易溶于有机溶剂,CCl4、汽油可作Br2的萃取剂;③盛溴的试剂瓶中加水,进行水封,保存液溴时不能用橡胶塞;④AgBr具有感光性,见光易分解,可用于照相的底板。
(3)碘及其化合物的特性
①I2遇淀粉变蓝色;②I2加热时易升华;③I2易溶于有机溶剂;④食用盐中加入KIO3可用于补碘,防止甲状腺肿大;⑤AgI具有感光性,见光易分解,可用于人工降雨。
3.卤素离子的检验
(1)AgNO3溶液——沉淀法
(3)氧化——淀粉检验I-
类卤素 类卤素通常是指由不同卤族元素组成的化合物,如IBr、ICl等,因其化学性质与卤素单质相似,故在化学上常称为类卤素,也叫卤素互化物等。它们能与大多数金属和非金属反应生成相应的卤化物,也可跟水和碱溶液反应。应注意IBr、ICl等虽能与卤素单质一样与水、碱溶液反应,但其反应实质是不同的。卤素单质与水、碱溶液反应为氧化还原反应(歧化反应),而IBr、ICl与水和碱溶液反应为非氧化还原反应
(二)类卤素和拟卤素
续表
[题点考法·全面练通]
题点(一) 卤素的性质与卤离子检验
1.下列说法正确的是________(填序号)。
①F2、Cl2、Br2与NaOH溶液反应的原理相似
②卤素单质与H2化合的条件均为加热或光照
③由Fe与Cl2反应生成FeCl3可推测Fe与I2反应生成FeI3
④Cl2、F2与H2O反应的原理相同,不属于置换反应
⑤由HF、HCl、HBr、HI的稳定性逐渐减弱可推测F、Cl、Br、I的非金属性逐渐减弱
⑥只用AgNO3溶液可鉴别Na2CO3、NaCl和KBr
⑦F2、Cl2、Br2、I2的熔沸点逐渐升高
⑧为验证Br2的氧化性强于I2,将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色
答案:⑤⑦⑧
2.下列能够检验出KI中是否含有Br-的实验是 ( )
A.加入足量的新制氯水,溶液变色则有Br-
B.加入酸性KMnO4溶液,观察溶液颜色是否褪去
C.加入少量的碘水,再加入CCl4振荡,有机层有色,则有Br-
D.加入足量FeCl3溶液,用CCl4完全萃取后,取无色的水层并加入AgNO3溶液,有淡黄色沉淀生成,则含有Br-
解析:A项,在KI中加入足量新制氯水,会置换出单质碘而使溶液变色,故不能确定是否含有Br-;
B项,Br-和I-均能使酸性KMnO4溶液褪色;
C项,加入少量的碘水,再加入CCl4振荡,有机层是萃取I2而显色,并没有Br2产生。
答案:D
项目 实验1 实验2 实验3
装置
现象 溶液颜色无明显变化;把蘸浓氨水的玻璃棒靠近试管口,产生白烟 溶液变黄;把湿润的淀粉KI试纸靠近试管口,变蓝 溶液变成深紫色;经检验溶液含单质碘
3.某小组比较Cl-、Br-、I-的还原性,实验如下:
下列对实验的分析合理的是 ( )
A.实验1中,白烟是(NH4)2SO4
B.根据实验1和实验2判断还原性:Br->Cl-
C.根据实验3判断还原性:I->Br-
D.上述实验利用了浓H2SO4的强酸性、强氧化性等性质
解析:A项,实验1中,白烟为NH4Cl,错误;
B项,实验2发生的反应为浓H2SO4氧化Br-生成Br2,实验1中生成HCl,能判断还原性Br->Cl-,正确;
C项,浓硫酸也能氧化I-生成I2,错误;
D项,实验利用了浓H2SO4的难挥发性、酸性和强氧化性,错误。
答案:B
题点(二) 类卤素与拟卤素
4.(2023·潍坊模拟)溴化碘(IBr)的化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,和某些非金属单质反应生成相应的卤化物,跟水反应的化学方程式为IBr+H2O??HBr+HIO,下列有关IBr的叙述中,不正确的是 ( )
A.IBr是双原子分子
B.在很多反应中,IBr是强氧化剂
C.和NaOH溶液反应生成NaBr和NaIO
D.和水反应时,既是氧化剂又是还原剂
答案:D
5.氰(CN)2、硫氰(SCN)2的化学性质和卤素很相似,化学上称为“拟卤素”,它们阴离子的还原性强弱为Cl-<Br-<CN-<SCN-<I-。试写出:
(1)(CN)2与KOH反应的化学方程式为_____________________________。
(2)在NaBr和KSCN的混合溶液中加入(CN)2的离子方程式为___________
______________________________________________________。
(3)NaCN与AgNO3溶液反应的离子方程式为______________________。
答案:(1)(CN)2+2KOH===KCN+KCNO+H2O
(2)(CN)2+2SCN-===2CN-+(SCN)2
(3)CN-+Ag+===AgCN↓
3.海带中提取碘和检验碘
(1)流程
[题点考法·全面练通]
1.从淡化海水中提取溴的流程如下:
解析:Na2SO3+Br2+H2O===Na2SO4+2HBr,A正确;
步骤Ⅲ根据氯的非金属性比溴的强,利用置换反应制取Br2,B正确;
反应Ⅰ和反应Ⅲ均使用到Cl2,故制取1 mol Br2消耗2 mol 氯气,但未标明氯气所处的温度和压强,C错误;
从浓溴水中提取溴,可利用有机溶剂(如苯)萃取溴,然后分液得到溴的有机溶液,再经蒸馏可得纯净的溴,D正确。
答案:C
2.从海带中提取碘单质,成熟的工艺流程如下。下列关于海带制碘的说法不正确的是 ( )
答案:A
3.(2021·全国甲卷)碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
(1)I2的一种制备方法如下图所示:
①加入Fe粉进行转化反应的离子方程式为________________________,
生成的沉淀与硝酸反应,生成________后可循环使用。
②通入Cl2的过程中,若氧化产物只有一种,反应的化学方程式为____________________________;若反应物用量比n(Cl2)/n(FeI2)=1.5时,氧化产物为________;当n(Cl2)/n(FeI2)>1.5后,单质碘的收率会降低,原因是____________________________________________________。
(2)以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2。上述制备I2的总反应的离子方程式为_______________________________________。
谢
谢
观
看
同课章节目录
