2024届高考化学一轮复习 第三章 金属及其化合物 第5讲 无机化学工艺流程解题策略(67张PPT)
文档属性
| 名称 | 2024届高考化学一轮复习 第三章 金属及其化合物 第5讲 无机化学工艺流程解题策略(67张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-17 23:12:54 | ||
图片预览








文档简介
(共67张PPT)
第5讲 无机化学工艺流程解题策略(综合应用课)
该题型以工艺流程图的形式再现实际生产的关键环节,情境真实而富有意义,旨在引导学生学以致用,解决生产、生活中的实际问题,有利于培养学生的科学精神和社会责任感。考查的知识多为产物的判断,陌生化学方程式、离子方程式或电极反应式的书写,温度控制在一定范围的原因分析,溶度积常数的有关计算等。工艺流程题是高考的热点题型,综合性强,难度较大,是高考试卷中的拉分题目之一。
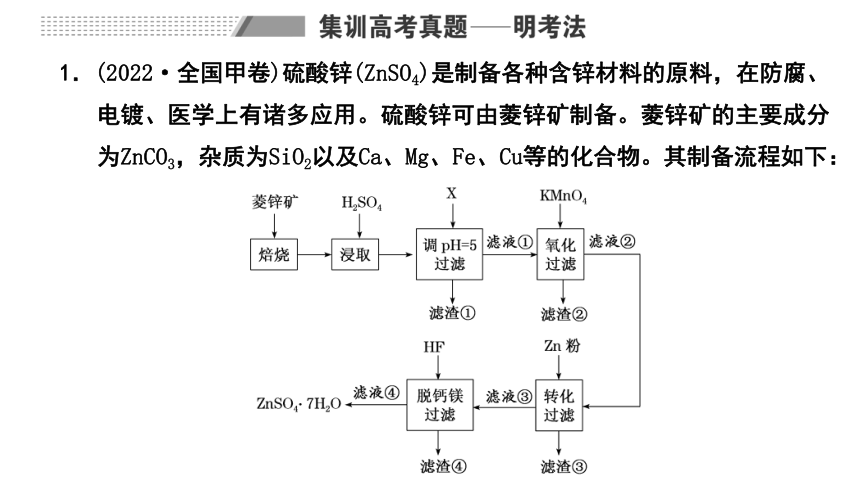
1.(2022·全国甲卷)硫酸锌(ZnSO4)是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。硫酸锌可由菱锌矿制备。菱锌矿的主要成分为ZnCO3,杂质为SiO2以及Ca、Mg、Fe、Cu等的化合物。其制备流程如下:
离子 Fe3+ Zn2+ Cu2+ Fe2+ Mg2+
Ksp 4.0×10-38 6.7×10-17 2.2×10-20 8.0×10-16 1.8×10-11
本题中所涉及离子的氢氧化物溶度积常数如下表:
(3)加入物质X调溶液pH=5,最适宜使用的X是________(填标号)。
A.NH3·H2O B.Ca(OH)2 C.NaOH
滤渣①的主要成分是__________、__________、__________。
(4)向80~90 ℃的滤液①中分批加入适量KMnO4溶液充分反应后过滤,滤渣②中有MnO2,该步反应的离子方程式为______________________________
_____________________________________________________________。
(5)滤液②中加入锌粉的目的是___________________________________
___________________________________________________________。
(6)滤渣④与浓H2SO4反应可以释放HF并循环利用,同时得到的副产物是__________、__________。
(3)NH3·H2O易分解产生NH3污染空气,且经济成本较高,故A不适宜;Ca(OH)2不会引入新的杂质,且成本较低,故B适宜;NaOH会引入杂质Na+,且成本较高,C不适宜;当沉淀完全时(离子浓度小于10-5mol·L-1),结合表格Ksp计算各离子完全沉淀时pH<5的只有Fe3+,故滤渣①中有Fe(OH)3,又CaSO4是微溶物,SiO2不溶于酸,故滤渣①的主要成分是Fe(OH)3、CaSO4、SiO2;
(4)向80~90 ℃滤液①中加入KMnO4溶液,可氧化Fe2+,得到Fe(OH)3和MnO2的滤渣②,反应的离子方程式为3Fe2++MnO+7H2O===3Fe(OH)3↓+MnO2↓+5H+;
(5)滤液②中加入锌粉,发生反应Zn+Cu2+===Zn2++Cu,故加入锌粉的目的为除去Cu2+;(6)由分析,滤渣④为CaF2、MgF2,与浓硫酸反应可得到HF,同时得到的副产物为CaSO4、MgSO4。
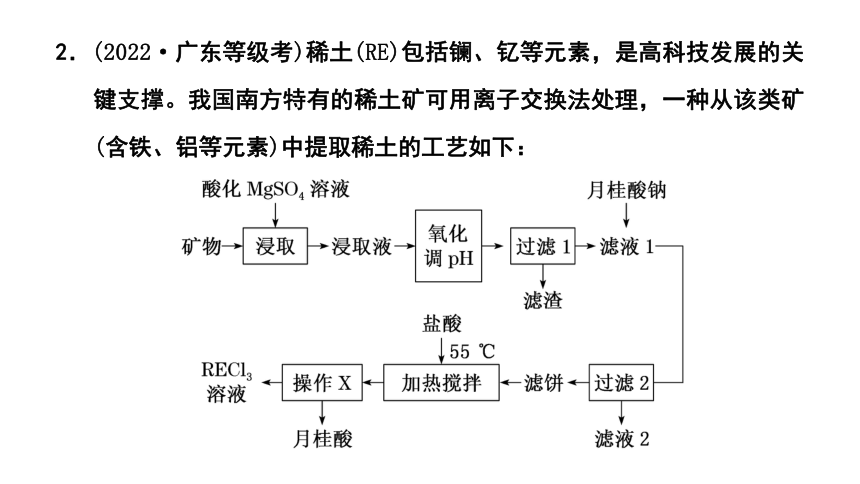
2.(2022·广东等级考)稀土(RE)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
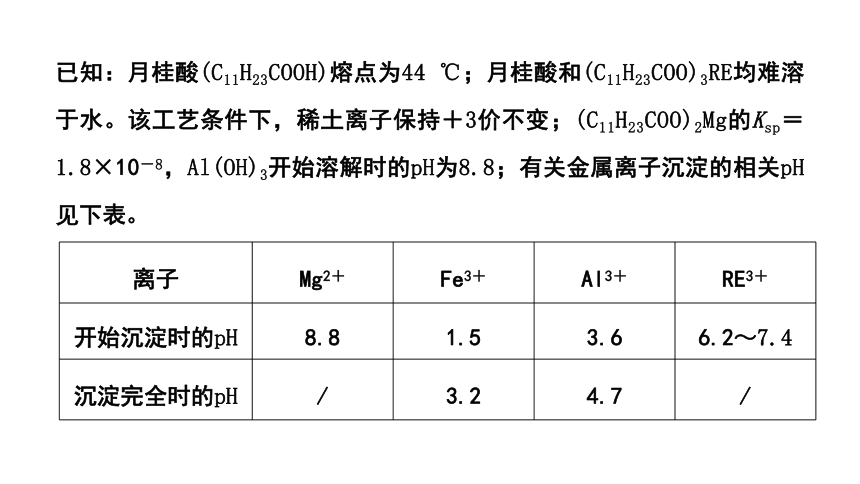
已知:月桂酸(C11H23COOH)熔点为44 ℃;月桂酸和(C11H23COO)3RE均难溶于水。该工艺条件下,稀土离子保持+3价不变;(C11H23COO)2Mg的Ksp=1.8×10-8,Al(OH)3开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀时的pH 8.8 1.5 3.6 6.2~7.4
沉淀完全时的pH / 3.2 4.7 /
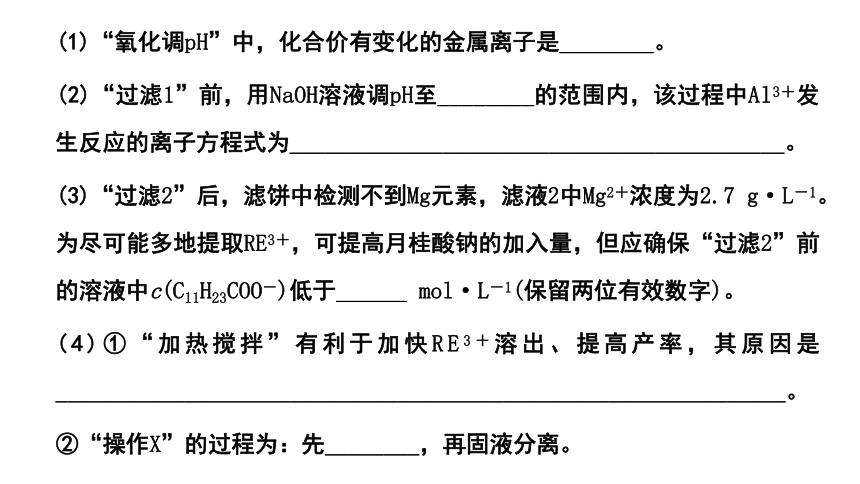
(1)“氧化调pH”中,化合价有变化的金属离子是________。
(2)“过滤1”前,用NaOH溶液调pH至________的范围内,该过程中Al3+发生反应的离子方程式为__________________________________________。
(3)“过滤2”后,滤饼中检测不到Mg元素,滤液2中Mg2+浓度为2.7 g·L-1。为尽可能多地提取RE3+,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中c(C11H23COO-)低于______ mol·L-1(保留两位有效数字)。
(4)①“加热搅拌”有利于加快RE3+溶出、提高产率,其原因是______________________________________________________________。
②“操作X”的过程为:先________,再固液分离。
(5)该工艺中,可再生循环利用的物质有________(写化学式)。
(6)稀土元素钇(Y)可用于制备高活性的合金类催化剂Pt3Y。
①还原YCl3和PtCl4熔融盐制备Pt3Y时,生成1 mol Pt3Y转移________ mol电子。
②Pt3Y/C用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化O2的还原,发生的电极反应为__________________________________________。
(4)①“加热搅拌”有利于加快RE3+溶出、提高产率,其原因是加热搅拌可加快反应速率;
② “操作X”的结果是分离出月桂酸,由信息可知,月桂酸(C11H23COOH)熔点为44 ℃,故“操作X”的过程为:先冷却结晶,再固液分离;
(5)由分析可知,该工艺中,可再生循环利用的物质有MgSO4;
(6)①YCl3中Y为+3价,PtCl4中Pt为+4价,而Pt3Y中金属均为0价,所以还原YCl3和PtCl4熔融盐制备Pt3Y时,生成1 mol Pt3Y转移15 mol电子;
②碱性溶液中,氢氧燃料电池正极发生还原反应,发生的电极反应为O2+4e-+2H2O===4OH-。
答案:(1)Fe2+
(2)4.7≤pH<6.2
Al3++3OH-===Al(OH)3↓
(3)4.0×10-4
(4)①加热搅拌可加快反应速率 ②冷却结晶
(5)MgSO4
(6)①15 ②O2+4e-+2H2O===4OH-
1.试题呈现形式
2.准确识图析图
化工流程题的考点主要从以下6点设置 基本操作 除杂、分离、检验、洗涤、干燥等实验操作的步骤描述;加入某些试剂或某个操作步骤的目的描述
物质的分 离与提纯 通过调节pH使溶液中的金属离子沉淀达到分离除杂的目的,据此选择需要加入的化学试剂;加入某种物质使难溶物转化为更难溶的物质后,通过过滤除去等
化学反应速 率与化学平衡 理论的运用 例如,研磨使反应物颗粒变小,增大反应物间的接触面积,从而增大反应速率,提高原料利用率;升高温度能增大反应速率,使吸热反应平衡正向移动等
3.常见考查角度
化学方程式 或离子方程 式的书写 根据流程图及设问中的信息找出反应物和生成物,书写指定的化学方程式或离子方程式
环境与绿色 化学思想 流程中物质的转化和循环、资源的回收和利用、“三废”的来源、对环境的影响及处理措施等
化学计算 联系原料纯度、转化率、损失率、产物产率等计算产品质量;联系溶液配制、滴定操作测定样品中某元素含量或产品纯度;联系溶度积常数,计算溶液中某离子浓度或完全沉淀时的pH等
续表
4.掌握解题流程
(1)审题干——明确原料成分和目的要求
看箭头 进入的是原料(即反应物);出去的是生成物(包括主产物和副产物)
看三线 主线主产品、分支副产品、回头为循环
找信息 明确反应条件控制和分离提纯方法
关注所加物质的可能作用 参与反应、提供反应氛围、满足定量要求
(2)审流程——明确各步转化原理和目的
不要 答非所问 要看清题目要求,按要求答题,防止答非所问
规范答题 回答问题要准确全面,注意语言表达的规范性,特别是化学用语的书写与表示要准确、规范
(3)审问题——明确答什么
[典例] (2021·湖南等级考)Ce2(CO3)3可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以CePO4形式存在,还含有SiO2、Al2O3、Fe2O3、CaF2等物质。以独居石为原料制备Ce2(CO3)3·nH2O的工艺流程如下:
回答下列问题:
(1)铈的某种核素含有58个质子和80个中子,该核素的符号为________。
(2)为提高“水浸”效率,可采取的措施有______________________(至少写两条)。
(3)滤渣Ⅲ的主要成分是________(填化学式)。
(4)加入絮凝剂的目的是______________________________________。
(5)“沉铈”过程中,生成Ce2(CO3)3·nH2O的离子方程式为________________________,常温下加入的NH4HCO3溶液呈______(填“酸性”“碱性”或“中性”)(已知:NH3·H2O的Kb=1.75×10-5,H2CO3的Ka1=4.4×10-7,Ka2=4.7×10-11)。
(6)滤渣Ⅱ的主要成分为FePO4,在高温条件下,Li2CO3、葡萄糖(C6H12O6)和FePO4可制备电极材料LiFePO4,同时生成CO和H2O,该反应的化学方程式为___________________________________________________。
[解题流程]
第一步:审题干→明目的
原料成分:独居石,主要成分以CePO4形式存在,还含有SiO2、Al2O3、Fe2O3、CaF2等杂质。
工艺目的:制备Ce2(CO3)3·nH2O。
第二步:审流程→理关系
焙烧浓硫酸和独居石的混合物,CePO4转化为Ce2(SO4)3和H3PO4,SiO2与硫酸不反应,Al2O3转化为Al2(SO4)3,Fe2O3转化为Fe2(SO4)3,CaF2转化为CaSO4和HF,酸性废气含HF
溶于水的物质为Ce2(SO4)3和H3PO4,Al2(SO4)3,Fe2(SO4)3,水浸的目的是除去滤渣Ⅰ(SiO2和CaSO4)
加入FeCl3溶液除磷,是为了把H3PO4转化为FePO4
除去
加入MgO,调节pH,是为了让铝离子、铁离子转化为沉淀除去,加入絮凝剂的目的是使悬浮粒子聚集变大,加快粒子聚沉速度,更快地形成沉淀
加碳酸氢铵沉铈是把Ce3+沉淀得到Ce2(CO3)3·nH2O
续表
碱性
题型(一) 以物质制备为主体的化工流程
1.工艺流程中的常见专业术语
释义
研磨、雾化 将块状或颗粒状的物质磨成粉末或将液体分散成微小液滴,增大反应物接触面积,以加快反应速率或使反应更充分
灼烧 (煅烧) 使固体在高温下分解或改变结构、使杂质高温氧化、分解等。如煅烧石灰石、高岭土、硫铁矿
浸取 向固体中加入适当溶剂或溶液,使其中可溶性的物质溶解,包括水浸取、酸溶、碱溶、醇溶等
酸浸 在酸性溶液中使可溶性金属离子进入溶液,不溶物通过过滤除去的过程
浸出率 固体溶解后,离子在溶液中的含量的多少
滴定 定量测定,可用于某种未知浓度物质的物质的量浓度的测定
酸作用 溶解、去氧化物(膜)、抑制某些金属离子的水解、除去杂质离子等
碱作用 去油污、去铝片氧化膜,溶解铝、二氧化硅、调节pH、促进水解(沉淀)
续表
控制体 系的环 境氛围 ①需要在酸性气流中干燥FeCl3、AlCl3、MgCl2等含水晶体,抑制水解并带走因分解产生的水汽。
②营造还原性氛围,防止还原性物质被氧化。如加入铁粉防止Fe2+被氧化。
③加入氧化剂进行氧化。如加入绿色氧化剂H2O2将Fe2+氧化为Fe3+,绿色氧化剂H2O2的优点:不引入新杂质,对环境无污染
2.物质制备过程中的条件控制
控制反 应温度 ①加热:加速溶解、加快反应速率或促使平衡向某个方向移动(如促进水解生成沉淀)。
②降温:防止某物质在某温度时会溶解或分解,或促使平衡向某个方向移动。
③控制温度在一定范围内:综合多方面因素考虑。如使反应速率不至于太慢、抑制或促进平衡移动、防止反应物分解、防止副反应发生、使催化剂的催化活性最高等。
④如题目中出现了包括产物在内的各种物质的溶解度信息,则要根据它们溶解度随温度升高而改变的情况,寻找合适的结晶分离方法
续表
控制 溶液的pH ①调节溶液的酸碱性,抑制水解(或使其中某些金属离子形成氢氧化物沉淀)。
②“酸作用”还可除去氧化物(膜)。
③“碱作用”还可除去油污,除去铝片氧化膜,溶解铝、二氧化硅等。
④特定的氧化还原反应需要的酸性条件(或碱性条件)
外界条件 对可逆反 应的控制 ①使催化剂的活性达到最高:如工业合成氨或SO2的催化氧化反应,选择的温度是500 ℃左右,原因之一就是该温度下可使催化剂的活性达到最高。
②对于一些工艺来说,降温或减压都可以减少能源成本,降低对设备的要求,达到绿色化学的目的
续表
[典例] (2022·辽宁等级考)某工厂采用辉铋矿(主要成分为Bi2S3,含有FeS2、SiO2杂质)与软锰矿(主要成分为MnO2)联合焙烧法制备BiOCl和MnSO4,工艺流程如下:
已知:①焙烧时过量的MnO2分解为Mn2O3,FeS2转变为Fe2O3;
②金属活动性:Fe>(H)>Bi>Cu;
③相关金属离子形成氢氧化物的pH范围如下:
开始沉淀pH 完全沉淀pH
Fe2+ 6.5 8.3
Fe3+ 1.6 2.8
Mn2+ 8.1 10.1
回答下列问题:
(1)为提高焙烧效率,可采取的措施为__________。
a.进一步粉碎矿石
b.鼓入适当过量的空气
c.降低焙烧温度
(2)Bi2S3在空气中单独焙烧生成Bi2O3,反应的化学方程式为______________________________________________________。
(3)“酸浸”中过量浓盐酸的作用为:
①充分浸出Bi3+和Mn2+;②______________。
(4)滤渣的主要成分为__________(填化学式)。
(5)生成气体A的离子方程式为_________________________________。
(6)加入金属Bi的目的是________________。
[解析] 联合焙烧:由已知信息①和第(2)问题干可知,发生转化:Bi2S3―→Bi2O3+SO2、FeS2―→Fe2O3+SO2、MnO2―→Mn2O3+MnSO4,故联合焙烧后得到Bi2O3、Fe2O3、Mn2O3、MnSO4和SiO2;
水浸:MnSO4进入滤液,滤渣为Bi2O3、Fe2O3、Mn2O3和SiO2;
酸浸:加入过量浓盐酸后,Bi2O3和Fe2O3发生转化:Bi2O3―→Bi3+、Fe2O3―→Fe3+,因Mn2O3有氧化性,会与浓盐酸发生氧化还原反应:Mn2O3+6H++2Cl-===2Mn2++Cl2↑+3H2O,气体A为Cl2,滤渣主要为不溶于浓盐酸的SiO2,滤液中金属离子为Bi3+、Fe3+、Mn2+;
第(4)(5)问转化:由已知信息②知,Fe的金属活动性强于Bi,且调pH=2.6时Mn2+和Fe2+进入滤液,可知加入金属Bi的目的是将Fe3+还原为Fe2+。(1)联合焙烧时,进一步粉碎矿石,可以增大矿石与空气的接触面积,能够提高焙烧效率,a符合题意;鼓入适当过量的空气有利于矿石充分反应,b符合题意;降低焙烧温度,反应速率减慢,不利于提高焙烧效率,c不符合题意;
[对点训练]
(2023·扬州模拟)工业以炼钢污泥(主要成分为铁的氧化物,还含有CaO、SiO2、C等杂质)为原料制备脱硫剂活性Fe2O3·H2O,并用该脱硫剂处理沼气中H2S的流程如图:
(2)“除杂”:若使还原后的滤液中Ca2+完全沉淀(离子浓度小于10-6mol·
L-1),则滤液中c(F-)需大于__________;若溶液的pH偏低,将会导致CaF2沉淀不完全,其原因是___________________________________
[Ksp(CaF2)=1.44×10-10,Ka(HF)=3.53×10-4]。
(3)“沉铁”:生成FeCO3沉淀的离子方程式为_______________________
____________________________________________________________。
(4)“脱硫、再生”:活性Fe2O3·H2O是一种固体脱硫剂(无水Fe2O3无脱硫作用),其原理是将废气中的含硫化合物化学吸附到脱硫剂的孔隙中,发生反应改变其化学组成。当脱硫剂达到饱和后,
即不再具有脱硫能力,需要对其进行再生。利用活性Fe2O3·H2O脱除沼气中的H2S可转化成Fe2S3·H2O,其脱除及常温下再生的原理如图所示。
①“脱硫”反应的化学方程式为________________________________
_______________________________________________________________。
②工业上要求脱除及再生整个过程温度不能超过90 ℃,原因是_____________________________________________________________;多次“再生”后,脱硫剂的活性不断下降,脱硫效果明显变差的原因可能是____________________________________________________________。
(4)①根据反应原理可知在“脱硫”反应中,Fe2O3·H2O和H2S反应产生Fe2S3·H2O和H2O;②工业上要求脱除及再生整个过程温度不能超过90 ℃,这是由于温度超过90 ℃,Fe2O3·H2O和Fe2S3·H2O均会发生分解,失去结晶水,失去脱硫作用;多次“再生”后,脱硫剂的活性不断下降,脱硫效果明显变差的原因可能是由于多次“再生”后,脱硫剂表面的大部分孔隙被S或其他物质覆盖,使得脱硫剂的活性下降。
题型(二) 以物质分离提纯为主体的化工流程
1.常用的分离方法
过滤 分离难溶物和易溶物,根据特殊需要采用趁热过滤或者抽滤等方法
萃取和 分液 利用溶质在互不相溶的溶剂里的溶解度不同提取分离物质,如用CCl4或苯萃取溴水中的溴
蒸发结晶 提取溶解度随温度变化不大的溶质,如NaCl
冷却结晶 提取溶解度随温度变化较大的溶质、易水解的溶质或结晶水合物,如KNO3、FeCl3、CuCl2、CuSO4·5H2O、FeSO4·7H2O等
蒸馏 或分馏 分离沸点不同且互溶的液体混合物,如分离乙醇和甘油
冷却法 利用气体液化的特点分离气体,如合成氨工业采用冷却法分离平衡混合气体中的氨气
水溶法 除去可溶性杂质
酸溶法 除去碱性杂质
碱溶法 除去酸性杂质
氧化剂或还原剂法 除去还原性或氧化性杂质
加热灼烧法 除去受热易分解或易挥发的杂质
调节溶液的pH法 如除去酸性Cu2+溶液中的Fe3+等
2.常用的提纯方法
[注意] 物质分离提纯的原则
①不增:不引入新的杂质。
②不减:不减少被提纯的物质。
③易分离:被提纯物质与杂质易于分离。
④易复原:被提纯的物质易恢复原来的组成、状态。
[典例] (2022·全国乙卷)废旧铅蓄电池的铅膏中主要含有PbSO4、PbO2、PbO和Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过如图流程实现铅的回收。
难溶电解质 PbSO4 PbCO3 BaSO4 BaCO3
Ksp 2.5×10-8 7.4×10-14 1.1×10-10 2.6×10-9
一些难溶电解质的溶度积常数如下表:
金属氢氧化物 Fe(OH)3 Fe(OH)2 Al(OH)3 Pb(OH)2
开始沉淀的pH 2.3 6.8 3.5 7.2
完全沉淀的pH 3.2 8.3 4.6 9.1
一定条件下,一些金属氢氧化物沉淀时的pH如下表:
回答下列问题:
(1)在“脱硫”中PbSO4转化反应的离子方程式为__________________,用沉淀溶解平衡原理解释选择Na2CO3的原因__________________________
____________________________。
(2)在“脱硫”中,加入Na2CO3不能使铅膏中BaSO4完全转化,原因是
_________________________________________。
(3)在“酸浸”中,除加入醋酸(HAc),还要加入H2O2。
(ⅰ)能被H2O2氧化的离子是____________;
(ⅱ)H2O2促进了金属Pb在醋酸中转化为Pb(Ac)2,其化学方程式为
_______________________________________________________;
(ⅲ)H2O2也能使PbO2转化为Pb(Ac)2,H2O2的作用是_________________。
(4)“酸浸”后溶液的pH约为4.9,滤渣的主要成分是__________________。
(5)“沉铅”的滤液中,金属离子有______________。
[解析] (1)PbCO3的Ksp远小于PbSO4的Ksp,易发生生成PbCO3的沉淀转化,且进行较为彻底。
(2)BaCO3的Ksp大于BaSO4的Ksp,不易发生生成BaCO3的沉淀转化,即使发生程度也很小。
(3)(ⅰ)过氧化氢有氧化性,亚铁离子有还原性,会被过氧化氢氧化为铁离子。(ⅱ)过氧化氢与Pb、HAc发生氧化还原反应生成Pb(Ac)2和H2O,反应的化学方程式为Pb+H2O2+2HAc===Pb(Ac)2+2H2O。
(ⅲ)过氧化氢也能使PbO2转化为Pb(Ac)2,铅元素化合价由+4价降低到了+2价,PbO2是氧化剂,则过氧化氢是还原剂。
(4)酸浸后溶液的pH约为4.9,依据金属氢氧化物沉淀时的pH可知,滤渣主要成分为氢氧化铝、氢氧化铁。
(5)依据分析可知,加入碳酸钠不能使铅膏中的BaSO4完全转化,铁离子、铝离子转化成了氢氧化铁、氢氧化铝沉淀,铅转化成了氢氧化铅,最终变成了氧化铅,因此沉铅的滤液中,金属离子有Ba2+和加入碳酸钠、氢氧化钠时引入的Na+。
[对点训练]
(2023·济南模拟)铈可用作优良的环保材料,现以氟碳铈矿(CeFCO3,含Fe2O3、FeO等杂质)为原料制备铈,其工艺流程如图所示:
回答下列问题:
(1)粉碎后“焙烧”时,氧化数据如表所示:
空气氧化法 氧化温度/ ℃ 氧化率/% 氧化时间/h
暴露空气中 450~500 88 14
对流空气氧化炉中 450~500 98 6
(2)用盐酸和H3BO3提取Ce元素时,体现盐酸的性质有______________,“滤渣Ⅰ”用饱和KCl溶液溶解时发生复分解反应,则“滤渣Ⅱ”主要成分为_________________________________________________(填化学式)。
(3)“滤液Ⅰ”中c(Ce3+)=0.1 mol·L-1,用氨水调pH的范围是__________,“滤液Ⅱ”中加入NH4HCO3反应的离子方程式为________________________________________,若Ce2(CO3)3经充分焙烧质量减少5.8 t,则获得CeO2的质量为__________t。
(4)用过量铝粉还原CeO2即可得Ce,反应的化学方程式为________________________,铝粉必须过量的原因是_________________
____________________________。
解析:氟碳铈矿在空气中焙烧,Ce(Ⅲ)在空气中被氧化为Ce(Ⅳ),Fe(Ⅱ)被氧化为Fe(Ⅲ),用盐酸和H3BO3的混合液浸取,Ce(Ⅳ)被还原,过滤得到滤渣Ⅰ,主要成分是难溶于水的Ce(BF4)3,Fe3+进入滤液Ⅰ;滤渣Ⅰ用饱和KCl溶液溶解时发生复分解反应,生成KBF4和CeCl3溶液,滤渣Ⅱ是KBF4;向滤液Ⅱ(含Ce3+的溶液)中再加入碳酸氢铵使Ce3+沉淀为Ce2(CO3)3,最后焙烧生成CeO2,再经还原得到Ce。
谢
谢
观
看
第5讲 无机化学工艺流程解题策略(综合应用课)
该题型以工艺流程图的形式再现实际生产的关键环节,情境真实而富有意义,旨在引导学生学以致用,解决生产、生活中的实际问题,有利于培养学生的科学精神和社会责任感。考查的知识多为产物的判断,陌生化学方程式、离子方程式或电极反应式的书写,温度控制在一定范围的原因分析,溶度积常数的有关计算等。工艺流程题是高考的热点题型,综合性强,难度较大,是高考试卷中的拉分题目之一。
1.(2022·全国甲卷)硫酸锌(ZnSO4)是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。硫酸锌可由菱锌矿制备。菱锌矿的主要成分为ZnCO3,杂质为SiO2以及Ca、Mg、Fe、Cu等的化合物。其制备流程如下:
离子 Fe3+ Zn2+ Cu2+ Fe2+ Mg2+
Ksp 4.0×10-38 6.7×10-17 2.2×10-20 8.0×10-16 1.8×10-11
本题中所涉及离子的氢氧化物溶度积常数如下表:
(3)加入物质X调溶液pH=5,最适宜使用的X是________(填标号)。
A.NH3·H2O B.Ca(OH)2 C.NaOH
滤渣①的主要成分是__________、__________、__________。
(4)向80~90 ℃的滤液①中分批加入适量KMnO4溶液充分反应后过滤,滤渣②中有MnO2,该步反应的离子方程式为______________________________
_____________________________________________________________。
(5)滤液②中加入锌粉的目的是___________________________________
___________________________________________________________。
(6)滤渣④与浓H2SO4反应可以释放HF并循环利用,同时得到的副产物是__________、__________。
(3)NH3·H2O易分解产生NH3污染空气,且经济成本较高,故A不适宜;Ca(OH)2不会引入新的杂质,且成本较低,故B适宜;NaOH会引入杂质Na+,且成本较高,C不适宜;当沉淀完全时(离子浓度小于10-5mol·L-1),结合表格Ksp计算各离子完全沉淀时pH<5的只有Fe3+,故滤渣①中有Fe(OH)3,又CaSO4是微溶物,SiO2不溶于酸,故滤渣①的主要成分是Fe(OH)3、CaSO4、SiO2;
(4)向80~90 ℃滤液①中加入KMnO4溶液,可氧化Fe2+,得到Fe(OH)3和MnO2的滤渣②,反应的离子方程式为3Fe2++MnO+7H2O===3Fe(OH)3↓+MnO2↓+5H+;
(5)滤液②中加入锌粉,发生反应Zn+Cu2+===Zn2++Cu,故加入锌粉的目的为除去Cu2+;(6)由分析,滤渣④为CaF2、MgF2,与浓硫酸反应可得到HF,同时得到的副产物为CaSO4、MgSO4。
2.(2022·广东等级考)稀土(RE)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
已知:月桂酸(C11H23COOH)熔点为44 ℃;月桂酸和(C11H23COO)3RE均难溶于水。该工艺条件下,稀土离子保持+3价不变;(C11H23COO)2Mg的Ksp=1.8×10-8,Al(OH)3开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀时的pH 8.8 1.5 3.6 6.2~7.4
沉淀完全时的pH / 3.2 4.7 /
(1)“氧化调pH”中,化合价有变化的金属离子是________。
(2)“过滤1”前,用NaOH溶液调pH至________的范围内,该过程中Al3+发生反应的离子方程式为__________________________________________。
(3)“过滤2”后,滤饼中检测不到Mg元素,滤液2中Mg2+浓度为2.7 g·L-1。为尽可能多地提取RE3+,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中c(C11H23COO-)低于______ mol·L-1(保留两位有效数字)。
(4)①“加热搅拌”有利于加快RE3+溶出、提高产率,其原因是______________________________________________________________。
②“操作X”的过程为:先________,再固液分离。
(5)该工艺中,可再生循环利用的物质有________(写化学式)。
(6)稀土元素钇(Y)可用于制备高活性的合金类催化剂Pt3Y。
①还原YCl3和PtCl4熔融盐制备Pt3Y时,生成1 mol Pt3Y转移________ mol电子。
②Pt3Y/C用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化O2的还原,发生的电极反应为__________________________________________。
(4)①“加热搅拌”有利于加快RE3+溶出、提高产率,其原因是加热搅拌可加快反应速率;
② “操作X”的结果是分离出月桂酸,由信息可知,月桂酸(C11H23COOH)熔点为44 ℃,故“操作X”的过程为:先冷却结晶,再固液分离;
(5)由分析可知,该工艺中,可再生循环利用的物质有MgSO4;
(6)①YCl3中Y为+3价,PtCl4中Pt为+4价,而Pt3Y中金属均为0价,所以还原YCl3和PtCl4熔融盐制备Pt3Y时,生成1 mol Pt3Y转移15 mol电子;
②碱性溶液中,氢氧燃料电池正极发生还原反应,发生的电极反应为O2+4e-+2H2O===4OH-。
答案:(1)Fe2+
(2)4.7≤pH<6.2
Al3++3OH-===Al(OH)3↓
(3)4.0×10-4
(4)①加热搅拌可加快反应速率 ②冷却结晶
(5)MgSO4
(6)①15 ②O2+4e-+2H2O===4OH-
1.试题呈现形式
2.准确识图析图
化工流程题的考点主要从以下6点设置 基本操作 除杂、分离、检验、洗涤、干燥等实验操作的步骤描述;加入某些试剂或某个操作步骤的目的描述
物质的分 离与提纯 通过调节pH使溶液中的金属离子沉淀达到分离除杂的目的,据此选择需要加入的化学试剂;加入某种物质使难溶物转化为更难溶的物质后,通过过滤除去等
化学反应速 率与化学平衡 理论的运用 例如,研磨使反应物颗粒变小,增大反应物间的接触面积,从而增大反应速率,提高原料利用率;升高温度能增大反应速率,使吸热反应平衡正向移动等
3.常见考查角度
化学方程式 或离子方程 式的书写 根据流程图及设问中的信息找出反应物和生成物,书写指定的化学方程式或离子方程式
环境与绿色 化学思想 流程中物质的转化和循环、资源的回收和利用、“三废”的来源、对环境的影响及处理措施等
化学计算 联系原料纯度、转化率、损失率、产物产率等计算产品质量;联系溶液配制、滴定操作测定样品中某元素含量或产品纯度;联系溶度积常数,计算溶液中某离子浓度或完全沉淀时的pH等
续表
4.掌握解题流程
(1)审题干——明确原料成分和目的要求
看箭头 进入的是原料(即反应物);出去的是生成物(包括主产物和副产物)
看三线 主线主产品、分支副产品、回头为循环
找信息 明确反应条件控制和分离提纯方法
关注所加物质的可能作用 参与反应、提供反应氛围、满足定量要求
(2)审流程——明确各步转化原理和目的
不要 答非所问 要看清题目要求,按要求答题,防止答非所问
规范答题 回答问题要准确全面,注意语言表达的规范性,特别是化学用语的书写与表示要准确、规范
(3)审问题——明确答什么
[典例] (2021·湖南等级考)Ce2(CO3)3可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以CePO4形式存在,还含有SiO2、Al2O3、Fe2O3、CaF2等物质。以独居石为原料制备Ce2(CO3)3·nH2O的工艺流程如下:
回答下列问题:
(1)铈的某种核素含有58个质子和80个中子,该核素的符号为________。
(2)为提高“水浸”效率,可采取的措施有______________________(至少写两条)。
(3)滤渣Ⅲ的主要成分是________(填化学式)。
(4)加入絮凝剂的目的是______________________________________。
(5)“沉铈”过程中,生成Ce2(CO3)3·nH2O的离子方程式为________________________,常温下加入的NH4HCO3溶液呈______(填“酸性”“碱性”或“中性”)(已知:NH3·H2O的Kb=1.75×10-5,H2CO3的Ka1=4.4×10-7,Ka2=4.7×10-11)。
(6)滤渣Ⅱ的主要成分为FePO4,在高温条件下,Li2CO3、葡萄糖(C6H12O6)和FePO4可制备电极材料LiFePO4,同时生成CO和H2O,该反应的化学方程式为___________________________________________________。
[解题流程]
第一步:审题干→明目的
原料成分:独居石,主要成分以CePO4形式存在,还含有SiO2、Al2O3、Fe2O3、CaF2等杂质。
工艺目的:制备Ce2(CO3)3·nH2O。
第二步:审流程→理关系
焙烧浓硫酸和独居石的混合物,CePO4转化为Ce2(SO4)3和H3PO4,SiO2与硫酸不反应,Al2O3转化为Al2(SO4)3,Fe2O3转化为Fe2(SO4)3,CaF2转化为CaSO4和HF,酸性废气含HF
溶于水的物质为Ce2(SO4)3和H3PO4,Al2(SO4)3,Fe2(SO4)3,水浸的目的是除去滤渣Ⅰ(SiO2和CaSO4)
加入FeCl3溶液除磷,是为了把H3PO4转化为FePO4
除去
加入MgO,调节pH,是为了让铝离子、铁离子转化为沉淀除去,加入絮凝剂的目的是使悬浮粒子聚集变大,加快粒子聚沉速度,更快地形成沉淀
加碳酸氢铵沉铈是把Ce3+沉淀得到Ce2(CO3)3·nH2O
续表
碱性
题型(一) 以物质制备为主体的化工流程
1.工艺流程中的常见专业术语
释义
研磨、雾化 将块状或颗粒状的物质磨成粉末或将液体分散成微小液滴,增大反应物接触面积,以加快反应速率或使反应更充分
灼烧 (煅烧) 使固体在高温下分解或改变结构、使杂质高温氧化、分解等。如煅烧石灰石、高岭土、硫铁矿
浸取 向固体中加入适当溶剂或溶液,使其中可溶性的物质溶解,包括水浸取、酸溶、碱溶、醇溶等
酸浸 在酸性溶液中使可溶性金属离子进入溶液,不溶物通过过滤除去的过程
浸出率 固体溶解后,离子在溶液中的含量的多少
滴定 定量测定,可用于某种未知浓度物质的物质的量浓度的测定
酸作用 溶解、去氧化物(膜)、抑制某些金属离子的水解、除去杂质离子等
碱作用 去油污、去铝片氧化膜,溶解铝、二氧化硅、调节pH、促进水解(沉淀)
续表
控制体 系的环 境氛围 ①需要在酸性气流中干燥FeCl3、AlCl3、MgCl2等含水晶体,抑制水解并带走因分解产生的水汽。
②营造还原性氛围,防止还原性物质被氧化。如加入铁粉防止Fe2+被氧化。
③加入氧化剂进行氧化。如加入绿色氧化剂H2O2将Fe2+氧化为Fe3+,绿色氧化剂H2O2的优点:不引入新杂质,对环境无污染
2.物质制备过程中的条件控制
控制反 应温度 ①加热:加速溶解、加快反应速率或促使平衡向某个方向移动(如促进水解生成沉淀)。
②降温:防止某物质在某温度时会溶解或分解,或促使平衡向某个方向移动。
③控制温度在一定范围内:综合多方面因素考虑。如使反应速率不至于太慢、抑制或促进平衡移动、防止反应物分解、防止副反应发生、使催化剂的催化活性最高等。
④如题目中出现了包括产物在内的各种物质的溶解度信息,则要根据它们溶解度随温度升高而改变的情况,寻找合适的结晶分离方法
续表
控制 溶液的pH ①调节溶液的酸碱性,抑制水解(或使其中某些金属离子形成氢氧化物沉淀)。
②“酸作用”还可除去氧化物(膜)。
③“碱作用”还可除去油污,除去铝片氧化膜,溶解铝、二氧化硅等。
④特定的氧化还原反应需要的酸性条件(或碱性条件)
外界条件 对可逆反 应的控制 ①使催化剂的活性达到最高:如工业合成氨或SO2的催化氧化反应,选择的温度是500 ℃左右,原因之一就是该温度下可使催化剂的活性达到最高。
②对于一些工艺来说,降温或减压都可以减少能源成本,降低对设备的要求,达到绿色化学的目的
续表
[典例] (2022·辽宁等级考)某工厂采用辉铋矿(主要成分为Bi2S3,含有FeS2、SiO2杂质)与软锰矿(主要成分为MnO2)联合焙烧法制备BiOCl和MnSO4,工艺流程如下:
已知:①焙烧时过量的MnO2分解为Mn2O3,FeS2转变为Fe2O3;
②金属活动性:Fe>(H)>Bi>Cu;
③相关金属离子形成氢氧化物的pH范围如下:
开始沉淀pH 完全沉淀pH
Fe2+ 6.5 8.3
Fe3+ 1.6 2.8
Mn2+ 8.1 10.1
回答下列问题:
(1)为提高焙烧效率,可采取的措施为__________。
a.进一步粉碎矿石
b.鼓入适当过量的空气
c.降低焙烧温度
(2)Bi2S3在空气中单独焙烧生成Bi2O3,反应的化学方程式为______________________________________________________。
(3)“酸浸”中过量浓盐酸的作用为:
①充分浸出Bi3+和Mn2+;②______________。
(4)滤渣的主要成分为__________(填化学式)。
(5)生成气体A的离子方程式为_________________________________。
(6)加入金属Bi的目的是________________。
[解析] 联合焙烧:由已知信息①和第(2)问题干可知,发生转化:Bi2S3―→Bi2O3+SO2、FeS2―→Fe2O3+SO2、MnO2―→Mn2O3+MnSO4,故联合焙烧后得到Bi2O3、Fe2O3、Mn2O3、MnSO4和SiO2;
水浸:MnSO4进入滤液,滤渣为Bi2O3、Fe2O3、Mn2O3和SiO2;
酸浸:加入过量浓盐酸后,Bi2O3和Fe2O3发生转化:Bi2O3―→Bi3+、Fe2O3―→Fe3+,因Mn2O3有氧化性,会与浓盐酸发生氧化还原反应:Mn2O3+6H++2Cl-===2Mn2++Cl2↑+3H2O,气体A为Cl2,滤渣主要为不溶于浓盐酸的SiO2,滤液中金属离子为Bi3+、Fe3+、Mn2+;
第(4)(5)问转化:由已知信息②知,Fe的金属活动性强于Bi,且调pH=2.6时Mn2+和Fe2+进入滤液,可知加入金属Bi的目的是将Fe3+还原为Fe2+。(1)联合焙烧时,进一步粉碎矿石,可以增大矿石与空气的接触面积,能够提高焙烧效率,a符合题意;鼓入适当过量的空气有利于矿石充分反应,b符合题意;降低焙烧温度,反应速率减慢,不利于提高焙烧效率,c不符合题意;
[对点训练]
(2023·扬州模拟)工业以炼钢污泥(主要成分为铁的氧化物,还含有CaO、SiO2、C等杂质)为原料制备脱硫剂活性Fe2O3·H2O,并用该脱硫剂处理沼气中H2S的流程如图:
(2)“除杂”:若使还原后的滤液中Ca2+完全沉淀(离子浓度小于10-6mol·
L-1),则滤液中c(F-)需大于__________;若溶液的pH偏低,将会导致CaF2沉淀不完全,其原因是___________________________________
[Ksp(CaF2)=1.44×10-10,Ka(HF)=3.53×10-4]。
(3)“沉铁”:生成FeCO3沉淀的离子方程式为_______________________
____________________________________________________________。
(4)“脱硫、再生”:活性Fe2O3·H2O是一种固体脱硫剂(无水Fe2O3无脱硫作用),其原理是将废气中的含硫化合物化学吸附到脱硫剂的孔隙中,发生反应改变其化学组成。当脱硫剂达到饱和后,
即不再具有脱硫能力,需要对其进行再生。利用活性Fe2O3·H2O脱除沼气中的H2S可转化成Fe2S3·H2O,其脱除及常温下再生的原理如图所示。
①“脱硫”反应的化学方程式为________________________________
_______________________________________________________________。
②工业上要求脱除及再生整个过程温度不能超过90 ℃,原因是_____________________________________________________________;多次“再生”后,脱硫剂的活性不断下降,脱硫效果明显变差的原因可能是____________________________________________________________。
(4)①根据反应原理可知在“脱硫”反应中,Fe2O3·H2O和H2S反应产生Fe2S3·H2O和H2O;②工业上要求脱除及再生整个过程温度不能超过90 ℃,这是由于温度超过90 ℃,Fe2O3·H2O和Fe2S3·H2O均会发生分解,失去结晶水,失去脱硫作用;多次“再生”后,脱硫剂的活性不断下降,脱硫效果明显变差的原因可能是由于多次“再生”后,脱硫剂表面的大部分孔隙被S或其他物质覆盖,使得脱硫剂的活性下降。
题型(二) 以物质分离提纯为主体的化工流程
1.常用的分离方法
过滤 分离难溶物和易溶物,根据特殊需要采用趁热过滤或者抽滤等方法
萃取和 分液 利用溶质在互不相溶的溶剂里的溶解度不同提取分离物质,如用CCl4或苯萃取溴水中的溴
蒸发结晶 提取溶解度随温度变化不大的溶质,如NaCl
冷却结晶 提取溶解度随温度变化较大的溶质、易水解的溶质或结晶水合物,如KNO3、FeCl3、CuCl2、CuSO4·5H2O、FeSO4·7H2O等
蒸馏 或分馏 分离沸点不同且互溶的液体混合物,如分离乙醇和甘油
冷却法 利用气体液化的特点分离气体,如合成氨工业采用冷却法分离平衡混合气体中的氨气
水溶法 除去可溶性杂质
酸溶法 除去碱性杂质
碱溶法 除去酸性杂质
氧化剂或还原剂法 除去还原性或氧化性杂质
加热灼烧法 除去受热易分解或易挥发的杂质
调节溶液的pH法 如除去酸性Cu2+溶液中的Fe3+等
2.常用的提纯方法
[注意] 物质分离提纯的原则
①不增:不引入新的杂质。
②不减:不减少被提纯的物质。
③易分离:被提纯物质与杂质易于分离。
④易复原:被提纯的物质易恢复原来的组成、状态。
[典例] (2022·全国乙卷)废旧铅蓄电池的铅膏中主要含有PbSO4、PbO2、PbO和Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过如图流程实现铅的回收。
难溶电解质 PbSO4 PbCO3 BaSO4 BaCO3
Ksp 2.5×10-8 7.4×10-14 1.1×10-10 2.6×10-9
一些难溶电解质的溶度积常数如下表:
金属氢氧化物 Fe(OH)3 Fe(OH)2 Al(OH)3 Pb(OH)2
开始沉淀的pH 2.3 6.8 3.5 7.2
完全沉淀的pH 3.2 8.3 4.6 9.1
一定条件下,一些金属氢氧化物沉淀时的pH如下表:
回答下列问题:
(1)在“脱硫”中PbSO4转化反应的离子方程式为__________________,用沉淀溶解平衡原理解释选择Na2CO3的原因__________________________
____________________________。
(2)在“脱硫”中,加入Na2CO3不能使铅膏中BaSO4完全转化,原因是
_________________________________________。
(3)在“酸浸”中,除加入醋酸(HAc),还要加入H2O2。
(ⅰ)能被H2O2氧化的离子是____________;
(ⅱ)H2O2促进了金属Pb在醋酸中转化为Pb(Ac)2,其化学方程式为
_______________________________________________________;
(ⅲ)H2O2也能使PbO2转化为Pb(Ac)2,H2O2的作用是_________________。
(4)“酸浸”后溶液的pH约为4.9,滤渣的主要成分是__________________。
(5)“沉铅”的滤液中,金属离子有______________。
[解析] (1)PbCO3的Ksp远小于PbSO4的Ksp,易发生生成PbCO3的沉淀转化,且进行较为彻底。
(2)BaCO3的Ksp大于BaSO4的Ksp,不易发生生成BaCO3的沉淀转化,即使发生程度也很小。
(3)(ⅰ)过氧化氢有氧化性,亚铁离子有还原性,会被过氧化氢氧化为铁离子。(ⅱ)过氧化氢与Pb、HAc发生氧化还原反应生成Pb(Ac)2和H2O,反应的化学方程式为Pb+H2O2+2HAc===Pb(Ac)2+2H2O。
(ⅲ)过氧化氢也能使PbO2转化为Pb(Ac)2,铅元素化合价由+4价降低到了+2价,PbO2是氧化剂,则过氧化氢是还原剂。
(4)酸浸后溶液的pH约为4.9,依据金属氢氧化物沉淀时的pH可知,滤渣主要成分为氢氧化铝、氢氧化铁。
(5)依据分析可知,加入碳酸钠不能使铅膏中的BaSO4完全转化,铁离子、铝离子转化成了氢氧化铁、氢氧化铝沉淀,铅转化成了氢氧化铅,最终变成了氧化铅,因此沉铅的滤液中,金属离子有Ba2+和加入碳酸钠、氢氧化钠时引入的Na+。
[对点训练]
(2023·济南模拟)铈可用作优良的环保材料,现以氟碳铈矿(CeFCO3,含Fe2O3、FeO等杂质)为原料制备铈,其工艺流程如图所示:
回答下列问题:
(1)粉碎后“焙烧”时,氧化数据如表所示:
空气氧化法 氧化温度/ ℃ 氧化率/% 氧化时间/h
暴露空气中 450~500 88 14
对流空气氧化炉中 450~500 98 6
(2)用盐酸和H3BO3提取Ce元素时,体现盐酸的性质有______________,“滤渣Ⅰ”用饱和KCl溶液溶解时发生复分解反应,则“滤渣Ⅱ”主要成分为_________________________________________________(填化学式)。
(3)“滤液Ⅰ”中c(Ce3+)=0.1 mol·L-1,用氨水调pH的范围是__________,“滤液Ⅱ”中加入NH4HCO3反应的离子方程式为________________________________________,若Ce2(CO3)3经充分焙烧质量减少5.8 t,则获得CeO2的质量为__________t。
(4)用过量铝粉还原CeO2即可得Ce,反应的化学方程式为________________________,铝粉必须过量的原因是_________________
____________________________。
解析:氟碳铈矿在空气中焙烧,Ce(Ⅲ)在空气中被氧化为Ce(Ⅳ),Fe(Ⅱ)被氧化为Fe(Ⅲ),用盐酸和H3BO3的混合液浸取,Ce(Ⅳ)被还原,过滤得到滤渣Ⅰ,主要成分是难溶于水的Ce(BF4)3,Fe3+进入滤液Ⅰ;滤渣Ⅰ用饱和KCl溶液溶解时发生复分解反应,生成KBF4和CeCl3溶液,滤渣Ⅱ是KBF4;向滤液Ⅱ(含Ce3+的溶液)中再加入碳酸氢铵使Ce3+沉淀为Ce2(CO3)3,最后焙烧生成CeO2,再经还原得到Ce。
谢
谢
观
看
同课章节目录
