3.3 离子晶体过渡晶体与混合型晶体 第2课时课件(27张)高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 3.3 离子晶体过渡晶体与混合型晶体 第2课时课件(27张)高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-18 00:00:00 | ||
图片预览







文档简介
(共27张PPT)
第2课时 离子晶体 过渡晶体与混合型晶体
第三节 金属晶体与离子晶体
【学习目标】
1.掌握离子晶体的结构特点。
2.能根据离子晶体的结构特点解释其物理性质。
【问题导学】阅读课本87-89页的内容, 思考回答下列问题:
1.什么是离子晶体?
2.如何判断离子晶体?
3.离子晶体中只有离子微粒构成的吗?
萤石
重晶石
烧碱
CaF2
BaSO4
NaOH
以上这些晶体属于哪种类型的晶体?为什么?
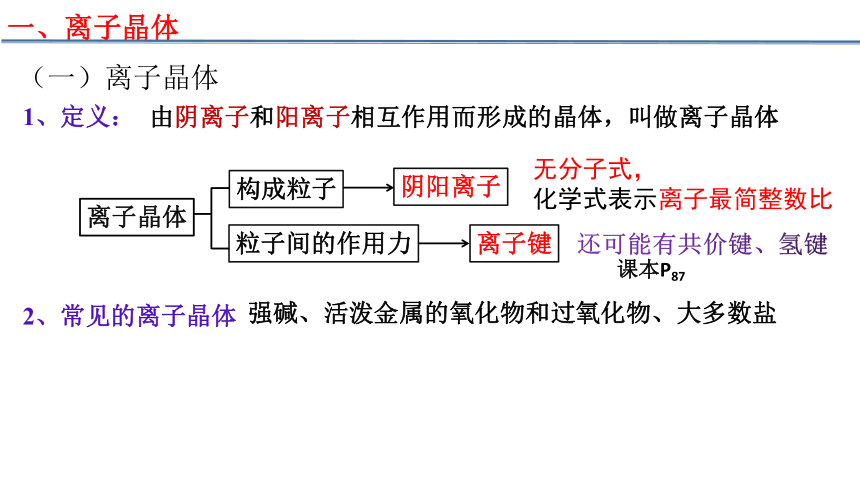
(一)离子晶体
强碱、活泼金属的氧化物和过氧化物、大多数盐
1、定义:
2、常见的离子晶体
构成粒子
离子晶体
阴阳离子
粒子间的作用力
离子键
一、离子晶体
无分子式,
化学式表示离子最简整数比
还可能有共价键、氢键
由阴离子和阳离子相互作用而形成的晶体,叫做离子晶体
课本P87
3、离子晶体的性质
熔沸点较高,硬度较大而且脆,难挥发难压缩。
一般易溶于水,而难溶于非极性溶剂
固态不导电,水溶液或者熔融状态下能导电
离子晶体物理性质需要克服离子键,离子键比分子间作用力强得多
一般情况下,熔点:共价晶体>离子晶体>分子晶体
(一)离子晶体
练习1:判断正误
1.MgF2晶体中存在共价键和离子键
2.任何晶体中,若含有阳离子也一定含有阴离子
3.离子晶体中一定存在离子键
4.离子晶体的结构中不可能存在电中性的分子
×
×
×
√
阴阳离子间通过静电作用所形成的强烈的相互作用叫做离子键。
成键粒子
键的本质
静电引力和斥力
离子键没有方向性和饱和性。
一般说来,阴、阳离子的电荷数越多,离子半径越小,离子键越强,离子晶体的熔、沸点越高,硬度越大
(二)离子键
练习2:
分析NaF、MgF2、AlF3的熔点大小。
离子半径越小,离子电荷数越多,离子键越强,离子晶体熔点越高。
Na+、Mg2+、Al3+离子的电荷数逐渐增多,离子半径逐渐减小,与F-之间的离子键逐渐增强,所以熔点: NaF【判断题】离子晶体的熔点:
√
分析下表中离子化合物的数据,能得出什么结论?
结论:与金属晶体类似,离子晶体由于离子键强弱不同,熔、沸点差异较大。引入有机基团可降低离子化合物的熔点。(课本P88)
【思考讨论】P88
NaCl晶胞
(2)配位数
一种离子周围最邻近的带相反电荷的离子数目
每个Na+周围与之等距且距离最近的Cl-有____个。
6
它们所围成的空间几何构是 。
正八面体
(三)常见离子晶体的结构
(1)每个晶胞含钠离子、氯离子的个数:
Na+:12×+1=4
Cl-:8×+6×=4
NaCl晶胞
(3)每个Na+周围与之等距且距离最近的Cl-有___个,Na+有___个。
每个Cl-周围与之等距且距离最近的Na+有____个,Cl-有____个。
Cl-
Na+
6
12
6
12
(三)常见离子晶体的结构
CsCl晶胞
(三)常见离子晶体的结构
(2)阳离子配位数 ,
它们所围成的空间几何构型
是 。
1
(1)每个晶胞中,Cl—有 个,
Cs +有 个
阴离子配位数 。
8
8
1
正六面体
Cl-
Cs+
CsCl晶胞
(3)每个Cs+周围与之等距且距离最近的Cl-有___个,Cs+有___个。
每个Cl-周围与之等距且距离最近的Cs+有____个,Cl-有____个。
8
6
8
6
(三)常见离子晶体的结构
(四)影响离子晶体配位数的因素
①几何因素:晶体中正负离子的半径比
②电荷因素:正负离子的电荷比
③键性因素:离子键的纯粹程度
阴离子配位数
(2)阳离子配位数
4
8
萤石(CaF2)晶胞结构如图所示,晶胞边长为a cm,
(1)小黑球代表的离子: 。
Ca2+
(3)每个Ca2+周围最近且等距离的Ca2+有 个
12
【习题巩固】
技巧小结: 晶体熔沸点高低的比较方法
不同类型晶体: 1、常温下的状态熔沸点:固体>液体>气体
2、一般情况下:原子晶体>离子晶体>分子晶体
(1)原子晶体:根据共价键强弱比较
结构相似时,原子半径越小,键长越小、键能越大,熔沸点越高
同种类型晶体
(2)金属晶体:根据金属键强弱比较
原子半径越小,价电子数越高,金属键就越强,熔沸点就越高
注意:合金的熔沸点低于其成分金属
(3)离子晶体:根据离子键强弱比较
结构相似时,离子半径越小,离子电荷越高,离子键就越强,熔沸点就越高
(4)分子晶体:根据分子间作用力强弱比较
①先看有无氢键:有分子间氢键的作用力强,熔沸点高,分子内氢键熔沸点降低(沸点:对羟基苯甲醛熔>邻羟基苯甲醛)
②组成和结构相似,相对分子质量越大,范德华力越强,熔沸点越高。
③相对分子质量相同或相近看分子极性越大,范德华力越强,熔沸点越高。
④烷烃的同分异构体,支链越多,沸点越低
离子晶体 共价晶体 分子晶体 金属晶体
存在 微粒
微粒间作用 离子键 共价键 分子间作用力 金属键
主要 性质 质地硬,熔沸点很高; 不溶于大多数溶剂;导电性差, 硬度小,溶沸点低; 水溶液能够导电 金属光泽,是电和热的良导体,熔沸点高或低
实例 食盐晶体 金刚石 NH3、HCl 镁、铝
【四种典型晶体的比较】
阴阳离子
原子
分子
金属离子、自由电子
硬而脆,熔沸点较高,难挥发难压缩。
一般易溶于水,而难溶于非极性溶剂
固态不导电,水溶液或者熔融状态下能导电
化学键既不是纯粹的离子键,也不是纯粹的共价键。
晶体是离子晶体和共价晶体之间的过渡晶体。
偏向离子晶体的过渡晶体当做离子晶体处理,如Na2O;
偏向共价晶体的过渡晶体当做共价晶体处理,如Al2O3、SiO2。
二、过渡晶体
分析下表中数据,如何理解化学键的组成?如何理解晶体类型?
推测P2O5、SO3、Cl2O7的化学键中离子键成分的百分数的变化趋势?结合元素周期律解释这一变化趋势产生的原因?
第三周期元素从左到右,电负性逐渐增强,与氧元素的电负性的差值逐渐减小,离子键成分逐渐减少,共价键成分逐渐增多。共价键不再贯穿整个晶体,而是局限于晶体微观空间的一个个分子中,由此推断P2O5、SO3、Cl2O7为分子晶体。
纯粹典型晶体是不多的,大多数晶体都是它们之间的过渡晶体。
离子晶体
共价晶体
分子晶体
金刚石熔点高、质地坚硬、不能导电。而石墨熔点高,但质地
较软、具有较好的导电性。请根据金刚石和石墨的结构模型分析
它们性质异同的原因?
三、混合型晶体
石墨晶体二维平面结构
sp2杂化
平面六元并环结构
sp3杂化
金刚石晶体结构
石墨的层状结构
层与层之间靠
范德华力维系
层与层之间易于断开而滑动,石墨质地较软,常用作润滑剂。
观察石墨晶体的结构,图中数据的意义是什么?决定了石墨的什么性质?
碳原子的
核间距
层间
距离
C-C共价键的键长很短,键能很大,石墨的熔点很高。
石墨结构中未参与杂化p轨道
未参与杂化p轨道,且有一个电子。
p轨道中的电子能在整个碳原子平面运动,因此石墨有类似金属晶体的导电性,且导电性只能沿石墨平面的方向。
层与层距离较远。
石墨晶体
{
分子晶体
金属晶体
混合型晶体
由石墨晶体结构以及物理性质特点,判断石墨晶体
的类型?
共价晶体
【当堂检测】
1.下列叙述正确的是( )
A.离子化合物受热熔化破坏化学键,吸收热量,属于化学变化
B.非金属原子间不可能形成离子键
C.金属元素与非金属元素化合时,一定形成离子键
D.某元素的原子最外层只有一个电子,它跟卤素结合时形成的化学键不一定是离子键
D
C
C
4.下列说法正确的是( )
A.MgF2晶体中存在共价键和离子键
B.任何晶体中,若含有阳离子也一定含有阴离子
C.离子晶体中一定存在离子键
D.离子晶体的结构中不可能存在电中性的分子
C
5.请回答下列问题:
(1)氯酸钾熔化时,粒子间克服了 ;二氧化硅熔化时,粒子间克服了 ;碘升华时,粒子间克服了 。三种晶体的熔点由高到低的顺序是 。
(2)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子有 ,由非极性键形成的非极性分子有 ,能形成分子晶体的物质是 ,属于离子晶体的是 ,属于共价晶体的是 ,五种物质的熔点由高到低的顺序是 。
答案:(1)离子键 共价键 分子间作用力(或范德华力) 二氧化硅>氯酸钾>碘
(2)CO2 H2 H2、CO2、HF (NH4)2SO4 SiC SiC>(NH4)2SO4>HF>CO2>H2
第2课时 离子晶体 过渡晶体与混合型晶体
第三节 金属晶体与离子晶体
【学习目标】
1.掌握离子晶体的结构特点。
2.能根据离子晶体的结构特点解释其物理性质。
【问题导学】阅读课本87-89页的内容, 思考回答下列问题:
1.什么是离子晶体?
2.如何判断离子晶体?
3.离子晶体中只有离子微粒构成的吗?
萤石
重晶石
烧碱
CaF2
BaSO4
NaOH
以上这些晶体属于哪种类型的晶体?为什么?
(一)离子晶体
强碱、活泼金属的氧化物和过氧化物、大多数盐
1、定义:
2、常见的离子晶体
构成粒子
离子晶体
阴阳离子
粒子间的作用力
离子键
一、离子晶体
无分子式,
化学式表示离子最简整数比
还可能有共价键、氢键
由阴离子和阳离子相互作用而形成的晶体,叫做离子晶体
课本P87
3、离子晶体的性质
熔沸点较高,硬度较大而且脆,难挥发难压缩。
一般易溶于水,而难溶于非极性溶剂
固态不导电,水溶液或者熔融状态下能导电
离子晶体物理性质需要克服离子键,离子键比分子间作用力强得多
一般情况下,熔点:共价晶体>离子晶体>分子晶体
(一)离子晶体
练习1:判断正误
1.MgF2晶体中存在共价键和离子键
2.任何晶体中,若含有阳离子也一定含有阴离子
3.离子晶体中一定存在离子键
4.离子晶体的结构中不可能存在电中性的分子
×
×
×
√
阴阳离子间通过静电作用所形成的强烈的相互作用叫做离子键。
成键粒子
键的本质
静电引力和斥力
离子键没有方向性和饱和性。
一般说来,阴、阳离子的电荷数越多,离子半径越小,离子键越强,离子晶体的熔、沸点越高,硬度越大
(二)离子键
练习2:
分析NaF、MgF2、AlF3的熔点大小。
离子半径越小,离子电荷数越多,离子键越强,离子晶体熔点越高。
Na+、Mg2+、Al3+离子的电荷数逐渐增多,离子半径逐渐减小,与F-之间的离子键逐渐增强,所以熔点: NaF
√
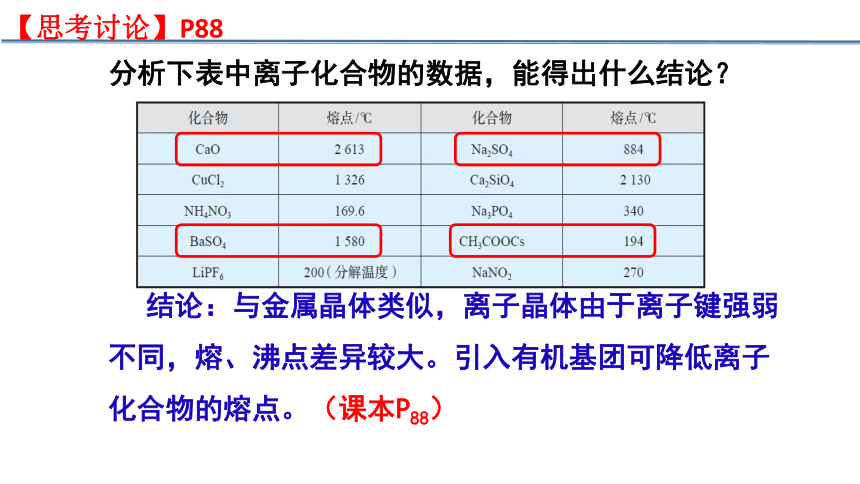
分析下表中离子化合物的数据,能得出什么结论?
结论:与金属晶体类似,离子晶体由于离子键强弱不同,熔、沸点差异较大。引入有机基团可降低离子化合物的熔点。(课本P88)
【思考讨论】P88
NaCl晶胞
(2)配位数
一种离子周围最邻近的带相反电荷的离子数目
每个Na+周围与之等距且距离最近的Cl-有____个。
6
它们所围成的空间几何构是 。
正八面体
(三)常见离子晶体的结构
(1)每个晶胞含钠离子、氯离子的个数:
Na+:12×+1=4
Cl-:8×+6×=4
NaCl晶胞
(3)每个Na+周围与之等距且距离最近的Cl-有___个,Na+有___个。
每个Cl-周围与之等距且距离最近的Na+有____个,Cl-有____个。
Cl-
Na+
6
12
6
12
(三)常见离子晶体的结构
CsCl晶胞
(三)常见离子晶体的结构
(2)阳离子配位数 ,
它们所围成的空间几何构型
是 。
1
(1)每个晶胞中,Cl—有 个,
Cs +有 个
阴离子配位数 。
8
8
1
正六面体
Cl-
Cs+
CsCl晶胞
(3)每个Cs+周围与之等距且距离最近的Cl-有___个,Cs+有___个。
每个Cl-周围与之等距且距离最近的Cs+有____个,Cl-有____个。
8
6
8
6
(三)常见离子晶体的结构
(四)影响离子晶体配位数的因素
①几何因素:晶体中正负离子的半径比
②电荷因素:正负离子的电荷比
③键性因素:离子键的纯粹程度
阴离子配位数
(2)阳离子配位数
4
8
萤石(CaF2)晶胞结构如图所示,晶胞边长为a cm,
(1)小黑球代表的离子: 。
Ca2+
(3)每个Ca2+周围最近且等距离的Ca2+有 个
12
【习题巩固】
技巧小结: 晶体熔沸点高低的比较方法
不同类型晶体: 1、常温下的状态熔沸点:固体>液体>气体
2、一般情况下:原子晶体>离子晶体>分子晶体
(1)原子晶体:根据共价键强弱比较
结构相似时,原子半径越小,键长越小、键能越大,熔沸点越高
同种类型晶体
(2)金属晶体:根据金属键强弱比较
原子半径越小,价电子数越高,金属键就越强,熔沸点就越高
注意:合金的熔沸点低于其成分金属
(3)离子晶体:根据离子键强弱比较
结构相似时,离子半径越小,离子电荷越高,离子键就越强,熔沸点就越高
(4)分子晶体:根据分子间作用力强弱比较
①先看有无氢键:有分子间氢键的作用力强,熔沸点高,分子内氢键熔沸点降低(沸点:对羟基苯甲醛熔>邻羟基苯甲醛)
②组成和结构相似,相对分子质量越大,范德华力越强,熔沸点越高。
③相对分子质量相同或相近看分子极性越大,范德华力越强,熔沸点越高。
④烷烃的同分异构体,支链越多,沸点越低
离子晶体 共价晶体 分子晶体 金属晶体
存在 微粒
微粒间作用 离子键 共价键 分子间作用力 金属键
主要 性质 质地硬,熔沸点很高; 不溶于大多数溶剂;导电性差, 硬度小,溶沸点低; 水溶液能够导电 金属光泽,是电和热的良导体,熔沸点高或低
实例 食盐晶体 金刚石 NH3、HCl 镁、铝
【四种典型晶体的比较】
阴阳离子
原子
分子
金属离子、自由电子
硬而脆,熔沸点较高,难挥发难压缩。
一般易溶于水,而难溶于非极性溶剂
固态不导电,水溶液或者熔融状态下能导电
化学键既不是纯粹的离子键,也不是纯粹的共价键。
晶体是离子晶体和共价晶体之间的过渡晶体。
偏向离子晶体的过渡晶体当做离子晶体处理,如Na2O;
偏向共价晶体的过渡晶体当做共价晶体处理,如Al2O3、SiO2。
二、过渡晶体
分析下表中数据,如何理解化学键的组成?如何理解晶体类型?
推测P2O5、SO3、Cl2O7的化学键中离子键成分的百分数的变化趋势?结合元素周期律解释这一变化趋势产生的原因?
第三周期元素从左到右,电负性逐渐增强,与氧元素的电负性的差值逐渐减小,离子键成分逐渐减少,共价键成分逐渐增多。共价键不再贯穿整个晶体,而是局限于晶体微观空间的一个个分子中,由此推断P2O5、SO3、Cl2O7为分子晶体。
纯粹典型晶体是不多的,大多数晶体都是它们之间的过渡晶体。
离子晶体
共价晶体
分子晶体
金刚石熔点高、质地坚硬、不能导电。而石墨熔点高,但质地
较软、具有较好的导电性。请根据金刚石和石墨的结构模型分析
它们性质异同的原因?
三、混合型晶体
石墨晶体二维平面结构
sp2杂化
平面六元并环结构
sp3杂化
金刚石晶体结构
石墨的层状结构
层与层之间靠
范德华力维系
层与层之间易于断开而滑动,石墨质地较软,常用作润滑剂。
观察石墨晶体的结构,图中数据的意义是什么?决定了石墨的什么性质?
碳原子的
核间距
层间
距离
C-C共价键的键长很短,键能很大,石墨的熔点很高。
石墨结构中未参与杂化p轨道
未参与杂化p轨道,且有一个电子。
p轨道中的电子能在整个碳原子平面运动,因此石墨有类似金属晶体的导电性,且导电性只能沿石墨平面的方向。
层与层距离较远。
石墨晶体
{
分子晶体
金属晶体
混合型晶体
由石墨晶体结构以及物理性质特点,判断石墨晶体
的类型?
共价晶体
【当堂检测】
1.下列叙述正确的是( )
A.离子化合物受热熔化破坏化学键,吸收热量,属于化学变化
B.非金属原子间不可能形成离子键
C.金属元素与非金属元素化合时,一定形成离子键
D.某元素的原子最外层只有一个电子,它跟卤素结合时形成的化学键不一定是离子键
D
C
C
4.下列说法正确的是( )
A.MgF2晶体中存在共价键和离子键
B.任何晶体中,若含有阳离子也一定含有阴离子
C.离子晶体中一定存在离子键
D.离子晶体的结构中不可能存在电中性的分子
C
5.请回答下列问题:
(1)氯酸钾熔化时,粒子间克服了 ;二氧化硅熔化时,粒子间克服了 ;碘升华时,粒子间克服了 。三种晶体的熔点由高到低的顺序是 。
(2)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子有 ,由非极性键形成的非极性分子有 ,能形成分子晶体的物质是 ,属于离子晶体的是 ,属于共价晶体的是 ,五种物质的熔点由高到低的顺序是 。
答案:(1)离子键 共价键 分子间作用力(或范德华力) 二氧化硅>氯酸钾>碘
(2)CO2 H2 H2、CO2、HF (NH4)2SO4 SiC SiC>(NH4)2SO4>HF>CO2>H2
