高中化学人教版必修第一册第17讲 物质的量浓度(PPT课件)(共31张PPT)
文档属性
| 名称 | 高中化学人教版必修第一册第17讲 物质的量浓度(PPT课件)(共31张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 17.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-18 11:21:58 | ||
图片预览




文档简介
(共17张PPT)
第17讲 物质的量浓度
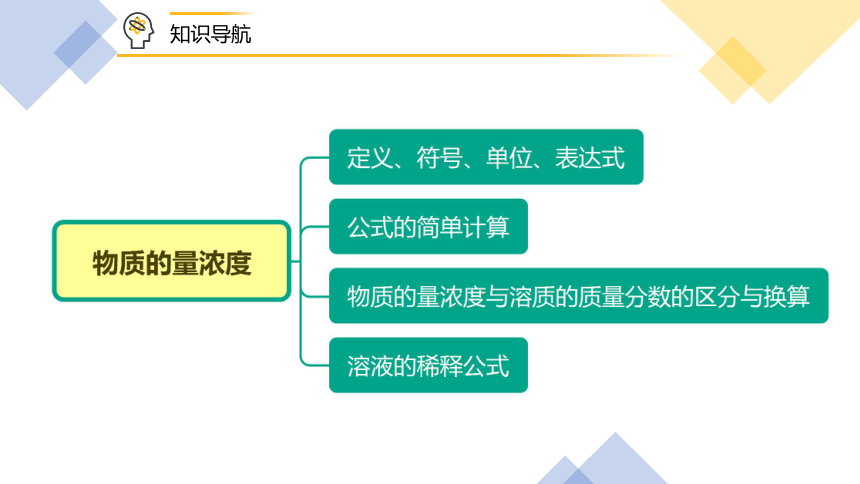
知识导航
一、物质的量浓度的基本概念
1. 定义:单位体积溶液里所含溶质B的物质的量,叫做B的物质的量浓度
2. 符号:_________________________;
3. 单位:_________________________;
4. 表达式:_______________________。
cB
cB =
mol/L(或 mol · L-1)
错误,体积指的是溶液的体积,而不是溶剂的体积。
将 1mol NaOH 溶于 1 L水中配成溶液,其物质的量浓度为1mol/L?
将 22.4L 的 HCl 溶于水配制成 1 L 溶液,所得溶液的浓度为1mol/L
温度和压强呢?用22.4 L/mol须在标况下
溶液是均一、稳定的,无论取多少体积的溶液,其物质的量浓度都不变的,溶质的物质的量才与所取体积有关。
从1 L 1mol/L 的 NaOH 溶液中取出 500 mL,浓度变为0.5 mol /L?
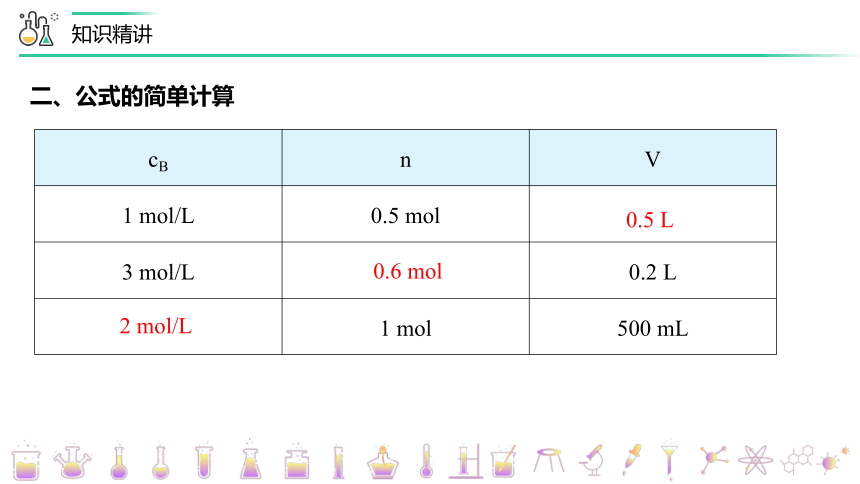
二、公式的简单计算
cB n V
1 mol/L 0.5 mol
3 mol/L 0.2 L
1 mol 500 mL
0.5 L
0.6 mol
2 mol/L
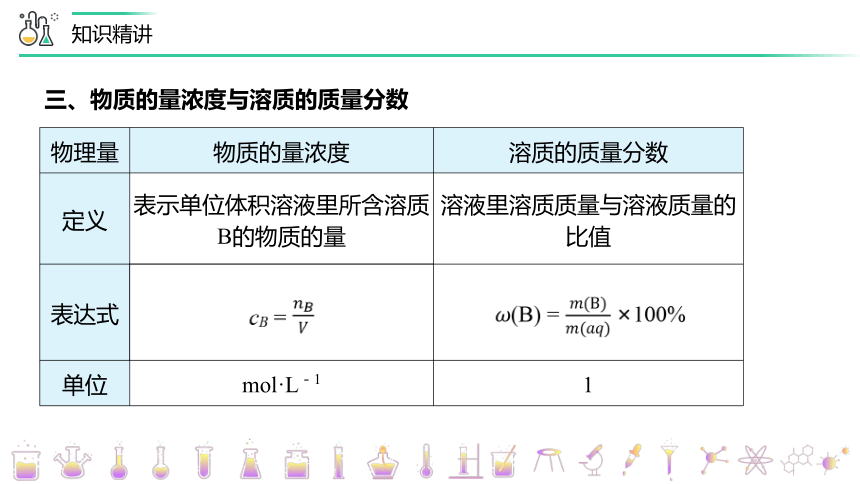
三、物质的量浓度与溶质的质量分数
物理量 物质的量浓度 溶质的质量分数
定义 表示单位体积溶液里所含溶质B的物质的量 溶液里溶质质量与溶液质量的比值
表达式 cB =
单位 mol·L-1 1
(B) = 100%
1000 ρ
M
(单位:mol / L )
物质的量浓度与质量分数的换算公式
举个例子
市售浓硫酸中溶质的质量分数为98%,密度为1.84g/cm3。则该浓硫酸中的物质的量浓度是多少?
质量分数为 36.5% 、密度为 1.18 g/cm3 的浓盐酸的物质的量浓度是多少?
18.4 mol/L
11.8 mol/L
四、溶液的稀释公式
溶液稀释时溶质的物质的量不变
c1V1 = c2V2
将5 mol·L-1 的盐酸10 mL稀释到200 mL,其物质的量浓度为多少?
5mol/L ×10mL= c2 ×200mL
c2 = 0.25 mol·L-1
知识点都掌握了吗?来做几道题检测下~
【例1】下列溶液中溶质的物质的量浓度为
1 mol·L—1的是
A.将40 g NaOH溶解于1 L水中配成NaOH溶液
B.常温常压下,将22.4 L HCl气体溶于水配成1 L的盐酸
C.将1 L 0.5 mol·L-1的盐酸加热浓缩为0.5 L
D.从1 000 mL 1 mol·L-1的NaCl溶液中取出100 mL的溶液
D
题型一:物质的量浓度的概念与基础计算
【变2-1】下列溶液中的c(Cl-)与550mL 1mol·L-1FeCl3,溶液中的c(Cl-)相等的是
A.150mL 1mol·L-1NaCl溶液 B.50mL 1mol·L-1NH4Cl溶液
C.150mL 3mol·L-1KCl溶液 D.100mL 1mol·L-1BaCl2溶液
C
题型一:物质的量浓度的概念与基础计算
【例3】已知某溶液中c(Na+)=0.2mol/L,c(Mg2+)=0.25 mol/L,c(Cl-)=0.4mol/L,如果溶液中还有SO42-,那么c(SO42-)应为
A.0.1 mol/L B.0.15molL C.0.3 mol/L D.0.5mol/L
B
题型二:溶液呈电中性的计算
【例4】将4 g NaOH溶于水配成250 mL溶液,则NaOH的物质的量浓度是______________;从中取出50 mL,则溶液中NaOH的物质的量浓度为__________;将取出的50 mL加水稀释到200 mL,稀释后NaOH的物质的量浓度为____________。
题型三:溶液的稀释/混合计算
【答案】0.4mol/L 0.4mol/L 0.1mol/L
【例5】实验室需要60 mL 1mol/L的硫酸溶液,现用市售98%浓硫酸(密度为1.84g/cm3)配制,用量筒取用的浓硫酸体积最适宜的是
A.5.4mL B.3.3mL C.13.5mL D. 27.2mL
A
题型四:物质的量浓度与质量分数的换算
知识导航
第17讲 物质的量浓度
知识导航
一、物质的量浓度的基本概念
1. 定义:单位体积溶液里所含溶质B的物质的量,叫做B的物质的量浓度
2. 符号:_________________________;
3. 单位:_________________________;
4. 表达式:_______________________。
cB
cB =
mol/L(或 mol · L-1)
错误,体积指的是溶液的体积,而不是溶剂的体积。
将 1mol NaOH 溶于 1 L水中配成溶液,其物质的量浓度为1mol/L?
将 22.4L 的 HCl 溶于水配制成 1 L 溶液,所得溶液的浓度为1mol/L
温度和压强呢?用22.4 L/mol须在标况下
溶液是均一、稳定的,无论取多少体积的溶液,其物质的量浓度都不变的,溶质的物质的量才与所取体积有关。
从1 L 1mol/L 的 NaOH 溶液中取出 500 mL,浓度变为0.5 mol /L?
二、公式的简单计算
cB n V
1 mol/L 0.5 mol
3 mol/L 0.2 L
1 mol 500 mL
0.5 L
0.6 mol
2 mol/L
三、物质的量浓度与溶质的质量分数
物理量 物质的量浓度 溶质的质量分数
定义 表示单位体积溶液里所含溶质B的物质的量 溶液里溶质质量与溶液质量的比值
表达式 cB =
单位 mol·L-1 1
(B) = 100%
1000 ρ
M
(单位:mol / L )
物质的量浓度与质量分数的换算公式
举个例子
市售浓硫酸中溶质的质量分数为98%,密度为1.84g/cm3。则该浓硫酸中的物质的量浓度是多少?
质量分数为 36.5% 、密度为 1.18 g/cm3 的浓盐酸的物质的量浓度是多少?
18.4 mol/L
11.8 mol/L
四、溶液的稀释公式
溶液稀释时溶质的物质的量不变
c1V1 = c2V2
将5 mol·L-1 的盐酸10 mL稀释到200 mL,其物质的量浓度为多少?
5mol/L ×10mL= c2 ×200mL
c2 = 0.25 mol·L-1
知识点都掌握了吗?来做几道题检测下~
【例1】下列溶液中溶质的物质的量浓度为
1 mol·L—1的是
A.将40 g NaOH溶解于1 L水中配成NaOH溶液
B.常温常压下,将22.4 L HCl气体溶于水配成1 L的盐酸
C.将1 L 0.5 mol·L-1的盐酸加热浓缩为0.5 L
D.从1 000 mL 1 mol·L-1的NaCl溶液中取出100 mL的溶液
D
题型一:物质的量浓度的概念与基础计算
【变2-1】下列溶液中的c(Cl-)与550mL 1mol·L-1FeCl3,溶液中的c(Cl-)相等的是
A.150mL 1mol·L-1NaCl溶液 B.50mL 1mol·L-1NH4Cl溶液
C.150mL 3mol·L-1KCl溶液 D.100mL 1mol·L-1BaCl2溶液
C
题型一:物质的量浓度的概念与基础计算
【例3】已知某溶液中c(Na+)=0.2mol/L,c(Mg2+)=0.25 mol/L,c(Cl-)=0.4mol/L,如果溶液中还有SO42-,那么c(SO42-)应为
A.0.1 mol/L B.0.15molL C.0.3 mol/L D.0.5mol/L
B
题型二:溶液呈电中性的计算
【例4】将4 g NaOH溶于水配成250 mL溶液,则NaOH的物质的量浓度是______________;从中取出50 mL,则溶液中NaOH的物质的量浓度为__________;将取出的50 mL加水稀释到200 mL,稀释后NaOH的物质的量浓度为____________。
题型三:溶液的稀释/混合计算
【答案】0.4mol/L 0.4mol/L 0.1mol/L
【例5】实验室需要60 mL 1mol/L的硫酸溶液,现用市售98%浓硫酸(密度为1.84g/cm3)配制,用量筒取用的浓硫酸体积最适宜的是
A.5.4mL B.3.3mL C.13.5mL D. 27.2mL
A
题型四:物质的量浓度与质量分数的换算
知识导航
