【核心素养目标】人教版(2019)高中化学 选择性必修1 3.1 电离平衡(第1课时 弱电解质的电离平衡)
文档属性
| 名称 | 【核心素养目标】人教版(2019)高中化学 选择性必修1 3.1 电离平衡(第1课时 弱电解质的电离平衡) |  | |
| 格式 | pptx | ||
| 文件大小 | 22.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-18 10:30:44 | ||
图片预览





文档简介
(共23张PPT)
第一节 电离平衡
第1课时 弱电解质的电离平衡
人教版选择性必修1
学习目标
1.结合真实情境中的应用实例,认识弱电解质在水溶液中存在电离平衡。
2.能用化学用语正确表示水溶液中的电离平衡。
学习目标
1.能从宏观的物质类别判断电解质的强弱,培养学生“宏观辨识与微观探析”的学科素养。
2.通过认识弱电解质的电离有一定限度,是可以调控的,能运用电离平衡原理解决简单的实际问题,培养学生“变化观念与平衡思想”“科学态度与社会责任”学科素养。
3.通过建立电离平衡的认知模型,并能运用该模型解释化学现象。培养学生“证据推理与模型认知”的学科素养。
素养目标
情境引入
盐酸和醋酸是生活中经常用到的酸,盐酸常用于卫生洁具的清洁。
醋酸的腐蚀性比盐酸的小,比较安全,为什么不用醋酸代替盐酸呢?
思考:
洁厕灵的主要成份是盐酸
教学过程
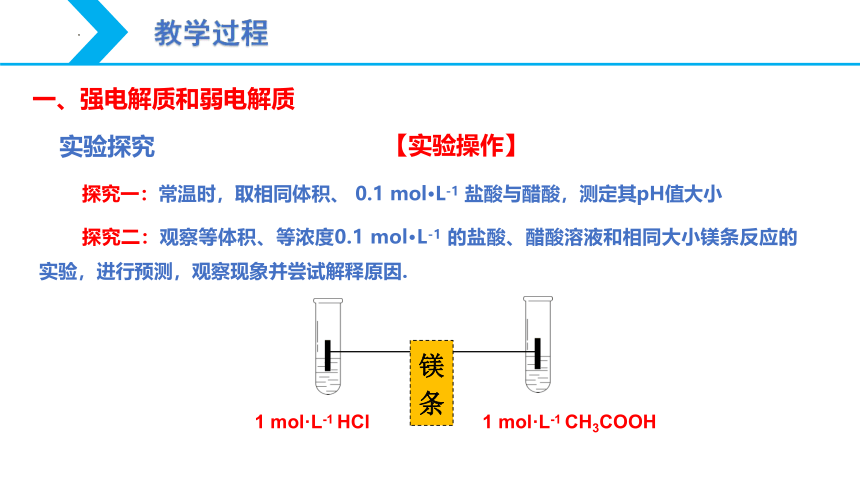
实验探究
探究一:常温时,取相同体积、 0.1 mol·L-1 盐酸与醋酸,测定其pH值大小
探究二:观察等体积、等浓度0.1 mol·L-1 的盐酸、醋酸溶液和相同大小镁条反应的实验,进行预测,观察现象并尝试解释原因.
镁条
1 mol·L-1 HCl
1 mol·L-1 CH3COOH
一、强电解质和弱电解质
【实验操作】
教学过程
实验视频
教学过程
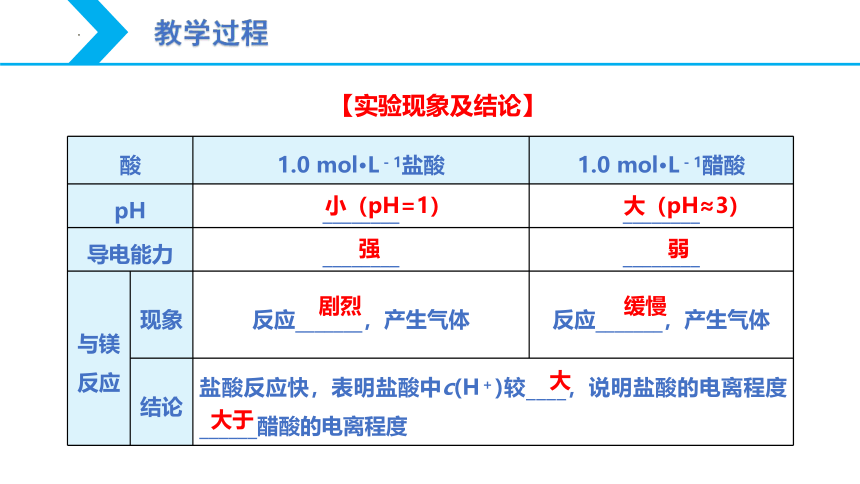
酸 1.0 mol·L-1盐酸 1.0 mol·L-1醋酸
pH ________ ________
导电能力 ________ ________
与镁 反应 现象 反应_______,产生气体 反应_______,产生气体
结论 盐酸反应快,表明盐酸中c(H+)较____,说明盐酸的电离程度______醋酸的电离程度 小(pH=1)
大(pH≈3)
强 弱
剧烈 缓慢
大
大于
【实验现象及结论】
教学过程
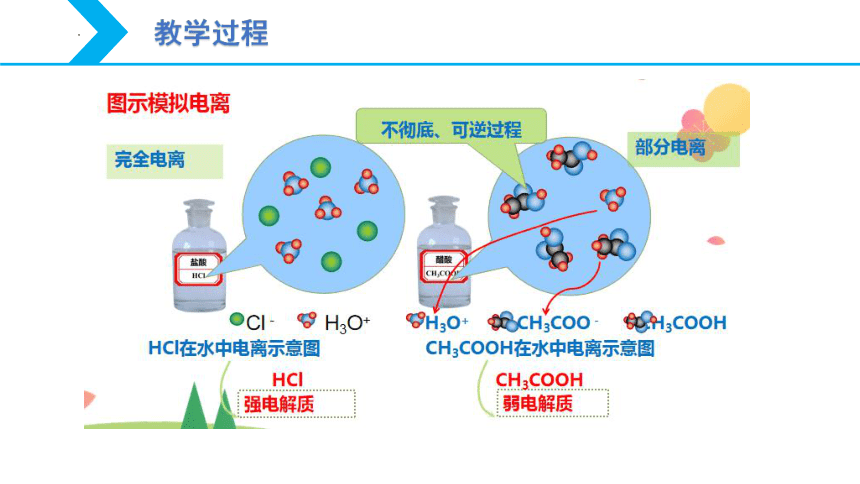
实验表明,相同物质的量浓度的盐酸和醋酸的pH、导电能力及与活泼金属反应的剧烈程度都有差别,这说明两种酸中的H+浓度是不同的,即HCl和CH3COOH的电离程度不同。
稀溶液中,HCl全部电离生成H+和Cl-,CH3COOH只有部分电离生成CH3COO-和H+。
【实验分析】
教学过程
教学过程
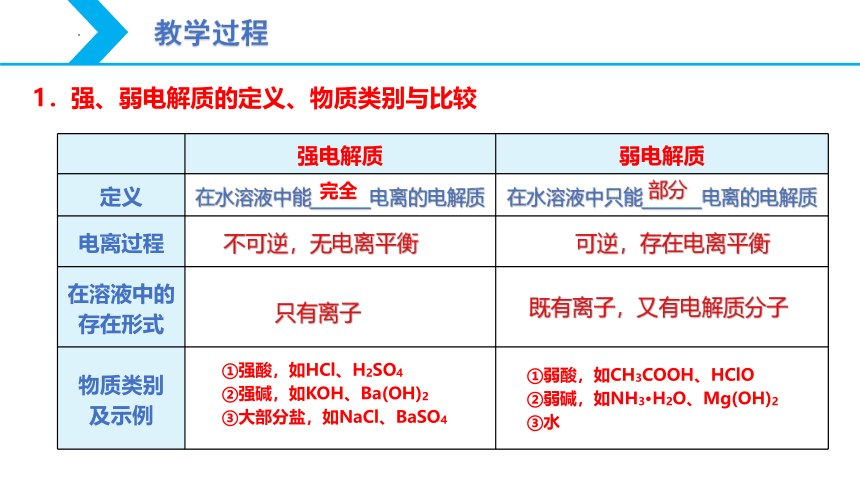
1.强、弱电解质的定义、物质类别与比较
强电解质 弱电解质
定义 在水溶液中能_______电离的电解质 在水溶液中只能_______电离的电解质
电离过程
在溶液中的 存在形式
物质类别 及示例
完全
部分
不可逆,无电离平衡
可逆,存在电离平衡
只有离子
既有离子,又有电解质分子
①强酸,如HCl、H2SO4
②强碱,如KOH、Ba(OH)2
③大部分盐,如NaCl、BaSO4
①弱酸,如CH3COOH、HClO
②弱碱,如NH3·H2O、Mg(OH)2
③水
教学过程
【注意】
1.电解质的强、弱与其溶解性无关。难溶的盐如AgCl、CaCO3等,溶于水的部分能完全电离,是强电解质。易溶的如CH3COOH、NH3·H2O等在溶液中电离程度较小,是弱电解质。
2.强电解质导电能力不一定强。溶液的导电能力取决于溶液的离子浓度和离子所带的电荷。
教学过程
2.强、弱电解质的电离方程式
强电解质 强酸
强碱
盐 正盐
强酸的酸式盐
弱酸的酸式盐
完全电离,如HCl === H+ + Cl-
完全电离,如Ba(OH)2 === Ba2+ + 2OH-
完全电离,如Na2CO3 === 2Na+ +
完全电离,如NaHSO4 === Na+ + H+ +
第一步完全电离,第二步弱酸酸根部分电离,如
NaHCO3 === Na+ + ,HCO3- H+ +
完全电离,如HCl === H+ + Cl-
教学过程
弱电解质 一元弱酸
一元弱碱
H2O
多元弱酸
多元弱碱
部分电离,如CH3COOH CH3COO- + H+
部分电离,如 NH3·H2O + OH-
部分电离, H2O H+ + OH-
分步电离,必须分步写出,不可合并(以第一步电离为主)如H2CO3 H+ + , H+ +
分步电离,中学阶段一步写出。如Fe(OH)3 Fe3+ + 3OH-
教学过程
二、弱电解质的电离平衡
1.定义:在一定条件(如温度、浓度)下,弱电解质分子电离成离子的速率与离子结合成弱电解质分子的速率相等,溶液中各分子和离子的浓度都不再发生变化,电离过程就达到了电离平衡状态。
2.建立过程
教学过程
3.特征
教学过程
4.影响因素
(1)内因:弱电解质本身的性质——决定因素
温度 温度升高,电离平衡 移动,电离程度 。
浓度 稀释溶液,电离平衡 移动,电离程度 。
同离子效应 加入与弱电解质具有相同离子的强电解质,电离平衡 移动,电离程度 。
加入能反应的物质 电离平衡 移动,电离程度 。
(2)外因:
增大
向右
向右
增大
减小
向左
向右
增大
教学过程
改变条件 移动方向 n(H+) c(H+) c(CH3COO-) 电离程度
升温
浓度 加水稀释
加冰醋酸
同离子效应 加固体醋酸钠
通入HCl气体
加入含有与弱电解质反应的物质 加固体氢氧化钠
加入镁粉
在醋酸溶液中存在电离平衡 CH3COOH CH3COO- + H+ ΔH>0,
填写下表格。
【典例】
教学过程
改变条件 移动方向 n(H+) c(H+) c(CH3COO-) 电离程度
升温 向右 增大 增大 增大 增大
浓度 加水稀释 向右 增大 减小 减小 增大
加冰醋酸 向右 增大 增大 增大 减小
同离子效应 加固体醋酸钠 向左 减小 减小 增大 减小
通入HCl气体 向左 增大 增大 减小 减小
加入含有与弱电解质反应的物质 加固体氢氧化钠 向右 减小 减小 增大 增大
加入镁粉 向右 减小 减小 增大 增大
【典例】
在醋酸溶液中存在电离平衡 CH3COOH CH3COO- + H+ ΔH>0,
填写下表格。
典例1.
【答案】A
课堂练习
下列有关叙述中正确的是 ( )
A.强电解质在水溶液中的电离过程是不可逆的
B.CO2的水溶液能导电,所以CO2是电解质
C.碳酸钙在水里的溶解度很小,所以碳酸钙是弱电解质
D.强电解质的水溶液导电能力一定比弱电解质的水溶液导电能力强
课堂小结
下列电离方程式书写正确的是 ( )
A.水溶液中NaHSO4的电离:NaHSO4 Na+ + H+ + SO42-
B.H2CO3的电离:H2CO3 2H+ + CO32-
C.Al(OH)3的碱式电离:Al(OH)3 Al3++3OH-
D.水溶液中NaHSO3的电离:NaHSO 3Na++HSO3-
典例2.
【答案】A
典例3.
【答案】B
【解析】因为电离是吸热过程,所以升高温度,平衡正向移动,所以A选项说法错误;加入少量同浓度的盐酸,由于盐酸完全电离,氢离子浓度增大,所以C选项说法错误;加入少量醋酸钠固体,由于醋酸根离子浓度增大,所以平衡逆向移动,醋酸电离程度减小,所以D选项说法错误。
课堂练习
在0.1 mol/L CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+。对于该平衡,下列叙述正确的是( )
A.升高温度,平衡逆向移动
B.加入少量NaOH固体,平衡正向移动
C.加入少量0.1 mol/L HCl溶液,溶液中c(H+)减小
D.加入少量醋酸钠固体,CH3COOH溶液的电离程度增大
课堂小结
课堂小任务
感 谢 倾 听
第一节 电离平衡
第1课时 弱电解质的电离平衡
人教版选择性必修1
学习目标
1.结合真实情境中的应用实例,认识弱电解质在水溶液中存在电离平衡。
2.能用化学用语正确表示水溶液中的电离平衡。
学习目标
1.能从宏观的物质类别判断电解质的强弱,培养学生“宏观辨识与微观探析”的学科素养。
2.通过认识弱电解质的电离有一定限度,是可以调控的,能运用电离平衡原理解决简单的实际问题,培养学生“变化观念与平衡思想”“科学态度与社会责任”学科素养。
3.通过建立电离平衡的认知模型,并能运用该模型解释化学现象。培养学生“证据推理与模型认知”的学科素养。
素养目标
情境引入
盐酸和醋酸是生活中经常用到的酸,盐酸常用于卫生洁具的清洁。
醋酸的腐蚀性比盐酸的小,比较安全,为什么不用醋酸代替盐酸呢?
思考:
洁厕灵的主要成份是盐酸
教学过程
实验探究
探究一:常温时,取相同体积、 0.1 mol·L-1 盐酸与醋酸,测定其pH值大小
探究二:观察等体积、等浓度0.1 mol·L-1 的盐酸、醋酸溶液和相同大小镁条反应的实验,进行预测,观察现象并尝试解释原因.
镁条
1 mol·L-1 HCl
1 mol·L-1 CH3COOH
一、强电解质和弱电解质
【实验操作】
教学过程
实验视频
教学过程
酸 1.0 mol·L-1盐酸 1.0 mol·L-1醋酸
pH ________ ________
导电能力 ________ ________
与镁 反应 现象 反应_______,产生气体 反应_______,产生气体
结论 盐酸反应快,表明盐酸中c(H+)较____,说明盐酸的电离程度______醋酸的电离程度 小(pH=1)
大(pH≈3)
强 弱
剧烈 缓慢
大
大于
【实验现象及结论】
教学过程
实验表明,相同物质的量浓度的盐酸和醋酸的pH、导电能力及与活泼金属反应的剧烈程度都有差别,这说明两种酸中的H+浓度是不同的,即HCl和CH3COOH的电离程度不同。
稀溶液中,HCl全部电离生成H+和Cl-,CH3COOH只有部分电离生成CH3COO-和H+。
【实验分析】
教学过程
教学过程
1.强、弱电解质的定义、物质类别与比较
强电解质 弱电解质
定义 在水溶液中能_______电离的电解质 在水溶液中只能_______电离的电解质
电离过程
在溶液中的 存在形式
物质类别 及示例
完全
部分
不可逆,无电离平衡
可逆,存在电离平衡
只有离子
既有离子,又有电解质分子
①强酸,如HCl、H2SO4
②强碱,如KOH、Ba(OH)2
③大部分盐,如NaCl、BaSO4
①弱酸,如CH3COOH、HClO
②弱碱,如NH3·H2O、Mg(OH)2
③水
教学过程
【注意】
1.电解质的强、弱与其溶解性无关。难溶的盐如AgCl、CaCO3等,溶于水的部分能完全电离,是强电解质。易溶的如CH3COOH、NH3·H2O等在溶液中电离程度较小,是弱电解质。
2.强电解质导电能力不一定强。溶液的导电能力取决于溶液的离子浓度和离子所带的电荷。
教学过程
2.强、弱电解质的电离方程式
强电解质 强酸
强碱
盐 正盐
强酸的酸式盐
弱酸的酸式盐
完全电离,如HCl === H+ + Cl-
完全电离,如Ba(OH)2 === Ba2+ + 2OH-
完全电离,如Na2CO3 === 2Na+ +
完全电离,如NaHSO4 === Na+ + H+ +
第一步完全电离,第二步弱酸酸根部分电离,如
NaHCO3 === Na+ + ,HCO3- H+ +
完全电离,如HCl === H+ + Cl-
教学过程
弱电解质 一元弱酸
一元弱碱
H2O
多元弱酸
多元弱碱
部分电离,如CH3COOH CH3COO- + H+
部分电离,如 NH3·H2O + OH-
部分电离, H2O H+ + OH-
分步电离,必须分步写出,不可合并(以第一步电离为主)如H2CO3 H+ + , H+ +
分步电离,中学阶段一步写出。如Fe(OH)3 Fe3+ + 3OH-
教学过程
二、弱电解质的电离平衡
1.定义:在一定条件(如温度、浓度)下,弱电解质分子电离成离子的速率与离子结合成弱电解质分子的速率相等,溶液中各分子和离子的浓度都不再发生变化,电离过程就达到了电离平衡状态。
2.建立过程
教学过程
3.特征
教学过程
4.影响因素
(1)内因:弱电解质本身的性质——决定因素
温度 温度升高,电离平衡 移动,电离程度 。
浓度 稀释溶液,电离平衡 移动,电离程度 。
同离子效应 加入与弱电解质具有相同离子的强电解质,电离平衡 移动,电离程度 。
加入能反应的物质 电离平衡 移动,电离程度 。
(2)外因:
增大
向右
向右
增大
减小
向左
向右
增大
教学过程
改变条件 移动方向 n(H+) c(H+) c(CH3COO-) 电离程度
升温
浓度 加水稀释
加冰醋酸
同离子效应 加固体醋酸钠
通入HCl气体
加入含有与弱电解质反应的物质 加固体氢氧化钠
加入镁粉
在醋酸溶液中存在电离平衡 CH3COOH CH3COO- + H+ ΔH>0,
填写下表格。
【典例】
教学过程
改变条件 移动方向 n(H+) c(H+) c(CH3COO-) 电离程度
升温 向右 增大 增大 增大 增大
浓度 加水稀释 向右 增大 减小 减小 增大
加冰醋酸 向右 增大 增大 增大 减小
同离子效应 加固体醋酸钠 向左 减小 减小 增大 减小
通入HCl气体 向左 增大 增大 减小 减小
加入含有与弱电解质反应的物质 加固体氢氧化钠 向右 减小 减小 增大 增大
加入镁粉 向右 减小 减小 增大 增大
【典例】
在醋酸溶液中存在电离平衡 CH3COOH CH3COO- + H+ ΔH>0,
填写下表格。
典例1.
【答案】A
课堂练习
下列有关叙述中正确的是 ( )
A.强电解质在水溶液中的电离过程是不可逆的
B.CO2的水溶液能导电,所以CO2是电解质
C.碳酸钙在水里的溶解度很小,所以碳酸钙是弱电解质
D.强电解质的水溶液导电能力一定比弱电解质的水溶液导电能力强
课堂小结
下列电离方程式书写正确的是 ( )
A.水溶液中NaHSO4的电离:NaHSO4 Na+ + H+ + SO42-
B.H2CO3的电离:H2CO3 2H+ + CO32-
C.Al(OH)3的碱式电离:Al(OH)3 Al3++3OH-
D.水溶液中NaHSO3的电离:NaHSO 3Na++HSO3-
典例2.
【答案】A
典例3.
【答案】B
【解析】因为电离是吸热过程,所以升高温度,平衡正向移动,所以A选项说法错误;加入少量同浓度的盐酸,由于盐酸完全电离,氢离子浓度增大,所以C选项说法错误;加入少量醋酸钠固体,由于醋酸根离子浓度增大,所以平衡逆向移动,醋酸电离程度减小,所以D选项说法错误。
课堂练习
在0.1 mol/L CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+。对于该平衡,下列叙述正确的是( )
A.升高温度,平衡逆向移动
B.加入少量NaOH固体,平衡正向移动
C.加入少量0.1 mol/L HCl溶液,溶液中c(H+)减小
D.加入少量醋酸钠固体,CH3COOH溶液的电离程度增大
课堂小结
课堂小任务
感 谢 倾 听
