【核心素养目标】人教版(2019)高中化学 选择性必修1 3.1 电离平衡(第2课时 电离平衡常数)
文档属性
| 名称 | 【核心素养目标】人教版(2019)高中化学 选择性必修1 3.1 电离平衡(第2课时 电离平衡常数) |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-18 10:30:57 | ||
图片预览





文档简介
第一节 电离平衡
第2课时 电离平衡常数
人教版选择性必修1
学习目标
1.了解电离平衡常数的含义。
2.掌握电离平衡常数的有关应用和计算。
学习目标
1.通过对电离平衡常数的理解,培养学生“变化观念与平衡思想”的学科素养。
2.通过电离平衡常数的计算,培养学生“证据推理与和模型认知”的学科素养。
素养目标
情境引入
甲酸(HCOOH)又称蚁酸,酸性很强,有腐蚀性,能刺激皮肤出现红肿。甲酸存在手某些蚁类和毛虫的分泌物中。
从电离平衡的角度分析皮肤被蚂蚁、毛虫叮咬后出现红肿的原因。
已知人体血液中存在如下平衡:
H2O + CO2 ? H2CO3 ? H+ + HCO3-
?
教学过程
一、电离平衡常数
1.概念:在一定条件下,当弱电解质的电离达到平衡时,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之比是一个常数,这个常数叫做电离平衡常数,简称电离常数,用 K 表示。
2.表达式:
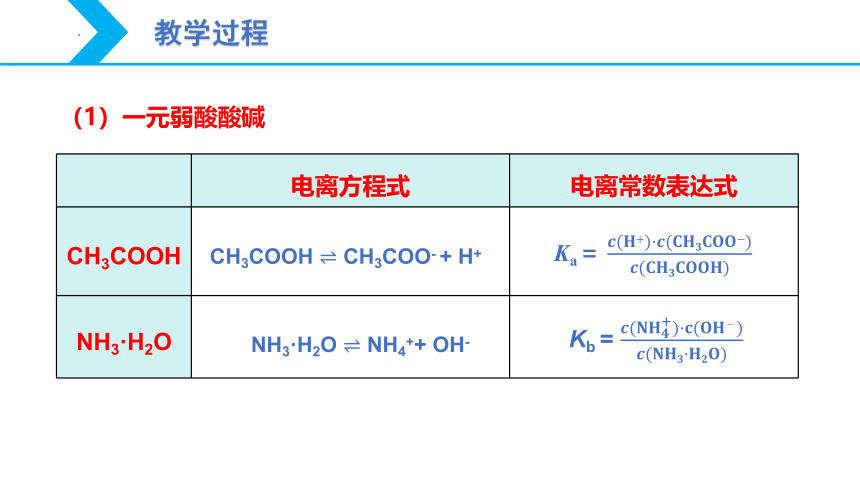
教学过程
?
电离方程式
电离常数表达式
CH3COOH
NH3·H2O
Ka= ????(????+)·????(?????????????????????????)????(????????????????????????????)
?
CH3COOH ? CH3COO- + H+
?
NH3·H2O ? NH4++ OH-
?
Kb = ????(????????????+)·????(????????-)????(????????????·????????????)
?
(1)一元弱酸酸碱
教学过程
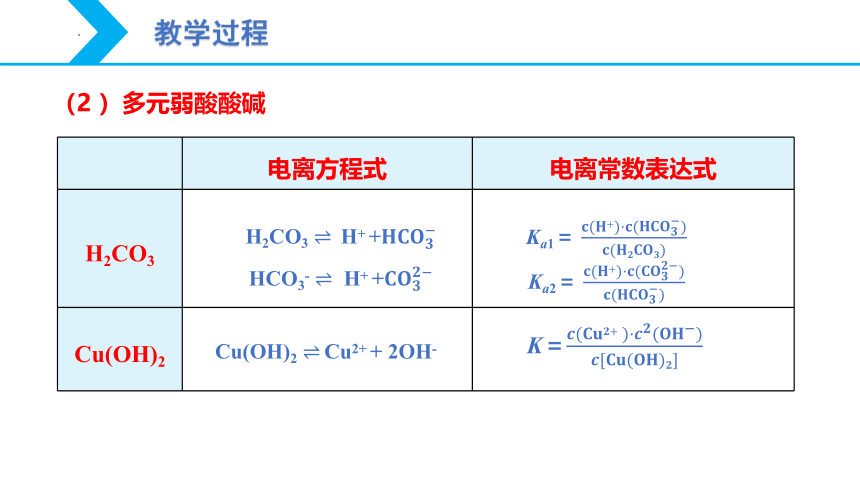
?
电离方程式
电离常数表达式
H2CO3
Cu(OH)2
(2 )多元弱酸酸碱
H2CO3 ? H+ +?????????????????
HCO3- ? H+ +?????????????????
?
Ka1= ????(????+)·????(?????????????????)????(????????????????????)
Ka2= ????(????+)·????(?????????????????)????(?????????????????)
?
Cu(OH)2 ? Cu2+ + 2OH-
?
K=????(????????????+?)·????????(?????????)????[????????(????????)????]
?
教学过程
一般多元弱酸各步电离常数的大小为Ka1?Ka2?Ka3,因此,多元弱酸的酸性主要由第一步电离决定。
由于多元弱碱为难溶碱,所以一般不用电离平衡常数,而用以后要学到的难溶物的溶度积常数。
提示:
教学过程
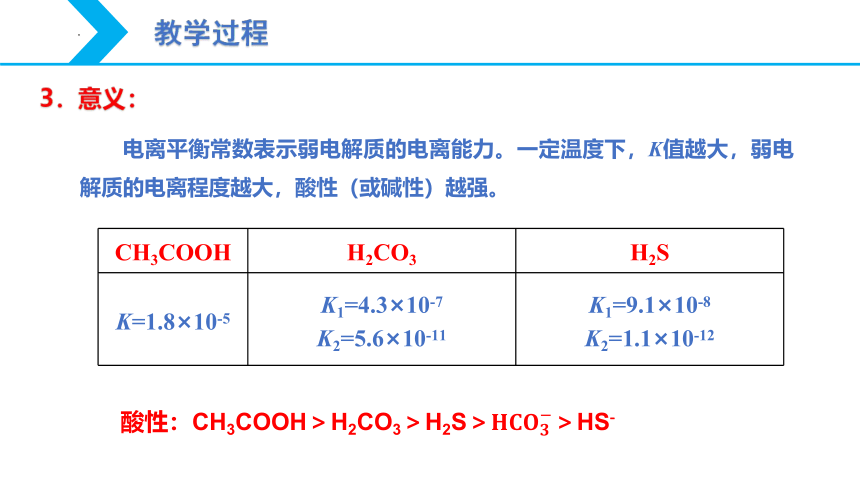
电离平衡常数表示弱电解质的电离能力。一定温度下,K值越大,弱电解质的电离程度越大,酸性(或碱性)越强。
CH3COOH
H2CO3
H2S
K=1.8×10-5
K1=4.3×10-7
K2=5.6×10-11
K1=9.1×10-8
K2=1.1×10-12
酸性:CH3COOH>H2CO3>H2S>?????????????????>HS?
?
3.意义:
教学过程
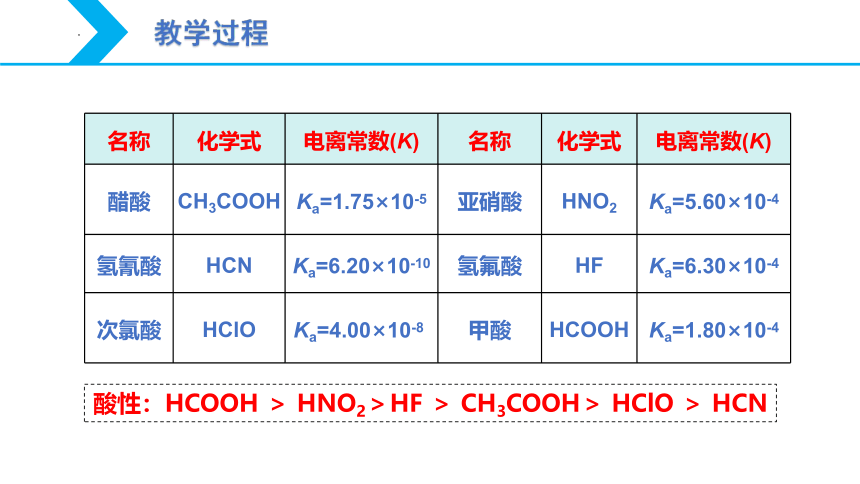
名称
化学式
电离常数(K)
名称
化学式
电离常数(K)
醋酸
CH3COOH
Ka=1.75×10-5
亚硝酸
HNO2
Ka=5.60×10-4
氢氰酸
HCN
Ka=6.20×10-10
氢氟酸
HF
Ka=6.30×10-4
次氯酸
HClO
Ka=4.00×10-8?
甲酸
HCOOH
Ka=1.80×10-4
酸性:HCOOH > HNO2>HF > CH3COOH> HClO > HCN
教学过程
(1)内因:弱电解质本身的性质。
(2)外因:电离平衡常数只跟温度有关,温度升高,电离平衡常数增大。
4.影响因素:
电离是吸热的,升高温度,平衡正向移动,电离常数 K 增大。
教学过程
(1)判断弱酸(或弱碱)的相对强弱,电离平衡常数越大,酸性(或碱性)越强。 (2)判断复分解反应能否发生,一般符合“强酸制弱酸”规律。 (3)判断溶液中微粒浓度比值的变化。如加水稀释醋酸溶液,由
不变,稀释后c(CH3COO-)减小,则
(c(H+)/c(CH3COOH)增大。
5.应用:
Ka= ????(????+)·????(?????????????????????????)????(????????????????????????????)
?
教学过程
应用:判断复分解反应能否发生,一般符合“强酸制弱酸”规律
实验:向盛有2 mL 1 mol/L 醋酸的试管中滴加1 mol/L Na2CO3溶液,观察现象。你能否由此推测Ka(CH3COOH)与Ka1(H2CO3)的大小关系?
2CH3COOH+Na2CO3 2CH3COONa + CO2↑+ H2O
CH3COOH > H2CO3
Ka(CH3COOH) > Ka1(H2CO3)
生成大量气泡
H2CO3
实验现象:
化学方程式:
酸性强弱:
电离常数大小:
教学过程
1. 概念:弱电解质达电离平衡时,已电离的电解质分子数占原来总分子数(包括已电离的和未电离的)的百分数。
2. 影响因素
①内因:弱电解质本身的性质
②外因:温度及浓度
3. 意义:表示不同弱电解质在水溶液中的电离程度,在相等条件下可用电离度比较弱电解质的相对强弱。
二、电离度
教学过程
三、电离常数的计算
1. 列出“三段式”计算
2. 由于弱电解质的电离程度比较小,最终计算时,一般弱电解质的平衡浓度≈起始浓度(即忽略弱电解质电离的部分)。
CH3COOH ? CH3COO-+ H+
起始浓度/mol·L-1 a 0 0
变化浓度/mol·L-1 x x x
平衡浓度/mol·L-1 a-x x x
则Ka=????(????+)·????(?????????????????????????)????(????????????????????????????) ≈
?
x2
a
教学过程
电离平衡常数计算题思维模型
教学过程
某温度下,氨水的浓度为 2.0 mol·L–1 , 达到电离平衡时,已电离的NH3·H2O 为1.7×10-3 mol·L–1 。计算该温度下的电离平衡常数。
典例:
典例1.
【答案】A
【解析】电离平衡常数K是温度的函数,所以B错。只要温度一定,不同浓度的同一弱电解质电离平衡常数K相同,所以C错。多元弱酸各步电离平衡常数相互关系应为K1>K2>K3,所以D错。
课堂练习
下列关于电离平衡常数(K)的说法中正确的是( )
A.组成相似时电离平衡常数(K)越小,表示弱电解质电离能力越弱
B.电离平衡常数(K)与温度无关
C.不同浓度的同一弱电解质,其电离平衡常数(K)不同
D.多元弱酸各步电离平衡常数相互关系为K1典例2.
【答案】B
【解析】相同温度下弱电解质的电离常数的大小是比较弱电解质相对强弱的条件之一。根据题中反应可知三种一元弱酸的酸性强弱顺序为HF>HNO2>HCN,由此可判断:Ka(HF)>Ka(HNO2)>Ka(HCN),其对应数据依次为Ka(HF)=6.3×10-4、Ka(HNO2)=5.6×10-4、Ka(HCN)=6.2×10-10。
课堂练习
已知下面三个数据:6.3×10-4、5.6×10-4、6.2×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:NaCN+HNO2=HCN+NaNO2;NaNO2+HF=HNO2+NaF。由此可判断下列叙述不正确的是( )
A.Ka(HF)=6.3×10-4
B.Ka(HNO2)=6.2×10-10
C.三种酸的强弱顺序为HF>HNO2>HCN
D.Ka(HCN)典例3.
课堂练习
下列推断正确的是( )
A.HX、HY两种弱酸的酸性:HXB.相同条件下溶液的碱性:NaX>Na2CO3>NaY>NaHCO3
C.向Na2CO3溶液中加入足量HX,反应的离子方程式:HX+CO32-=HCO3-+X-
D.HX溶液中c(H+)一定比HY溶液的大
弱酸化学式
HX
HY
H2CO3
电离平衡常数
7.8×10-9
3.7×10-15
K1=4.4×10-7
K2=4.7×10-11
【答案】C 【解析】B项,Ka越小,酸越弱,水解程度越大,碱性越强,即NaY>Na2CO3>NaX>NaHCO3,错误;D项,没有指明溶液浓度,无法比较c(H+),错误。
课堂小结
感 谢 倾 听
第2课时 电离平衡常数
人教版选择性必修1
学习目标
1.了解电离平衡常数的含义。
2.掌握电离平衡常数的有关应用和计算。
学习目标
1.通过对电离平衡常数的理解,培养学生“变化观念与平衡思想”的学科素养。
2.通过电离平衡常数的计算,培养学生“证据推理与和模型认知”的学科素养。
素养目标
情境引入
甲酸(HCOOH)又称蚁酸,酸性很强,有腐蚀性,能刺激皮肤出现红肿。甲酸存在手某些蚁类和毛虫的分泌物中。
从电离平衡的角度分析皮肤被蚂蚁、毛虫叮咬后出现红肿的原因。
已知人体血液中存在如下平衡:
H2O + CO2 ? H2CO3 ? H+ + HCO3-
?
教学过程
一、电离平衡常数
1.概念:在一定条件下,当弱电解质的电离达到平衡时,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之比是一个常数,这个常数叫做电离平衡常数,简称电离常数,用 K 表示。
2.表达式:
教学过程
?
电离方程式
电离常数表达式
CH3COOH
NH3·H2O
Ka= ????(????+)·????(?????????????????????????)????(????????????????????????????)
?
CH3COOH ? CH3COO- + H+
?
NH3·H2O ? NH4++ OH-
?
Kb = ????(????????????+)·????(????????-)????(????????????·????????????)
?
(1)一元弱酸酸碱
教学过程
?
电离方程式
电离常数表达式
H2CO3
Cu(OH)2
(2 )多元弱酸酸碱
H2CO3 ? H+ +?????????????????
HCO3- ? H+ +?????????????????
?
Ka1= ????(????+)·????(?????????????????)????(????????????????????)
Ka2= ????(????+)·????(?????????????????)????(?????????????????)
?
Cu(OH)2 ? Cu2+ + 2OH-
?
K=????(????????????+?)·????????(?????????)????[????????(????????)????]
?
教学过程
一般多元弱酸各步电离常数的大小为Ka1?Ka2?Ka3,因此,多元弱酸的酸性主要由第一步电离决定。
由于多元弱碱为难溶碱,所以一般不用电离平衡常数,而用以后要学到的难溶物的溶度积常数。
提示:
教学过程
电离平衡常数表示弱电解质的电离能力。一定温度下,K值越大,弱电解质的电离程度越大,酸性(或碱性)越强。
CH3COOH
H2CO3
H2S
K=1.8×10-5
K1=4.3×10-7
K2=5.6×10-11
K1=9.1×10-8
K2=1.1×10-12
酸性:CH3COOH>H2CO3>H2S>?????????????????>HS?
?
3.意义:
教学过程
名称
化学式
电离常数(K)
名称
化学式
电离常数(K)
醋酸
CH3COOH
Ka=1.75×10-5
亚硝酸
HNO2
Ka=5.60×10-4
氢氰酸
HCN
Ka=6.20×10-10
氢氟酸
HF
Ka=6.30×10-4
次氯酸
HClO
Ka=4.00×10-8?
甲酸
HCOOH
Ka=1.80×10-4
酸性:HCOOH > HNO2>HF > CH3COOH> HClO > HCN
教学过程
(1)内因:弱电解质本身的性质。
(2)外因:电离平衡常数只跟温度有关,温度升高,电离平衡常数增大。
4.影响因素:
电离是吸热的,升高温度,平衡正向移动,电离常数 K 增大。
教学过程
(1)判断弱酸(或弱碱)的相对强弱,电离平衡常数越大,酸性(或碱性)越强。 (2)判断复分解反应能否发生,一般符合“强酸制弱酸”规律。 (3)判断溶液中微粒浓度比值的变化。如加水稀释醋酸溶液,由
不变,稀释后c(CH3COO-)减小,则
(c(H+)/c(CH3COOH)增大。
5.应用:
Ka= ????(????+)·????(?????????????????????????)????(????????????????????????????)
?
教学过程
应用:判断复分解反应能否发生,一般符合“强酸制弱酸”规律
实验:向盛有2 mL 1 mol/L 醋酸的试管中滴加1 mol/L Na2CO3溶液,观察现象。你能否由此推测Ka(CH3COOH)与Ka1(H2CO3)的大小关系?
2CH3COOH+Na2CO3 2CH3COONa + CO2↑+ H2O
CH3COOH > H2CO3
Ka(CH3COOH) > Ka1(H2CO3)
生成大量气泡
H2CO3
实验现象:
化学方程式:
酸性强弱:
电离常数大小:
教学过程
1. 概念:弱电解质达电离平衡时,已电离的电解质分子数占原来总分子数(包括已电离的和未电离的)的百分数。
2. 影响因素
①内因:弱电解质本身的性质
②外因:温度及浓度
3. 意义:表示不同弱电解质在水溶液中的电离程度,在相等条件下可用电离度比较弱电解质的相对强弱。
二、电离度
教学过程
三、电离常数的计算
1. 列出“三段式”计算
2. 由于弱电解质的电离程度比较小,最终计算时,一般弱电解质的平衡浓度≈起始浓度(即忽略弱电解质电离的部分)。
CH3COOH ? CH3COO-+ H+
起始浓度/mol·L-1 a 0 0
变化浓度/mol·L-1 x x x
平衡浓度/mol·L-1 a-x x x
则Ka=????(????+)·????(?????????????????????????)????(????????????????????????????) ≈
?
x2
a
教学过程
电离平衡常数计算题思维模型
教学过程
某温度下,氨水的浓度为 2.0 mol·L–1 , 达到电离平衡时,已电离的NH3·H2O 为1.7×10-3 mol·L–1 。计算该温度下的电离平衡常数。
典例:
典例1.
【答案】A
【解析】电离平衡常数K是温度的函数,所以B错。只要温度一定,不同浓度的同一弱电解质电离平衡常数K相同,所以C错。多元弱酸各步电离平衡常数相互关系应为K1>K2>K3,所以D错。
课堂练习
下列关于电离平衡常数(K)的说法中正确的是( )
A.组成相似时电离平衡常数(K)越小,表示弱电解质电离能力越弱
B.电离平衡常数(K)与温度无关
C.不同浓度的同一弱电解质,其电离平衡常数(K)不同
D.多元弱酸各步电离平衡常数相互关系为K1
【答案】B
【解析】相同温度下弱电解质的电离常数的大小是比较弱电解质相对强弱的条件之一。根据题中反应可知三种一元弱酸的酸性强弱顺序为HF>HNO2>HCN,由此可判断:Ka(HF)>Ka(HNO2)>Ka(HCN),其对应数据依次为Ka(HF)=6.3×10-4、Ka(HNO2)=5.6×10-4、Ka(HCN)=6.2×10-10。
课堂练习
已知下面三个数据:6.3×10-4、5.6×10-4、6.2×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:NaCN+HNO2=HCN+NaNO2;NaNO2+HF=HNO2+NaF。由此可判断下列叙述不正确的是( )
A.Ka(HF)=6.3×10-4
B.Ka(HNO2)=6.2×10-10
C.三种酸的强弱顺序为HF>HNO2>HCN
D.Ka(HCN)
课堂练习
下列推断正确的是( )
A.HX、HY两种弱酸的酸性:HX
C.向Na2CO3溶液中加入足量HX,反应的离子方程式:HX+CO32-=HCO3-+X-
D.HX溶液中c(H+)一定比HY溶液的大
弱酸化学式
HX
HY
H2CO3
电离平衡常数
7.8×10-9
3.7×10-15
K1=4.4×10-7
K2=4.7×10-11
【答案】C 【解析】B项,Ka越小,酸越弱,水解程度越大,碱性越强,即NaY>Na2CO3>NaX>NaHCO3,错误;D项,没有指明溶液浓度,无法比较c(H+),错误。
课堂小结
感 谢 倾 听
