【核心素养目标】人教版(2019)高中化学 选择性必修1 3.2 水的电离和溶液的pH(第1课时 水的电离 )
文档属性
| 名称 | 【核心素养目标】人教版(2019)高中化学 选择性必修1 3.2 水的电离和溶液的pH(第1课时 水的电离 ) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-18 10:31:53 | ||
图片预览






文档简介
第二节 水的电离和溶液的pH
第1课时 水的电离
人教版选择性必修1
学习目标
1.认识水的电离,水是一种极弱的电解质。
2.结合电离常数,了解水的离子积常数,其适用于任何水溶液。能够运用水的离子积常数进行有关计算及判断。
学习目标
1.能从微观角度通过c(H+)和c(OH-)的相对大小判断溶液的酸碱性,同时从宏观角度通过pH计、pH试纸等判断溶液的酸碱性,培养“宏观辨识与微观探析”学科素养。
2.能从电离平衡的角度,理解外界条件对水的电离平衡的影响,解释溶液酸碱性的变化,培养“变化观念与平衡思想”
3.理解水的离子积常数,形成认知模型,能够运用水的离子积常数进行有关计算及判断,培养“证据推理与模型认知”学科素养。
素养目标
情境引入
在水溶液中,酸、碱和盐全部或部分以离子形式存在,那么,其中的溶剂水是全部以分子形式存在,还是部分以离子形式存在呢? 怎样验证你的猜想?
教学过程
【实验探究1】水的导电性实验
一、水的电离
蒸馏水
实验现象
实验结论
(1)灵敏电流表指针偏转;(2)灯泡不亮。
水是一种极弱的电解质,能发生微弱的电离
教学过程
精确的电导性实验表明:纯水大部分以H2O分子的形式存在,但其中也存在着极少量的离子。
电导率仪
【实验探究2】利用手持技术测定水的电导率
教学过程
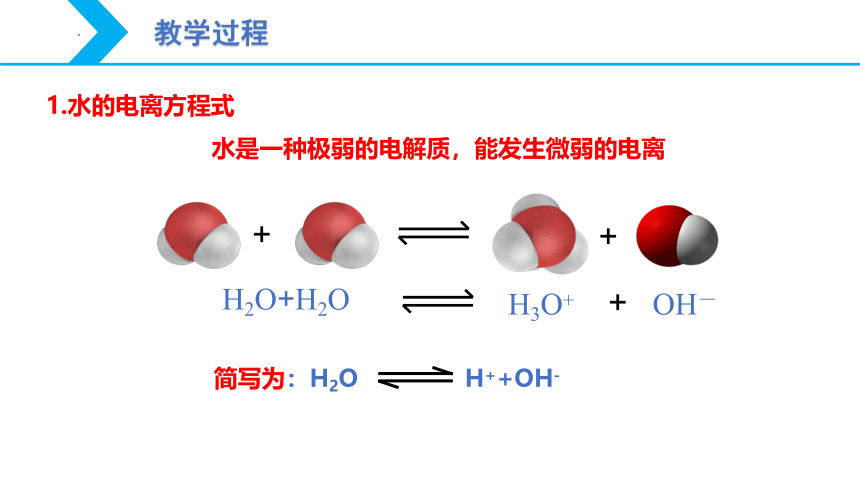
+
+
H2O+H2O
OH-
H3O+
1.水的电离方程式
+
简写为:H2O H++OH-
水是一种极弱的电解质,能发生微弱的电离
教学过程
当水的电离达到平衡时,电离平衡常数K 的表达式为:
Kw 水的离子积常数,简称水的离子积
2.水的离子积常数
K =????(????+)·????(?????????)????(????????????)
?
K?????(????????????)=????(????+)·????(?????????)
?
纯水及稀溶液中c(H2O)为常数
????????=?????(????+)·????(?????????)
?
教学过程
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}不同温度下水的离子积常数
t/℃
0
10
20
25
40
50
90
100
Kw/10-14
0.115
0.296
0.687
1.01
2.87
5.31
37.1
54.5
【思考】分析表格中的数据,有何规律,得出什么结论?并解释?
水的电离是吸热过程,升高温度,促进水的电离, Kw增大。
常温(25 ℃)下, Kw =c(H+) · c(OH-) =1.0×10-14
结论:
教学过程
注意:
(1)Kw是温度函数,只随温度的升高而增大, 与c(H+) 、c(OH-) 无关。
(2)Kw适用于一定温度下任何稀的电解质溶液, 不管是哪种溶液均有: c(H+)H2O = c (OH―)H2O KW=c (H+)溶液·c (OH―)溶液
(3)在任何水溶液中,均存在水的电离平衡,也就是任何水溶液中都是H+、OH-共存的。
教学过程
3.水的电离平衡
根据水的电离平衡,思考下列情况中,c(H+)和c(OH-)的如何变化?
条件
移动方向
c(H+)
c(OH-)
电离程度
Kw
升温
通入HCl(g)
加入NaOH(s)
加入少量Na(s)
加入NaHSO4(s)
H2O?? H+ +OH-
?
教学过程
条件
移动方向
c(H+)
c(OH-)
电离程度
Kw
升温
右移
增大
增大
增大
增大
通入HCl(g)
左移
增大
减小
减小
不变
通入NaOH(s)
左移
减小
增大
减小
不变
加 入少量Na(s)
右移
减小
增大
增大
不变
加入NaHSO4(s)
左移
增大
减小
减小
不变
3.水的电离平衡
根据水的电离平衡,思考下列情况中,c(H+)和c(OH-)的如何变化?
H2O?? H+ +OH-
?
教学过程
1、 温度升高,促进水的电离,Kw增大;
3、外加能与H+、OH- 反应的物质,会促进水的电离,Kw不变。
2、酸(H+)、碱(OH- )抑制水的电离,Kw不变;
总结归纳
教学过程
(1)曲线上的任意点的Kw都相同,即c(H+)·c(OH-)相同,温度相同。 (2)曲线外的任意点与曲线上任意点的Kw不同,温度不同。 (3)实现曲线上点之间的转化需保持温度相同,改变酸碱性;实现曲线上点与曲线外点之间的转化一定改变温度。
4.水的电离曲线
典例1.25 ℃时,水溶液中c(H+)与c(OH-)的变化关系如图所示,下列判断错误的是( )
A.ac曲线上的任意一点都有c(H+)·c(OH-)=10-14 B.bd线段上任意一点对应的溶液都呈中性 C.d点对应溶液的温度高于25 ℃,pH<7 D.c点溶液不可能是盐溶液
【答案】D 【解析】ac曲线上的任意一点,由于温度相同,所以水的离子积常数相同,根据b点可知, c(H+)·c(OH-)=10-14,A项正确;bd线段上任意一点都满足c(H+)=c(OH-),溶液一定呈中性,B项正确;d点时,c(H+)=c(OH-)=1×10-6 mol·L-1>1×10-7 mol·L-1,溶液的pH=6,水的电离为吸热反应,所以d点温度高于25 ℃,C项正确;在c点c(H+)=1×10-8 mol·L-1,c(OH-)=1×10-6 mol·L-1,溶液显碱性,而醋酸钠溶液显碱性,所以c点可能为醋酸钠溶液,D项错误。
课堂练习
典例2.
【答案】C
【解析】25 ℃时,纯水的pH=7,4 ℃时,纯水的电离程度减小,pH稍大于7,A错误;温度升高,水的电离平衡向右移动,c(H+)与c(OH-)均增大,B错误;水是一种极弱的电解质,电离程度很小,25 ℃时,纯水电离出的H+浓度只有1.0×10-7 mol·L-1,纯水中主要存在形态是水分子,C正确;水的离子积不受溶液酸碱性的影响,D错误
课堂练习
水是最宝贵的资源之一。下列表述正确的是( )
A.4 ℃时,纯水的pH=7
B.温度升高,纯水中的c(H+)增大,c(OH-)减小
C.水的电离程度很小,纯水中主要存在形态是水分子
D.向水中加入酸或碱,都可抑制水的电离,使水的离子积减小
典例3.
【答案】A
【解析】A项,二者c(H+)、c(OH-)相同,对水电离抑制程度相同;B、C项,没有告诉温度,Kw不知,无法求水电离出的cH2O(H+)、cH2O(OH-);D项,二者均抑制水电离。
课堂练习
在相同温度下,0.01 mol·L-1的NaOH溶液和0.01 mol·L-1的盐酸相比较,下列说法正确的是( )
A.由水电离出的c(H+)相等
B.由水电离出的c(H+)都是1.0×10-12 mol·L-1
C.由水电离出的c(OH-)都是0.01 mol·L-1
D.两者都促进了水的电离
课堂小结
课堂小任务
德国化学家西奥多·格罗特斯在1806年的“电流分解液体的理论”中,格罗特斯提出了水电导率理论。格罗特斯提出:质子通过氢键与O-H共价键为桥梁,在相邻两个水分子间跳跃前行,完成传递。这就是著名的格罗斯特机制,又名“质子跳跃”机制。
200年以来,随着微观表征技术的进步,科学家们渐渐意识到,格罗斯特机制并非严格正确。但打破了旧机理,却没有迎来公认的新理论。因此,格罗斯特机制一直存在于教科书中,用以解释质子在水中的传递过程。
daluhuaxuegognuzoushi
格罗斯特机制
拓展延伸
感 谢 倾 听
第1课时 水的电离
人教版选择性必修1
学习目标
1.认识水的电离,水是一种极弱的电解质。
2.结合电离常数,了解水的离子积常数,其适用于任何水溶液。能够运用水的离子积常数进行有关计算及判断。
学习目标
1.能从微观角度通过c(H+)和c(OH-)的相对大小判断溶液的酸碱性,同时从宏观角度通过pH计、pH试纸等判断溶液的酸碱性,培养“宏观辨识与微观探析”学科素养。
2.能从电离平衡的角度,理解外界条件对水的电离平衡的影响,解释溶液酸碱性的变化,培养“变化观念与平衡思想”
3.理解水的离子积常数,形成认知模型,能够运用水的离子积常数进行有关计算及判断,培养“证据推理与模型认知”学科素养。
素养目标
情境引入
在水溶液中,酸、碱和盐全部或部分以离子形式存在,那么,其中的溶剂水是全部以分子形式存在,还是部分以离子形式存在呢? 怎样验证你的猜想?
教学过程
【实验探究1】水的导电性实验
一、水的电离
蒸馏水
实验现象
实验结论
(1)灵敏电流表指针偏转;(2)灯泡不亮。
水是一种极弱的电解质,能发生微弱的电离
教学过程
精确的电导性实验表明:纯水大部分以H2O分子的形式存在,但其中也存在着极少量的离子。
电导率仪
【实验探究2】利用手持技术测定水的电导率
教学过程
+
+
H2O+H2O
OH-
H3O+
1.水的电离方程式
+
简写为:H2O H++OH-
水是一种极弱的电解质,能发生微弱的电离
教学过程
当水的电离达到平衡时,电离平衡常数K 的表达式为:
Kw 水的离子积常数,简称水的离子积
2.水的离子积常数
K =????(????+)·????(?????????)????(????????????)
?
K?????(????????????)=????(????+)·????(?????????)
?
纯水及稀溶液中c(H2O)为常数
????????=?????(????+)·????(?????????)
?
教学过程
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}不同温度下水的离子积常数
t/℃
0
10
20
25
40
50
90
100
Kw/10-14
0.115
0.296
0.687
1.01
2.87
5.31
37.1
54.5
【思考】分析表格中的数据,有何规律,得出什么结论?并解释?
水的电离是吸热过程,升高温度,促进水的电离, Kw增大。
常温(25 ℃)下, Kw =c(H+) · c(OH-) =1.0×10-14
结论:
教学过程
注意:
(1)Kw是温度函数,只随温度的升高而增大, 与c(H+) 、c(OH-) 无关。
(2)Kw适用于一定温度下任何稀的电解质溶液, 不管是哪种溶液均有: c(H+)H2O = c (OH―)H2O KW=c (H+)溶液·c (OH―)溶液
(3)在任何水溶液中,均存在水的电离平衡,也就是任何水溶液中都是H+、OH-共存的。
教学过程
3.水的电离平衡
根据水的电离平衡,思考下列情况中,c(H+)和c(OH-)的如何变化?
条件
移动方向
c(H+)
c(OH-)
电离程度
Kw
升温
通入HCl(g)
加入NaOH(s)
加入少量Na(s)
加入NaHSO4(s)
H2O?? H+ +OH-
?
教学过程
条件
移动方向
c(H+)
c(OH-)
电离程度
Kw
升温
右移
增大
增大
增大
增大
通入HCl(g)
左移
增大
减小
减小
不变
通入NaOH(s)
左移
减小
增大
减小
不变
加 入少量Na(s)
右移
减小
增大
增大
不变
加入NaHSO4(s)
左移
增大
减小
减小
不变
3.水的电离平衡
根据水的电离平衡,思考下列情况中,c(H+)和c(OH-)的如何变化?
H2O?? H+ +OH-
?
教学过程
1、 温度升高,促进水的电离,Kw增大;
3、外加能与H+、OH- 反应的物质,会促进水的电离,Kw不变。
2、酸(H+)、碱(OH- )抑制水的电离,Kw不变;
总结归纳
教学过程
(1)曲线上的任意点的Kw都相同,即c(H+)·c(OH-)相同,温度相同。 (2)曲线外的任意点与曲线上任意点的Kw不同,温度不同。 (3)实现曲线上点之间的转化需保持温度相同,改变酸碱性;实现曲线上点与曲线外点之间的转化一定改变温度。
4.水的电离曲线
典例1.25 ℃时,水溶液中c(H+)与c(OH-)的变化关系如图所示,下列判断错误的是( )
A.ac曲线上的任意一点都有c(H+)·c(OH-)=10-14 B.bd线段上任意一点对应的溶液都呈中性 C.d点对应溶液的温度高于25 ℃,pH<7 D.c点溶液不可能是盐溶液
【答案】D 【解析】ac曲线上的任意一点,由于温度相同,所以水的离子积常数相同,根据b点可知, c(H+)·c(OH-)=10-14,A项正确;bd线段上任意一点都满足c(H+)=c(OH-),溶液一定呈中性,B项正确;d点时,c(H+)=c(OH-)=1×10-6 mol·L-1>1×10-7 mol·L-1,溶液的pH=6,水的电离为吸热反应,所以d点温度高于25 ℃,C项正确;在c点c(H+)=1×10-8 mol·L-1,c(OH-)=1×10-6 mol·L-1,溶液显碱性,而醋酸钠溶液显碱性,所以c点可能为醋酸钠溶液,D项错误。
课堂练习
典例2.
【答案】C
【解析】25 ℃时,纯水的pH=7,4 ℃时,纯水的电离程度减小,pH稍大于7,A错误;温度升高,水的电离平衡向右移动,c(H+)与c(OH-)均增大,B错误;水是一种极弱的电解质,电离程度很小,25 ℃时,纯水电离出的H+浓度只有1.0×10-7 mol·L-1,纯水中主要存在形态是水分子,C正确;水的离子积不受溶液酸碱性的影响,D错误
课堂练习
水是最宝贵的资源之一。下列表述正确的是( )
A.4 ℃时,纯水的pH=7
B.温度升高,纯水中的c(H+)增大,c(OH-)减小
C.水的电离程度很小,纯水中主要存在形态是水分子
D.向水中加入酸或碱,都可抑制水的电离,使水的离子积减小
典例3.
【答案】A
【解析】A项,二者c(H+)、c(OH-)相同,对水电离抑制程度相同;B、C项,没有告诉温度,Kw不知,无法求水电离出的cH2O(H+)、cH2O(OH-);D项,二者均抑制水电离。
课堂练习
在相同温度下,0.01 mol·L-1的NaOH溶液和0.01 mol·L-1的盐酸相比较,下列说法正确的是( )
A.由水电离出的c(H+)相等
B.由水电离出的c(H+)都是1.0×10-12 mol·L-1
C.由水电离出的c(OH-)都是0.01 mol·L-1
D.两者都促进了水的电离
课堂小结
课堂小任务
德国化学家西奥多·格罗特斯在1806年的“电流分解液体的理论”中,格罗特斯提出了水电导率理论。格罗特斯提出:质子通过氢键与O-H共价键为桥梁,在相邻两个水分子间跳跃前行,完成传递。这就是著名的格罗斯特机制,又名“质子跳跃”机制。
200年以来,随着微观表征技术的进步,科学家们渐渐意识到,格罗斯特机制并非严格正确。但打破了旧机理,却没有迎来公认的新理论。因此,格罗斯特机制一直存在于教科书中,用以解释质子在水中的传递过程。
daluhuaxuegognuzoushi
格罗斯特机制
拓展延伸
感 谢 倾 听
