第三单元 物质构成的奥秘——2023-2024 学年初中化学上学期单元卷(含答案)
文档属性
| 名称 | 第三单元 物质构成的奥秘——2023-2024 学年初中化学上学期单元卷(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 182.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-18 00:00:00 | ||
图片预览



文档简介
第三单元 物质构成的奥秘
1.下列关于空气的说法正确的是( )
A.空气是由多种物质组成的 B.空气是由多种元素组成的
C.空气是由多种原子构成的 D.空气是由空气分子构成的
2.元素观、微粒观是化学的重要观念。下列有关元素和微粒的说法不正确的是( )
A.分子、原子和离子都是构成物质的粒子
B.质子数相同的两种粒子属于同种元素
C.元素的原子序数与该元素原子核电荷数在数值上相同
D.在物质发生化学变化时,原子的种类不变,元素的种类也不会改变
3.2020年6月23日我国的北斗导航“收官之星”在西昌发射成功,北斗导航卫星系统采用铷原子钟提供精确时间,铷元素在元素周期表中的相关信息与铷原子的结构示意图如图。下列说法不正确的是( )
A.铷属于金属元素
B.的值是37,的值是1
C.铷的相对原子质量为85.47g
D.在化学反应中,铷原子容易失去电子变成阳离子
4.下列符号既可以表示一个原子,又可以表示一种元素,还可以表示一种物质的是( )
A. B.2N C.Au D.O
5.如图是钠与氯气()反应生成氯化钠的模拟图。下列相关叙述中不正确的是( )
A.钠原子易失去一个电子,氯原子易得到一个电子
B.反应中氯分子分成氯原子
C.核外电子在化学反应中起着重要作用
D.钠离子与钠原子有相似的化学性质
6.地壳中的元素分布如图,其中区域②代表的元素是( )
A.氧 B.硅 C.铝 D.铁
7.保持二氧化碳化学性质的最小微粒是( )
A.氧分子 B.碳原子 C.二氧化碳分子 D.氧原子
8.在原子结构中,与元素的化学性质关系最密切的是( )
A.核外电子数 B.最外层电子数 C.相对原子质量 D.核内质子数
9.如图是元素周期表中硫元素的信息示意图,下列对图中信息理解错误的是( )
A.原子质量——32.06g B.元素名称——硫
C.元素符号——S D.原子序数——16
10.下列对于宏观现象的微观解释错误的是( )
A.变瘪的乒乓球放入热水中能鼓起来,是因为分子受热膨胀变大
B.氧气加压后变成液态氧,是因为分子间的间隔变小
C.氧气可支持燃烧,二氧化碳不支持燃烧,是因为不同的分子性质不同
D.非吸烟者受到被动吸烟的危害,是因为分子在不断地运动
11.若一个碳12原子的质量为千克,某元素一个原子的质量为千克,则该元素的相对原子质量为( )
A. B. C.克 D.
12.回答下列问题:
(1)用化学用语填空:锌元素______;2个氢原子_______;2个镁离子_____。
(2)在分子、原子、质子、中子、电子中,找出符合下列条件的粒子名称,填在相应的横线上。
①能直接构成纯净物的粒子是______________。
②能保持物质化学性质的粒子是______________。
③化学变化中的最小粒子是______________。
④带正电荷的粒子是______________。
⑤带负电荷的粒子是______________。
⑥不显电性的粒子是______________。
⑦决定原子质量大小的粒子是______________。
⑧在同一原子中数目相等的粒子是______________。
13.元素周期表是学习化学的重要工具,如表为元素周期表中部分元素的相关信息,利用表中信息回答相关问题。
(1)表中金属元素有__________种。
(2)C、N、O排在同一周期是因为________相同。
(3)He和Mg的化学性质_________(填“相似”或“不相似”)。
(4)氟的相对原子质量是________。
(5)1个磷原子含有___________个质子,1个含有_________个电子。
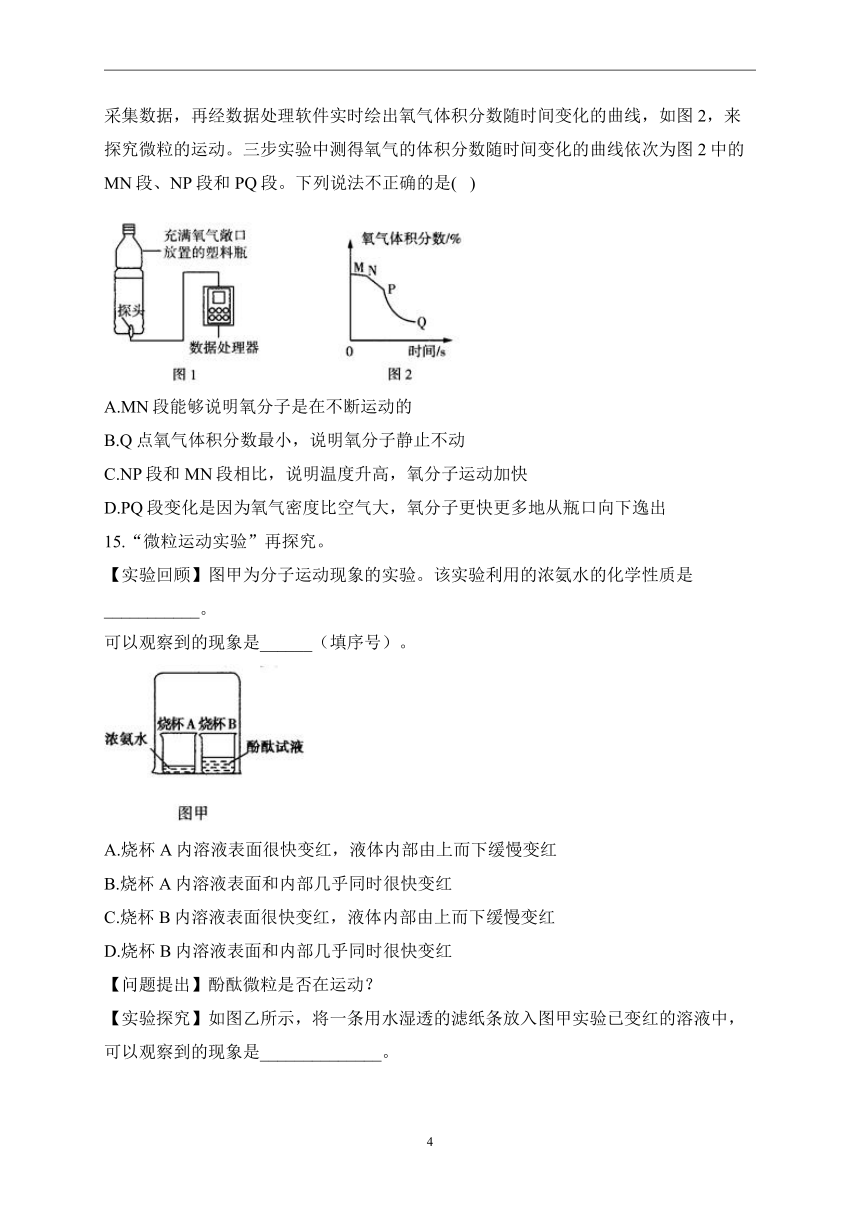
14.某化学兴趣小组收集一塑料瓶氧气进行以下三步实验:①敞口放置;②双手贴在塑料瓶外壁上;③将塑料瓶的瓶口朝下。并运用如图1实验装置,借助氧气传感器探头采集数据,再经数据处理软件实时绘出氧气体积分数随时间变化的曲线,如图2,来探究微粒的运动。三步实验中测得氧气的体积分数随时间变化的曲线依次为图2中的MN段、NP段和PQ段。下列说法不正确的是( )
A.MN段能够说明氧分子是在不断运动的
B.Q点氧气体积分数最小,说明氧分子静止不动
C.NP段和MN段相比,说明温度升高,氧分子运动加快
D.PQ段变化是因为氧气密度比空气大,氧分子更快更多地从瓶口向下逸出
15.“微粒运动实验”再探究。
【实验回顾】图甲为分子运动现象的实验。该实验利用的浓氨水的化学性质是___________。
可以观察到的现象是______(填序号)。
A.烧杯A内溶液表面很快变红,液体内部由上而下缓慢变红
B.烧杯A内溶液表面和内部几乎同时很快变红
C.烧杯B内溶液表面很快变红,液体内部由上而下缓慢变红
D.烧杯B内溶液表面和内部几乎同时很快变红
【问题提出】酚酞微粒是否在运动?
【实验探究】如图乙所示,将一条用水湿透的滤纸条放入图甲实验已变红的溶液中,可以观察到的现象是______________。
【表达交流】同学们讨论后认为,只利用图甲中药品,不用滤纸条,改用胶头滴管也能完成实验探究,则操作步骤和现象是______________。
【实验结论】由本实验可以得出有关微粒运动的结论是______(不定项选择)。
A.有的微粒是运动的,有的微粒是静止的
B.微粒都在不停地运动,但运动速率可能不同
C.微粒的运动速率与微粒的种类有关
D.微粒的运动速率与所处介质有关
E.微粒的运动速率与温度有关
答案以及解析
1.答案:A
解析:空气是由氧气、氮气等物质组成,由氧分子、氮分子等粒子构成。
2.答案:B
解析:分子、原子和离子都是构成物质的粒子;粒子可以是分子、原子或离子,质子数相同的两种粒子不一定属于同种元素,如水分子和氖原子的质子数相同,但不能说两者属于同种元素;元素周期表是按照原子序数依次增多的顺序排列起来的,故原子的原子序数与原子核电荷数在数值上相等;在物质发生化学变化时,原子的种类不变,元素的种类也不会改变。故选B 。
3.答案:C
解析:铷带“钅”字旁,属于金属元素,A正确。根据元素周期表中的一格中信息可知,左上角的数字为37,表示原子序数为37;根据原子中原子序数=核电荷数=质子数=核外电子数,则该元素的原子核内质子数和核外电子数为37,的值是37;原子中,质子数=核外电子数,37=2+8+18+8+,=1,B正确。相对原子质量是一个比值,单位为“1”,常省略不写,铷的相对原子质量为85.47,C错误。铷原子的最外层电子数为1,在化学反应中易失去1个电子而形成带1个单位正电荷的阳离子,D正确。
4.答案:C
解析:可以表示1个氢分子,还可以表示氢气这种物质;2N只能表示2个氮原子;Au可以表示1个金原子,又可以表示金元素,还可以表示金这种物质;O可以表示1个氧原子,还可以表示氧元素。故选C。
5.答案:D
解析:由题中图示可知,钠原子易失去一个电子,氯原子易得到一个电子,A选项正确;由化学变化的实质以及题中图示可知,反应中氯分子会先分解成氯原子,再与钠原子通过得失电子分别形成离子,由于静电作用,进而形成氯化钠这种由离子构成的化合物,B选项正确;元素的化学性质与原子的最外层电子数有密切关系,C选项正确;钠离子与钠原子的最外层电子数不同,化学性质不同,D选项错误。故选D。
6.答案:B
解析:地壳中含量最多的元素是氧,其次是硅,根据图示,区域②代表的是硅。
7.答案:C
解析:由分子构成的物质,分子是保持其化学性质的最小微粒,二氧化碳是由二氧化碳分子构成的,因此保持二氧化碳化学性质的最小微粒是二氧化碳分子。故选C。
8.答案:B
解析:原子最外层电子数与元素的化学性质关系最密切。
9.答案:A
解析:32.06是硫原子的相对原子质量。相对原子质量是个比值,单位为“1”,常省略不写。故选A。
10.答案:A
解析:变瘪的乒乓球放入热水中能鼓起来,是因为受热时分子间隔变大,而不是分子自身体积变大。
11.答案:D
解析:根据相对原子质量的概念列式进行计算。
12.答案:(1) Zn;2H;
(2)①分子、原子
②分子、原子
③原子
④质子
⑤电子
⑥分子、原子、中子
⑦质子、中子
⑧质子、电子
解析:
13.答案:(1)5
(2)核外电子层数
(3)不相似
(4)19.00
(5)15;10
解析:(3)氦原子只有一个电子层,该电子层上有2个电子,属于稳定结构;镁原子的最外电子层上有2个电子,在化学反应中易失去最外层电子,二者化学性质不相似。
(5)磷元素的原子序数为15,即1个磷原子中含有15个质子;1个氮原子含有7个电子,1个氢原子含有1个电子,所以1个含有个电子。
14.答案:B
解析:敞口放置氧气体积分数不断减小,是由于氧分子不断运动,部分氧分子运动到瓶外,MN段能够说明氧分子是不断运动的;NP段,双手贴在塑料瓶外壁上,瓶内温度升高,分子间间隔变大,运动速率加快;PQ段是将塑料瓶的瓶口朝下,由于氧气的密度比空气大,部分氧气会由于重力作用而快速下降逸出;Q点氧分子是在不断运动的。故选B。
15.答案:【实验回顾】能使酚酞试液变红;C
【实验探究】滤纸条由下往上逐渐变红
【表达交流】用胶头滴管吸取变红的酚酞试液滴入浓氨水中,溶液逐渐全部变红
【实验结论】BCD
解析:【实验回顾】浓氨水具有挥发性,能挥发出氨气,氨气溶于水形成氨水,氨水能使酚酞试液变红,所以该实验利用了氨水能使酚酞变红的化学性质。可以观察到的现象:烧杯B内溶液表面很快变红,液体内部由上而下缓慢变红。
【实验结论】此实验没有涉及微粒的运动速率与温度的关系。
2
1.下列关于空气的说法正确的是( )
A.空气是由多种物质组成的 B.空气是由多种元素组成的
C.空气是由多种原子构成的 D.空气是由空气分子构成的
2.元素观、微粒观是化学的重要观念。下列有关元素和微粒的说法不正确的是( )
A.分子、原子和离子都是构成物质的粒子
B.质子数相同的两种粒子属于同种元素
C.元素的原子序数与该元素原子核电荷数在数值上相同
D.在物质发生化学变化时,原子的种类不变,元素的种类也不会改变
3.2020年6月23日我国的北斗导航“收官之星”在西昌发射成功,北斗导航卫星系统采用铷原子钟提供精确时间,铷元素在元素周期表中的相关信息与铷原子的结构示意图如图。下列说法不正确的是( )
A.铷属于金属元素
B.的值是37,的值是1
C.铷的相对原子质量为85.47g
D.在化学反应中,铷原子容易失去电子变成阳离子
4.下列符号既可以表示一个原子,又可以表示一种元素,还可以表示一种物质的是( )
A. B.2N C.Au D.O
5.如图是钠与氯气()反应生成氯化钠的模拟图。下列相关叙述中不正确的是( )
A.钠原子易失去一个电子,氯原子易得到一个电子
B.反应中氯分子分成氯原子
C.核外电子在化学反应中起着重要作用
D.钠离子与钠原子有相似的化学性质
6.地壳中的元素分布如图,其中区域②代表的元素是( )
A.氧 B.硅 C.铝 D.铁
7.保持二氧化碳化学性质的最小微粒是( )
A.氧分子 B.碳原子 C.二氧化碳分子 D.氧原子
8.在原子结构中,与元素的化学性质关系最密切的是( )
A.核外电子数 B.最外层电子数 C.相对原子质量 D.核内质子数
9.如图是元素周期表中硫元素的信息示意图,下列对图中信息理解错误的是( )
A.原子质量——32.06g B.元素名称——硫
C.元素符号——S D.原子序数——16
10.下列对于宏观现象的微观解释错误的是( )
A.变瘪的乒乓球放入热水中能鼓起来,是因为分子受热膨胀变大
B.氧气加压后变成液态氧,是因为分子间的间隔变小
C.氧气可支持燃烧,二氧化碳不支持燃烧,是因为不同的分子性质不同
D.非吸烟者受到被动吸烟的危害,是因为分子在不断地运动
11.若一个碳12原子的质量为千克,某元素一个原子的质量为千克,则该元素的相对原子质量为( )
A. B. C.克 D.
12.回答下列问题:
(1)用化学用语填空:锌元素______;2个氢原子_______;2个镁离子_____。
(2)在分子、原子、质子、中子、电子中,找出符合下列条件的粒子名称,填在相应的横线上。
①能直接构成纯净物的粒子是______________。
②能保持物质化学性质的粒子是______________。
③化学变化中的最小粒子是______________。
④带正电荷的粒子是______________。
⑤带负电荷的粒子是______________。
⑥不显电性的粒子是______________。
⑦决定原子质量大小的粒子是______________。
⑧在同一原子中数目相等的粒子是______________。
13.元素周期表是学习化学的重要工具,如表为元素周期表中部分元素的相关信息,利用表中信息回答相关问题。
(1)表中金属元素有__________种。
(2)C、N、O排在同一周期是因为________相同。
(3)He和Mg的化学性质_________(填“相似”或“不相似”)。
(4)氟的相对原子质量是________。
(5)1个磷原子含有___________个质子,1个含有_________个电子。
14.某化学兴趣小组收集一塑料瓶氧气进行以下三步实验:①敞口放置;②双手贴在塑料瓶外壁上;③将塑料瓶的瓶口朝下。并运用如图1实验装置,借助氧气传感器探头采集数据,再经数据处理软件实时绘出氧气体积分数随时间变化的曲线,如图2,来探究微粒的运动。三步实验中测得氧气的体积分数随时间变化的曲线依次为图2中的MN段、NP段和PQ段。下列说法不正确的是( )
A.MN段能够说明氧分子是在不断运动的
B.Q点氧气体积分数最小,说明氧分子静止不动
C.NP段和MN段相比,说明温度升高,氧分子运动加快
D.PQ段变化是因为氧气密度比空气大,氧分子更快更多地从瓶口向下逸出
15.“微粒运动实验”再探究。
【实验回顾】图甲为分子运动现象的实验。该实验利用的浓氨水的化学性质是___________。
可以观察到的现象是______(填序号)。
A.烧杯A内溶液表面很快变红,液体内部由上而下缓慢变红
B.烧杯A内溶液表面和内部几乎同时很快变红
C.烧杯B内溶液表面很快变红,液体内部由上而下缓慢变红
D.烧杯B内溶液表面和内部几乎同时很快变红
【问题提出】酚酞微粒是否在运动?
【实验探究】如图乙所示,将一条用水湿透的滤纸条放入图甲实验已变红的溶液中,可以观察到的现象是______________。
【表达交流】同学们讨论后认为,只利用图甲中药品,不用滤纸条,改用胶头滴管也能完成实验探究,则操作步骤和现象是______________。
【实验结论】由本实验可以得出有关微粒运动的结论是______(不定项选择)。
A.有的微粒是运动的,有的微粒是静止的
B.微粒都在不停地运动,但运动速率可能不同
C.微粒的运动速率与微粒的种类有关
D.微粒的运动速率与所处介质有关
E.微粒的运动速率与温度有关
答案以及解析
1.答案:A
解析:空气是由氧气、氮气等物质组成,由氧分子、氮分子等粒子构成。
2.答案:B
解析:分子、原子和离子都是构成物质的粒子;粒子可以是分子、原子或离子,质子数相同的两种粒子不一定属于同种元素,如水分子和氖原子的质子数相同,但不能说两者属于同种元素;元素周期表是按照原子序数依次增多的顺序排列起来的,故原子的原子序数与原子核电荷数在数值上相等;在物质发生化学变化时,原子的种类不变,元素的种类也不会改变。故选B 。
3.答案:C
解析:铷带“钅”字旁,属于金属元素,A正确。根据元素周期表中的一格中信息可知,左上角的数字为37,表示原子序数为37;根据原子中原子序数=核电荷数=质子数=核外电子数,则该元素的原子核内质子数和核外电子数为37,的值是37;原子中,质子数=核外电子数,37=2+8+18+8+,=1,B正确。相对原子质量是一个比值,单位为“1”,常省略不写,铷的相对原子质量为85.47,C错误。铷原子的最外层电子数为1,在化学反应中易失去1个电子而形成带1个单位正电荷的阳离子,D正确。
4.答案:C
解析:可以表示1个氢分子,还可以表示氢气这种物质;2N只能表示2个氮原子;Au可以表示1个金原子,又可以表示金元素,还可以表示金这种物质;O可以表示1个氧原子,还可以表示氧元素。故选C。
5.答案:D
解析:由题中图示可知,钠原子易失去一个电子,氯原子易得到一个电子,A选项正确;由化学变化的实质以及题中图示可知,反应中氯分子会先分解成氯原子,再与钠原子通过得失电子分别形成离子,由于静电作用,进而形成氯化钠这种由离子构成的化合物,B选项正确;元素的化学性质与原子的最外层电子数有密切关系,C选项正确;钠离子与钠原子的最外层电子数不同,化学性质不同,D选项错误。故选D。
6.答案:B
解析:地壳中含量最多的元素是氧,其次是硅,根据图示,区域②代表的是硅。
7.答案:C
解析:由分子构成的物质,分子是保持其化学性质的最小微粒,二氧化碳是由二氧化碳分子构成的,因此保持二氧化碳化学性质的最小微粒是二氧化碳分子。故选C。
8.答案:B
解析:原子最外层电子数与元素的化学性质关系最密切。
9.答案:A
解析:32.06是硫原子的相对原子质量。相对原子质量是个比值,单位为“1”,常省略不写。故选A。
10.答案:A
解析:变瘪的乒乓球放入热水中能鼓起来,是因为受热时分子间隔变大,而不是分子自身体积变大。
11.答案:D
解析:根据相对原子质量的概念列式进行计算。
12.答案:(1) Zn;2H;
(2)①分子、原子
②分子、原子
③原子
④质子
⑤电子
⑥分子、原子、中子
⑦质子、中子
⑧质子、电子
解析:
13.答案:(1)5
(2)核外电子层数
(3)不相似
(4)19.00
(5)15;10
解析:(3)氦原子只有一个电子层,该电子层上有2个电子,属于稳定结构;镁原子的最外电子层上有2个电子,在化学反应中易失去最外层电子,二者化学性质不相似。
(5)磷元素的原子序数为15,即1个磷原子中含有15个质子;1个氮原子含有7个电子,1个氢原子含有1个电子,所以1个含有个电子。
14.答案:B
解析:敞口放置氧气体积分数不断减小,是由于氧分子不断运动,部分氧分子运动到瓶外,MN段能够说明氧分子是不断运动的;NP段,双手贴在塑料瓶外壁上,瓶内温度升高,分子间间隔变大,运动速率加快;PQ段是将塑料瓶的瓶口朝下,由于氧气的密度比空气大,部分氧气会由于重力作用而快速下降逸出;Q点氧分子是在不断运动的。故选B。
15.答案:【实验回顾】能使酚酞试液变红;C
【实验探究】滤纸条由下往上逐渐变红
【表达交流】用胶头滴管吸取变红的酚酞试液滴入浓氨水中,溶液逐渐全部变红
【实验结论】BCD
解析:【实验回顾】浓氨水具有挥发性,能挥发出氨气,氨气溶于水形成氨水,氨水能使酚酞试液变红,所以该实验利用了氨水能使酚酞变红的化学性质。可以观察到的现象:烧杯B内溶液表面很快变红,液体内部由上而下缓慢变红。
【实验结论】此实验没有涉及微粒的运动速率与温度的关系。
2
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
