1.1.1原子核 核素 课件(共24张PPT)-2023-2024学年高一化学鲁教版必修第二册课件
文档属性
| 名称 | 1.1.1原子核 核素 课件(共24张PPT)-2023-2024学年高一化学鲁教版必修第二册课件 |

|
|
| 格式 | pptx | ||
| 文件大小 | 451.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-18 20:15:23 | ||
图片预览







文档简介
(共24张PPT)
第1节 原子结构与元素性质
课时1 原子核 核素
第1章
原子结构 元素周期律
带一个单位 电荷
带一个单位 电荷
一、原子核
1. 原子的构成
正
负
原子核
质子:
原子
不带电
核外电子:
中子:
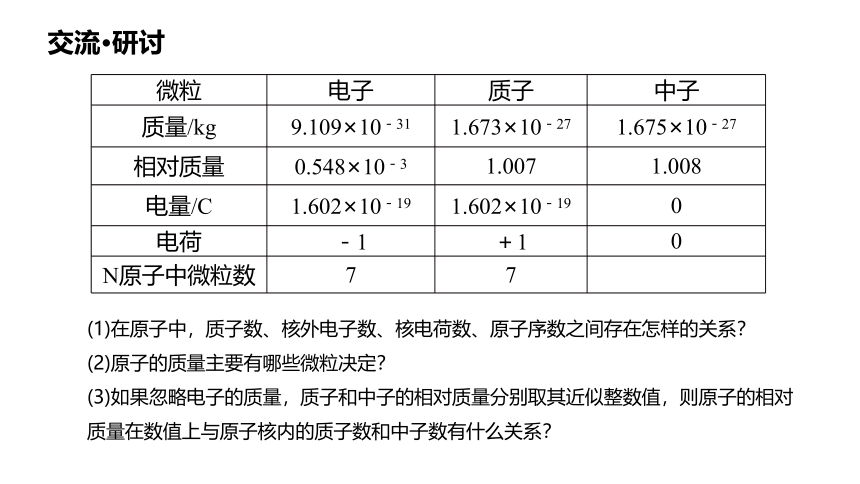
微粒 电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.548×10-3 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
N原子中微粒数 7 7
交流·研讨
(1)在原子中,质子数、核外电子数、核电荷数、原子序数之间存在怎样的关系?
(2)原子的质量主要有哪些微粒决定?
(3)如果忽略电子的质量,质子和中子的相对质量分别取其近似整数值,则原子的相对质量在数值上与原子核内的质子数和中子数有什么关系?
(1)在原子中,质子数、核外电子数、核电荷数、原子序数之间存在怎样的关系?
原子:质子数 = 核外电子数 = 核电荷数 = 原子序数
原子
失电子
阳离子
得电子
阴离子
核内质子数>核外电子数
核内质子数<核外电子数
(2)原子的质量主要有哪些微粒决定?
电子的质量很小,相对于质子、中子的质量可以忽略不计,因此原子的质量可以看作原子核中质子和中子的质量之和,人们将原子核中质子和中子数之和称之为质量数(A)
质子数(Z)+中子数(N) = 质量数(A)
(3)如果忽略电子的质量,质子和中子的相对质量分别取其近似整数值,则原子的相对质量在数值上与原子核内的质子数和中子数有什么关系?
2.原子组成表示方法
X
A
Z
—元素符号
质量数 —
一般用符号 表示一个质量数为A、质子数为Z的原子
质子数 —
原子核
质子:
原子
核外电子:
中子:
Z个
(A—Z)个
Z个
交流·研讨
a
b
+
d
X
c+
-
-
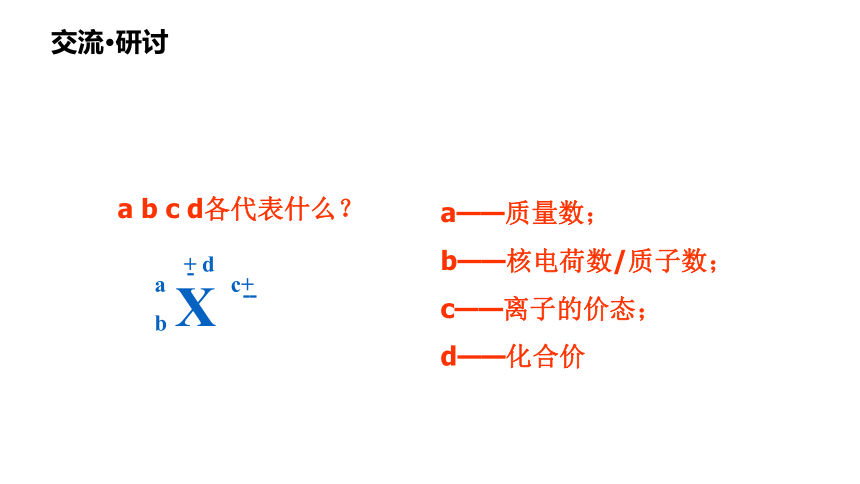
a b c d各代表什么?
a——质量数;
b——核电荷数/质子数;
c——离子的价态;
d——化合价
-
提示:×。 的质子数为1,中子数为0。
(1) 的质子数为1,中子数也为1。 ( )
思考
(2)23Na+的质子数为11,中子数为12,电子数为11。( )
(3)24Mg2+中含有12个中子和12个电子。 ( )
提示:×。23Na+的电子数为10。
提示:×。由于Mg是12号元素,质量数为24,离子失去两个电子,所以24Mg2+中含有12个中子和10个电子。
深入思考:
针对练习:
C
二、核素
观察思考:比较氕(pie)、氘(dao)、氚(chuan)中质子、中子和电子的关系:
H
D
T
0
2
认识氢的核素
质子
中子
质子数
中子数
丰度
相对原子质量
3.元素的相对原子质量
归纳总结:元素、核素、同位素的区别和联系
归纳总结:
第1节 原子结构与元素性质
课时1 原子核 核素
第1章
原子结构 元素周期律
带一个单位 电荷
带一个单位 电荷
一、原子核
1. 原子的构成
正
负
原子核
质子:
原子
不带电
核外电子:
中子:
微粒 电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.548×10-3 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
N原子中微粒数 7 7
交流·研讨
(1)在原子中,质子数、核外电子数、核电荷数、原子序数之间存在怎样的关系?
(2)原子的质量主要有哪些微粒决定?
(3)如果忽略电子的质量,质子和中子的相对质量分别取其近似整数值,则原子的相对质量在数值上与原子核内的质子数和中子数有什么关系?
(1)在原子中,质子数、核外电子数、核电荷数、原子序数之间存在怎样的关系?
原子:质子数 = 核外电子数 = 核电荷数 = 原子序数
原子
失电子
阳离子
得电子
阴离子
核内质子数>核外电子数
核内质子数<核外电子数
(2)原子的质量主要有哪些微粒决定?
电子的质量很小,相对于质子、中子的质量可以忽略不计,因此原子的质量可以看作原子核中质子和中子的质量之和,人们将原子核中质子和中子数之和称之为质量数(A)
质子数(Z)+中子数(N) = 质量数(A)
(3)如果忽略电子的质量,质子和中子的相对质量分别取其近似整数值,则原子的相对质量在数值上与原子核内的质子数和中子数有什么关系?
2.原子组成表示方法
X
A
Z
—元素符号
质量数 —
一般用符号 表示一个质量数为A、质子数为Z的原子
质子数 —
原子核
质子:
原子
核外电子:
中子:
Z个
(A—Z)个
Z个
交流·研讨
a
b
+
d
X
c+
-
-
a b c d各代表什么?
a——质量数;
b——核电荷数/质子数;
c——离子的价态;
d——化合价
-
提示:×。 的质子数为1,中子数为0。
(1) 的质子数为1,中子数也为1。 ( )
思考
(2)23Na+的质子数为11,中子数为12,电子数为11。( )
(3)24Mg2+中含有12个中子和12个电子。 ( )
提示:×。23Na+的电子数为10。
提示:×。由于Mg是12号元素,质量数为24,离子失去两个电子,所以24Mg2+中含有12个中子和10个电子。
深入思考:
针对练习:
C
二、核素
观察思考:比较氕(pie)、氘(dao)、氚(chuan)中质子、中子和电子的关系:
H
D
T
0
2
认识氢的核素
质子
中子
质子数
中子数
丰度
相对原子质量
3.元素的相对原子质量
归纳总结:元素、核素、同位素的区别和联系
归纳总结:
