1.1.2核外电子排布 课件(共25张PPT)-2023-2024学年高一化学鲁版必修第二册课件
文档属性
| 名称 | 1.1.2核外电子排布 课件(共25张PPT)-2023-2024学年高一化学鲁版必修第二册课件 |  | |
| 格式 | pptx | ||
| 文件大小 | 357.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-18 21:23:56 | ||
图片预览





文档简介
(共25张PPT)
第1章
原子结构 元素周期律
第1节 原子结构与元素性质
第2课时 核外电子排布
1.核外电子的分层排布
(1)电子层
在含有多个电子的原子里,由于电子的能量不相同,所以电子运动的区域也不相同。通常能量低的电子在离核较 的区域运动,而能量高的电子在离核较 的区域运动。为了研究问题的方便,科学家认为电子是在原子核外离核由近及远、能量由低到高的不同 上分层排布的。
核外电子排布
近
远
电子层
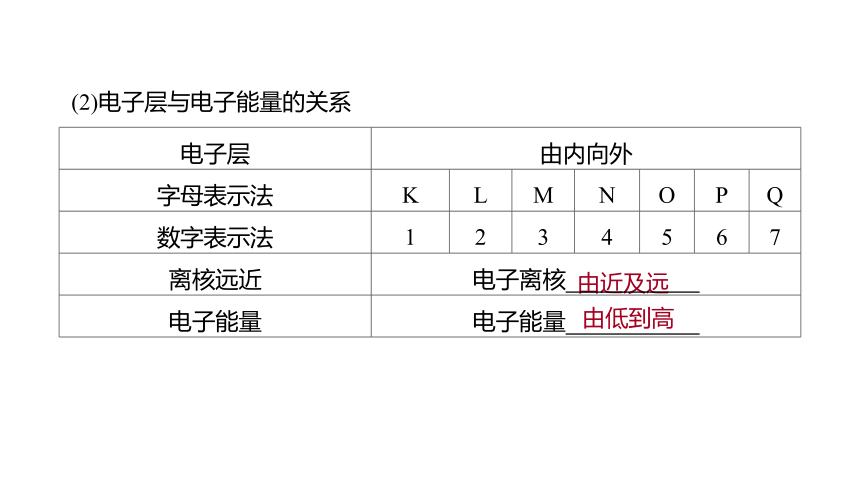
(2)电子层与电子能量的关系
由近及远
由低到高
电子层 由内向外
字母表示法 K L M N O P Q
数字表示法 1 2 3 4 5 6 7
离核远近 电子离核
电子能量 电子能量
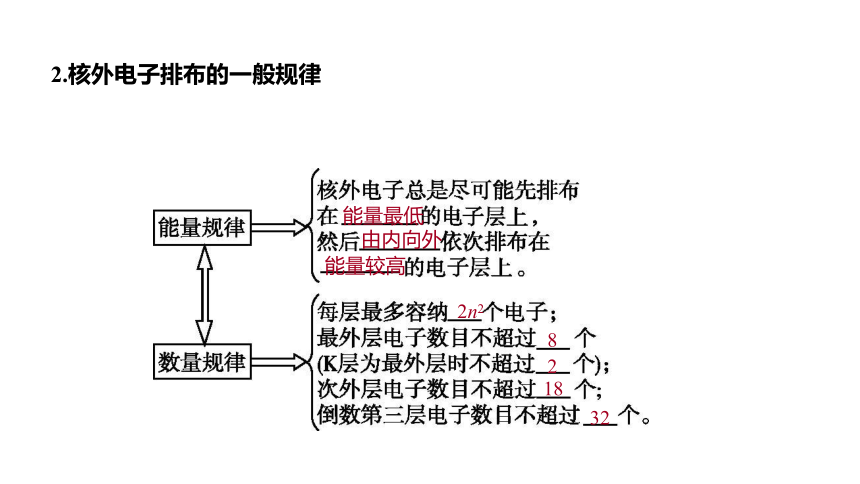
2.核外电子排布的一般规律
能量最低
由内向外
能量较高
2n2
8
2
18
32
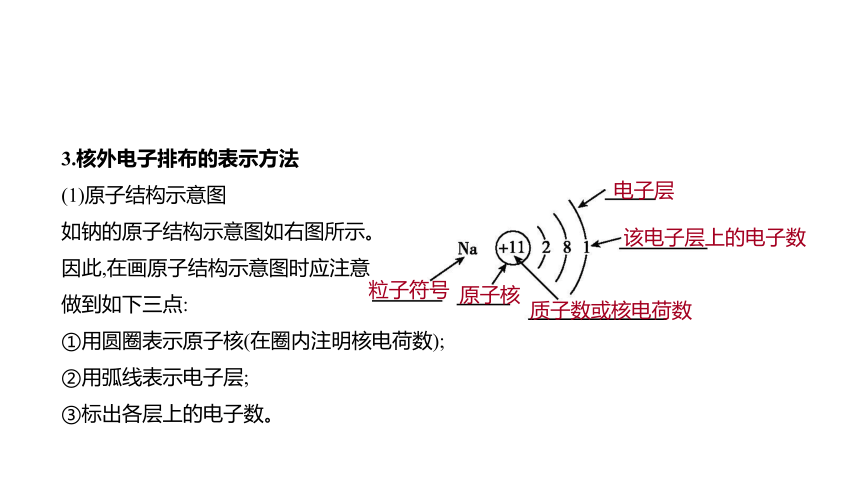
3.核外电子排布的表示方法
(1)原子结构示意图
如钠的原子结构示意图如右图所示。
因此,在画原子结构示意图时应注意
做到如下三点:
①用圆圈表示原子核(在圈内注明核电荷数);
②用弧线表示电子层;
③标出各层上的电子数。
粒子符号
原子核
质子数或核电荷数
电子层
该电子层上的电子数
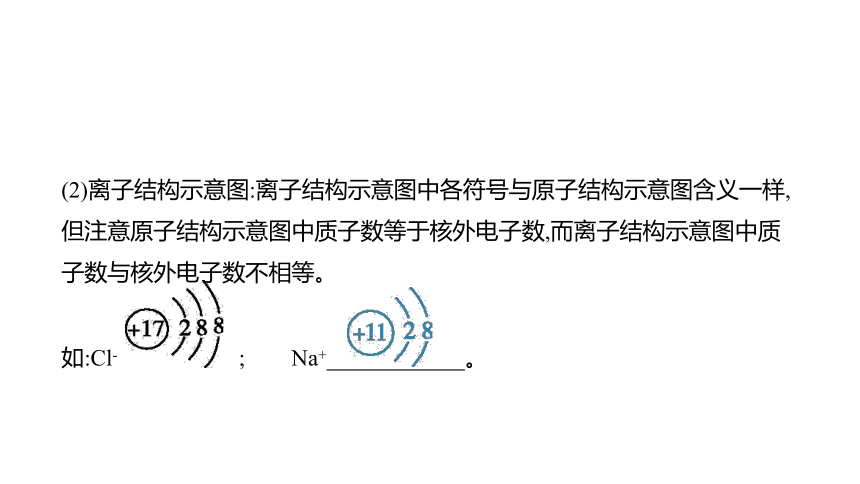
(2)离子结构示意图:离子结构示意图中各符号与原子结构示意图含义一样,但注意原子结构示意图中质子数等于核外电子数,而离子结构示意图中质子数与核外电子数不相等。
如:Cl- ; Na+ 。
[素养养成]
1.核外电子排布相同的微粒化学性质一定相同吗
[答案]不一定,如同位素之间化学性质几乎完全相同;又如Na+与Ne、F-与Mg2+之间化学性质不同。
2.两种微粒的质子数和核外电子数分别相等,它们可能的关系有哪些
3.单核离子的最外层电子一定达到8电子稳定结构吗
[答案]不一定,如Li+、Be2+最外层达到2电子稳定结构,而H+最外层已经没有电子。
例1 下列叙述中正确的是( )
A.电子的能量越低,运动区域离原子核越远
B.核外电子的分层排布即是核外电子的
分层运动
C.稀有气体元素原子的最外层都排有
8个电子
D.当M层是最外层时,最多可排布18个电子
B
[解析] 在离核较近区域内运动的电子能量较低,A错误;
核外电子的分层排布即是核外电子的分层运动,B正确;
氦原子最外层只有2个电子,C错误;
任何电子层作最外层时,所容纳的电子均不超过8个,D错误。
例2 下列微粒的结构示意图中,不正确的是( )
A B C D
B
[解析] A中核电荷数和核外电子数都是8,这是8O的原子结构示意图,正确;
B中核电荷数为11,这是Na的原子核,钠原子的核外有11个电子,钠元素的最高化合价为+1价,Na+的核外应有10个电子,而图中核外只有9个电子,错误;
C中核电荷数和核外电子数都是17,这是17Cl的原子结构示意图,正确;
D中核电荷数和核外电子数分别是17和18,这是17Cl-的结构示意图,正确。
[规律小结] 对核外电子排布规律的理解
1.核外电子排布规律可概括为“一低四不超”。
2.核外电子的排布规律之间既相互联系,又相互制约,不能孤立片面地理解和使用。
如M层不是最外层时,其电子数目最多为18个,当它是最外层时,其电子数目最多是8个。各电子层中的电子数有最大限量,但可以小于这个限量,即不一定都填满。
3.此规律仅为一般规律,有一定的局限性,有些原子的核外电子排布还不能完全用它解释。
4.最外层电子数达到8个(He为2个)时,该原子的结构为相对稳定结构,未达到稳定结构
的原子具有得(失)电子达到稳定结构的倾向,这是原子间能发生反应的内在原因。
1.原子结构与元素性质的关系
元素性质与原子的 电子数密切相关。
(1)稀有气体元素原子最外层电子数为 ,原子结构稳定,原子既不容易 ,
电子,也不容易 电子,化学性质 。
(2)金属元素原子最外层电子数一般 ,原子较易 电子形成阳离子。
(3)非金属元素原子最外层电子数一般 ,原子较易 电子形成阴离子。
元素性质与原子结构的关系
最外层
8(He为2)
获得
失去
不活泼(稳定)
小于4
失去
大于或等于4
获得
2.原子结构与元素化合价的关系
元素的化合价与原子的电子层结构,特别是 有关。
(1)稀有气体元素原子结构为稳定结构,常见化合价为 。
(2)主族金属元素易失去最外层电子,达到稳定结构,其最高正价为 (设m为该元素最外层电子数,下同)。
(3)非金属元素得到一定数目的电子,达到稳定结构,其最低负价为 (H为m-2)。
最外层电子数
零
+m
m-8
稀有气体元素 金属元素 非金属元素
最外层电子数 8(氦为2) 一般小于4 一般大于或等于4
原子得失电子能力 不易得失电子 一般易失电子 一般易得电子
单质氧化(还原)性 一般不跟其他物质反应 只具有还原性 一般具有氧化性
化合价 零价 只显正价,且一般等于最外层电子数 既显正价,也显负价,其最高正价=最外层电子数(除O、F),负价=最外层电子数-8(除H)
[素养养成]
1.金属元素的最外层电子数一定小于4吗
[答案]不一定。如锡和锑的最外层电子数分别为4和5。有些元素,如氢、氦,最外层电子数虽小于4,但却不是金属元素。
2.是否所有的非金属元素原子最外层电子数都大于4,易得电子形成8电子
稳定结构
[答案]不是。如氢、硼两元素原子最外层电子数分别为1、3,氢可以形成最外层为2电子的稳定结构。
例3 核电荷数为1~18的元素中,下列叙述正确的是( )
A.最外层只有1个电子的元素一定是金属元素
B.最外层只有2个电子的元素一定是金属元素
C.原子核外各层电子数相等的元素一定是
金属元素
D.核电荷数为17的元素容易失去1个电子
C
[解析] 在核电荷数为1~18的元素中,最外层只有1个电子的元素有H、Li、Na,其中H是非金属元素,故A项错误;
最外层只有2个电子的元素有He、Be、Mg,其中He是非金属元素,故B项错误;
例3 核电荷数为1~18的元素中,下列叙述正确的是( )
A.最外层只有1个电子的元素一定是金属元素
B.最外层只有2个电子的元素一定是金属元素
C.原子核外各层电子数相等的元素一定是
金属元素
D.核电荷数为17的元素容易失去1个电子
C
原子核外各层电子数相等的元素只有Be,它是金属元素,故C项正确;
核电荷数为17的元素是氯元素,其最外层电子数为7,很容易获得1个电子达到8电子的稳定结构,故D项错误。
例4 有A、B、C三种元素,A元素的原子得到2个电子、B元素的原子失去 1个电子后,所形成的微粒均与氖原子有相同的电子层结构,C元素的原子只有1个电子。试写出:
(1)A、B的元素符号:
A ,B 。
O
[解析] 有A、B、C三种元素,A元素的原子得到2个电子、B元素的原子失去1个电子后,所形成的微粒均与氖原子有相同的电子层结构,则A原子的质子数为10-2=8,故A为氧元素,B原子的质子数为10+1=11,故B为钠元素;C元素的原子只有1个电子,则C为氢元素。由上述分析可知,A为O,B为Na。
Na
(2)画出B元素的离子结构示意图:
。
[解析]钠离子质子数为11,核外有10个电子,有2个电子层,由里到外各层电子数为、
2、8,钠离子结构示意图为 。
(3)写出由该三种元素组成的物质D在水溶液中的电离方程式:
。
NaOH=Na++OH-
[解析]三种元素组成的化合物为NaOH,属于强电解质,在溶液中电离出钠离子与氢氧根离子,电离方程式为NaOH=Na++OH-。
(4)写出与氖原子有相同数目的电子的多核微粒(写一种): 。
CH4
THANKS
第1章
原子结构 元素周期律
第1节 原子结构与元素性质
第2课时 核外电子排布
1.核外电子的分层排布
(1)电子层
在含有多个电子的原子里,由于电子的能量不相同,所以电子运动的区域也不相同。通常能量低的电子在离核较 的区域运动,而能量高的电子在离核较 的区域运动。为了研究问题的方便,科学家认为电子是在原子核外离核由近及远、能量由低到高的不同 上分层排布的。
核外电子排布
近
远
电子层
(2)电子层与电子能量的关系
由近及远
由低到高
电子层 由内向外
字母表示法 K L M N O P Q
数字表示法 1 2 3 4 5 6 7
离核远近 电子离核
电子能量 电子能量
2.核外电子排布的一般规律
能量最低
由内向外
能量较高
2n2
8
2
18
32
3.核外电子排布的表示方法
(1)原子结构示意图
如钠的原子结构示意图如右图所示。
因此,在画原子结构示意图时应注意
做到如下三点:
①用圆圈表示原子核(在圈内注明核电荷数);
②用弧线表示电子层;
③标出各层上的电子数。
粒子符号
原子核
质子数或核电荷数
电子层
该电子层上的电子数
(2)离子结构示意图:离子结构示意图中各符号与原子结构示意图含义一样,但注意原子结构示意图中质子数等于核外电子数,而离子结构示意图中质子数与核外电子数不相等。
如:Cl- ; Na+ 。
[素养养成]
1.核外电子排布相同的微粒化学性质一定相同吗
[答案]不一定,如同位素之间化学性质几乎完全相同;又如Na+与Ne、F-与Mg2+之间化学性质不同。
2.两种微粒的质子数和核外电子数分别相等,它们可能的关系有哪些
3.单核离子的最外层电子一定达到8电子稳定结构吗
[答案]不一定,如Li+、Be2+最外层达到2电子稳定结构,而H+最外层已经没有电子。
例1 下列叙述中正确的是( )
A.电子的能量越低,运动区域离原子核越远
B.核外电子的分层排布即是核外电子的
分层运动
C.稀有气体元素原子的最外层都排有
8个电子
D.当M层是最外层时,最多可排布18个电子
B
[解析] 在离核较近区域内运动的电子能量较低,A错误;
核外电子的分层排布即是核外电子的分层运动,B正确;
氦原子最外层只有2个电子,C错误;
任何电子层作最外层时,所容纳的电子均不超过8个,D错误。
例2 下列微粒的结构示意图中,不正确的是( )
A B C D
B
[解析] A中核电荷数和核外电子数都是8,这是8O的原子结构示意图,正确;
B中核电荷数为11,这是Na的原子核,钠原子的核外有11个电子,钠元素的最高化合价为+1价,Na+的核外应有10个电子,而图中核外只有9个电子,错误;
C中核电荷数和核外电子数都是17,这是17Cl的原子结构示意图,正确;
D中核电荷数和核外电子数分别是17和18,这是17Cl-的结构示意图,正确。
[规律小结] 对核外电子排布规律的理解
1.核外电子排布规律可概括为“一低四不超”。
2.核外电子的排布规律之间既相互联系,又相互制约,不能孤立片面地理解和使用。
如M层不是最外层时,其电子数目最多为18个,当它是最外层时,其电子数目最多是8个。各电子层中的电子数有最大限量,但可以小于这个限量,即不一定都填满。
3.此规律仅为一般规律,有一定的局限性,有些原子的核外电子排布还不能完全用它解释。
4.最外层电子数达到8个(He为2个)时,该原子的结构为相对稳定结构,未达到稳定结构
的原子具有得(失)电子达到稳定结构的倾向,这是原子间能发生反应的内在原因。
1.原子结构与元素性质的关系
元素性质与原子的 电子数密切相关。
(1)稀有气体元素原子最外层电子数为 ,原子结构稳定,原子既不容易 ,
电子,也不容易 电子,化学性质 。
(2)金属元素原子最外层电子数一般 ,原子较易 电子形成阳离子。
(3)非金属元素原子最外层电子数一般 ,原子较易 电子形成阴离子。
元素性质与原子结构的关系
最外层
8(He为2)
获得
失去
不活泼(稳定)
小于4
失去
大于或等于4
获得
2.原子结构与元素化合价的关系
元素的化合价与原子的电子层结构,特别是 有关。
(1)稀有气体元素原子结构为稳定结构,常见化合价为 。
(2)主族金属元素易失去最外层电子,达到稳定结构,其最高正价为 (设m为该元素最外层电子数,下同)。
(3)非金属元素得到一定数目的电子,达到稳定结构,其最低负价为 (H为m-2)。
最外层电子数
零
+m
m-8
稀有气体元素 金属元素 非金属元素
最外层电子数 8(氦为2) 一般小于4 一般大于或等于4
原子得失电子能力 不易得失电子 一般易失电子 一般易得电子
单质氧化(还原)性 一般不跟其他物质反应 只具有还原性 一般具有氧化性
化合价 零价 只显正价,且一般等于最外层电子数 既显正价,也显负价,其最高正价=最外层电子数(除O、F),负价=最外层电子数-8(除H)
[素养养成]
1.金属元素的最外层电子数一定小于4吗
[答案]不一定。如锡和锑的最外层电子数分别为4和5。有些元素,如氢、氦,最外层电子数虽小于4,但却不是金属元素。
2.是否所有的非金属元素原子最外层电子数都大于4,易得电子形成8电子
稳定结构
[答案]不是。如氢、硼两元素原子最外层电子数分别为1、3,氢可以形成最外层为2电子的稳定结构。
例3 核电荷数为1~18的元素中,下列叙述正确的是( )
A.最外层只有1个电子的元素一定是金属元素
B.最外层只有2个电子的元素一定是金属元素
C.原子核外各层电子数相等的元素一定是
金属元素
D.核电荷数为17的元素容易失去1个电子
C
[解析] 在核电荷数为1~18的元素中,最外层只有1个电子的元素有H、Li、Na,其中H是非金属元素,故A项错误;
最外层只有2个电子的元素有He、Be、Mg,其中He是非金属元素,故B项错误;
例3 核电荷数为1~18的元素中,下列叙述正确的是( )
A.最外层只有1个电子的元素一定是金属元素
B.最外层只有2个电子的元素一定是金属元素
C.原子核外各层电子数相等的元素一定是
金属元素
D.核电荷数为17的元素容易失去1个电子
C
原子核外各层电子数相等的元素只有Be,它是金属元素,故C项正确;
核电荷数为17的元素是氯元素,其最外层电子数为7,很容易获得1个电子达到8电子的稳定结构,故D项错误。
例4 有A、B、C三种元素,A元素的原子得到2个电子、B元素的原子失去 1个电子后,所形成的微粒均与氖原子有相同的电子层结构,C元素的原子只有1个电子。试写出:
(1)A、B的元素符号:
A ,B 。
O
[解析] 有A、B、C三种元素,A元素的原子得到2个电子、B元素的原子失去1个电子后,所形成的微粒均与氖原子有相同的电子层结构,则A原子的质子数为10-2=8,故A为氧元素,B原子的质子数为10+1=11,故B为钠元素;C元素的原子只有1个电子,则C为氢元素。由上述分析可知,A为O,B为Na。
Na
(2)画出B元素的离子结构示意图:
。
[解析]钠离子质子数为11,核外有10个电子,有2个电子层,由里到外各层电子数为、
2、8,钠离子结构示意图为 。
(3)写出由该三种元素组成的物质D在水溶液中的电离方程式:
。
NaOH=Na++OH-
[解析]三种元素组成的化合物为NaOH,属于强电解质,在溶液中电离出钠离子与氢氧根离子,电离方程式为NaOH=Na++OH-。
(4)写出与氖原子有相同数目的电子的多核微粒(写一种): 。
CH4
THANKS
