2024届高考化学一轮复习 第七章 化学反应速率与化学平衡 第2讲 催化剂的反应机理与能垒图像(54张PPT)
文档属性
| 名称 | 2024届高考化学一轮复习 第七章 化学反应速率与化学平衡 第2讲 催化剂的反应机理与能垒图像(54张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-18 00:00:00 | ||
图片预览





文档简介
(共54张PPT)
第2讲 催化剂的反应机理与能垒图像(综合应用课)
新高考强调素养为本的情境化命题,高考通过真实情境的创设,考查学生的信息获取能力和创新思维。近几年高考常以催化剂的催化反应机理和能垒图像(2022年山东卷第10题、2022年湖南卷第12题、2021年福建卷第9题等)为情境载体进行命题。这两类命题,由于陌生度高,思维转化大,且命题视角在不断地创新和发展(如2021年湖南卷第14题),成为大多数考生的失分点。所以,很有必要对这两类题型进行专题指导。
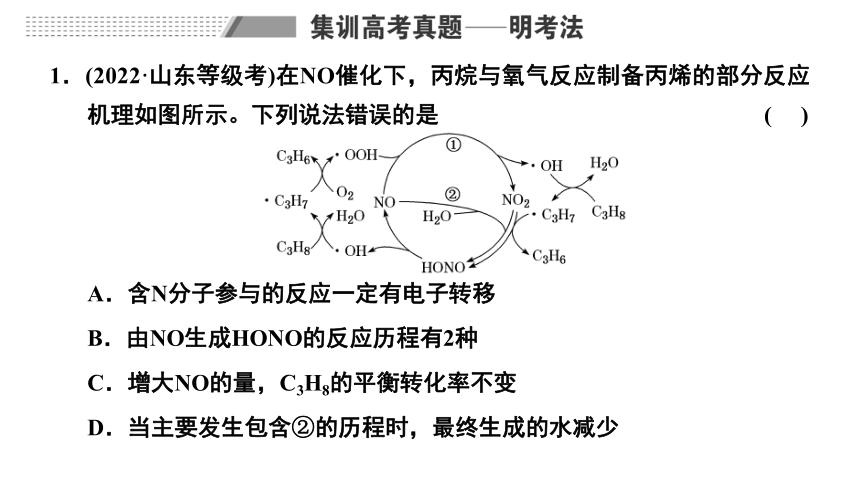
1.(2022·山东等级考)在NO催化下,丙烷与氧气反应制备丙烯的部分反应机理如图所示。下列说法错误的是 ( )
A.含N分子参与的反应一定有电子转移
B.由NO生成HONO的反应历程有2种
C.增大NO的量,C3H8的平衡转化率不变
D.当主要发生包含②的历程时,最终生成的水减少
解析:根据反应机理的图示知,含N分子发生的反应有NO+·OOH===NO2+·OH、NO+NO2+H2O===2HONO、NO2+·C3H7===C3H6+HONO、HONO===NO+·OH,含N分子NO、NO2、HONO中N元素的化合价依次为+2价、+4价、+3价,上述反应中均有元素化合价的升降,都为氧化还原反应,一定有电子转移,A项正确;
根据图示,由NO生成HONO的反应历程有2种,B项正确;
NO是催化剂,增大NO的量,C3H8的平衡转化率不变,C项正确;
答案:D
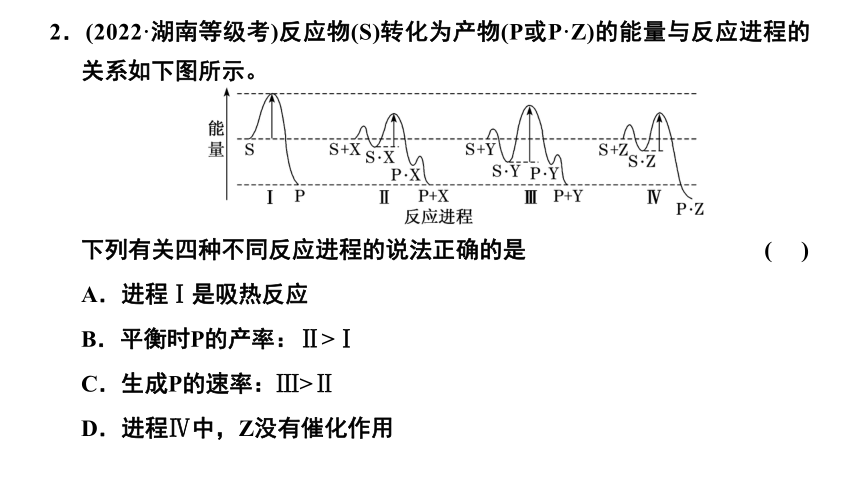
2.(2022·湖南等级考)反应物(S)转化为产物(P或P·Z)的能量与反应进程的关系如下图所示。
下列有关四种不同反应进程的说法正确的是 ( )
A.进程Ⅰ是吸热反应
B.平衡时P的产率:Ⅱ>Ⅰ
C.生成P的速率:Ⅲ>Ⅱ
D.进程Ⅳ中,Z没有催化作用
解析:由图中信息可知,进程Ⅰ中S的总能量大于产物P的总能量,因此进程Ⅰ是放热反应,A错误;
进程Ⅱ中使用了催化剂X,但是催化剂不能改变平衡产率,因此在两个进程中平衡时P的产率相同,B不正确;
进程Ⅲ中由S·Y转化为P·Y的活化能高于进程Ⅱ中由S·X转化为P·X的活化能,由于这两步反应分别是两个进程的决速步骤,因此生成P的速率为Ⅲ<Ⅱ,C不正确;
进程Ⅳ中S吸附到Z表面生成S·Z,然后S·Z转化为产物P·Z,由于P·Z没有转化为P+Z,因此,Z没有表现出催化作用,D正确。
答案:D
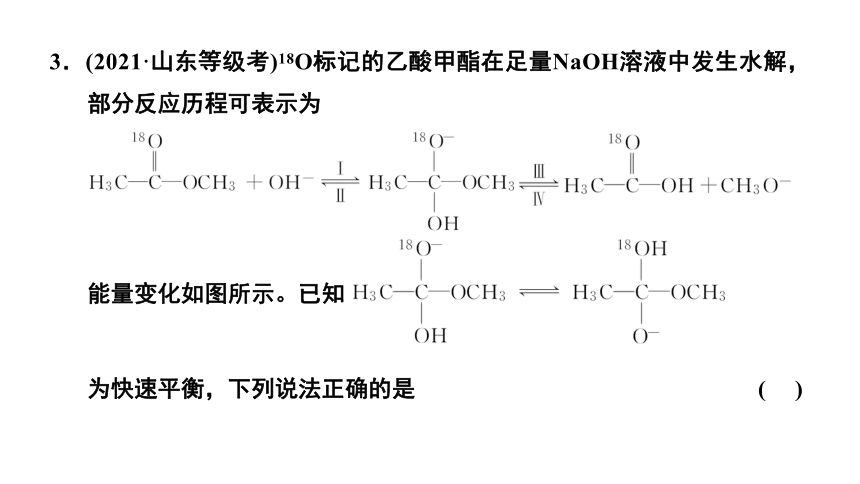
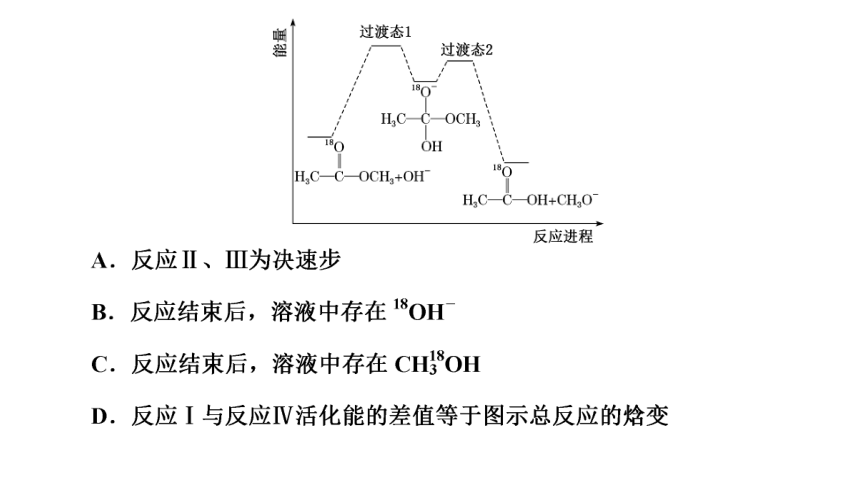
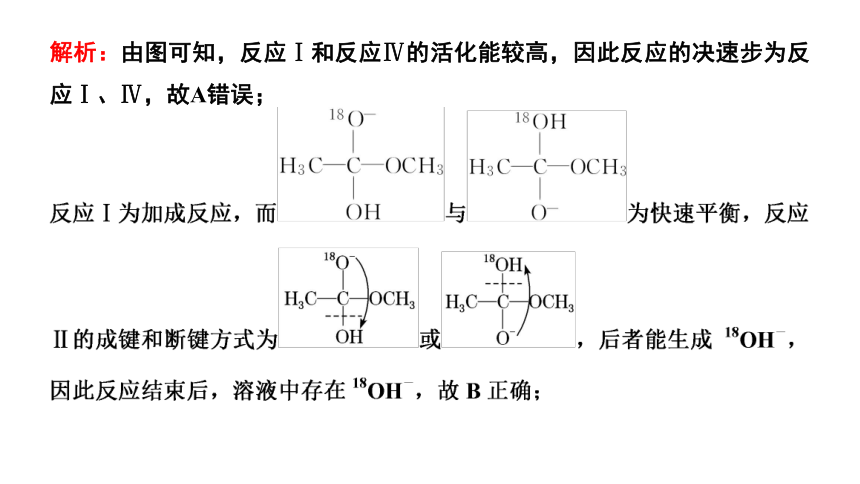
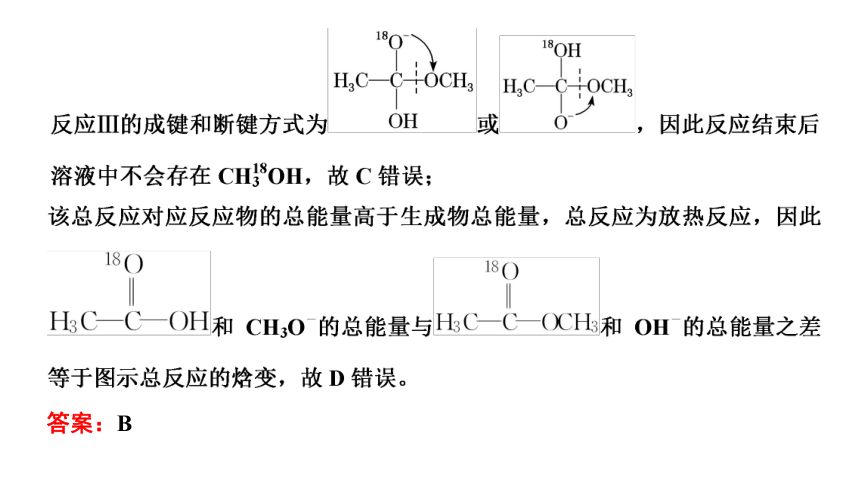
3.(2021·山东等级考)18O标记的乙酸甲酯在足量NaOH溶液中发生水解,部分反应历程可表示为
能量变化如图所示。已知
为快速平衡,下列说法正确的是 ( )
解析:由图可知,反应Ⅰ和反应Ⅳ的活化能较高,因此反应的决速步为反应Ⅰ、Ⅳ,故A错误;
答案:B
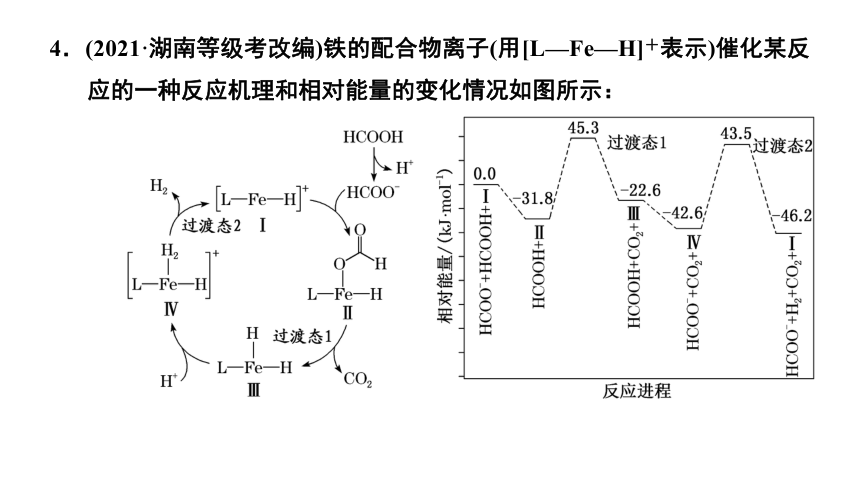
4.(2021·湖南等级考改编)铁的配合物离子(用[L—Fe—H]+表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
H+浓度过大,抑制HCOOH的电离,HCOO-浓度减小,会降低Ⅰ→Ⅱ步骤的反应速率,H+浓度过小,会降低Ⅲ→Ⅳ步骤反应速率,故H+浓度过大或者过小,均会导致反应速率降低,B说法正确;
整个催化循环过程中Fe元素化合价均为+3价,故该催化循环中Fe元素的化合价没有发生变化,C说法错误;
由相对能量的变化情况图可以得出,该反应过程中的Ⅳ→Ⅰ步骤的活化能Ea=86.1 kJ·mol-1,为该反应进程中的最大活化能,故该过程的决速步骤为Ⅳ→Ⅰ步骤,D说法正确。
答案:C
题型(一) 催化剂的反应机理分析
1.催化剂的“四能”“四不能”
催化剂为通过参与化学反应,改变反应历程,从而降低活化能,加快反应速率,缩短到达平衡所需时间,但反应前后其质量和化学性质不变的物质。
2.催化反应机理的图像分析
(1)循环模型
(2)微观原子模型
[注意] 进入机理的箭头为反应物,离开机理的箭头为生成物;生成最终产物的步骤同样生成催化剂,其余为中间产物。
3.催化反应机理题的两步解题流程
第一步:通览全图,找准一“剂”三“物”
一“剂”指催化剂 催化剂在机理图中多数是以完整的循环出现的,以催化剂粒子为主题的多个物种一定在机理图中的主线上 三“物”指反应物、生成物、中间 物种(或中间体) 反应物 通过一个箭头进入整个历程的物质是反应物
生成物 通过一个箭头最终脱离整个历程的物质一般多是生成物
中间体 通过一个箭头脱离整个历程,但又生成生成物的是中间体,通过两个箭头进入整个历程的物质也是中间体,中间体有时在反应历程中用“[ ]”标出
第二步:逐项分析,获取正确答案
由第一步题给情境信息,找出催化剂、反应物、生成物、中间体,再结合每一选项设计的问题逐项分析判断,选出正确答案。
[典例] (2020·全国卷Ⅰ)铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。
下列叙述错误的是 ( )
A.CH3COI是反应中间体
B.甲醇羰基化反应为CH3OH+CO===
CH3CO2H
C.反应过程中Rh的成键数目保持不变
D.存在反应CH3OH+HI===CH3I+H2O
[解题流程]
第一步:通览全图,找准一剂三物
一剂 催化剂:[Rh(CO)2I2]-
三物 反应物:_________和CO(进入循环)
生成物:_____________ (最终生成物)
中间体:HI、H2O、CH3I、CH3COI、
等物质
CH3OH
CH3COOH
[答案] C
[综合应用训练]
1.某科研人员提出HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程,该历程示意图如下(图中只画出了HAP的部分结构)。
答案:D
答案:A
3.在MoO3作用下,HOCH2CH2OH发生反应的历程如图所示。下列说法正确的是 ( )
解析:由题图可知,反应过程中Mo形成共价键的数目发生了改变,A错误。
MoO3在反应中作催化剂,能够改变反应途径,但不能使化学平衡发生移动,故不能提高HOCH2CH2OH的平衡转化率,B错误。
答案:C
4.盐酸羟胺(NH3OHCl)是一种常见的还原剂和显像剂,其化学性质类似NH4Cl。工业上主要采用向两侧电极分别通入NO和H2,以盐酸为电解质来进行制备,其电池装置(图1)和含Fe的催化电极反应机理(图2)如下。不考虑溶液体积的变化,下列说法正确的是 ( )
A.电池工作时,Pt电极为正极
B.图2中,A为H+和e-,B为NH3OH+
C.电池工作时,每消耗2.24 L NO(标准状况下)左室溶液质量增加3.3 g
D.电池工作一段时间后,正、负极区溶液的pH均下降
解析: Pt电极H2→H+,做负极,电极反应式:H2-2e-===2H+,含铁的催化电极为正极,其电极反应为NO+3e-+4H++Cl-===NH3OHCl,A错误;
根据题意可知,NH2OH具有类似NH3的弱碱性,可以和盐酸反应生成盐酸羟胺,所以缺少的一步反应为NH2OH+H+===NH3OH+,图2中,A为H+,B为NH3OH+,B错误;
负极电极反应式:H2-2e-===2H+,H+浓度增大,pH减小,正极电极反应为NO+3e-+4H++ Cl-===NH3OHCl,正极区H+浓度减小,pH增大,故D错误。
答案:C
题型(二) 能垒图像
三步突破能量变化能垒图
[典例] 水煤气变换[CO(g)+H2O(g)===CO2(g)+H2(g)]是重要的化工过程。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。
可知水煤气变换的ΔH_______0(填“大于”“等于”或“小于”)。该历程中最大能垒(活化能)E正=_______eV,写出该步骤的化学方程式____________________________。
[解题流程]
第一步:通览全图,理清坐标含义
此图为水煤气变换的反应历程中能量变化,横坐标表示CO2(g)与H2O(g)反应在金催化剂表面的反应历程;而纵坐标表示反应历程中的不同阶段的能量变化,从总体来看,反应CO(g)+H2O(g)===CO2(g)+H2(g)的过程中相对能量由0到-0.72 eV ΔH___0,为_______过程。
<
放热
第二步:细看变化,分析各段反应
分段细分析,反应历程中过渡态Ⅰ的能垒(活化能)E正为1.59 eV-(-0.32 eV)=______ eV,结合图给信息可得此过程中的化学方程式为CO*+H2O*+H2O(g)===CO*+OH*+H*+H2O(g),而过渡态Ⅱ的能垒(活化能)E正为1.86 eV-(-0.16 eV)=2.02 eV,结合图给信息可得此过程中的化学方程式为COOH*+H*+H2O*===COOH*+2H*+OH*。
1.91
第三步:综合分析,写出合理答案
由第一步分析ΔH____0,由第二步分析过渡态Ⅰ和过渡态Ⅱ的能垒E正比较得出,反应历程中最大能垒E正为过渡态Ⅱ,E正=____ eV,化学方程式为_________________________________________。
[答案] 小于 2.02 COOH*+H*+H2O*===COOH*+2H*+OH*(或H2O*===H*+OH*)
<
2.02
COOH*+H*+H2O*===COOH*+2H*+OH*
[综合应用训练]
1.甲烷和二氧化碳催化合成乙酸,其中一步为甲烷在催化剂表面脱氢,其方式有两种:甲烷分子单独脱氢,甲烷分子与二氧化碳共吸附脱氢,反应历程如下(由乙酸分子构型可知以二氧化碳结合甲基和氢原子是最简单的合成过程),下列说法正确的是 ( )
A.甲烷脱去首个氢原子的焓变,单独脱氢小于共吸附脱氢
B.甲烷脱去首个氢原子的能垒,共吸附脱氢比单独脱氢下降0.15 eV
C.单独脱氢的决速步为第一步
D.共吸附脱氢不利于乙酸的合成
解析:甲烷脱去首个氢原子的焓变,根据图中信息单独脱氢焓变为1.12 eV,共吸附脱氢焓变为0.97 eV,则单独脱氢大于共吸附脱氢,故A错误;甲烷脱去首个氢原子的能垒,共吸附脱氢能垒为2.45 eV,单独脱氢能垒为3.20 eV,共吸附脱氢比单独脱氢下降0.75 eV,故B错误;单独脱氢的第一步能垒最大,因此单独脱氢的决速步为第一步,故C正确;单独脱氢的第一步能垒比共吸附脱氢任意一步的能垒都大,因此共吸附脱氢有利于乙酸的合成,故D错误。
答案:C
2.Shyam Kattle等结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示,吸附在Pt/SiO2催化剂表面上的物种用·标注,Ts表示过渡态。下列有关说法错误的是 ( )
答案:D
3.我国科研人员合成了Y,Sc(Y1/NC,Sc1/NC)单原子催化剂,可用于电化学催化氢气还原氮气的反应。反应历程与相对能量模拟计算结果如图所示(图中*表示吸附在稀土单原子催化剂表面)。下列说法错误的是 ( )
A.新型催化剂会降低合成氨反应的焓变,从而降低生产能耗
B.将催化剂附着在纳米多孔载体的表面可提高氨气的生产效率
C.使用Sc1/NC单原子催化剂的反应历程中,最大能垒的反应过程可表示为*N2+H―→*NNH
D.Sc1/NC单原子催化剂的催化效率理论上应高于Y1/NC单原子催化剂
解析:催化剂能降低反应的活化能,改变反应的途径,但不能改变反应的焓变,A项错误;催化剂能降低反应的活化能,加快反应速率,可提高氨气的生产效率,B项正确;由图可知,使用Sc1/NC单原子催化剂的反应历程中,最大能垒的反应过程可表示为*N2+H―→*NNH,C项正确;由图可知,Y1/NC单原子催化剂催化的反应历程中有一步反应的活化能最高,则理论上其催化效率应低于Sc1/NC单原子催化剂,D项正确。
答案:A
4.Sheth等得出乙炔在Pd表面选择加氢的反应机理(如图)。其中吸附在Pd表面上的物种用*标注。
上述吸附反应为 (填“放热”或“吸热”)反应,该历程中最大能垒(活化能)为_________kJ·mol-1,该步骤的化学方程式为_________________。
谢
谢
观
看
第2讲 催化剂的反应机理与能垒图像(综合应用课)
新高考强调素养为本的情境化命题,高考通过真实情境的创设,考查学生的信息获取能力和创新思维。近几年高考常以催化剂的催化反应机理和能垒图像(2022年山东卷第10题、2022年湖南卷第12题、2021年福建卷第9题等)为情境载体进行命题。这两类命题,由于陌生度高,思维转化大,且命题视角在不断地创新和发展(如2021年湖南卷第14题),成为大多数考生的失分点。所以,很有必要对这两类题型进行专题指导。
1.(2022·山东等级考)在NO催化下,丙烷与氧气反应制备丙烯的部分反应机理如图所示。下列说法错误的是 ( )
A.含N分子参与的反应一定有电子转移
B.由NO生成HONO的反应历程有2种
C.增大NO的量,C3H8的平衡转化率不变
D.当主要发生包含②的历程时,最终生成的水减少
解析:根据反应机理的图示知,含N分子发生的反应有NO+·OOH===NO2+·OH、NO+NO2+H2O===2HONO、NO2+·C3H7===C3H6+HONO、HONO===NO+·OH,含N分子NO、NO2、HONO中N元素的化合价依次为+2价、+4价、+3价,上述反应中均有元素化合价的升降,都为氧化还原反应,一定有电子转移,A项正确;
根据图示,由NO生成HONO的反应历程有2种,B项正确;
NO是催化剂,增大NO的量,C3H8的平衡转化率不变,C项正确;
答案:D
2.(2022·湖南等级考)反应物(S)转化为产物(P或P·Z)的能量与反应进程的关系如下图所示。
下列有关四种不同反应进程的说法正确的是 ( )
A.进程Ⅰ是吸热反应
B.平衡时P的产率:Ⅱ>Ⅰ
C.生成P的速率:Ⅲ>Ⅱ
D.进程Ⅳ中,Z没有催化作用
解析:由图中信息可知,进程Ⅰ中S的总能量大于产物P的总能量,因此进程Ⅰ是放热反应,A错误;
进程Ⅱ中使用了催化剂X,但是催化剂不能改变平衡产率,因此在两个进程中平衡时P的产率相同,B不正确;
进程Ⅲ中由S·Y转化为P·Y的活化能高于进程Ⅱ中由S·X转化为P·X的活化能,由于这两步反应分别是两个进程的决速步骤,因此生成P的速率为Ⅲ<Ⅱ,C不正确;
进程Ⅳ中S吸附到Z表面生成S·Z,然后S·Z转化为产物P·Z,由于P·Z没有转化为P+Z,因此,Z没有表现出催化作用,D正确。
答案:D
3.(2021·山东等级考)18O标记的乙酸甲酯在足量NaOH溶液中发生水解,部分反应历程可表示为
能量变化如图所示。已知
为快速平衡,下列说法正确的是 ( )
解析:由图可知,反应Ⅰ和反应Ⅳ的活化能较高,因此反应的决速步为反应Ⅰ、Ⅳ,故A错误;
答案:B
4.(2021·湖南等级考改编)铁的配合物离子(用[L—Fe—H]+表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
H+浓度过大,抑制HCOOH的电离,HCOO-浓度减小,会降低Ⅰ→Ⅱ步骤的反应速率,H+浓度过小,会降低Ⅲ→Ⅳ步骤反应速率,故H+浓度过大或者过小,均会导致反应速率降低,B说法正确;
整个催化循环过程中Fe元素化合价均为+3价,故该催化循环中Fe元素的化合价没有发生变化,C说法错误;
由相对能量的变化情况图可以得出,该反应过程中的Ⅳ→Ⅰ步骤的活化能Ea=86.1 kJ·mol-1,为该反应进程中的最大活化能,故该过程的决速步骤为Ⅳ→Ⅰ步骤,D说法正确。
答案:C
题型(一) 催化剂的反应机理分析
1.催化剂的“四能”“四不能”
催化剂为通过参与化学反应,改变反应历程,从而降低活化能,加快反应速率,缩短到达平衡所需时间,但反应前后其质量和化学性质不变的物质。
2.催化反应机理的图像分析
(1)循环模型
(2)微观原子模型
[注意] 进入机理的箭头为反应物,离开机理的箭头为生成物;生成最终产物的步骤同样生成催化剂,其余为中间产物。
3.催化反应机理题的两步解题流程
第一步:通览全图,找准一“剂”三“物”
一“剂”指催化剂 催化剂在机理图中多数是以完整的循环出现的,以催化剂粒子为主题的多个物种一定在机理图中的主线上 三“物”指反应物、生成物、中间 物种(或中间体) 反应物 通过一个箭头进入整个历程的物质是反应物
生成物 通过一个箭头最终脱离整个历程的物质一般多是生成物
中间体 通过一个箭头脱离整个历程,但又生成生成物的是中间体,通过两个箭头进入整个历程的物质也是中间体,中间体有时在反应历程中用“[ ]”标出
第二步:逐项分析,获取正确答案
由第一步题给情境信息,找出催化剂、反应物、生成物、中间体,再结合每一选项设计的问题逐项分析判断,选出正确答案。
[典例] (2020·全国卷Ⅰ)铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。
下列叙述错误的是 ( )
A.CH3COI是反应中间体
B.甲醇羰基化反应为CH3OH+CO===
CH3CO2H
C.反应过程中Rh的成键数目保持不变
D.存在反应CH3OH+HI===CH3I+H2O
[解题流程]
第一步:通览全图,找准一剂三物
一剂 催化剂:[Rh(CO)2I2]-
三物 反应物:_________和CO(进入循环)
生成物:_____________ (最终生成物)
中间体:HI、H2O、CH3I、CH3COI、
等物质
CH3OH
CH3COOH
[答案] C
[综合应用训练]
1.某科研人员提出HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程,该历程示意图如下(图中只画出了HAP的部分结构)。
答案:D
答案:A
3.在MoO3作用下,HOCH2CH2OH发生反应的历程如图所示。下列说法正确的是 ( )
解析:由题图可知,反应过程中Mo形成共价键的数目发生了改变,A错误。
MoO3在反应中作催化剂,能够改变反应途径,但不能使化学平衡发生移动,故不能提高HOCH2CH2OH的平衡转化率,B错误。
答案:C
4.盐酸羟胺(NH3OHCl)是一种常见的还原剂和显像剂,其化学性质类似NH4Cl。工业上主要采用向两侧电极分别通入NO和H2,以盐酸为电解质来进行制备,其电池装置(图1)和含Fe的催化电极反应机理(图2)如下。不考虑溶液体积的变化,下列说法正确的是 ( )
A.电池工作时,Pt电极为正极
B.图2中,A为H+和e-,B为NH3OH+
C.电池工作时,每消耗2.24 L NO(标准状况下)左室溶液质量增加3.3 g
D.电池工作一段时间后,正、负极区溶液的pH均下降
解析: Pt电极H2→H+,做负极,电极反应式:H2-2e-===2H+,含铁的催化电极为正极,其电极反应为NO+3e-+4H++Cl-===NH3OHCl,A错误;
根据题意可知,NH2OH具有类似NH3的弱碱性,可以和盐酸反应生成盐酸羟胺,所以缺少的一步反应为NH2OH+H+===NH3OH+,图2中,A为H+,B为NH3OH+,B错误;
负极电极反应式:H2-2e-===2H+,H+浓度增大,pH减小,正极电极反应为NO+3e-+4H++ Cl-===NH3OHCl,正极区H+浓度减小,pH增大,故D错误。
答案:C
题型(二) 能垒图像
三步突破能量变化能垒图
[典例] 水煤气变换[CO(g)+H2O(g)===CO2(g)+H2(g)]是重要的化工过程。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。
可知水煤气变换的ΔH_______0(填“大于”“等于”或“小于”)。该历程中最大能垒(活化能)E正=_______eV,写出该步骤的化学方程式____________________________。
[解题流程]
第一步:通览全图,理清坐标含义
此图为水煤气变换的反应历程中能量变化,横坐标表示CO2(g)与H2O(g)反应在金催化剂表面的反应历程;而纵坐标表示反应历程中的不同阶段的能量变化,从总体来看,反应CO(g)+H2O(g)===CO2(g)+H2(g)的过程中相对能量由0到-0.72 eV ΔH___0,为_______过程。
<
放热
第二步:细看变化,分析各段反应
分段细分析,反应历程中过渡态Ⅰ的能垒(活化能)E正为1.59 eV-(-0.32 eV)=______ eV,结合图给信息可得此过程中的化学方程式为CO*+H2O*+H2O(g)===CO*+OH*+H*+H2O(g),而过渡态Ⅱ的能垒(活化能)E正为1.86 eV-(-0.16 eV)=2.02 eV,结合图给信息可得此过程中的化学方程式为COOH*+H*+H2O*===COOH*+2H*+OH*。
1.91
第三步:综合分析,写出合理答案
由第一步分析ΔH____0,由第二步分析过渡态Ⅰ和过渡态Ⅱ的能垒E正比较得出,反应历程中最大能垒E正为过渡态Ⅱ,E正=____ eV,化学方程式为_________________________________________。
[答案] 小于 2.02 COOH*+H*+H2O*===COOH*+2H*+OH*(或H2O*===H*+OH*)
<
2.02
COOH*+H*+H2O*===COOH*+2H*+OH*
[综合应用训练]
1.甲烷和二氧化碳催化合成乙酸,其中一步为甲烷在催化剂表面脱氢,其方式有两种:甲烷分子单独脱氢,甲烷分子与二氧化碳共吸附脱氢,反应历程如下(由乙酸分子构型可知以二氧化碳结合甲基和氢原子是最简单的合成过程),下列说法正确的是 ( )
A.甲烷脱去首个氢原子的焓变,单独脱氢小于共吸附脱氢
B.甲烷脱去首个氢原子的能垒,共吸附脱氢比单独脱氢下降0.15 eV
C.单独脱氢的决速步为第一步
D.共吸附脱氢不利于乙酸的合成
解析:甲烷脱去首个氢原子的焓变,根据图中信息单独脱氢焓变为1.12 eV,共吸附脱氢焓变为0.97 eV,则单独脱氢大于共吸附脱氢,故A错误;甲烷脱去首个氢原子的能垒,共吸附脱氢能垒为2.45 eV,单独脱氢能垒为3.20 eV,共吸附脱氢比单独脱氢下降0.75 eV,故B错误;单独脱氢的第一步能垒最大,因此单独脱氢的决速步为第一步,故C正确;单独脱氢的第一步能垒比共吸附脱氢任意一步的能垒都大,因此共吸附脱氢有利于乙酸的合成,故D错误。
答案:C
2.Shyam Kattle等结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示,吸附在Pt/SiO2催化剂表面上的物种用·标注,Ts表示过渡态。下列有关说法错误的是 ( )
答案:D
3.我国科研人员合成了Y,Sc(Y1/NC,Sc1/NC)单原子催化剂,可用于电化学催化氢气还原氮气的反应。反应历程与相对能量模拟计算结果如图所示(图中*表示吸附在稀土单原子催化剂表面)。下列说法错误的是 ( )
A.新型催化剂会降低合成氨反应的焓变,从而降低生产能耗
B.将催化剂附着在纳米多孔载体的表面可提高氨气的生产效率
C.使用Sc1/NC单原子催化剂的反应历程中,最大能垒的反应过程可表示为*N2+H―→*NNH
D.Sc1/NC单原子催化剂的催化效率理论上应高于Y1/NC单原子催化剂
解析:催化剂能降低反应的活化能,改变反应的途径,但不能改变反应的焓变,A项错误;催化剂能降低反应的活化能,加快反应速率,可提高氨气的生产效率,B项正确;由图可知,使用Sc1/NC单原子催化剂的反应历程中,最大能垒的反应过程可表示为*N2+H―→*NNH,C项正确;由图可知,Y1/NC单原子催化剂催化的反应历程中有一步反应的活化能最高,则理论上其催化效率应低于Sc1/NC单原子催化剂,D项正确。
答案:A
4.Sheth等得出乙炔在Pd表面选择加氢的反应机理(如图)。其中吸附在Pd表面上的物种用*标注。
上述吸附反应为 (填“放热”或“吸热”)反应,该历程中最大能垒(活化能)为_________kJ·mol-1,该步骤的化学方程式为_________________。
谢
谢
观
看
同课章节目录
