2024届高考化学一轮复习 第七章 化学反应速率与化学平衡 第3讲 化学平衡状态 化学平衡常数 课件(共46张PPT)
文档属性
| 名称 | 2024届高考化学一轮复习 第七章 化学反应速率与化学平衡 第3讲 化学平衡状态 化学平衡常数 课件(共46张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-18 00:00:00 | ||
图片预览










文档简介
第3讲 化学平衡状态 化学平衡常数(基础落实课)
逐点清(一) 化学平衡状态
1.可逆反应
定义
在__________下既可以向正反应方向进行,同时又可以向逆反应方向进行的化学反应
特点
双向性
指可逆反应分为方向相反的两个反应:正反应和逆反应
双同性
指正、逆反应是在同一条件下,同时进行
共存性
指反应物的转化率_____100%,______与______共存
同一条件
小于
反应物
生成物
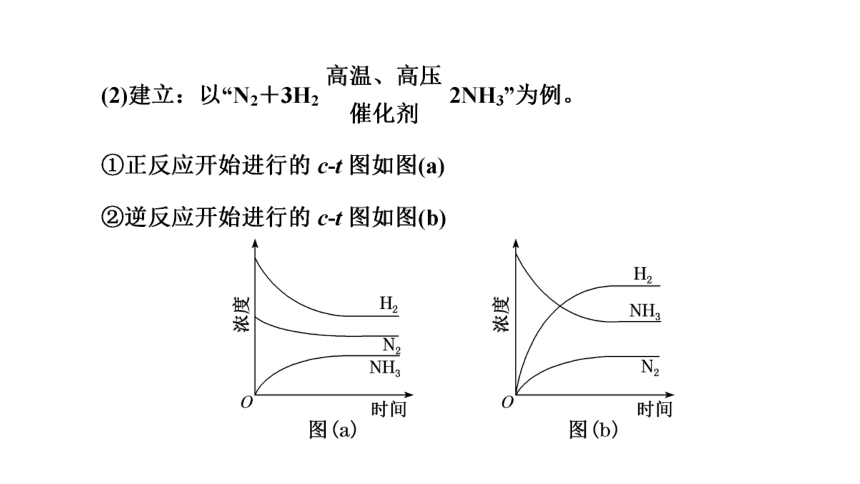
2.化学平衡状态
(1)概念
一定条件下的可逆反应,当反应进行到一定程度时,正反应速率和逆反应速率_______,反应物和生成物的浓度均保持不变,我们称为“化学平衡状态”,简称化学平衡。
相等
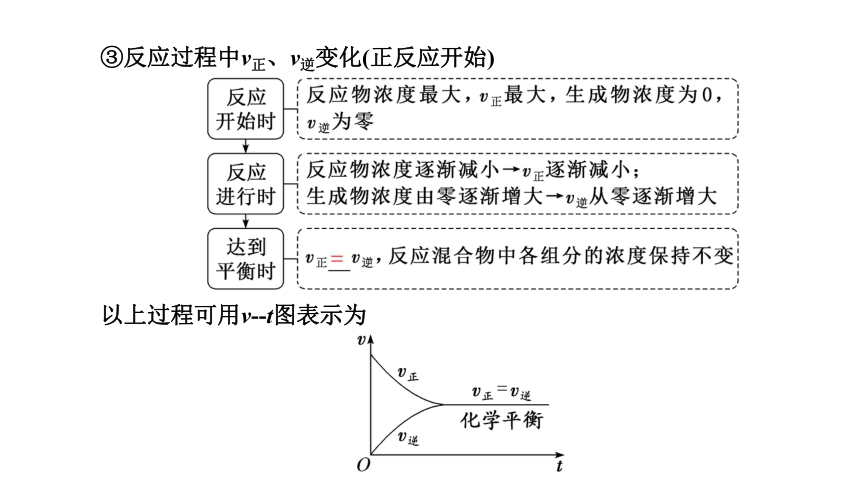
③反应过程中v正、v逆变化(正反应开始)
以上过程可用v?-t图表示为
(3)特征
逆
反应向正、逆两个反应方向进行
动
化学平衡是一种_____平衡,即当达到平衡时,正、逆反应仍在进行,没有停止
等
正、逆反应速率_____,即v正=v逆≠0
定
反应物和生成物的含量(即反应物与生成物的物质的量、物质的量浓度、质量分数、体积分数等)保持不变
变
条件改变,平衡状态可能改变,新条件下建立新的平衡状态
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)NH3和HCl生成NH4Cl与NH4Cl分解生成NH3和HCl互为可逆反应 ( )
(2)可逆反应到达平衡时,各组分的浓度相等 ( )
(3)可逆反应平衡时,生成物不再变化,反应停止了 ( )
×
×
×
√
×
×
2.在密闭容器中进行反应:X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,c(Y2)_____0.2 mol·L-1(填“>”“<”或“=”),c(Z)的范围为______________。
解析:若正向进行完全,c(Y2)=0.2 mol·L-1,c(X2)=0,不合理,故c(Y2)大于0.2 mol·L-1;若正反应完全:c(Z)=0.4 mol·L-1;若逆反应完全:c(Z)=0,故反应平衡时,0 答案:> 0 A.①②③⑤ B.②③④⑥
C.①③⑤⑥ D.②③④⑤
答案:B
2.在一定温度下的恒容容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的浓度之比等于化学计量数之比,⑦某种气体的百分含量
答案:(1)①③④⑦
(2)⑤⑦
(3)①③④⑤⑦
(4)①②③④⑦
(5)①②③
(1)A点的v正(CO2)_____(填“>”“<”或“=”)A点的v逆(CO2)。
(2)A点的v正(CO2) _____ (填“>”“<”或“=”)B点的v逆(H2O),原因是__________________________________________________。
(3)B点v正(CO2)与v逆(NH3)的定量关系式为_______________。
(4)A点v逆(CO2)与B点v正(CO2)的大小关系为_______________。
倒数
。
Kn
K1·K2
(3)意义及影响因素
意义
K值越大
正反应进行的程度越____
反应物的转化率越_____
影响因素
内因
反应物本身的性质
外因
温度升高
ΔH<0,K值减小
ΔH>0,K值增大
一般地,当K>105时,认为反应基本完全了
大
大
2.平衡常数的两大应用
(1)利用K与Q的相对大小判断反应程度
Q=K
体系处于平衡状态
Q 反应___向进行,v正____v逆
Q>K
反应___向进行,v正____v逆
正
>
逆
<
(2)判断可逆反应的反应热
升高温度
K值增大
正反应为____热反应
K值减小
正反应为____热反应
降低温度
K值增大
正反应为____热反应
K值减小
正反应为____热反应
吸
放
放
吸
×
×
×
×
×
×
2.某温度下,将含有H2和I2各0.10 mol的气体混合物充入10 L的密闭容器中,充分反应并达到平衡后,测得c(H2)=0.008 mol·L-1。
(1)计算该反应的K。
(2)在上述温度下,若起始时间容器中通入的H2和I2(g)各0.20 mol时,求达到平衡时H2的转化率。
答案:(1)0.25
(2)20%
B项,由图像可知,反应从T2到T1时,甲醇的物质的量增大,根据平衡常数和计算式可知T1时的平衡常数比T2 时的大,错误;
C项,由图像可知在T2温度下反应先达到平衡,反应速率较T1快,则有T2>T1,从图像的纵坐标分析可得温度降低,平衡向正反应方向移动,则正反应为放热反应,错误;
答案:D
a点的温度低,d点的温度高,温度越高反应速率越快,则d点v正(CO)大于a点
v正(CO),故C错误;
答案:B
谢
谢
观
看
逐点清(一) 化学平衡状态
1.可逆反应
定义
在__________下既可以向正反应方向进行,同时又可以向逆反应方向进行的化学反应
特点
双向性
指可逆反应分为方向相反的两个反应:正反应和逆反应
双同性
指正、逆反应是在同一条件下,同时进行
共存性
指反应物的转化率_____100%,______与______共存
同一条件
小于
反应物
生成物
2.化学平衡状态
(1)概念
一定条件下的可逆反应,当反应进行到一定程度时,正反应速率和逆反应速率_______,反应物和生成物的浓度均保持不变,我们称为“化学平衡状态”,简称化学平衡。
相等
③反应过程中v正、v逆变化(正反应开始)
以上过程可用v?-t图表示为
(3)特征
逆
反应向正、逆两个反应方向进行
动
化学平衡是一种_____平衡,即当达到平衡时,正、逆反应仍在进行,没有停止
等
正、逆反应速率_____,即v正=v逆≠0
定
反应物和生成物的含量(即反应物与生成物的物质的量、物质的量浓度、质量分数、体积分数等)保持不变
变
条件改变,平衡状态可能改变,新条件下建立新的平衡状态
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)NH3和HCl生成NH4Cl与NH4Cl分解生成NH3和HCl互为可逆反应 ( )
(2)可逆反应到达平衡时,各组分的浓度相等 ( )
(3)可逆反应平衡时,生成物不再变化,反应停止了 ( )
×
×
×
√
×
×
2.在密闭容器中进行反应:X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,c(Y2)_____0.2 mol·L-1(填“>”“<”或“=”),c(Z)的范围为______________。
解析:若正向进行完全,c(Y2)=0.2 mol·L-1,c(X2)=0,不合理,故c(Y2)大于0.2 mol·L-1;若正反应完全:c(Z)=0.4 mol·L-1;若逆反应完全:c(Z)=0,故反应平衡时,0
C.①③⑤⑥ D.②③④⑤
答案:B
2.在一定温度下的恒容容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的浓度之比等于化学计量数之比,⑦某种气体的百分含量
答案:(1)①③④⑦
(2)⑤⑦
(3)①③④⑤⑦
(4)①②③④⑦
(5)①②③
(1)A点的v正(CO2)_____(填“>”“<”或“=”)A点的v逆(CO2)。
(2)A点的v正(CO2) _____ (填“>”“<”或“=”)B点的v逆(H2O),原因是__________________________________________________。
(3)B点v正(CO2)与v逆(NH3)的定量关系式为_______________。
(4)A点v逆(CO2)与B点v正(CO2)的大小关系为_______________。
倒数
。
Kn
K1·K2
(3)意义及影响因素
意义
K值越大
正反应进行的程度越____
反应物的转化率越_____
影响因素
内因
反应物本身的性质
外因
温度升高
ΔH<0,K值减小
ΔH>0,K值增大
一般地,当K>105时,认为反应基本完全了
大
大
2.平衡常数的两大应用
(1)利用K与Q的相对大小判断反应程度
Q=K
体系处于平衡状态
Q
Q>K
反应___向进行,v正____v逆
正
>
逆
<
(2)判断可逆反应的反应热
升高温度
K值增大
正反应为____热反应
K值减小
正反应为____热反应
降低温度
K值增大
正反应为____热反应
K值减小
正反应为____热反应
吸
放
放
吸
×
×
×
×
×
×
2.某温度下,将含有H2和I2各0.10 mol的气体混合物充入10 L的密闭容器中,充分反应并达到平衡后,测得c(H2)=0.008 mol·L-1。
(1)计算该反应的K。
(2)在上述温度下,若起始时间容器中通入的H2和I2(g)各0.20 mol时,求达到平衡时H2的转化率。
答案:(1)0.25
(2)20%
B项,由图像可知,反应从T2到T1时,甲醇的物质的量增大,根据平衡常数和计算式可知T1时的平衡常数比T2 时的大,错误;
C项,由图像可知在T2温度下反应先达到平衡,反应速率较T1快,则有T2>T1,从图像的纵坐标分析可得温度降低,平衡向正反应方向移动,则正反应为放热反应,错误;
答案:D
a点的温度低,d点的温度高,温度越高反应速率越快,则d点v正(CO)大于a点
v正(CO),故C错误;
答案:B
谢
谢
观
看
同课章节目录
