2024届高考化学一轮复习 第七章 化学反应速率与化学平衡 第5讲 化学平衡移动 化学反应的方向(51张PPT)
文档属性
| 名称 | 2024届高考化学一轮复习 第七章 化学反应速率与化学平衡 第5讲 化学平衡移动 化学反应的方向(51张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-18 00:00:00 | ||
图片预览









文档简介
(共51张PPT)
第5讲 化学平衡移动 化学反应的方向(基础落实课)
逐点清(一) 影响化学平衡的因素
1.化学平衡移动的过程
定义 由原有的平衡状态达到新的平衡状态的过程叫化学平衡移动
过程示意图
本质 ①v正>v逆:平衡向___反应方向移动
②v正=v逆:反应达到平衡状态,平衡不移动
③v正正
逆
2.影响化学平衡的因素
(1)影响化学平衡的因素
条件的改变(其他条件不变) 化学平衡的移动 浓度 增大反应物浓度或减小生成物浓度 向___反应方向移动 减小反应物浓度或增大生成物浓度 向___反应方向移动 压强(对有气体参加的反应) 反应前后气体分子数改变 增大压强 向气体体积_____的方向移动 减小压强 向气体体积_____的方向移动 反应前后气体分子数不变 改变压强 平衡___移动
正
逆
减小
增大
不
温度 升高温度 向_____反应方向移动
降低温度 向_____反应方向移动
催化剂 使用催化剂 平衡____移动
吸热
放热
不
续表
[注意] 根据K与Q的相对大小判断
当Q=K时 反应处于平衡状态
当Q当Q>K时 平衡向逆反应方向移动
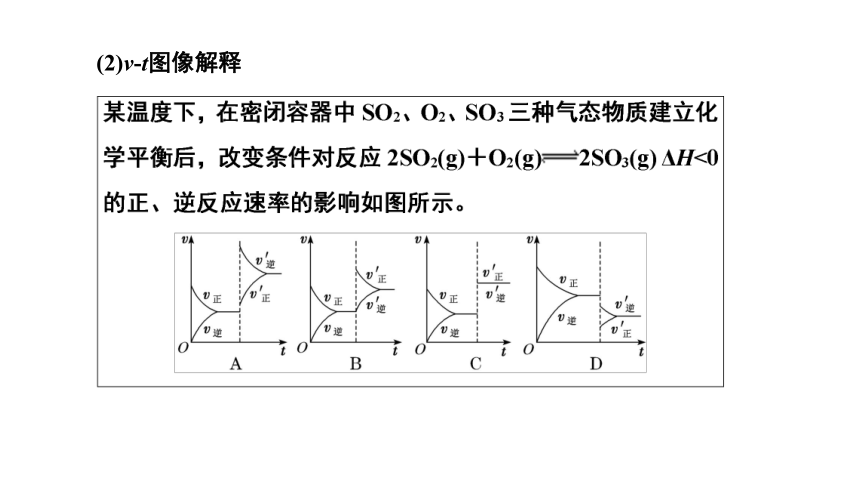
(2)v t图像解释
①加催化剂对反应速率影响的图像是__ (填字母),平衡__移动
②升高温度对反应速率影响的图像是__ (填字母),平衡向______方向移动
③增大反应容器体积对反应速率影响的图像是__ (填字母),平衡向______方向移动
④增大O2的浓度对反应速率影响的图像是__ (填字母),平衡向_______方向移动
C
不
A
逆反应
D
逆反应
B
正反应
续表
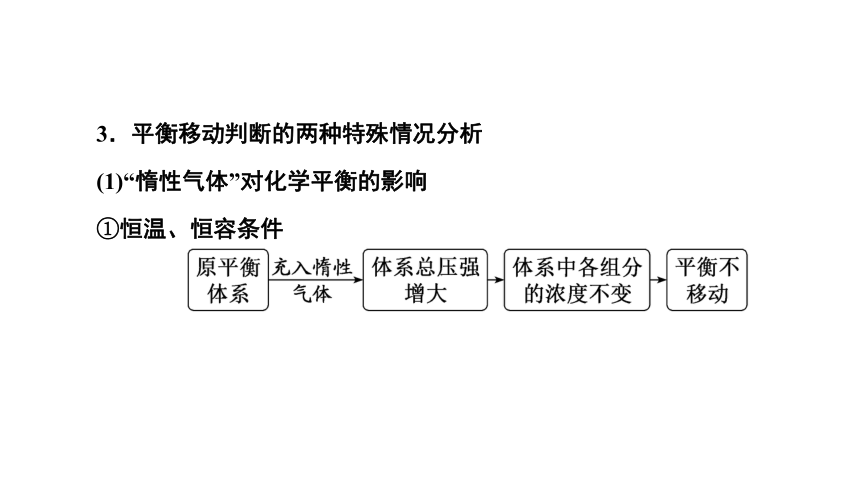
3.平衡移动判断的两种特殊情况分析
(1)“惰性气体”对化学平衡的影响
①恒温、恒容条件
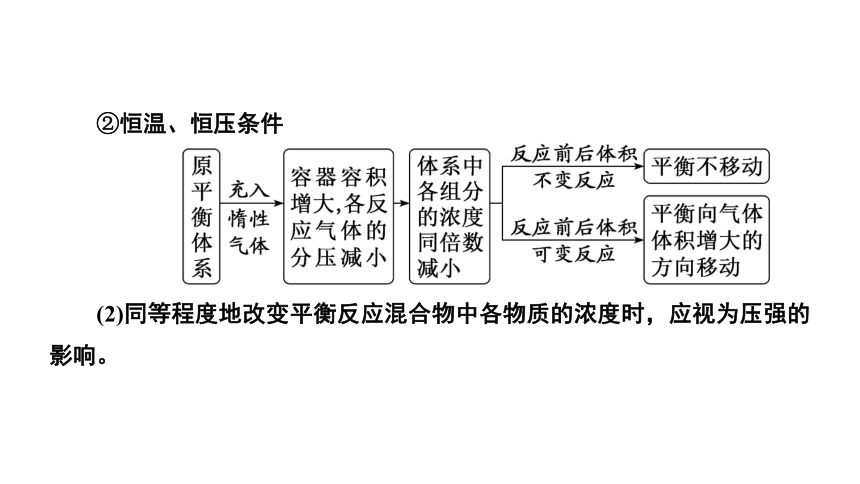
②恒温、恒压条件
(2)同等程度地改变平衡反应混合物中各物质的浓度时,应视为压强的影响。
减弱
<
<
×
×
×
×
×
×
×
答案:①③④
解析:该反应是一个气体分子数减少的反应,增大压强可以加快化学反应速率,正反应速率增大的幅度大于逆反应的,故v正>v逆,平衡向正反应方向移动,但是因为温度不变,故平衡常数不变,A不正确;催化剂不影响化学平衡状态,因此,加入催化剂不影响平衡时CH3CH2OH(g)的浓度,B不正确;恒容下,充入一定量的H2O(g),H2O(g)的浓度增大,平衡向正反应方向移动,C正确;恒容下,充入一定量的CH2===CH2 (g),平衡向正反应方向移动,但是CH2===CH2 (g)的平衡转化率减小,D不正确。
答案:C
2.(2023·烟台模拟)科研工作者利用无水乙醇催化脱水制备乙烯,有关反应在不同温度下的化学平衡常数如表所示。下列说法正确的是 ( )
解析:升高温度,反应速率加快,故反应Ⅰ、Ⅱ的速率均加快,A错误。由温度升高,反应Ⅰ的平衡常数增大,反应Ⅱ的平衡常数减小,可知反应Ⅰ为吸热反应,反应Ⅱ为放热反应,若改变温度为升高温度,则可使反应Ⅱ平衡向逆反应方向移动,反应Ⅰ向正反应方向移动,即抑制反应Ⅱ促进反应Ⅰ;但由于反应Ⅱ为反应前后气体分子数不变的反应,故改变压强反应Ⅱ平衡不移动,既不能促进也不能抑制反应Ⅱ,B错误。增大C2H5OH的浓度,反应Ⅰ的转化率减小,而反应Ⅱ的转化率不变,D错误。
答案:C
A.升高温度
B.增大容器体积
C.恒温恒容通入1 mol SO2、0.5 mol O2、1 mol SO3混合气体
D.恒温恒容通入1 mol 氩气
解析:升温平衡逆向移动,A错误;减小压强平衡逆向移动,B错误;恒温恒容通入1 mol SO2、0.5 mol O2、1 mol SO3相当于加压,使平衡正向移动,C正确;恒温恒容通“惰气”,平衡不移动,D错误。
答案:C
条件的改变 反应物平衡转化率(α)及气体的体积分数(φ)的变化 恒容时只增加反应物A的量 α(A)减小,α(B)增大 同等倍数增大反应物A、B的量 恒温恒压条件下 α(A)和α(B)均不变 恒温恒容条件下 m+n>p+q α(A)和α(B)均增大
m+n<p+q α(A)和α(B)均减小
m+n=p+q α(A)和α(B)均不变
增加反应物A的量 恒温恒压条件下 α(A)不变 恒温恒容条件下 m>n+p α(A)增大,φ(A)减小
m<n+p α(A)减小,φ(A)增大
m=n+p α(A)、φ(A)均不变
解析:根据图a曲线可知,温度越高,逆反应速率越大,故升高温度平衡逆向移动,正反应为放热反应,A项正确;催化剂能加快反应速率,缩短达到平衡所用的时间,但不能使平衡发生移动,B项正确;升高温度,平衡向吸热方向移动,C项正确;根据图像曲线可知,温度越高,混合气体的平均相对分子质量减小,故升高温度平衡逆向移动,因此可判断正反应为放热反应,D项错误。
答案:D
解析:由题图可知,t0~t1时,v(逆)逐渐增大,t1时刻达到平衡,说明该过程中反应正向进行,则有v(正)>v(逆),A正确。Ⅰ、Ⅱ两过程分别达到平衡时,v(逆)相等,说明过程Ⅰ和Ⅱ的平衡是等效平衡,则A的体积分数:φ(Ⅰ)=φ(Ⅱ),B正确。t2时刻改变条件,v(逆)瞬间增大,随后逐渐减小,再次建立的新平衡与原平衡是等效平衡,则加入的物质应是C,C错误。平衡常数K只与温度有关,Ⅰ、Ⅱ过程在相同温度下达到平衡,则平衡常数:KⅠ=KⅡ,D正确。
答案:C
[归纳拓展]
(1 )对于任何可逆反应,升高温度,v正、v逆均增大且增大的倍数不同,吸热方向增大的倍数较大。
(2 )对于非等体积气体的反应,增大压强,v正、v逆均增大,且增大的倍数不同,气体体积缩小方向增大的倍数较大;对于等体积气体反应,增大压强,v正、v逆同倍数增大。
逐点清(二) 化学反应的调控在工农业生产中的应用
1.工业合成氨的条件调控
合成氨条件的调控 压强 10~30 MPa的压强。压强越大,转化率越大,但对材料设备的要求越高,需要的动力也越大,增大了生产投资,降低了经济效益
温度 400~500 ℃的温度。温度要适宜,既要考虑速率又要考虑反应转化率,同时还要考虑催化剂的活性
合成氨条件的调控 催化剂 使用催化剂可提高反应速率,且不同的催化剂有不同的活性和选择性
浓度 迅速冷却NH3,减少c(NH3),使平衡右移
循环操作 将分离出NH3的原料循环使用,提高原料利用率
续表
2.化工生产适宜条件选择的一般原则
条件 原则
从速率分析 既不能过快,又不能太慢
从化学平衡移动分析 既要注意外界条件对速率和平衡影响的一致性,又要注意对二者影响的矛盾性
从原料的利用率分析 ①增加易得廉价原料,提高难得高价原料的利用率,从而降低生产成本
②循环操作
从实际生产能力分析 如设备承受高温、高压能力等
从催化剂的使用活性和选择性分析 注意催化剂的活性和选择性对温度的限制
A.使用Cu Zn Fe催化剂可大大提高生产效率
B.反应需在300 ℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
解析:使用Cu Zn Fe催化剂可加快反应速率,能大大提高生产效率,A项正确;反应加热与反应是放热还是吸热没有直接的关系,如煤的燃烧放热,但需要加热,B项错误;充入大量CO2气体,平衡会正向移动,所以可提高H2的转化率,C项正确;从平衡混合气体中分离出CH3CH2OH和H2O会使平衡正向移动,所以可提高CO2和H2的利用率,D项正确。
答案:B
2.苯乙烯与溴苯在一定条件下发生Heck反应:
溴苯用量/mmol 100 100 100 100 100 100 100
催化剂用量/mmol 2 2 2 2 2 2 2
反应温度/℃ 100 100 100 100 120 140 160
反应时间/h 10 12 14 16 14 14 14
产率/% 81.2 84.4 86.6 86.2 93.5 96.6 89.0
根据上表数据,下列说法正确的是 ( )
A.最佳反应温度为100 ℃
B.最佳反应时间为16 h
C.温度过高时催化剂活性可能降低
D.反应产物是顺式结构
答案:C
温度/℃ 平衡时SO2的转化率/% 0.1 MPa 0.5 MPa 1 MPa 5 MPa 10 MPa
450 97.5 98.9 99.2 99.6 99.7
550 85.6 92.9 94.9 97.7 98.3
(1)从理论上分析,为了使二氧化硫尽可能多地转化为三氧化硫,应选择的条件是_______________。
(2)在实际生产中,选定的温度为400~500 ℃,原因是__________________。
(3)在实际生产中,采用的压强为常压,原因是________________________。
(4)在实际生产中,通入过量的空气,原因是__________________________。
(5)尾气中的SO2必须回收,原因是___________________________________。
答案:(1)低温高压
(2)保持较高反应速率和反应限度,同时使催化剂活性最高
(3)常压下SO2的转化率已很高,若再加压,对设备、动力要求较高,成本增加,不符合经济效益
(4)增大O2的浓度,提高SO2的转化率
(5)SO2污染大气
逐点清(三) 化学反应的方向
1.自发过程
含义 在一定条件下,不需要借助光、电等外力作用就能自动进行的过程
特点 放热过程可能自发进行
混乱度小转变为混乱度大的过程可能自发进行
2.熵和熵变
(1)熵是度量体系_____程度的物理量,符号为S。
(2)影响熵大小的因素:
①相同条件下,物质不同熵不同。
②同一物质:S(g)__ S(l)__ S(s)。
(3)熵变(ΔS)=生成物的总熵-反应物的总熵。
混乱
>
>
3.化学反应方向的判断
焓变(ΔH)<0 有自发进行的倾向,但有些ΔH__0的反应也可自发进行,焓变判断反应进行的方向不全面
熵变(ΔS)>0 有自发进行的倾向,但有些ΔS__0的反应也可自发进行,熵变判断反应进行的方向不全面
自由能(ΔG)<0 ΔG=ΔH-TΔS,ΔG<0的反应可自发进行,ΔG=0,反应处于平衡状态,ΔG>0,反应不能自发进行
>
<
[注意] ①ΔH<0,ΔS>0时反应能自发进行;②ΔH>0,ΔS<0时反应不能自发进行;③ΔH>0,ΔS>0,高温可能自发进行;④ΔH<0,ΔS<0,低温可能自发进行。
[题点考法·全面练通]
1.判断正误(正确的打“√”,错误的打“×”)。
(1)自发反应一定能发生,非自发反应一定不能发生 ( )
(2)Na与H2O的反应是熵增的放热反应,该反应能自发进行 ( )
(3)吸热反应不可以自发进行 ( )
(4)同种物质气态时熵值最大 ( )
×
√
×
√
√
×
√
×
2.(2022·浙江选考)AB型强电解质在水中的溶解(可视作特殊的化学反应)表示为AB(s)===An+(aq)+Bn-(aq),其焓变和熵变分别为ΔH和ΔS。对于不同组成的AB型强电解质,下列说法正确的是 ( )
A.ΔH和ΔS均大于零
B.ΔH和ΔS均小于零
C.ΔH可能大于零或小于零,ΔS大于零
D.ΔH和ΔS均可能大于零或小于零
答案:D
解析:(1)根据盖斯定律,由Ⅰ+Ⅱ即得到反应Ⅲ的ΔH=234 kJ·mol-1,这说明反应Ⅲ是吸热的体积增大(即ΔS>0)的反应,根据ΔG=ΔH-TΔS<0可自发进行可知反应Ⅲ自发进行的条件是高温;
(2)结合图像可知,600 ℃时,A、B中反应的ΔG均小于0, 反应可自发进行,C中的ΔG>0,反应不能自发进行,根据盖斯定律,TiO2(s)+C(s)+2Cl2(g)===TiCl4(g)+CO2(g)可由A+C得到,则600 ℃时其ΔG<0,反应可自发进行,故D不符合题意。
(3)若反应能自发进行,则ΔG=ΔH-TΔS<0,代入数据,ΔG=ΔH-TΔS=90.8×103 J·mol-1-T×198.9 J·mol-1·K-1<0,则T>456.5 K,转化为摄氏温度,则T>183.5 ℃,故选C、D。
答案:(1)高温 (2)C (3)CD
谢
谢
观
看
第5讲 化学平衡移动 化学反应的方向(基础落实课)
逐点清(一) 影响化学平衡的因素
1.化学平衡移动的过程
定义 由原有的平衡状态达到新的平衡状态的过程叫化学平衡移动
过程示意图
本质 ①v正>v逆:平衡向___反应方向移动
②v正=v逆:反应达到平衡状态,平衡不移动
③v正
逆
2.影响化学平衡的因素
(1)影响化学平衡的因素
条件的改变(其他条件不变) 化学平衡的移动 浓度 增大反应物浓度或减小生成物浓度 向___反应方向移动 减小反应物浓度或增大生成物浓度 向___反应方向移动 压强(对有气体参加的反应) 反应前后气体分子数改变 增大压强 向气体体积_____的方向移动 减小压强 向气体体积_____的方向移动 反应前后气体分子数不变 改变压强 平衡___移动
正
逆
减小
增大
不
温度 升高温度 向_____反应方向移动
降低温度 向_____反应方向移动
催化剂 使用催化剂 平衡____移动
吸热
放热
不
续表
[注意] 根据K与Q的相对大小判断
当Q=K时 反应处于平衡状态
当Q
(2)v t图像解释
①加催化剂对反应速率影响的图像是__ (填字母),平衡__移动
②升高温度对反应速率影响的图像是__ (填字母),平衡向______方向移动
③增大反应容器体积对反应速率影响的图像是__ (填字母),平衡向______方向移动
④增大O2的浓度对反应速率影响的图像是__ (填字母),平衡向_______方向移动
C
不
A
逆反应
D
逆反应
B
正反应
续表
3.平衡移动判断的两种特殊情况分析
(1)“惰性气体”对化学平衡的影响
①恒温、恒容条件
②恒温、恒压条件
(2)同等程度地改变平衡反应混合物中各物质的浓度时,应视为压强的影响。
减弱
<
<
×
×
×
×
×
×
×
答案:①③④
解析:该反应是一个气体分子数减少的反应,增大压强可以加快化学反应速率,正反应速率增大的幅度大于逆反应的,故v正>v逆,平衡向正反应方向移动,但是因为温度不变,故平衡常数不变,A不正确;催化剂不影响化学平衡状态,因此,加入催化剂不影响平衡时CH3CH2OH(g)的浓度,B不正确;恒容下,充入一定量的H2O(g),H2O(g)的浓度增大,平衡向正反应方向移动,C正确;恒容下,充入一定量的CH2===CH2 (g),平衡向正反应方向移动,但是CH2===CH2 (g)的平衡转化率减小,D不正确。
答案:C
2.(2023·烟台模拟)科研工作者利用无水乙醇催化脱水制备乙烯,有关反应在不同温度下的化学平衡常数如表所示。下列说法正确的是 ( )
解析:升高温度,反应速率加快,故反应Ⅰ、Ⅱ的速率均加快,A错误。由温度升高,反应Ⅰ的平衡常数增大,反应Ⅱ的平衡常数减小,可知反应Ⅰ为吸热反应,反应Ⅱ为放热反应,若改变温度为升高温度,则可使反应Ⅱ平衡向逆反应方向移动,反应Ⅰ向正反应方向移动,即抑制反应Ⅱ促进反应Ⅰ;但由于反应Ⅱ为反应前后气体分子数不变的反应,故改变压强反应Ⅱ平衡不移动,既不能促进也不能抑制反应Ⅱ,B错误。增大C2H5OH的浓度,反应Ⅰ的转化率减小,而反应Ⅱ的转化率不变,D错误。
答案:C
A.升高温度
B.增大容器体积
C.恒温恒容通入1 mol SO2、0.5 mol O2、1 mol SO3混合气体
D.恒温恒容通入1 mol 氩气
解析:升温平衡逆向移动,A错误;减小压强平衡逆向移动,B错误;恒温恒容通入1 mol SO2、0.5 mol O2、1 mol SO3相当于加压,使平衡正向移动,C正确;恒温恒容通“惰气”,平衡不移动,D错误。
答案:C
条件的改变 反应物平衡转化率(α)及气体的体积分数(φ)的变化 恒容时只增加反应物A的量 α(A)减小,α(B)增大 同等倍数增大反应物A、B的量 恒温恒压条件下 α(A)和α(B)均不变 恒温恒容条件下 m+n>p+q α(A)和α(B)均增大
m+n<p+q α(A)和α(B)均减小
m+n=p+q α(A)和α(B)均不变
增加反应物A的量 恒温恒压条件下 α(A)不变 恒温恒容条件下 m>n+p α(A)增大,φ(A)减小
m<n+p α(A)减小,φ(A)增大
m=n+p α(A)、φ(A)均不变
解析:根据图a曲线可知,温度越高,逆反应速率越大,故升高温度平衡逆向移动,正反应为放热反应,A项正确;催化剂能加快反应速率,缩短达到平衡所用的时间,但不能使平衡发生移动,B项正确;升高温度,平衡向吸热方向移动,C项正确;根据图像曲线可知,温度越高,混合气体的平均相对分子质量减小,故升高温度平衡逆向移动,因此可判断正反应为放热反应,D项错误。
答案:D
解析:由题图可知,t0~t1时,v(逆)逐渐增大,t1时刻达到平衡,说明该过程中反应正向进行,则有v(正)>v(逆),A正确。Ⅰ、Ⅱ两过程分别达到平衡时,v(逆)相等,说明过程Ⅰ和Ⅱ的平衡是等效平衡,则A的体积分数:φ(Ⅰ)=φ(Ⅱ),B正确。t2时刻改变条件,v(逆)瞬间增大,随后逐渐减小,再次建立的新平衡与原平衡是等效平衡,则加入的物质应是C,C错误。平衡常数K只与温度有关,Ⅰ、Ⅱ过程在相同温度下达到平衡,则平衡常数:KⅠ=KⅡ,D正确。
答案:C
[归纳拓展]
(1 )对于任何可逆反应,升高温度,v正、v逆均增大且增大的倍数不同,吸热方向增大的倍数较大。
(2 )对于非等体积气体的反应,增大压强,v正、v逆均增大,且增大的倍数不同,气体体积缩小方向增大的倍数较大;对于等体积气体反应,增大压强,v正、v逆同倍数增大。
逐点清(二) 化学反应的调控在工农业生产中的应用
1.工业合成氨的条件调控
合成氨条件的调控 压强 10~30 MPa的压强。压强越大,转化率越大,但对材料设备的要求越高,需要的动力也越大,增大了生产投资,降低了经济效益
温度 400~500 ℃的温度。温度要适宜,既要考虑速率又要考虑反应转化率,同时还要考虑催化剂的活性
合成氨条件的调控 催化剂 使用催化剂可提高反应速率,且不同的催化剂有不同的活性和选择性
浓度 迅速冷却NH3,减少c(NH3),使平衡右移
循环操作 将分离出NH3的原料循环使用,提高原料利用率
续表
2.化工生产适宜条件选择的一般原则
条件 原则
从速率分析 既不能过快,又不能太慢
从化学平衡移动分析 既要注意外界条件对速率和平衡影响的一致性,又要注意对二者影响的矛盾性
从原料的利用率分析 ①增加易得廉价原料,提高难得高价原料的利用率,从而降低生产成本
②循环操作
从实际生产能力分析 如设备承受高温、高压能力等
从催化剂的使用活性和选择性分析 注意催化剂的活性和选择性对温度的限制
A.使用Cu Zn Fe催化剂可大大提高生产效率
B.反应需在300 ℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
解析:使用Cu Zn Fe催化剂可加快反应速率,能大大提高生产效率,A项正确;反应加热与反应是放热还是吸热没有直接的关系,如煤的燃烧放热,但需要加热,B项错误;充入大量CO2气体,平衡会正向移动,所以可提高H2的转化率,C项正确;从平衡混合气体中分离出CH3CH2OH和H2O会使平衡正向移动,所以可提高CO2和H2的利用率,D项正确。
答案:B
2.苯乙烯与溴苯在一定条件下发生Heck反应:
溴苯用量/mmol 100 100 100 100 100 100 100
催化剂用量/mmol 2 2 2 2 2 2 2
反应温度/℃ 100 100 100 100 120 140 160
反应时间/h 10 12 14 16 14 14 14
产率/% 81.2 84.4 86.6 86.2 93.5 96.6 89.0
根据上表数据,下列说法正确的是 ( )
A.最佳反应温度为100 ℃
B.最佳反应时间为16 h
C.温度过高时催化剂活性可能降低
D.反应产物是顺式结构
答案:C
温度/℃ 平衡时SO2的转化率/% 0.1 MPa 0.5 MPa 1 MPa 5 MPa 10 MPa
450 97.5 98.9 99.2 99.6 99.7
550 85.6 92.9 94.9 97.7 98.3
(1)从理论上分析,为了使二氧化硫尽可能多地转化为三氧化硫,应选择的条件是_______________。
(2)在实际生产中,选定的温度为400~500 ℃,原因是__________________。
(3)在实际生产中,采用的压强为常压,原因是________________________。
(4)在实际生产中,通入过量的空气,原因是__________________________。
(5)尾气中的SO2必须回收,原因是___________________________________。
答案:(1)低温高压
(2)保持较高反应速率和反应限度,同时使催化剂活性最高
(3)常压下SO2的转化率已很高,若再加压,对设备、动力要求较高,成本增加,不符合经济效益
(4)增大O2的浓度,提高SO2的转化率
(5)SO2污染大气
逐点清(三) 化学反应的方向
1.自发过程
含义 在一定条件下,不需要借助光、电等外力作用就能自动进行的过程
特点 放热过程可能自发进行
混乱度小转变为混乱度大的过程可能自发进行
2.熵和熵变
(1)熵是度量体系_____程度的物理量,符号为S。
(2)影响熵大小的因素:
①相同条件下,物质不同熵不同。
②同一物质:S(g)__ S(l)__ S(s)。
(3)熵变(ΔS)=生成物的总熵-反应物的总熵。
混乱
>
>
3.化学反应方向的判断
焓变(ΔH)<0 有自发进行的倾向,但有些ΔH__0的反应也可自发进行,焓变判断反应进行的方向不全面
熵变(ΔS)>0 有自发进行的倾向,但有些ΔS__0的反应也可自发进行,熵变判断反应进行的方向不全面
自由能(ΔG)<0 ΔG=ΔH-TΔS,ΔG<0的反应可自发进行,ΔG=0,反应处于平衡状态,ΔG>0,反应不能自发进行
>
<
[注意] ①ΔH<0,ΔS>0时反应能自发进行;②ΔH>0,ΔS<0时反应不能自发进行;③ΔH>0,ΔS>0,高温可能自发进行;④ΔH<0,ΔS<0,低温可能自发进行。
[题点考法·全面练通]
1.判断正误(正确的打“√”,错误的打“×”)。
(1)自发反应一定能发生,非自发反应一定不能发生 ( )
(2)Na与H2O的反应是熵增的放热反应,该反应能自发进行 ( )
(3)吸热反应不可以自发进行 ( )
(4)同种物质气态时熵值最大 ( )
×
√
×
√
√
×
√
×
2.(2022·浙江选考)AB型强电解质在水中的溶解(可视作特殊的化学反应)表示为AB(s)===An+(aq)+Bn-(aq),其焓变和熵变分别为ΔH和ΔS。对于不同组成的AB型强电解质,下列说法正确的是 ( )
A.ΔH和ΔS均大于零
B.ΔH和ΔS均小于零
C.ΔH可能大于零或小于零,ΔS大于零
D.ΔH和ΔS均可能大于零或小于零
答案:D
解析:(1)根据盖斯定律,由Ⅰ+Ⅱ即得到反应Ⅲ的ΔH=234 kJ·mol-1,这说明反应Ⅲ是吸热的体积增大(即ΔS>0)的反应,根据ΔG=ΔH-TΔS<0可自发进行可知反应Ⅲ自发进行的条件是高温;
(2)结合图像可知,600 ℃时,A、B中反应的ΔG均小于0, 反应可自发进行,C中的ΔG>0,反应不能自发进行,根据盖斯定律,TiO2(s)+C(s)+2Cl2(g)===TiCl4(g)+CO2(g)可由A+C得到,则600 ℃时其ΔG<0,反应可自发进行,故D不符合题意。
(3)若反应能自发进行,则ΔG=ΔH-TΔS<0,代入数据,ΔG=ΔH-TΔS=90.8×103 J·mol-1-T×198.9 J·mol-1·K-1<0,则T>456.5 K,转化为摄氏温度,则T>183.5 ℃,故选C、D。
答案:(1)高温 (2)C (3)CD
谢
谢
观
看
同课章节目录
