2024届高考化学一轮复习 第一章 物质及其变化 第2讲 离子反应及其离子方程式(69张PPT)
文档属性
| 名称 | 2024届高考化学一轮复习 第一章 物质及其变化 第2讲 离子反应及其离子方程式(69张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-18 21:38:13 | ||
图片预览











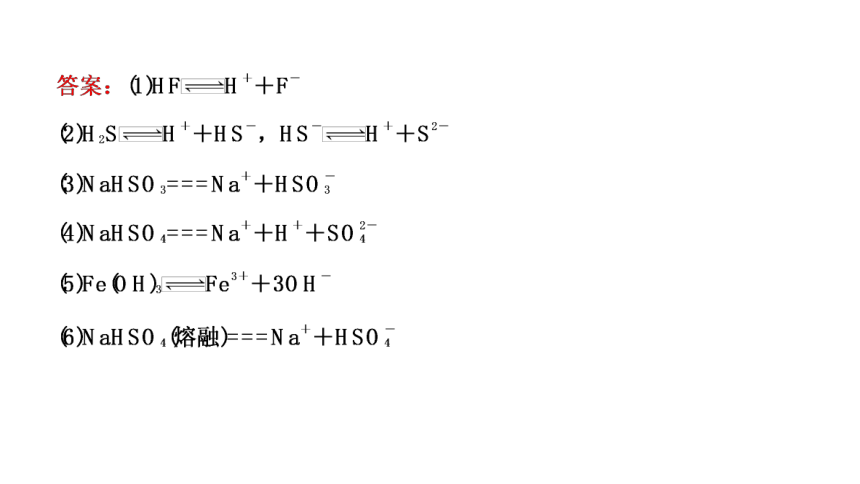
文档简介
(共69张PPT)
第2讲 离子反应及其离子方程式(基础落实课)
逐点清(一) 电离和电离方程式
(一)强电解质和弱电解质
1.强电解质与弱电解质的比较
强电解质 弱电解质
定义 在水溶液中能完全电离的电解质 在水溶液中只能部分电离的电解质
电离平衡 不存在 存在
微粒种类 离子、水分子 离子、水分子、_____________
弱电解质分子
强电解质 弱电解质
举例 ①强酸:HCl、H2SO4、 HI、HNO3、HClO4、HBr等; ②强碱:KOH、NaOH、Ba(OH)2等; ③绝大部分盐:BaSO4、BaCl2等 ①弱酸:CH3COOH、HF、H2S、H2CO3等;
②弱碱:NH3·H2O、Cu(OH)2等;
③水(H2O);
④Al(OH)3(两性)
2.电解质的强弱与电解质的导电性分析
(1)电解质的强弱与物质溶解性的关系
电解质强弱与物质溶解性无关,溶解度小的物质易被误认为是弱电解质。如BaSO4、AgCl、CaCO3等在水溶液中溶解度很小,但溶解部分是完全电离的,因此属于强电解质。
(2)金属导电与电解质导电的比较
①金属导电是由于自由电子定向移动而电解质导电是在熔化或溶于水后自由移动的阴、阳离子定向移动;
②电解质溶液导电能力的大小和电解质的强弱没有必然联系,取决于溶液中自由移动离子的浓度和离子的电荷数。但温度升高时,弱电解质电离程度增大,离子浓度增大,导电性会增强;但强电解质溶液的导电性不变;金属导电性减弱。
宏观 现象 氯化钠固体不导电,水很难导电,但两种不导电的物质组成的氯化钠水溶液能导电
微观 分析 两种物质放在一起产生了什么新物质?这种物质同时具有两种性质(带电荷、能移动)
符号 表征 NaCl水溶液发生了电离:NaCl===Na++Cl-
(二)从“宏、微、符”三重表征认识电离
1.电离及其条件
电解质在水溶液中或熔融状态下,离解成自由移动离子的过程。离子化合物的电离条件:水溶液中或熔融状态下,共价化合物的电离条件:水溶液中。
[注意] 电离方程式要遵循电荷守恒规律,即在电解质溶液中,阳离子所带的正电荷总数等于阴离子所带的负电荷总数,电解质溶液呈电中性。
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)强电解质都是离子化合物,弱电解质都是共价化合物 ( )
(2)强电解质溶液的导电性一定强于弱电解质溶液的导电性 ( )
(3)NaClO溶于水,在电流作用下可以电离出Na+和ClO- ( )
×
×
×
×
√
2.写出下列物质的电离方程式。
(1)HF:_______________________________________________________,
(2)H2S:______________________________________________________,
(3)NaHSO3:__________________________________________________,
(4)NaHSO4:___________________________________________________,
(5)Fe(OH)3:__________________________________________________,
(6)NaHSO4(熔融):____________________________________________。
[题点考法·全面练通]
题点(一) 强、弱电解质及其电离
1.下列物质的分类正确的是 ( )
选项 纯净物 强电解质 弱电解质 非电解质
A 胆矾 苛性钠 碳酸 氨气
B 液氯 氯化钾 氢溴酸 二氧化碳
C 冰醋酸 硫酸钡 氟化氢 氯化银
D 盐酸 硫酸 醋酸 氯气
解析:B项,氢溴酸为强电解质,错误;
C项,AgCl为强电解质,错误;
D项,盐酸是溶液不是纯净物,Cl2为单质不是非电解质,错误。
答案:A
题点(二) 导电性判断
3.同一温度下,强电解质溶液a、弱电解质溶液b、金属导体c三者的导电能力相同,若升高温度后,它们的导电能力强弱顺序是 ( )
A.b>a>c B.a=b=c
C.c>a>b D.b>c>a
解析:升高温度,弱电解质溶液导电性明显增强,强电解质变化不明显,金属导电性减弱,A项正确。
答案:A
4.今有下列几种导电性变化图像,把符合要求的图像序号填在相应的题目后面括号中。
(1)向H2SO4溶液中加入等体积、等物质的量浓度的Ba(OH)2溶液 ( )
(2)向AgNO3溶液通入少量HCl ( )
(3)向氨水中通入HCl直至过量 ( )
(4)向NaOH溶液中通入少量Cl2 ( )
(5)向饱和石灰水中不断通入CO2 ( )
答案:(1)④ (2)③ (3)② (4)③ (5)①
逐点清(二) 离子反应与离子方程式
(一)离子反应的条件和本质
1.概念:有离子参加或有离子生成的反应统称为离子反应。
2.离子反应的条件
在稀硫酸中分别加入下列物质,能发生反应的请写出有关反应的离子方程式:
A.加入BaCl2溶液:________________________;
B.加入CH3COONa溶液:____________________________;
C.加入Na2CO3溶液:________________________;
Ba2++SO===BaSO4↓
CH3COO-+H+===CH3COOH
2H++CO===CO2↑+H2O
D.加入Zn粒:___________________________;
E.加入NaOH溶液:____________________。
从A~E可知离子反应发生的条件:(1)生成难溶的物质,(2)生成难电离的物质,(3)生成气体的物质,(4)发生氧化还原反应。
2H++Zn===H2↑+Zn2+
H++OH-===H2O
(二)离子方程式
1.概念及意义
用实际参加反应的离子符号来表示反应的式子。离子方程式不仅可以表示某一个具体的化学反应,还可以表示同一类型的离子反应。如强酸、强碱中和反应生成可溶性盐通常可用H++OH-===H2O表示。
2.离子方程式的书写(以CaCO3与盐酸的反应为例)
3.物质的“拆分”原则
书写离子方程式时,氧化物、过氧化物、弱电解质、多元弱酸的酸式酸根离子、沉淀、气体、非电解质在离子方程式中均不能拆分。
4.微溶物在离子方程式中的书写方法
微溶物出现在反应物中时,澄清溶液可以拆,悬浊液不可拆;微溶物出现在生成物中时当沉淀处理,不可拆。如:澄清石灰水与盐酸反应的离子方程式:H++OH-===H2O;用石灰乳制漂白粉的离子方程式:Ca(OH)2+Cl2===Ca2++Cl-+ClO-+H2O。
[注意] ①氨水作为反应物,书写成NH3·H2O;氨水作为生成物,若有加热条件或在浓溶液中生成,则书写成NH3↑+H2O,若无加热条件或在稀溶液中生成,则书写成NH3·H2O。
②氨气与酸反应和氨水与酸反应不同,前者为化合反应生成铵盐,后者发生中和反应生成铵盐与H2O。
[题点考法·全面练通]
1.写出下列反应的离子方程式。
(1)NH4Cl溶液与NaOH溶液混合:
_____________________________________________________________。
(2)浓HNO3与Cu的反应:
_____________________________________________________________。
(3)Cu(OH)2与醋酸溶液反应:
_____________________________________________________________。
(4)(NH4)2SO4溶液与NaOH溶液混合加热:
_____________________________________________________________。
(5)Na2CO3溶液与CaCl2溶液混合:
_______________________________________________________________。
(6)NaHCO3溶液与稀盐酸混合:
_______________________________________________________________。
(7)Na2S溶液显碱性:
_______________________________________________________________。
(8)Al2O3与NaOH溶液反应:
_______________________________________________________________。
(9)向NaHSO3溶液中加入过量NaHSO4溶液:
_______________________________________________________________。
2.写出下列离子方程式对应的化学方程式。
(1)Cu2++Fe===Fe2++Cu
__________________________________________________________。
(2)H++OH-===H2O
__________________________________________________________。
(3)Fe3++3OH-===Fe(OH)3↓________________________________。
答案:(1)CuSO4+Fe===FeSO4+Cu
(2)HNO3+NaOH===NaNO3+H2O
(3)FeCl3+3NaOH===Fe(OH)3↓+3NaCl
(4)Ca(OH)2+NaHCO3===CaCO3↓+H2O+NaOH
(5)Na2CO3+CaCl2===CaCO3+2NaCl
(6)NaHS+CuSO4===CuS↓+NaHSO4
逐点清(三) 特殊离子方程式的书写
类型(一) 连续反应型——“分步分析”法
连续反应型是指反应生成的物质又能与过量反应物反应,导致反应物的量不同时,离子方程式不同。
(1)可溶性多元弱酸(如H2S等)与碱反应
酸不足(或碱过量)时生成正盐,如H2S+2OH-===S2-+2H2O,酸过量(或碱不足)时生成酸式盐,如H2S+OH-===HS-+H2O。
[例1] 向NaAlO2溶液中慢慢通入过量CO2,反应过程的有关离子方程式为____________________________________________________,总反应离子方程式为______________________________________________。
[对点训练]
1.写出下列反应的离子方程式。
CO2通入NaOH溶液中
(1)CO2少量:________________________________________________;
(2)CO2过量:_____________________________________________。
2.(1)84消毒液通入过量CO2反应的离子方程式为____________________。
(2)AlCl3溶液中滴入少量NaOH溶液反应的离子方程式为
______________________________________。
(3)苯酚钠(C6H5ONa)溶液中通入少量CO2反应的离子方程式为
_________________________________________。
类型(二) 物质配比型——“少定多变”法
(一)少量与过量型
1.将少量物质定为“1 mol”,若少量物质有两种或两种以上离子参加反应,则参加反应离子的物质的量之比与物质组成之比相符。
2.依据少量物质中离子的物质的量,由以少定多原则,确定过量物质中实际参加反应的离子的物质的量。
[例2] NaHCO3溶液与过量Ca(OH)2溶液反应的离子方程式为_______________________________________________________________。
[解题流程]
[对点训练]
3.写出下列反应的离子方程式。
(1)Ca(HCO3)2溶液与NaOH溶液反应
①NaOH不足:______________________________________________。
②NaOH过量:______________________________________________。
(2)Ba(OH)2溶液与NaHSO4溶液反应
①Ba(OH)2不足:__________________________________________。
②Ba(OH)2过量:___________________________________________。
(二)定量型
首先按题给条件中反应物的物质的量,结合“以少定多”的原则及离子反应顺序,逐步写出各步反应的离子方程式;然后把各步离子方程式加和即可得到总反应的离子方程式。
[例3] 同浓度同体积的明矾与Ba(OH)2溶液混合反应的离子方程式为
____________________________________________________________。
[解题流程]
[对点训练]
4.向NaHSO4溶液中滴加Ba(OH)2溶液。
(1)至溶液呈中性:___________________________________________;
(2)至硫酸根离子完全沉淀:___________________________________
____________________________________________________________。
5.NH4Al(SO4)2与Ba(OH)2溶液反应。
(1)n[NH4Al(SO4)2]∶n[Ba(OH)2]=1∶1
_____________________________________________________________
_____________________________________________________________;
(2)n[NH4Al(SO4)2]∶n[Ba(OH)2]=1∶2
_____________________________________________________________
____________________________________________________________。
2.氧化还原型的离子反应
对于氧化还原反应,按“先强后弱”的顺序书写,即氧化性(或还原性)强的优先发生反应,氧化性(或还原性)弱的后发生反应。
如向FeBr2和FeI2的混合液中通入一定的Cl2,反应先后为I->Fe2+>Br-。
[例4] 写出下列反应的离子方程式。
(1)向(NH4)2Fe(SO4)2溶液中加NaOH溶液至Fe2+刚好沉淀完全:_______________________________________________________________。
(2)向FeBr2溶液中通入与其等物质的量的Cl2:___________________
___________________________________________;
[解析] (1)加入NaOH溶液先与Fe2+反应,然后再与NH反应。
(2)通入Cl2,先氧化Fe2+,然后氧化Br-。
[答案] (1)Fe2++2OH-===Fe(OH)2↓
(2)2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-
[对点训练]
6.写出下列反应的离子方程式。
(1)NH4Al(SO4)2溶液与NaOH溶液的反应。
①NaOH溶液少量:_____________________________________________;
②n[NH4Al(SO4)2]∶n(NaOH)=1∶4时:___________________________;
③NaOH溶液足量:_____________________________________________。
(2)将Fe(NO3)3溶液与HI混合。
HI不足:_____________________________________________________;
HI过量:______________________________________________________。
逐点清(四) 离子方程式的正误判断
(一)“拆分”陷阱
离子方程式的正误判断中,常常设置物质是否能“拆分”的陷阱。①易溶于水、易电离的强电解质必须拆分。②非电解质、弱电解质(弱酸、弱碱、水等)、难溶物、气体、氧化物、单质均不能“拆分”,用化学式表示。
[对点训练]
1.(1)向CuSO4溶液中通入H2S气体:
Cu2++S2-===CuS↓ ( )
(2)氯气溶于水:
Cl2+H2O===2H++Cl-+ClO- ( )
答案:(1)× (2)× (3)× (4)× (5)× (6)×
(二)“原理”陷阱
[对点训练]
2.(1)将Na投入到CuSO4溶液中:
2Na+Cu2+===2Na++Cu ( )
(2)Fe和稀硝酸反应:
Fe+2H+===Fe2++H2↑ ( )
(三)“量比”陷阱
在离子方程式正误判断中,学生往往忽略相对量的影响,命题者往往设置“离子方程式正确,但不符合相对量”的陷阱。突破“陷阱”的方法一是审准“相对量”的多少,二是看离子反应是否符合该量。
[对点训练]
3.(1)向FeBr2溶液中通入等量Cl2:
2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl- ( )
(四)“守恒”陷阱
离子方程式除符合质量守恒外,还应符合电荷守恒,学生往往只注意质量守恒,而忽略电荷守恒,这也是命题者经常设置的“陷阱”。
[对点训练]
4.(1)向FeCl2溶液中通入Cl2:
Fe2++Cl2===Fe3++2Cl- ( )
(4)用过氧化氢从酸化的海带灰浸出液中提取碘:
2I-+H2O2+2H+===I2+2H2O ( )
答案:(1)× (2)× (3)× (4)√
谢
谢
观
看
第2讲 离子反应及其离子方程式(基础落实课)
逐点清(一) 电离和电离方程式
(一)强电解质和弱电解质
1.强电解质与弱电解质的比较
强电解质 弱电解质
定义 在水溶液中能完全电离的电解质 在水溶液中只能部分电离的电解质
电离平衡 不存在 存在
微粒种类 离子、水分子 离子、水分子、_____________
弱电解质分子
强电解质 弱电解质
举例 ①强酸:HCl、H2SO4、 HI、HNO3、HClO4、HBr等; ②强碱:KOH、NaOH、Ba(OH)2等; ③绝大部分盐:BaSO4、BaCl2等 ①弱酸:CH3COOH、HF、H2S、H2CO3等;
②弱碱:NH3·H2O、Cu(OH)2等;
③水(H2O);
④Al(OH)3(两性)
2.电解质的强弱与电解质的导电性分析
(1)电解质的强弱与物质溶解性的关系
电解质强弱与物质溶解性无关,溶解度小的物质易被误认为是弱电解质。如BaSO4、AgCl、CaCO3等在水溶液中溶解度很小,但溶解部分是完全电离的,因此属于强电解质。
(2)金属导电与电解质导电的比较
①金属导电是由于自由电子定向移动而电解质导电是在熔化或溶于水后自由移动的阴、阳离子定向移动;
②电解质溶液导电能力的大小和电解质的强弱没有必然联系,取决于溶液中自由移动离子的浓度和离子的电荷数。但温度升高时,弱电解质电离程度增大,离子浓度增大,导电性会增强;但强电解质溶液的导电性不变;金属导电性减弱。
宏观 现象 氯化钠固体不导电,水很难导电,但两种不导电的物质组成的氯化钠水溶液能导电
微观 分析 两种物质放在一起产生了什么新物质?这种物质同时具有两种性质(带电荷、能移动)
符号 表征 NaCl水溶液发生了电离:NaCl===Na++Cl-
(二)从“宏、微、符”三重表征认识电离
1.电离及其条件
电解质在水溶液中或熔融状态下,离解成自由移动离子的过程。离子化合物的电离条件:水溶液中或熔融状态下,共价化合物的电离条件:水溶液中。
[注意] 电离方程式要遵循电荷守恒规律,即在电解质溶液中,阳离子所带的正电荷总数等于阴离子所带的负电荷总数,电解质溶液呈电中性。
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)强电解质都是离子化合物,弱电解质都是共价化合物 ( )
(2)强电解质溶液的导电性一定强于弱电解质溶液的导电性 ( )
(3)NaClO溶于水,在电流作用下可以电离出Na+和ClO- ( )
×
×
×
×
√
2.写出下列物质的电离方程式。
(1)HF:_______________________________________________________,
(2)H2S:______________________________________________________,
(3)NaHSO3:__________________________________________________,
(4)NaHSO4:___________________________________________________,
(5)Fe(OH)3:__________________________________________________,
(6)NaHSO4(熔融):____________________________________________。
[题点考法·全面练通]
题点(一) 强、弱电解质及其电离
1.下列物质的分类正确的是 ( )
选项 纯净物 强电解质 弱电解质 非电解质
A 胆矾 苛性钠 碳酸 氨气
B 液氯 氯化钾 氢溴酸 二氧化碳
C 冰醋酸 硫酸钡 氟化氢 氯化银
D 盐酸 硫酸 醋酸 氯气
解析:B项,氢溴酸为强电解质,错误;
C项,AgCl为强电解质,错误;
D项,盐酸是溶液不是纯净物,Cl2为单质不是非电解质,错误。
答案:A
题点(二) 导电性判断
3.同一温度下,强电解质溶液a、弱电解质溶液b、金属导体c三者的导电能力相同,若升高温度后,它们的导电能力强弱顺序是 ( )
A.b>a>c B.a=b=c
C.c>a>b D.b>c>a
解析:升高温度,弱电解质溶液导电性明显增强,强电解质变化不明显,金属导电性减弱,A项正确。
答案:A
4.今有下列几种导电性变化图像,把符合要求的图像序号填在相应的题目后面括号中。
(1)向H2SO4溶液中加入等体积、等物质的量浓度的Ba(OH)2溶液 ( )
(2)向AgNO3溶液通入少量HCl ( )
(3)向氨水中通入HCl直至过量 ( )
(4)向NaOH溶液中通入少量Cl2 ( )
(5)向饱和石灰水中不断通入CO2 ( )
答案:(1)④ (2)③ (3)② (4)③ (5)①
逐点清(二) 离子反应与离子方程式
(一)离子反应的条件和本质
1.概念:有离子参加或有离子生成的反应统称为离子反应。
2.离子反应的条件
在稀硫酸中分别加入下列物质,能发生反应的请写出有关反应的离子方程式:
A.加入BaCl2溶液:________________________;
B.加入CH3COONa溶液:____________________________;
C.加入Na2CO3溶液:________________________;
Ba2++SO===BaSO4↓
CH3COO-+H+===CH3COOH
2H++CO===CO2↑+H2O
D.加入Zn粒:___________________________;
E.加入NaOH溶液:____________________。
从A~E可知离子反应发生的条件:(1)生成难溶的物质,(2)生成难电离的物质,(3)生成气体的物质,(4)发生氧化还原反应。
2H++Zn===H2↑+Zn2+
H++OH-===H2O
(二)离子方程式
1.概念及意义
用实际参加反应的离子符号来表示反应的式子。离子方程式不仅可以表示某一个具体的化学反应,还可以表示同一类型的离子反应。如强酸、强碱中和反应生成可溶性盐通常可用H++OH-===H2O表示。
2.离子方程式的书写(以CaCO3与盐酸的反应为例)
3.物质的“拆分”原则
书写离子方程式时,氧化物、过氧化物、弱电解质、多元弱酸的酸式酸根离子、沉淀、气体、非电解质在离子方程式中均不能拆分。
4.微溶物在离子方程式中的书写方法
微溶物出现在反应物中时,澄清溶液可以拆,悬浊液不可拆;微溶物出现在生成物中时当沉淀处理,不可拆。如:澄清石灰水与盐酸反应的离子方程式:H++OH-===H2O;用石灰乳制漂白粉的离子方程式:Ca(OH)2+Cl2===Ca2++Cl-+ClO-+H2O。
[注意] ①氨水作为反应物,书写成NH3·H2O;氨水作为生成物,若有加热条件或在浓溶液中生成,则书写成NH3↑+H2O,若无加热条件或在稀溶液中生成,则书写成NH3·H2O。
②氨气与酸反应和氨水与酸反应不同,前者为化合反应生成铵盐,后者发生中和反应生成铵盐与H2O。
[题点考法·全面练通]
1.写出下列反应的离子方程式。
(1)NH4Cl溶液与NaOH溶液混合:
_____________________________________________________________。
(2)浓HNO3与Cu的反应:
_____________________________________________________________。
(3)Cu(OH)2与醋酸溶液反应:
_____________________________________________________________。
(4)(NH4)2SO4溶液与NaOH溶液混合加热:
_____________________________________________________________。
(5)Na2CO3溶液与CaCl2溶液混合:
_______________________________________________________________。
(6)NaHCO3溶液与稀盐酸混合:
_______________________________________________________________。
(7)Na2S溶液显碱性:
_______________________________________________________________。
(8)Al2O3与NaOH溶液反应:
_______________________________________________________________。
(9)向NaHSO3溶液中加入过量NaHSO4溶液:
_______________________________________________________________。
2.写出下列离子方程式对应的化学方程式。
(1)Cu2++Fe===Fe2++Cu
__________________________________________________________。
(2)H++OH-===H2O
__________________________________________________________。
(3)Fe3++3OH-===Fe(OH)3↓________________________________。
答案:(1)CuSO4+Fe===FeSO4+Cu
(2)HNO3+NaOH===NaNO3+H2O
(3)FeCl3+3NaOH===Fe(OH)3↓+3NaCl
(4)Ca(OH)2+NaHCO3===CaCO3↓+H2O+NaOH
(5)Na2CO3+CaCl2===CaCO3+2NaCl
(6)NaHS+CuSO4===CuS↓+NaHSO4
逐点清(三) 特殊离子方程式的书写
类型(一) 连续反应型——“分步分析”法
连续反应型是指反应生成的物质又能与过量反应物反应,导致反应物的量不同时,离子方程式不同。
(1)可溶性多元弱酸(如H2S等)与碱反应
酸不足(或碱过量)时生成正盐,如H2S+2OH-===S2-+2H2O,酸过量(或碱不足)时生成酸式盐,如H2S+OH-===HS-+H2O。
[例1] 向NaAlO2溶液中慢慢通入过量CO2,反应过程的有关离子方程式为____________________________________________________,总反应离子方程式为______________________________________________。
[对点训练]
1.写出下列反应的离子方程式。
CO2通入NaOH溶液中
(1)CO2少量:________________________________________________;
(2)CO2过量:_____________________________________________。
2.(1)84消毒液通入过量CO2反应的离子方程式为____________________。
(2)AlCl3溶液中滴入少量NaOH溶液反应的离子方程式为
______________________________________。
(3)苯酚钠(C6H5ONa)溶液中通入少量CO2反应的离子方程式为
_________________________________________。
类型(二) 物质配比型——“少定多变”法
(一)少量与过量型
1.将少量物质定为“1 mol”,若少量物质有两种或两种以上离子参加反应,则参加反应离子的物质的量之比与物质组成之比相符。
2.依据少量物质中离子的物质的量,由以少定多原则,确定过量物质中实际参加反应的离子的物质的量。
[例2] NaHCO3溶液与过量Ca(OH)2溶液反应的离子方程式为_______________________________________________________________。
[解题流程]
[对点训练]
3.写出下列反应的离子方程式。
(1)Ca(HCO3)2溶液与NaOH溶液反应
①NaOH不足:______________________________________________。
②NaOH过量:______________________________________________。
(2)Ba(OH)2溶液与NaHSO4溶液反应
①Ba(OH)2不足:__________________________________________。
②Ba(OH)2过量:___________________________________________。
(二)定量型
首先按题给条件中反应物的物质的量,结合“以少定多”的原则及离子反应顺序,逐步写出各步反应的离子方程式;然后把各步离子方程式加和即可得到总反应的离子方程式。
[例3] 同浓度同体积的明矾与Ba(OH)2溶液混合反应的离子方程式为
____________________________________________________________。
[解题流程]
[对点训练]
4.向NaHSO4溶液中滴加Ba(OH)2溶液。
(1)至溶液呈中性:___________________________________________;
(2)至硫酸根离子完全沉淀:___________________________________
____________________________________________________________。
5.NH4Al(SO4)2与Ba(OH)2溶液反应。
(1)n[NH4Al(SO4)2]∶n[Ba(OH)2]=1∶1
_____________________________________________________________
_____________________________________________________________;
(2)n[NH4Al(SO4)2]∶n[Ba(OH)2]=1∶2
_____________________________________________________________
____________________________________________________________。
2.氧化还原型的离子反应
对于氧化还原反应,按“先强后弱”的顺序书写,即氧化性(或还原性)强的优先发生反应,氧化性(或还原性)弱的后发生反应。
如向FeBr2和FeI2的混合液中通入一定的Cl2,反应先后为I->Fe2+>Br-。
[例4] 写出下列反应的离子方程式。
(1)向(NH4)2Fe(SO4)2溶液中加NaOH溶液至Fe2+刚好沉淀完全:_______________________________________________________________。
(2)向FeBr2溶液中通入与其等物质的量的Cl2:___________________
___________________________________________;
[解析] (1)加入NaOH溶液先与Fe2+反应,然后再与NH反应。
(2)通入Cl2,先氧化Fe2+,然后氧化Br-。
[答案] (1)Fe2++2OH-===Fe(OH)2↓
(2)2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-
[对点训练]
6.写出下列反应的离子方程式。
(1)NH4Al(SO4)2溶液与NaOH溶液的反应。
①NaOH溶液少量:_____________________________________________;
②n[NH4Al(SO4)2]∶n(NaOH)=1∶4时:___________________________;
③NaOH溶液足量:_____________________________________________。
(2)将Fe(NO3)3溶液与HI混合。
HI不足:_____________________________________________________;
HI过量:______________________________________________________。
逐点清(四) 离子方程式的正误判断
(一)“拆分”陷阱
离子方程式的正误判断中,常常设置物质是否能“拆分”的陷阱。①易溶于水、易电离的强电解质必须拆分。②非电解质、弱电解质(弱酸、弱碱、水等)、难溶物、气体、氧化物、单质均不能“拆分”,用化学式表示。
[对点训练]
1.(1)向CuSO4溶液中通入H2S气体:
Cu2++S2-===CuS↓ ( )
(2)氯气溶于水:
Cl2+H2O===2H++Cl-+ClO- ( )
答案:(1)× (2)× (3)× (4)× (5)× (6)×
(二)“原理”陷阱
[对点训练]
2.(1)将Na投入到CuSO4溶液中:
2Na+Cu2+===2Na++Cu ( )
(2)Fe和稀硝酸反应:
Fe+2H+===Fe2++H2↑ ( )
(三)“量比”陷阱
在离子方程式正误判断中,学生往往忽略相对量的影响,命题者往往设置“离子方程式正确,但不符合相对量”的陷阱。突破“陷阱”的方法一是审准“相对量”的多少,二是看离子反应是否符合该量。
[对点训练]
3.(1)向FeBr2溶液中通入等量Cl2:
2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl- ( )
(四)“守恒”陷阱
离子方程式除符合质量守恒外,还应符合电荷守恒,学生往往只注意质量守恒,而忽略电荷守恒,这也是命题者经常设置的“陷阱”。
[对点训练]
4.(1)向FeCl2溶液中通入Cl2:
Fe2++Cl2===Fe3++2Cl- ( )
(4)用过氧化氢从酸化的海带灰浸出液中提取碘:
2I-+H2O2+2H+===I2+2H2O ( )
答案:(1)× (2)× (3)× (4)√
谢
谢
观
看
同课章节目录
