2024届高考化学一轮复习 第一章 物质及其变化 第1讲 物质的组成、分类及转化 课件(共57张PPT)
文档属性
| 名称 | 2024届高考化学一轮复习 第一章 物质及其变化 第1讲 物质的组成、分类及转化 课件(共57张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-18 00:00:00 | ||
图片预览







文档简介
(共57张PPT)
第1讲 物质的组成、分类及转化(基础落实课)
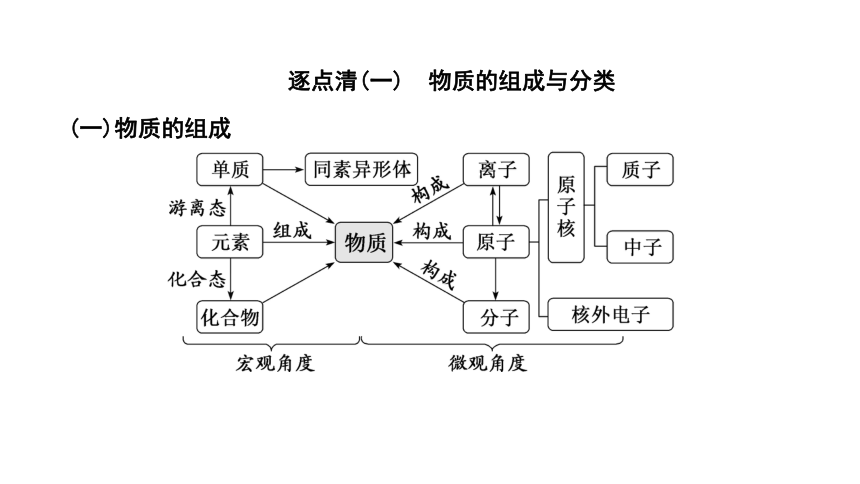
逐点清(一) 物质的组成与分类
(一)物质的组成
纯净物 由_____单质或化合物组成的物质
混合物 由几种_____的单质或化合物组成的物质
化合物 由不同_____构成的纯净物
1.纯净物、混合物、化合物的辨析
同种
不同
元素
概念 同种元素形成的_____单质叫同素异形体
形成 方式 原子个数不同,如O2和O3
原子排列方式不同,如金刚石和石墨
性质 差异 物理性质差别较大,同素异形体之间的转化属于化学变化
2.同素异形体的解读
不同
[注意] ①由同种元素组成的物质不一定是纯净物。若某物质是由一种元素组成的不同单质混合而成,如O2、O3组成的混合气体就是混合物。
②由同位素的不同原子构成的单质(或化合物)是纯净物,如H2和D2、H2O和D2O,由12C和13C组成的石墨也是纯净物。
③分子式相同的物质不一定为纯净物,如正丁烷(C4H10)与异丁烷(C4H10)的混合物。
④结晶水合物(如CuSO4·5H2O)属于纯净物而不是混合物;高分子化合物(如聚乙烯?CH2—CH2?)属于混合物而不是纯净物,因为聚合度n不同。
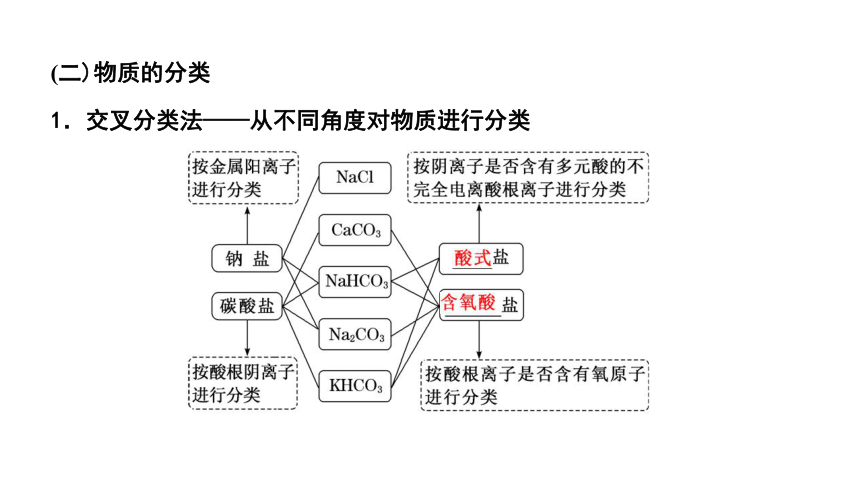
(二)物质的分类
1.交叉分类法——从不同角度对物质进行分类
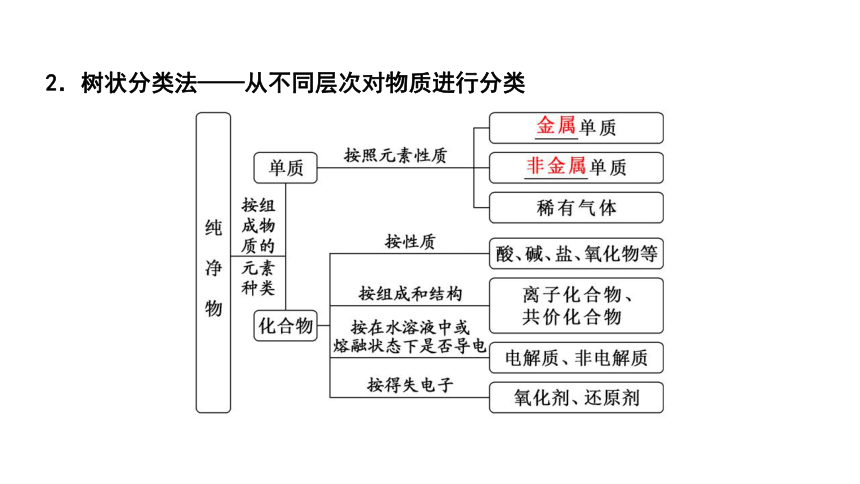
2.树状分类法——从不同层次对物质进行分类
(三)有关概念理解
1.酸、碱、盐
酸 电离出的阳离子全部是______的化合物是酸,分为强酸与弱酸、含氧酸与无氧酸等;但能电离出H+的物质不一定是酸,如NaHSO4是一种盐
碱 电离出的阴离子全部是______的化合物是碱,分为强碱与弱碱、可溶性碱与难溶性碱等
盐 由金属阳离子(或铵根离子)与酸根离子构成的化合物是盐, 分为可溶性盐与难溶性盐,酸式盐、碱式盐与正盐等
H+
OH-
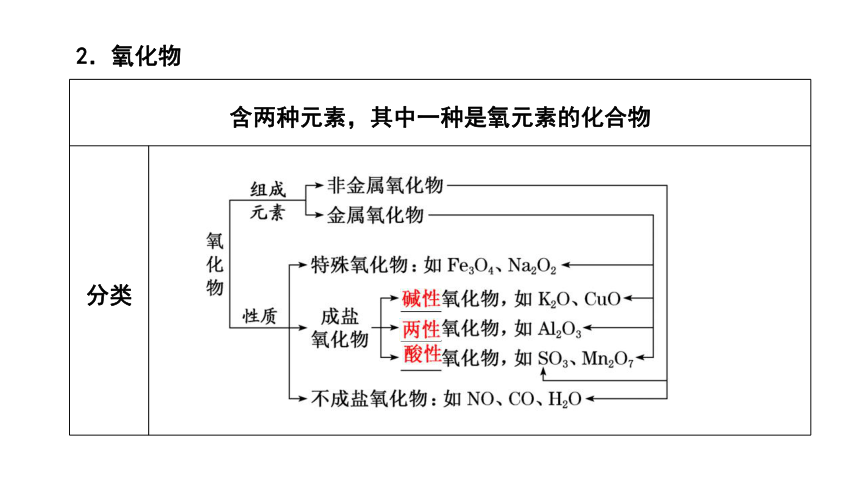
含两种元素,其中一种是氧元素的化合物 分类
2.氧化物
辨析 ①金属氧化物不一定是碱性氧化物,如Mn2O7是酸性氧化物,Al2O3是两性氧化物。②非金属氧化物不一定是酸性氧化物,如NO、CO是不成盐氧化物。③酸性氧化物不一定是非金属氧化物,如Mn2O7是金属氧化物。④碱性氧化物都是金属氧化物。⑤酸性氧化物、碱性氧化物不一定能与水反应生成相应的酸或碱,如SiO2、Fe2O3都不溶于水,也不与水反应。⑥与碱反应生成盐和水的氧化物不一定是酸性氧化物,如2NO2+2NaOH===NaNO3+NaNO2+H2O,NO2不是酸性氧化物
续表
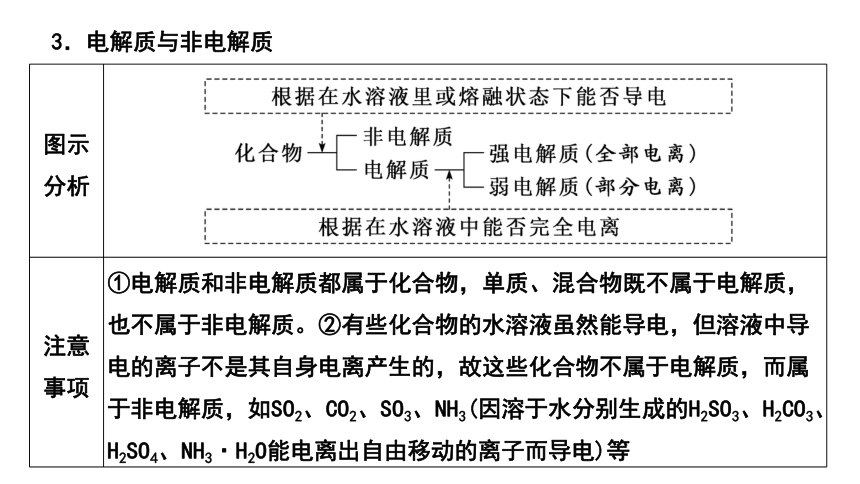
图示分析
注意事项 ①电解质和非电解质都属于化合物,单质、混合物既不属于电解质,也不属于非电解质。②有些化合物的水溶液虽然能导电,但溶液中导电的离子不是其自身电离产生的,故这些化合物不属于电解质,而属于非电解质,如SO2、CO2、SO3、NH3(因溶于水分别生成的H2SO3、H2CO3、H2SO4、NH3·H2O能电离出自由移动的离子而导电)等
3.电解质与非电解质
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)NaCl、SiO2、H2SO4都是由原子构成的化合物 ( )
(2)BaSO4是一种难溶于水的电解质 ( )
(3)Fe(OH)3胶体和CuSO4溶液都是混合物 ( )
(4)由一种元素形成的单质一定为纯净物 ( )
(5)冰醋酸、纯碱、小苏打分别属于酸、碱、盐 ( )
(6)金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物 ( )
(7)Na2CO3溶液呈碱性,Na2CO3既属于盐又属于碱 ( )
√
√
×
×
×
×
×
2.有下列物质:①氧气 ②二氧化碳 ③臭氧(O3)
④盐酸 ⑤铁 ⑥碳酸钠 ⑦空气 ⑧氢氧化钠
⑨冰水混合物 ⑩乙醇 二甲醚
(1)其中由分子直接构成的纯净物有_______________________________。
(2)由离子直接构成的纯净物有_______________________________ 。
(3)互为同素异形体的是_______________________________ 。
(4)属于单质的有_______________________________ 。
(5)属于化合物的有_______________________________ 。
(6)属于混合物的有_______________________________ 。
(7)属于电解质的有________________,非电解质的有________________。
答案:(1)①②③⑨⑩
(2)⑥⑧
(3)①③
(4)①③⑤
(5)②⑥⑧⑨⑩
(6)④⑦
(7)⑥⑧⑨ ②⑩
[题点考法·全面练通]
1.2022年2月,我国科学家成功开发全球首套二氧化碳加氢制汽油(碳原子数在5~12之间的烃)的装置。下列有关二氧化碳加氢制汽油的说法正确的是 ( )
A.汽油属于纯净物
B.汽油中含有C、H、O三种元素
C.CO2属于酸性氧化物
D.该反应为化合反应
解析:CO2能与碱反应生成盐和水,这类氧化物称为酸性氧化物。
答案:C
选项 碱 盐 电解质 非电解质
A 胆矾 食盐 铜 酒精
B 纯碱 CaCO3 NH3·H2O Fe
C 烧碱 小苏打 BaSO4 干冰
D KOH CuSO4 SO3 葡萄糖
2.下列表格中各项都正确的是 ( )
解析:胆矾是CuSO4·5H2O,属于盐,铜既不属于电解质也不属于非电解质,故A错误;纯碱为碳酸钠,属于盐,Fe是单质,既不属于电解质也不属于非电解质,故B错误。SO3属于非电解质;故D错误。
答案:C
3.分类法是化学学习和研究的重要思想方法。下列有关物质的分类或说法正确的是 ( )
A.根据树状分类法可知,碳酸钠属于钠盐、碳酸盐、正盐
B.淀粉、聚氯乙烯、王水均为混合物
C.C919大型客机、“蛟龙”号载人潜水器等使用的合金材料中都不含非金属元素
D.H2O2、光气(COCl2)、Na2O2均为氧化物
解析:Na2CO3属于钠盐、碳酸盐、正盐,属于交叉分类法,A错误;
合金材料中可以含非金属如C,C错误;
光气(COCl2)含三种元素,不是氧化物,D错误。
答案:B
解析:A项,TiO2和CO2与NaOH溶液反应只生成盐和水,故属于酸性氧化物,正确;
D项,CO2与H2O反应生成电解质H2CO3,CO2属于非电解质,错误。
答案:D
气体 混合物 空气、水煤气(CO和H2)、爆鸣气(H2和O2)、天然气(主要成分是CH4)、焦炉气(主要成分是H2和CH4)、高炉煤气、石油气、裂解气
液体 混合物 氨水、氯水、王水、天然水、硬水、软水、水玻璃、福尔马林、浓硫酸、盐酸、汽油、植物油、胶体
固体 混合物 大理石、碱石灰、漂白粉、高分子化合物、玻璃、水泥、合金、铝热剂
[归纳拓展] 常见的混合物归类汇总
逐点清(二) 物质的性质与变化
(一)物质的变化与性质
1.物质的变化与物质性质的关系
物理变化 化学变化
三馏 蒸馏、分馏 干馏
四色 焰色试验 显色反应、颜色反应、指示剂变色反应
五解 潮解 分解、电解、水解、裂解
十五化 熔化、汽化、液化、升华 氧化、风化、炭化、钝化、催化、皂化、歧化、硝化、酯化、裂化、油脂的硬化
2.常见的物理变化和化学变化
[注意] ①有旧化学键断裂,同时有新化学键形成的是化学变化;只有化学键断裂的不一定是化学变化,如NaCl晶体的熔化。
②化学变化中一定伴随着物理变化。
(二)单质、氧化物、酸(或碱)和盐的转化关系
[注意] 物质间转化的5个常见易错点
①S燃烧不能直接生成SO3而是生成SO2。
②Al2O3、SiO2、Fe2O3与H2O不反应,不能直接转化为Al(OH)3、H2SiO3、Fe(OH)3。
③NH3催化氧化不能直接生成NO2。
④Fe与Cl2反应不能直接生成FeCl2。
⑤Fe与H+、Cu2+、S、I2反应不能直接生成Fe3+。
(三)常见物质的转化规律
1.“易溶制难溶”规律
如Na2SO4溶液与BaCl2溶液反应,其离子方程式为Ba2++SO===BaSO4↓。
2.“难挥发制易挥发”规律
如浓磷酸与NaBr固体反应:
分类 实例 离子方程式
酸 CH3COONa+HCl CH3COO-+H+===___________
碱 FeCl3+NaOH Fe3++3OH-===____________
氧化剂 Cl2+KI Cl2+2I-===I2+2Cl-
还原剂 Fe+CuSO4 Cu2++Fe===Cu+Fe2+
3.“强制弱”规律
CH3COOH
Fe(OH)3↓
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)金属的导电、导热性和延展性是金属的化学性质 ( )
(2)CaCl2的潮解和Na2CO3·10H2O的风化均是化学变化 ( )
(3)水的汽化和煤的气化均为物理变化 ( )
(4)激光法蒸发石墨得C60发生的是化学变化 ( )
(5)用铂丝蘸取Na2SO4溶液进行焰色试验是化学变化 ( )
(6)碱性氧化物均可以与H2O反应生成碱 ( )
×
×
×
×
×
√
2.写出下列转化的化学方程式,并注明反应类型。
①____________________________________________________________,
反应类型________________。
②____________________________________________________________,
反应类型________________。
③____________________________________________________________,
反应类型________________。
①_____________________________________________________________,
反应类型________________。
②_____________________________________________________________。
③_____________________________________________________________,
反应类型________________。
[题点考法·全面练通]
题点(一) 物质的性质及应用与变化确定
1.(2022·湖南等级考)化学促进了科技进步和社会发展。下列叙述中没有涉及化学变化的是 ( )
A.《神农本草经》中记载的“石胆能化铁为铜”
B.利用“侯氏联合制碱法”制备纯碱
C.科学家成功将CO2转化为淀粉或葡萄糖
D.北京冬奥会场馆使用CO2跨临界直冷制冰
解析: “石胆能化铁为铜”指的是铁与硫酸铜发生置换反应生成铜,A发生了化学变化;工业上利用“侯氏联合制碱法”制备纯碱,二氧化碳、氨气、氯化钠和水发生反应生成的碳酸氢钠晶体经加热后分解生成碳酸钠(即纯碱),B发生了化学变化;CO2转化为淀粉或葡萄糖,有新物质生成,C发生了化学变化;使用CO2跨临界直冷制冰,将水直接转化为冰,没有新物质生成,只发生了物理变化,D符合题意。
答案:D
选项 劳动项目 化学知识
A 面包师用小苏打作发泡剂烘焙面包 Na2CO3可与酸反应
B 环保工程师用熟石灰处理酸性废水 熟石灰具有碱性
C 工人将模具干燥后再注入熔融钢水 铁与H2O高温下会反应
D 技术人员开发高端耐腐蚀镀铝钢板 铝能形成致密氧化膜
2.(2022·广东等级考)劳动开创未来。下列劳动项目与所述的化学知识没有关联的是 ( )
解析:小苏打是碳酸氢钠,不是碳酸钠,故A没有关联;熟石灰是氢氧化钙,具有碱性,可以用于处理酸性废水,故B有关联;熔融的铁与水蒸气在高温下反应会生成四氧化三铁和氢气,因此必须将模具干燥,故C有关联;钢板上镀铝,保护钢板,金属铝表面形成致密氧化膜而保护金属铝不被腐蚀,故D有关联。
答案:A
题点(二) 物质的转化与反应类型
3.(2023·无锡模拟)在指定条件下,下列选项所示的物质间转化能实现的是 ( )
解析:NaOH过量,发生反应:CO2+2NaOH===Na2CO3+H2O,A错误;
侯氏制碱法中发生反应:NaCl+CO2+NH3+H2O===NaHCO3↓+NH4Cl,B错误;
MgO与CO不反应,C错误;
A.青铜是铜的一种合金
B.O2和O3是氧元素的同素异形体
C.Cu2S只作还原剂
D.该反应属于置换反应
解析:该反应中Cu2S中Cu元素化合价降低,S元素化合价升高,所以既是氧化剂又是还原剂。
答案:C
5.混合物M中可能含有Al2O3、Fe2O3、Al、Cu,为确定其组成,某同学设计如图所示分析方案。下列分析不正确的是 ( )
解析:向混合物M中加过量NaOH溶液,得到不溶物固体N,向固体N中加过量盐酸,生成蓝绿色溶液,说明混合物M中一定含Fe2O3和Cu,Fe2O3溶于酸生成的Fe3+与Cu反应生成浅绿色的Fe2+和蓝色的Cu2+,若m1>m2,则混合物M中一定含Al2O3和Al中的至少一种,A项正确;盐酸过量,则固体P一定是Cu,属于纯净物,C项错误;若混合物M中含Al,则加入过量NaOH溶液,Al与NaOH反应生成H2,D项正确。
答案:C
逐点清(三) 分散系
(一)分散系
1.概念:把一种(或多种)物质以_______形式分散到另一种(或多种)物质中所形成的混合物。
2.分类
(1)若按分散质或分散剂的状态分类,可分为9种分散系,如图:
粒子
烟属于______分散系;雾属于_____分散系;
悬浊液属于_______分散系;合金属于______分散系。
固气
液气
固液
固固
(2)根据分散质粒子的_________将分散系分为溶液、浊液和______,可用如下直观地表示。
直径大小
胶体
分散系 溶液 胶体 浊液
分散质粒子 单个小分子或离子 高分子或多分子集合体 巨大数目的分子集合体
性质 外观 均一、透明 均一 不均一、不透明
稳定性 ______ 较稳定 不稳定
能否透过滤纸 不能
能否透过半透膜 ______ 不能 不能
鉴别 无丁达尔效应 有丁达尔效应 静置分层或沉淀
3.三种分散系的比较
能
能
能
稳定
(二)胶 体
1.本质特征:分散质粒子的直径为___________。
2.制备Fe(OH)3胶体的实验
(1)操作图示
1~100 nm
(2)操作步骤
向小烧杯中注入一定量蒸馏水,置于三脚架上方的陶土网上,将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至液体呈________,停止加热,即制得Fe(OH)3胶体。
(3)化学方程式
_________________________________________
红褐色
按分散 剂状态 气溶胶 雾、云、烟
液溶胶 Fe(OH)3胶体、蛋白质溶液
固溶胶 烟水晶、有色玻璃
按分散质 粒子胶体 分散质粒子是很多小分子或离子的集合体,如Fe(OH)3胶体
分子胶体 分散质粒子是高分子化合物,如淀粉溶液、蛋白质溶液
3.胶体的分类
丁达尔 效应 可见光束通过胶体时,会出现一条光亮的“______”的现象(应用:鉴别溶液和胶体)
聚沉 胶体粒子聚集成较大颗粒,形成沉淀从分散剂里析出的过程。使胶体聚沉的方法:①加入电解质;②加入与胶粒带相反电荷的胶体;③加热(应用:三角洲的形成;明矾、铁盐溶液净水;盐卤制豆腐)
电泳 在电场作用下,胶体粒子在分散剂中作定向移动的现象。如带正电荷的Fe(OH)3胶体粒子向阴极移动(应用:工厂静电除尘)
渗析 胶体粒子不能透过半透膜,而溶液中的溶质分子或离子可以透过半透膜的现象(应用:除去胶体中的电解质)
4.胶体的性质及应用
通路
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)胶体区别于其他分散系的本质特征是有丁达尔效应 ( )
(2)“血液透析”利用了胶体的性质 ( )
(3)浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 ( )
(4)胶体粒子在电场作用下可定向移动,说明胶体带电 ( )
(5)将NaCl晶体粉碎成纳米颗粒溶于水形成的分散系具有丁达尔效应 ( )
(6)分离Fe(OH)3胶体中胶体粒子可以用过滤法 ( )
√
×
×
×
×
×
2.FeCl3溶液、Fe(OH)3胶体、Fe(OH)3浊液是三种重要的分散系:
(1)Fe(OH)3胶体区别于其他分散系的本质特征是_____________________
_______________________________________________。
(2)分别用一束光透过三种分散系,具有丁达尔效应的是______________。
(3)三种分散系中,能与盐酸反应的是________________________,具有吸附性的是____________________________________________________。
(4)三种分散系属于混合物的是___________________________________
______________________________________________________________。
答案:(1)分散质粒子的直径在1~100 nm
(2)Fe(OH)3胶体
(3)Fe(OH)3胶体、Fe(OH)3浊液 Fe(OH)3胶体
(4)FeCl3溶液、Fe(OH)3胶体、Fe(OH)3浊液
[题点考法·全面练通]
1.磁流体是电子材料的新秀。在一定条件下,将含等物质的量的FeSO4和Fe2(SO4)3的溶液混合,再滴入稍过量的NaOH溶液,可得到分散质粒子直径大小在36~55 nm之间的黑色磁流体。下列说法中正确的是 ( )
A.所得的分散系属于悬浊液
B.用一束光照射该分散系能产生丁达尔效应
C.所得的分散系中分散质为Fe2O3,不能透过滤纸
D.分散系为胶体,分散质粒子大小即Fe(OH)3分子直径大小
解析:由题意磁流体分散系分散质粒子直径,知该分散系属于胶体,能产生丁达尔效应。
答案:B
2.下列现象或应用不能用胶体知识解释的是 ( )
A.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
B.牛油与NaOH溶液共煮,向反应后所得的溶液中加入食盐有固体析出
C.氯化铝溶液中加入小苏打溶液会产生白色沉淀和气体
D.水泥厂、冶金厂常用静电除尘法除去工厂烟尘,减少对空气的污染
解析:人体的血液是胶体,不能透过半透膜,因此可以用血液透析来治疗肾衰竭引起的血液中毒,A项不符合题意;
牛油与NaOH溶液反应是皂化反应,生成高级脂肪酸钠,加食盐,使前者溶解度变小,所以会析出,这叫盐析,属于胶体的性质,B项不符合题意;
氯化铝与碳酸氢钠溶液反应属于相互促进的水解反应,不属于胶体的性质,C项符合题意;
工厂里的烟尘属于胶体,其粒子带电荷,可以发生电泳,因此用高压电除去烟尘,D项不符合题意。
答案:C
3.高铁酸钾(K2FeO4)被广泛应用在水处理方面,高铁酸钾的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌于一体的新型高效多功能水处理剂。干燥的高铁酸钾受热易分解,但在198 ℃以下是稳定的。高铁酸钾在水处理过程中涉及的变化过程有 ( )
①胶体的吸附 ②盐类水解 ③焰色试验④氧化还原反应
A.①②③④ B.①②④
C.②③④ D.①③④
解析:K2FeO4具有强氧化性,杀菌消毒,发生氧化还原反应生成Fe3+水解,生成胶体吸附悬浮物而净水。
答案:B
4.用Fe(OH)3胶体进行下列实验。
(1)判断是否为Fe(OH)3胶体的简单方法是____________________。
(2)将其装入U形管中,用石墨电极接通直流电,通电一段时间后,发现阴极附近的颜色加深,这说明________________________,这种现象称为__________。
(3)向其中加入饱和(NH4)2SO4溶液发生的现象是______________________,原因是_________________________________________________________。
(4)向其中滴入过量稀硫酸,现象是________________________________,其原因是______________________________________________________。
(5)提纯此分散系常用的方法是________。
答案:(1)丁达尔效应
(2)Fe(OH)3胶体粒子带正电荷 电泳
(3)产生红褐色沉淀 电解质溶液使胶体发生了聚沉
(4)先出现红褐色沉淀,后沉淀溶解 开始加入稀硫酸时,胶体发生聚沉生成氢氧化铁沉淀,当酸过量时又使沉淀溶解
(5)渗析法
[归纳拓展]
(1)常见的净水剂:KAl(SO4)2·12H2O、FeCl3·6H2O等,其净水原理是Al3+、Fe3+水解分别生成Al(OH)3胶体、Fe(OH)3胶体而达到净化水的目的。
(2)胶体具有介稳性的主要原因是胶体粒子可以通过吸附带电粒子而带有电荷,且同种电荷相互排斥,不易聚集成较大的颗粒。
(3)丁达尔效应是物理变化而不是化学变化。
(4)胶体不带电,胶体中的胶粒能够吸附体系中的带电粒子而使胶粒带电荷,但整个分散系仍呈电中性。
(5)胶体聚沉属于物理变化,如蛋白质的盐析就属于胶体聚沉现象。但蛋白质的变性不属于胶体的聚沉,此过程属于化学变化。
谢
谢
观
看
第1讲 物质的组成、分类及转化(基础落实课)
逐点清(一) 物质的组成与分类
(一)物质的组成
纯净物 由_____单质或化合物组成的物质
混合物 由几种_____的单质或化合物组成的物质
化合物 由不同_____构成的纯净物
1.纯净物、混合物、化合物的辨析
同种
不同
元素
概念 同种元素形成的_____单质叫同素异形体
形成 方式 原子个数不同,如O2和O3
原子排列方式不同,如金刚石和石墨
性质 差异 物理性质差别较大,同素异形体之间的转化属于化学变化
2.同素异形体的解读
不同
[注意] ①由同种元素组成的物质不一定是纯净物。若某物质是由一种元素组成的不同单质混合而成,如O2、O3组成的混合气体就是混合物。
②由同位素的不同原子构成的单质(或化合物)是纯净物,如H2和D2、H2O和D2O,由12C和13C组成的石墨也是纯净物。
③分子式相同的物质不一定为纯净物,如正丁烷(C4H10)与异丁烷(C4H10)的混合物。
④结晶水合物(如CuSO4·5H2O)属于纯净物而不是混合物;高分子化合物(如聚乙烯?CH2—CH2?)属于混合物而不是纯净物,因为聚合度n不同。
(二)物质的分类
1.交叉分类法——从不同角度对物质进行分类
2.树状分类法——从不同层次对物质进行分类
(三)有关概念理解
1.酸、碱、盐
酸 电离出的阳离子全部是______的化合物是酸,分为强酸与弱酸、含氧酸与无氧酸等;但能电离出H+的物质不一定是酸,如NaHSO4是一种盐
碱 电离出的阴离子全部是______的化合物是碱,分为强碱与弱碱、可溶性碱与难溶性碱等
盐 由金属阳离子(或铵根离子)与酸根离子构成的化合物是盐, 分为可溶性盐与难溶性盐,酸式盐、碱式盐与正盐等
H+
OH-
含两种元素,其中一种是氧元素的化合物 分类
2.氧化物
辨析 ①金属氧化物不一定是碱性氧化物,如Mn2O7是酸性氧化物,Al2O3是两性氧化物。②非金属氧化物不一定是酸性氧化物,如NO、CO是不成盐氧化物。③酸性氧化物不一定是非金属氧化物,如Mn2O7是金属氧化物。④碱性氧化物都是金属氧化物。⑤酸性氧化物、碱性氧化物不一定能与水反应生成相应的酸或碱,如SiO2、Fe2O3都不溶于水,也不与水反应。⑥与碱反应生成盐和水的氧化物不一定是酸性氧化物,如2NO2+2NaOH===NaNO3+NaNO2+H2O,NO2不是酸性氧化物
续表
图示分析
注意事项 ①电解质和非电解质都属于化合物,单质、混合物既不属于电解质,也不属于非电解质。②有些化合物的水溶液虽然能导电,但溶液中导电的离子不是其自身电离产生的,故这些化合物不属于电解质,而属于非电解质,如SO2、CO2、SO3、NH3(因溶于水分别生成的H2SO3、H2CO3、H2SO4、NH3·H2O能电离出自由移动的离子而导电)等
3.电解质与非电解质
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)NaCl、SiO2、H2SO4都是由原子构成的化合物 ( )
(2)BaSO4是一种难溶于水的电解质 ( )
(3)Fe(OH)3胶体和CuSO4溶液都是混合物 ( )
(4)由一种元素形成的单质一定为纯净物 ( )
(5)冰醋酸、纯碱、小苏打分别属于酸、碱、盐 ( )
(6)金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物 ( )
(7)Na2CO3溶液呈碱性,Na2CO3既属于盐又属于碱 ( )
√
√
×
×
×
×
×
2.有下列物质:①氧气 ②二氧化碳 ③臭氧(O3)
④盐酸 ⑤铁 ⑥碳酸钠 ⑦空气 ⑧氢氧化钠
⑨冰水混合物 ⑩乙醇 二甲醚
(1)其中由分子直接构成的纯净物有_______________________________。
(2)由离子直接构成的纯净物有_______________________________ 。
(3)互为同素异形体的是_______________________________ 。
(4)属于单质的有_______________________________ 。
(5)属于化合物的有_______________________________ 。
(6)属于混合物的有_______________________________ 。
(7)属于电解质的有________________,非电解质的有________________。
答案:(1)①②③⑨⑩
(2)⑥⑧
(3)①③
(4)①③⑤
(5)②⑥⑧⑨⑩
(6)④⑦
(7)⑥⑧⑨ ②⑩
[题点考法·全面练通]
1.2022年2月,我国科学家成功开发全球首套二氧化碳加氢制汽油(碳原子数在5~12之间的烃)的装置。下列有关二氧化碳加氢制汽油的说法正确的是 ( )
A.汽油属于纯净物
B.汽油中含有C、H、O三种元素
C.CO2属于酸性氧化物
D.该反应为化合反应
解析:CO2能与碱反应生成盐和水,这类氧化物称为酸性氧化物。
答案:C
选项 碱 盐 电解质 非电解质
A 胆矾 食盐 铜 酒精
B 纯碱 CaCO3 NH3·H2O Fe
C 烧碱 小苏打 BaSO4 干冰
D KOH CuSO4 SO3 葡萄糖
2.下列表格中各项都正确的是 ( )
解析:胆矾是CuSO4·5H2O,属于盐,铜既不属于电解质也不属于非电解质,故A错误;纯碱为碳酸钠,属于盐,Fe是单质,既不属于电解质也不属于非电解质,故B错误。SO3属于非电解质;故D错误。
答案:C
3.分类法是化学学习和研究的重要思想方法。下列有关物质的分类或说法正确的是 ( )
A.根据树状分类法可知,碳酸钠属于钠盐、碳酸盐、正盐
B.淀粉、聚氯乙烯、王水均为混合物
C.C919大型客机、“蛟龙”号载人潜水器等使用的合金材料中都不含非金属元素
D.H2O2、光气(COCl2)、Na2O2均为氧化物
解析:Na2CO3属于钠盐、碳酸盐、正盐,属于交叉分类法,A错误;
合金材料中可以含非金属如C,C错误;
光气(COCl2)含三种元素,不是氧化物,D错误。
答案:B
解析:A项,TiO2和CO2与NaOH溶液反应只生成盐和水,故属于酸性氧化物,正确;
D项,CO2与H2O反应生成电解质H2CO3,CO2属于非电解质,错误。
答案:D
气体 混合物 空气、水煤气(CO和H2)、爆鸣气(H2和O2)、天然气(主要成分是CH4)、焦炉气(主要成分是H2和CH4)、高炉煤气、石油气、裂解气
液体 混合物 氨水、氯水、王水、天然水、硬水、软水、水玻璃、福尔马林、浓硫酸、盐酸、汽油、植物油、胶体
固体 混合物 大理石、碱石灰、漂白粉、高分子化合物、玻璃、水泥、合金、铝热剂
[归纳拓展] 常见的混合物归类汇总
逐点清(二) 物质的性质与变化
(一)物质的变化与性质
1.物质的变化与物质性质的关系
物理变化 化学变化
三馏 蒸馏、分馏 干馏
四色 焰色试验 显色反应、颜色反应、指示剂变色反应
五解 潮解 分解、电解、水解、裂解
十五化 熔化、汽化、液化、升华 氧化、风化、炭化、钝化、催化、皂化、歧化、硝化、酯化、裂化、油脂的硬化
2.常见的物理变化和化学变化
[注意] ①有旧化学键断裂,同时有新化学键形成的是化学变化;只有化学键断裂的不一定是化学变化,如NaCl晶体的熔化。
②化学变化中一定伴随着物理变化。
(二)单质、氧化物、酸(或碱)和盐的转化关系
[注意] 物质间转化的5个常见易错点
①S燃烧不能直接生成SO3而是生成SO2。
②Al2O3、SiO2、Fe2O3与H2O不反应,不能直接转化为Al(OH)3、H2SiO3、Fe(OH)3。
③NH3催化氧化不能直接生成NO2。
④Fe与Cl2反应不能直接生成FeCl2。
⑤Fe与H+、Cu2+、S、I2反应不能直接生成Fe3+。
(三)常见物质的转化规律
1.“易溶制难溶”规律
如Na2SO4溶液与BaCl2溶液反应,其离子方程式为Ba2++SO===BaSO4↓。
2.“难挥发制易挥发”规律
如浓磷酸与NaBr固体反应:
分类 实例 离子方程式
酸 CH3COONa+HCl CH3COO-+H+===___________
碱 FeCl3+NaOH Fe3++3OH-===____________
氧化剂 Cl2+KI Cl2+2I-===I2+2Cl-
还原剂 Fe+CuSO4 Cu2++Fe===Cu+Fe2+
3.“强制弱”规律
CH3COOH
Fe(OH)3↓
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)金属的导电、导热性和延展性是金属的化学性质 ( )
(2)CaCl2的潮解和Na2CO3·10H2O的风化均是化学变化 ( )
(3)水的汽化和煤的气化均为物理变化 ( )
(4)激光法蒸发石墨得C60发生的是化学变化 ( )
(5)用铂丝蘸取Na2SO4溶液进行焰色试验是化学变化 ( )
(6)碱性氧化物均可以与H2O反应生成碱 ( )
×
×
×
×
×
√
2.写出下列转化的化学方程式,并注明反应类型。
①____________________________________________________________,
反应类型________________。
②____________________________________________________________,
反应类型________________。
③____________________________________________________________,
反应类型________________。
①_____________________________________________________________,
反应类型________________。
②_____________________________________________________________。
③_____________________________________________________________,
反应类型________________。
[题点考法·全面练通]
题点(一) 物质的性质及应用与变化确定
1.(2022·湖南等级考)化学促进了科技进步和社会发展。下列叙述中没有涉及化学变化的是 ( )
A.《神农本草经》中记载的“石胆能化铁为铜”
B.利用“侯氏联合制碱法”制备纯碱
C.科学家成功将CO2转化为淀粉或葡萄糖
D.北京冬奥会场馆使用CO2跨临界直冷制冰
解析: “石胆能化铁为铜”指的是铁与硫酸铜发生置换反应生成铜,A发生了化学变化;工业上利用“侯氏联合制碱法”制备纯碱,二氧化碳、氨气、氯化钠和水发生反应生成的碳酸氢钠晶体经加热后分解生成碳酸钠(即纯碱),B发生了化学变化;CO2转化为淀粉或葡萄糖,有新物质生成,C发生了化学变化;使用CO2跨临界直冷制冰,将水直接转化为冰,没有新物质生成,只发生了物理变化,D符合题意。
答案:D
选项 劳动项目 化学知识
A 面包师用小苏打作发泡剂烘焙面包 Na2CO3可与酸反应
B 环保工程师用熟石灰处理酸性废水 熟石灰具有碱性
C 工人将模具干燥后再注入熔融钢水 铁与H2O高温下会反应
D 技术人员开发高端耐腐蚀镀铝钢板 铝能形成致密氧化膜
2.(2022·广东等级考)劳动开创未来。下列劳动项目与所述的化学知识没有关联的是 ( )
解析:小苏打是碳酸氢钠,不是碳酸钠,故A没有关联;熟石灰是氢氧化钙,具有碱性,可以用于处理酸性废水,故B有关联;熔融的铁与水蒸气在高温下反应会生成四氧化三铁和氢气,因此必须将模具干燥,故C有关联;钢板上镀铝,保护钢板,金属铝表面形成致密氧化膜而保护金属铝不被腐蚀,故D有关联。
答案:A
题点(二) 物质的转化与反应类型
3.(2023·无锡模拟)在指定条件下,下列选项所示的物质间转化能实现的是 ( )
解析:NaOH过量,发生反应:CO2+2NaOH===Na2CO3+H2O,A错误;
侯氏制碱法中发生反应:NaCl+CO2+NH3+H2O===NaHCO3↓+NH4Cl,B错误;
MgO与CO不反应,C错误;
A.青铜是铜的一种合金
B.O2和O3是氧元素的同素异形体
C.Cu2S只作还原剂
D.该反应属于置换反应
解析:该反应中Cu2S中Cu元素化合价降低,S元素化合价升高,所以既是氧化剂又是还原剂。
答案:C
5.混合物M中可能含有Al2O3、Fe2O3、Al、Cu,为确定其组成,某同学设计如图所示分析方案。下列分析不正确的是 ( )
解析:向混合物M中加过量NaOH溶液,得到不溶物固体N,向固体N中加过量盐酸,生成蓝绿色溶液,说明混合物M中一定含Fe2O3和Cu,Fe2O3溶于酸生成的Fe3+与Cu反应生成浅绿色的Fe2+和蓝色的Cu2+,若m1>m2,则混合物M中一定含Al2O3和Al中的至少一种,A项正确;盐酸过量,则固体P一定是Cu,属于纯净物,C项错误;若混合物M中含Al,则加入过量NaOH溶液,Al与NaOH反应生成H2,D项正确。
答案:C
逐点清(三) 分散系
(一)分散系
1.概念:把一种(或多种)物质以_______形式分散到另一种(或多种)物质中所形成的混合物。
2.分类
(1)若按分散质或分散剂的状态分类,可分为9种分散系,如图:
粒子
烟属于______分散系;雾属于_____分散系;
悬浊液属于_______分散系;合金属于______分散系。
固气
液气
固液
固固
(2)根据分散质粒子的_________将分散系分为溶液、浊液和______,可用如下直观地表示。
直径大小
胶体
分散系 溶液 胶体 浊液
分散质粒子 单个小分子或离子 高分子或多分子集合体 巨大数目的分子集合体
性质 外观 均一、透明 均一 不均一、不透明
稳定性 ______ 较稳定 不稳定
能否透过滤纸 不能
能否透过半透膜 ______ 不能 不能
鉴别 无丁达尔效应 有丁达尔效应 静置分层或沉淀
3.三种分散系的比较
能
能
能
稳定
(二)胶 体
1.本质特征:分散质粒子的直径为___________。
2.制备Fe(OH)3胶体的实验
(1)操作图示
1~100 nm
(2)操作步骤
向小烧杯中注入一定量蒸馏水,置于三脚架上方的陶土网上,将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至液体呈________,停止加热,即制得Fe(OH)3胶体。
(3)化学方程式
_________________________________________
红褐色
按分散 剂状态 气溶胶 雾、云、烟
液溶胶 Fe(OH)3胶体、蛋白质溶液
固溶胶 烟水晶、有色玻璃
按分散质 粒子胶体 分散质粒子是很多小分子或离子的集合体,如Fe(OH)3胶体
分子胶体 分散质粒子是高分子化合物,如淀粉溶液、蛋白质溶液
3.胶体的分类
丁达尔 效应 可见光束通过胶体时,会出现一条光亮的“______”的现象(应用:鉴别溶液和胶体)
聚沉 胶体粒子聚集成较大颗粒,形成沉淀从分散剂里析出的过程。使胶体聚沉的方法:①加入电解质;②加入与胶粒带相反电荷的胶体;③加热(应用:三角洲的形成;明矾、铁盐溶液净水;盐卤制豆腐)
电泳 在电场作用下,胶体粒子在分散剂中作定向移动的现象。如带正电荷的Fe(OH)3胶体粒子向阴极移动(应用:工厂静电除尘)
渗析 胶体粒子不能透过半透膜,而溶液中的溶质分子或离子可以透过半透膜的现象(应用:除去胶体中的电解质)
4.胶体的性质及应用
通路
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)胶体区别于其他分散系的本质特征是有丁达尔效应 ( )
(2)“血液透析”利用了胶体的性质 ( )
(3)浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 ( )
(4)胶体粒子在电场作用下可定向移动,说明胶体带电 ( )
(5)将NaCl晶体粉碎成纳米颗粒溶于水形成的分散系具有丁达尔效应 ( )
(6)分离Fe(OH)3胶体中胶体粒子可以用过滤法 ( )
√
×
×
×
×
×
2.FeCl3溶液、Fe(OH)3胶体、Fe(OH)3浊液是三种重要的分散系:
(1)Fe(OH)3胶体区别于其他分散系的本质特征是_____________________
_______________________________________________。
(2)分别用一束光透过三种分散系,具有丁达尔效应的是______________。
(3)三种分散系中,能与盐酸反应的是________________________,具有吸附性的是____________________________________________________。
(4)三种分散系属于混合物的是___________________________________
______________________________________________________________。
答案:(1)分散质粒子的直径在1~100 nm
(2)Fe(OH)3胶体
(3)Fe(OH)3胶体、Fe(OH)3浊液 Fe(OH)3胶体
(4)FeCl3溶液、Fe(OH)3胶体、Fe(OH)3浊液
[题点考法·全面练通]
1.磁流体是电子材料的新秀。在一定条件下,将含等物质的量的FeSO4和Fe2(SO4)3的溶液混合,再滴入稍过量的NaOH溶液,可得到分散质粒子直径大小在36~55 nm之间的黑色磁流体。下列说法中正确的是 ( )
A.所得的分散系属于悬浊液
B.用一束光照射该分散系能产生丁达尔效应
C.所得的分散系中分散质为Fe2O3,不能透过滤纸
D.分散系为胶体,分散质粒子大小即Fe(OH)3分子直径大小
解析:由题意磁流体分散系分散质粒子直径,知该分散系属于胶体,能产生丁达尔效应。
答案:B
2.下列现象或应用不能用胶体知识解释的是 ( )
A.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
B.牛油与NaOH溶液共煮,向反应后所得的溶液中加入食盐有固体析出
C.氯化铝溶液中加入小苏打溶液会产生白色沉淀和气体
D.水泥厂、冶金厂常用静电除尘法除去工厂烟尘,减少对空气的污染
解析:人体的血液是胶体,不能透过半透膜,因此可以用血液透析来治疗肾衰竭引起的血液中毒,A项不符合题意;
牛油与NaOH溶液反应是皂化反应,生成高级脂肪酸钠,加食盐,使前者溶解度变小,所以会析出,这叫盐析,属于胶体的性质,B项不符合题意;
氯化铝与碳酸氢钠溶液反应属于相互促进的水解反应,不属于胶体的性质,C项符合题意;
工厂里的烟尘属于胶体,其粒子带电荷,可以发生电泳,因此用高压电除去烟尘,D项不符合题意。
答案:C
3.高铁酸钾(K2FeO4)被广泛应用在水处理方面,高铁酸钾的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌于一体的新型高效多功能水处理剂。干燥的高铁酸钾受热易分解,但在198 ℃以下是稳定的。高铁酸钾在水处理过程中涉及的变化过程有 ( )
①胶体的吸附 ②盐类水解 ③焰色试验④氧化还原反应
A.①②③④ B.①②④
C.②③④ D.①③④
解析:K2FeO4具有强氧化性,杀菌消毒,发生氧化还原反应生成Fe3+水解,生成胶体吸附悬浮物而净水。
答案:B
4.用Fe(OH)3胶体进行下列实验。
(1)判断是否为Fe(OH)3胶体的简单方法是____________________。
(2)将其装入U形管中,用石墨电极接通直流电,通电一段时间后,发现阴极附近的颜色加深,这说明________________________,这种现象称为__________。
(3)向其中加入饱和(NH4)2SO4溶液发生的现象是______________________,原因是_________________________________________________________。
(4)向其中滴入过量稀硫酸,现象是________________________________,其原因是______________________________________________________。
(5)提纯此分散系常用的方法是________。
答案:(1)丁达尔效应
(2)Fe(OH)3胶体粒子带正电荷 电泳
(3)产生红褐色沉淀 电解质溶液使胶体发生了聚沉
(4)先出现红褐色沉淀,后沉淀溶解 开始加入稀硫酸时,胶体发生聚沉生成氢氧化铁沉淀,当酸过量时又使沉淀溶解
(5)渗析法
[归纳拓展]
(1)常见的净水剂:KAl(SO4)2·12H2O、FeCl3·6H2O等,其净水原理是Al3+、Fe3+水解分别生成Al(OH)3胶体、Fe(OH)3胶体而达到净化水的目的。
(2)胶体具有介稳性的主要原因是胶体粒子可以通过吸附带电粒子而带有电荷,且同种电荷相互排斥,不易聚集成较大的颗粒。
(3)丁达尔效应是物理变化而不是化学变化。
(4)胶体不带电,胶体中的胶粒能够吸附体系中的带电粒子而使胶粒带电荷,但整个分散系仍呈电中性。
(5)胶体聚沉属于物理变化,如蛋白质的盐析就属于胶体聚沉现象。但蛋白质的变性不属于胶体的聚沉,此过程属于化学变化。
谢
谢
观
看
同课章节目录
