2024届高考化学一轮复习 第二章 化学常用计量 第1讲 物质的量 气体摩尔体积(32张PPT)
文档属性
| 名称 | 2024届高考化学一轮复习 第二章 化学常用计量 第1讲 物质的量 气体摩尔体积(32张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-18 21:42:22 | ||
图片预览










文档简介
(共32张PPT)
第1讲 物质的量 气体摩尔体积(基础落实课)
逐点清(一) 物质的量 摩尔质量
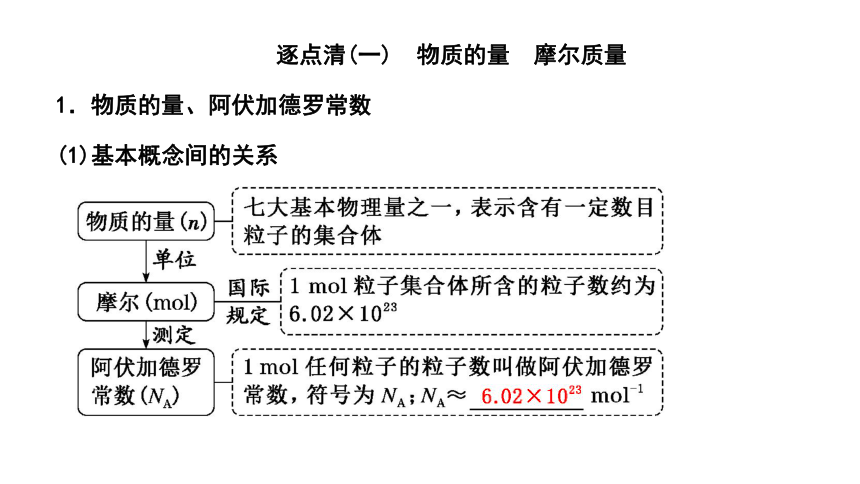
1.物质的量、阿伏加德罗常数
(1)基本概念间的关系
[注意] ①“物质的量”的计量对象是微观粒子(如分子、原子、离子、原子团、质子、中子、电子等),而不是宏观物质颗粒,如不能说1 mol大米。
[题点考法·全面练通]
题点(一) 概念辨析
1.下列关于物质的量、摩尔质量的叙述正确的是 ( )
A.0.012 kg 12C中含有约6.02×1023个碳原子
B.1 mol H2O中含有2 mol氢和1 mol氧
C.氢氧化钠的摩尔质量是40 g
D.2 mol水的摩尔质量是1 mol水的摩尔质量的2倍
答案:A
2.2022年11月29日,搭载神舟十五号载人飞船的长征二号
F遥十五运载火箭在酒泉卫星发射中心发射。卫星的发射
需要用到运载火箭,偏二甲肼(C2H8N2)是一种高能燃料,
燃烧产生巨大能量,可作为航天运载火箭的推动力来源。
下列叙述中正确的是 ( )
A.偏二甲肼的摩尔质量为60 g
B.6.02×1023个偏二甲肼分子的质量为60 g
C.1 mol偏二甲肼的质量为60 g·mol-1
D.6 g偏二甲肼含有NA个偏二甲肼分子
4.根据相关量的关系,完成下列填空。
(1)有以下四种物质:①22 g二氧化碳 ②8 g氢气
③1.204×1024个氮气分子 ④4 ℃时18 mL水,它们所含分子数最多的是________,所含原子数最多的是________,质量最大的是________,所含电子数最多的是________(填序号)。
(2)12.4 g Na2R含Na+ 0.4 mol,则Na2R的摩尔质量为__________,R的相对原子质量为______,含R的质量为1.6 g的Na2R,其物质的量为________。
答案:(1)② ② ③ ③
(2)62 g·mol-1 16 0.1 mol
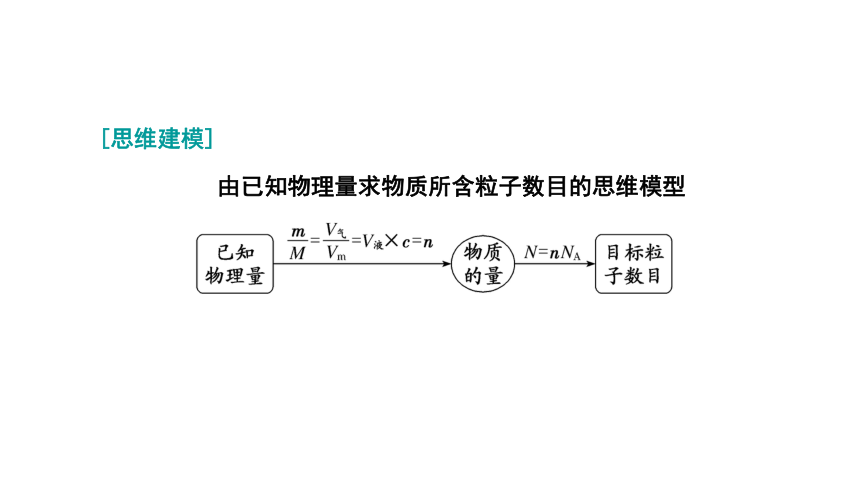
[思维建模]
由已知物理量求物质所含粒子数目的思维模型
逐点清(二) 气体摩尔体积 阿伏加德罗定律
1.影响物质体积的因素
(3)影响因素:气体摩尔体积的数值不是固定不变的,它取决于气体所处的_____和______。
Vm
温度
压强
使用对象 必须是气体,可以是单一气体,也可以是混合气体。如水、酒精、SO3、CCl4等在标准状况下不是气体,不能用气体摩尔体积计算
数值 标准状况下Vm=22.4 L·mol-1,常温常压下Vm>22.4 L·mol-1
22.4 L·mol-1 的理解 气体摩尔体积的数值与温度、压强有关;非标准状况下气体摩尔体积可能是22.4 L·mol-1,也可能不是22.4 L·mol-1。故1 mol 气体的体积若为22.4 L,它所处的状况不一定是标准状况,如气体在273 ℃和202 kPa时,Vm也为22.4 L·mol-1
(4)注意事项
3.阿伏加德罗定律及其推论
(1)阿伏加德罗定律
同温同压下,相同______的任何气体,含有______数目的分子(或气体的物质的量相同)。即“三同”定“一同”。
体积
相同
(2)阿伏加德罗定律的推论
摩尔质量
[注意] ①同温、同压、同体积的任何气体的分子数相等,但原子数不一定相等。②阿伏加德罗定律既适用于单一气体,也适用于混合气体。③在同温同压条件下,可利用气体的相对分子质量大小判断气体密度的大小,如ρ(空气)<ρ(Cl2)。
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)标准状况下,任何物质的摩尔体积都约为22.4 L·mol-1 ( )
(2)20 ℃、101 kPa,1 mol任何气体都约为22.4 L ( )
(3)某混合气体摩尔体积为22.4 L·mol-1 ,则该气体一定处于标准状况
( )
(4)标准状况下,1 mol N2和O2混合气体的体积约为22.4 L ( )
(5)同温同压下,ρ(H2)<ρ(O2) ( )
(6)同温同压下,相同体积的氩气与氧气含有相同的分子数和原子数 ( )
×
×
×
×
√
√
2.(1)2 mol O3和3 mol O2的质量之比为________,分子数之比为________;同温同压下的密度之比为________,含氧原子数之比为________,体积之比为________。
(2)在相同温度、相同体积的密闭容器中分别通入16 g O2和16 g H2,两容器中气体物质的量之比为________,压强之比为________。
答案:(1)1∶1 2∶3 3∶2 1∶1 2∶3
(2)1∶16 1∶16
[题点考法·全面练通]
题点(一) 气体摩尔体积及有关计算
1.一定温度和压强下,30 L某种气态纯净物中含有6.02×1023个分子,该分子由1.204×1024个原子构成,下列有关说法中不正确的是( )
A.该温度和压强可能是标准状况
B.标准状况下,该纯净物若为气态,其体积约是 22.4 L
C.该气体中每个分子含有两个原子
D.若O2在该条件下为气态,则1 mol O2在该条件下的体积也为30 L
解析:若该物质为气态物质,则其在标准状况下的体积为22.4 L,故该温度和压强不可能是标准状况,A项错误,B项正确;由分子数和原子数的关系可知该分子为双原子分子,且其物质的量为1 mol,C项正确;根据题意,在此温度和压强条件下,Vm=30 L·mol-1,D项正确。
答案:A
题点(二) 阿伏加德罗定律及其推论
3.下列条件下,两瓶气体所含原子数一定相等的是 ( )
A.同质量、不同密度的N2和CO
B.同温度、同体积的H2和N2
C.同体积、不同密度的C2H4和C3H6
D.同压强、同体积的N2O和CO2
解析:B项,压强不一定相同,错误;C项,温度未指明,错误;D项,未指明温度,错误。
答案:A
4.一定温度和压强下,用m g的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球(如图),下列说法中正确的是 ( )
5.气体化合物A的化学式可表示为OxFy,已知同温同压下10 mL A受热分解生成15 mL O2和10 mL F2,则A的化学式为________,推断的依据是________________________________。
题点(三) 摩尔质量的有关计算
6.(1)已知标准状况下,气体A的密度为2.857 g·L-1,则气体A的相对分子质量为__________,可能是________气体。
(2)标准状况下,1.92 g某气体的体积为672 mL,则此气体的摩尔质量为________。
7.CO和CO2的混合气体18 g,完全燃烧后测得CO2体积为11.2 L(标准状况),
(1)混合气体在标准状况下的密度是______g·L-1;
(2)混合气体的平均摩尔质量是______g·mol-1。
谢
谢
观
看
第1讲 物质的量 气体摩尔体积(基础落实课)
逐点清(一) 物质的量 摩尔质量
1.物质的量、阿伏加德罗常数
(1)基本概念间的关系
[注意] ①“物质的量”的计量对象是微观粒子(如分子、原子、离子、原子团、质子、中子、电子等),而不是宏观物质颗粒,如不能说1 mol大米。
[题点考法·全面练通]
题点(一) 概念辨析
1.下列关于物质的量、摩尔质量的叙述正确的是 ( )
A.0.012 kg 12C中含有约6.02×1023个碳原子
B.1 mol H2O中含有2 mol氢和1 mol氧
C.氢氧化钠的摩尔质量是40 g
D.2 mol水的摩尔质量是1 mol水的摩尔质量的2倍
答案:A
2.2022年11月29日,搭载神舟十五号载人飞船的长征二号
F遥十五运载火箭在酒泉卫星发射中心发射。卫星的发射
需要用到运载火箭,偏二甲肼(C2H8N2)是一种高能燃料,
燃烧产生巨大能量,可作为航天运载火箭的推动力来源。
下列叙述中正确的是 ( )
A.偏二甲肼的摩尔质量为60 g
B.6.02×1023个偏二甲肼分子的质量为60 g
C.1 mol偏二甲肼的质量为60 g·mol-1
D.6 g偏二甲肼含有NA个偏二甲肼分子
4.根据相关量的关系,完成下列填空。
(1)有以下四种物质:①22 g二氧化碳 ②8 g氢气
③1.204×1024个氮气分子 ④4 ℃时18 mL水,它们所含分子数最多的是________,所含原子数最多的是________,质量最大的是________,所含电子数最多的是________(填序号)。
(2)12.4 g Na2R含Na+ 0.4 mol,则Na2R的摩尔质量为__________,R的相对原子质量为______,含R的质量为1.6 g的Na2R,其物质的量为________。
答案:(1)② ② ③ ③
(2)62 g·mol-1 16 0.1 mol
[思维建模]
由已知物理量求物质所含粒子数目的思维模型
逐点清(二) 气体摩尔体积 阿伏加德罗定律
1.影响物质体积的因素
(3)影响因素:气体摩尔体积的数值不是固定不变的,它取决于气体所处的_____和______。
Vm
温度
压强
使用对象 必须是气体,可以是单一气体,也可以是混合气体。如水、酒精、SO3、CCl4等在标准状况下不是气体,不能用气体摩尔体积计算
数值 标准状况下Vm=22.4 L·mol-1,常温常压下Vm>22.4 L·mol-1
22.4 L·mol-1 的理解 气体摩尔体积的数值与温度、压强有关;非标准状况下气体摩尔体积可能是22.4 L·mol-1,也可能不是22.4 L·mol-1。故1 mol 气体的体积若为22.4 L,它所处的状况不一定是标准状况,如气体在273 ℃和202 kPa时,Vm也为22.4 L·mol-1
(4)注意事项
3.阿伏加德罗定律及其推论
(1)阿伏加德罗定律
同温同压下,相同______的任何气体,含有______数目的分子(或气体的物质的量相同)。即“三同”定“一同”。
体积
相同
(2)阿伏加德罗定律的推论
摩尔质量
[注意] ①同温、同压、同体积的任何气体的分子数相等,但原子数不一定相等。②阿伏加德罗定律既适用于单一气体,也适用于混合气体。③在同温同压条件下,可利用气体的相对分子质量大小判断气体密度的大小,如ρ(空气)<ρ(Cl2)。
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)标准状况下,任何物质的摩尔体积都约为22.4 L·mol-1 ( )
(2)20 ℃、101 kPa,1 mol任何气体都约为22.4 L ( )
(3)某混合气体摩尔体积为22.4 L·mol-1 ,则该气体一定处于标准状况
( )
(4)标准状况下,1 mol N2和O2混合气体的体积约为22.4 L ( )
(5)同温同压下,ρ(H2)<ρ(O2) ( )
(6)同温同压下,相同体积的氩气与氧气含有相同的分子数和原子数 ( )
×
×
×
×
√
√
2.(1)2 mol O3和3 mol O2的质量之比为________,分子数之比为________;同温同压下的密度之比为________,含氧原子数之比为________,体积之比为________。
(2)在相同温度、相同体积的密闭容器中分别通入16 g O2和16 g H2,两容器中气体物质的量之比为________,压强之比为________。
答案:(1)1∶1 2∶3 3∶2 1∶1 2∶3
(2)1∶16 1∶16
[题点考法·全面练通]
题点(一) 气体摩尔体积及有关计算
1.一定温度和压强下,30 L某种气态纯净物中含有6.02×1023个分子,该分子由1.204×1024个原子构成,下列有关说法中不正确的是( )
A.该温度和压强可能是标准状况
B.标准状况下,该纯净物若为气态,其体积约是 22.4 L
C.该气体中每个分子含有两个原子
D.若O2在该条件下为气态,则1 mol O2在该条件下的体积也为30 L
解析:若该物质为气态物质,则其在标准状况下的体积为22.4 L,故该温度和压强不可能是标准状况,A项错误,B项正确;由分子数和原子数的关系可知该分子为双原子分子,且其物质的量为1 mol,C项正确;根据题意,在此温度和压强条件下,Vm=30 L·mol-1,D项正确。
答案:A
题点(二) 阿伏加德罗定律及其推论
3.下列条件下,两瓶气体所含原子数一定相等的是 ( )
A.同质量、不同密度的N2和CO
B.同温度、同体积的H2和N2
C.同体积、不同密度的C2H4和C3H6
D.同压强、同体积的N2O和CO2
解析:B项,压强不一定相同,错误;C项,温度未指明,错误;D项,未指明温度,错误。
答案:A
4.一定温度和压强下,用m g的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球(如图),下列说法中正确的是 ( )
5.气体化合物A的化学式可表示为OxFy,已知同温同压下10 mL A受热分解生成15 mL O2和10 mL F2,则A的化学式为________,推断的依据是________________________________。
题点(三) 摩尔质量的有关计算
6.(1)已知标准状况下,气体A的密度为2.857 g·L-1,则气体A的相对分子质量为__________,可能是________气体。
(2)标准状况下,1.92 g某气体的体积为672 mL,则此气体的摩尔质量为________。
7.CO和CO2的混合气体18 g,完全燃烧后测得CO2体积为11.2 L(标准状况),
(1)混合气体在标准状况下的密度是______g·L-1;
(2)混合气体的平均摩尔质量是______g·mol-1。
谢
谢
观
看
同课章节目录
