2024届高考化学一轮复习 第二章 化学常用计量 第4讲 以物质的量为中心的化学计算常用方法 课件(共38张PPT)
文档属性
| 名称 | 2024届高考化学一轮复习 第二章 化学常用计量 第4讲 以物质的量为中心的化学计算常用方法 课件(共38张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-18 21:41:55 | ||
图片预览









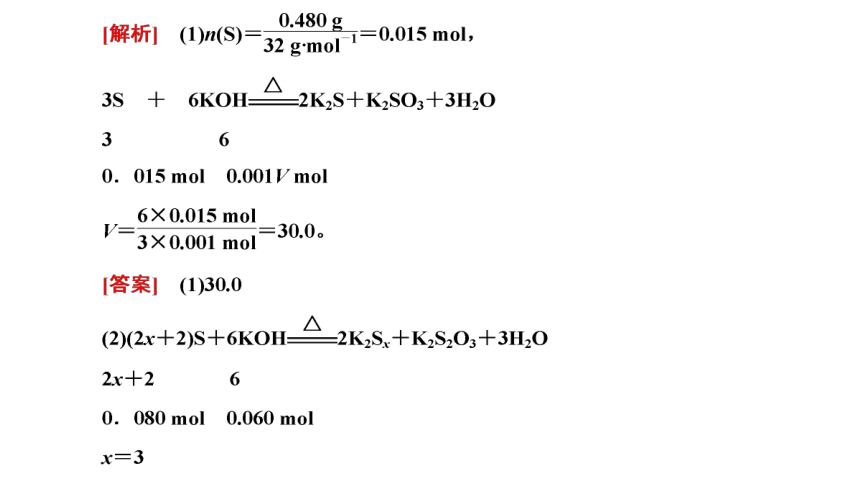

文档简介
(共38张PPT)
第4讲 以物质的量为中心的化学计算常用方法(综合应用课)
以物质的量为中心的化学计算是高考的必考点,涉及的运算方法主要有比例式法、关系式法和热重分析法。学通学精这些方法是解题的金钥匙,能使复杂的计算简单化、规律化。有利于学生养成解决相关问题的科学思维。
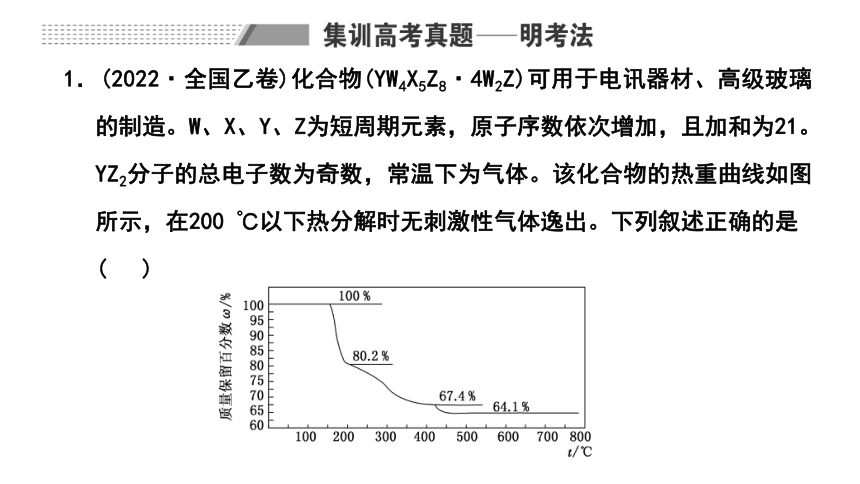
1.(2022·全国乙卷)化合物(YW4X5Z8·4W2Z)可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。YZ2分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在200 ℃以下热分解时无刺激性气体逸出。下列叙述正确的是 ( )
答案:D
2.(2022·湖南等级考·节选)产品中BaCl2·2H2O的含量测定。
①称取产品0.500 0 g,用100 mL水溶解,酸化,加热至近沸;
②在不断搅拌下,向①所得溶液逐滴加入热的0.100 mol·L-1H2SO4溶液;
③沉淀完全后,60 ℃水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为0.466 0 g。
产品中BaCl2·2H2O的质量分数为__________(保留三位有效数字)。
3.(2022·辽宁等级考·节选)取2.50 g H2O2产品,加蒸馏水定容至100 mL摇匀。取20.00 mL于锥形瓶中,用0.050 0 mol·L-1酸性KMnO4标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为19.98 mL、20.90 mL、20.02 mL。假设其他杂质不干扰结果,产品中H2O2质量分数为________。
4.(2022·浙江选考)某同学设计实验确定Al(NO3)3·xH2O的结晶水数目。称取样品7.50 g,经热分解测得气体产物中有NO2、O2、HNO3、H2O,其中H2O的质量为3.06 g;残留的固体产物是Al2O3,质量为1.02 g。计算:
(1)x=__________(写出计算过程)。
(2)气体产物中n(O2)=________mol。
(一)比例式法
1.应用原理
写 写出有关的化学方程式
找 找出相关物质对应的化学计量数,从而找出相关物质的物质的量之比
列 将有关的四个量列出比例式
解 根据比例式求出n,再求m、V或c
答 写出简明答案
2.解题步骤
[综合应用训练]
1.在标准状况下,15.6 g Na2O2投入足量水中,充分反应,生成NaOH的物质的量为多少?生成O2的体积为多少?
2.200 g含MnO2 87%的软锰矿与足量浓盐酸共热,充分反应。请计算:
(1)在标准状况下生成Cl2为________L。
(2)被氧化的HCl为________ g。
(二)关系式法
关系式是表示两种或多种物质之间“量”的关系的一种简化式子,在多步反应中,它可以把始态的反应物与终态的生成物之间“量”的关系表示出来,把多步计算简化成一步计算。高考题量大,时间紧,对于涉及多步计算的问题,如滴定实验的有关计算,巧妙运用关系式法,可以缩短答题时间;解题的关键是正确书写关系式。
类型(一) 根据多步反应的方程式找关系式
[例1] (2021·山东等级考·节选)六氯化钨(WCl6)可用作有机合成催化剂,熔点为283 ℃,沸点为340 ℃,易溶于CS2,极易水解。实验室中,先将三氧化钨(WO3)还原为金属钨(W)再制备WCl6,利用碘量法测定WCl6产品纯度,实验如下:
(1)称量:将足量CS2(易挥发)加入干燥的称量瓶中,盖紧称重为m1 g;开盖并计时1分钟,盖紧称重为m2 g;再开盖加入待测样品并计时1分钟,盖紧称重为m3 g,则样品质量为________g(不考虑空气中水蒸气的干扰)。
[思维建模] 多步反应找关系式的解题步骤
类型(二) 根据不同物质中所含同种元素的原子个数找关系式
[例2] 银铜合金广泛用于航空工业,从切割废料中回收银并制备铜化工产品的工艺如下:
[思维建模] 用原子守恒找关系式的方法
(1)实际化工生产中往往涉及多步反应,但原料和产品中的某种主要元素是相同的,据此可以找出关系式,如利用转化反应中Cu原子守恒可得出关系式:Cu~CuO~CuSO4~CuAlO2,这样可避免书写化学方程式,缩短解题时间。
(2)寻找关系式时,要特别注意原料中的主要元素是否全部转化为产物,如不能完全转化,可以将分步转化率换算成总转化率进行计算。
[综合应用训练]
1.工业上,利用黄铜矿(主要成分是CuFeS2)冶炼金属,产生的废气可以制备硫酸。某黄铜矿中铜元素的质量分数为a%(假设杂质不含铜、铁、硫元素),其煅烧过程转化率为75%,得到的SO2转化为SO3的转化率为80%,SO3的吸收率为96%。现有黄铜矿100 t,其废气最多能制备98%的硫酸 ( )
A.1.8a t B.2.8a t C.3.2a t D.4.5a t
答案:A
(三)热重分析法
[典例] 热重分析法是程序控制温度下测量物质的质量与温度关系的一种实验方法。MgCl2·6H2O的热重曲线如图所示。已知:MgCl2·6H2O在空气中受热脱水时,不产生无水氯化镁。
分析图像,明确坐标含义 分析失重图像,横坐标一般是分解的温度,纵坐标一般为剩余固体的质量或固体残留率
依据性质,猜测各段反应 含结晶水的盐加热失重时一般先失去部分或全部结晶水,再失去非金属氧化物,失重最后一般为金属氧化物或金属,晶体中金属质量不减少,仍在残留固体中
整合数据,验证猜测结果 根据纵坐标的数据变化或题目给定的数据,根据金属原子守恒,即可求出失重后物质的化学式,或者判断出发生的化学反应
[思维建模] 三步突破热重分析题
[综合应用训练]
1.若胆矾(CuSO4·5H2O)的质量为0.80 g,在受热脱水过程中测得固体质量随温度变化的曲线如图所示。
2.草酸钴是制备钴氧化物的重要原料。如图为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300 ℃及以上所得固体均为钴氧化物。
(2)取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3价),用480 mL 5 mol·L-1盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比(列式计算)。
3.(1)25.35 g MnSO4·H2O样品受热分解过程的热重曲线(样品质量随温度变化的曲线)如图所示。
①300 ℃时,所得固体的化学式为____________。
②1 150 ℃时,反应的化学方程式为_______________
_______________________________________________ 。
(2)若称取100 g MgCO3·nH2O晶体进行热重分析,得到的热重曲线如图所示,则该晶体中n=________(取整数)。
谢
谢
观
看
第4讲 以物质的量为中心的化学计算常用方法(综合应用课)
以物质的量为中心的化学计算是高考的必考点,涉及的运算方法主要有比例式法、关系式法和热重分析法。学通学精这些方法是解题的金钥匙,能使复杂的计算简单化、规律化。有利于学生养成解决相关问题的科学思维。
1.(2022·全国乙卷)化合物(YW4X5Z8·4W2Z)可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。YZ2分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在200 ℃以下热分解时无刺激性气体逸出。下列叙述正确的是 ( )
答案:D
2.(2022·湖南等级考·节选)产品中BaCl2·2H2O的含量测定。
①称取产品0.500 0 g,用100 mL水溶解,酸化,加热至近沸;
②在不断搅拌下,向①所得溶液逐滴加入热的0.100 mol·L-1H2SO4溶液;
③沉淀完全后,60 ℃水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为0.466 0 g。
产品中BaCl2·2H2O的质量分数为__________(保留三位有效数字)。
3.(2022·辽宁等级考·节选)取2.50 g H2O2产品,加蒸馏水定容至100 mL摇匀。取20.00 mL于锥形瓶中,用0.050 0 mol·L-1酸性KMnO4标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为19.98 mL、20.90 mL、20.02 mL。假设其他杂质不干扰结果,产品中H2O2质量分数为________。
4.(2022·浙江选考)某同学设计实验确定Al(NO3)3·xH2O的结晶水数目。称取样品7.50 g,经热分解测得气体产物中有NO2、O2、HNO3、H2O,其中H2O的质量为3.06 g;残留的固体产物是Al2O3,质量为1.02 g。计算:
(1)x=__________(写出计算过程)。
(2)气体产物中n(O2)=________mol。
(一)比例式法
1.应用原理
写 写出有关的化学方程式
找 找出相关物质对应的化学计量数,从而找出相关物质的物质的量之比
列 将有关的四个量列出比例式
解 根据比例式求出n,再求m、V或c
答 写出简明答案
2.解题步骤
[综合应用训练]
1.在标准状况下,15.6 g Na2O2投入足量水中,充分反应,生成NaOH的物质的量为多少?生成O2的体积为多少?
2.200 g含MnO2 87%的软锰矿与足量浓盐酸共热,充分反应。请计算:
(1)在标准状况下生成Cl2为________L。
(2)被氧化的HCl为________ g。
(二)关系式法
关系式是表示两种或多种物质之间“量”的关系的一种简化式子,在多步反应中,它可以把始态的反应物与终态的生成物之间“量”的关系表示出来,把多步计算简化成一步计算。高考题量大,时间紧,对于涉及多步计算的问题,如滴定实验的有关计算,巧妙运用关系式法,可以缩短答题时间;解题的关键是正确书写关系式。
类型(一) 根据多步反应的方程式找关系式
[例1] (2021·山东等级考·节选)六氯化钨(WCl6)可用作有机合成催化剂,熔点为283 ℃,沸点为340 ℃,易溶于CS2,极易水解。实验室中,先将三氧化钨(WO3)还原为金属钨(W)再制备WCl6,利用碘量法测定WCl6产品纯度,实验如下:
(1)称量:将足量CS2(易挥发)加入干燥的称量瓶中,盖紧称重为m1 g;开盖并计时1分钟,盖紧称重为m2 g;再开盖加入待测样品并计时1分钟,盖紧称重为m3 g,则样品质量为________g(不考虑空气中水蒸气的干扰)。
[思维建模] 多步反应找关系式的解题步骤
类型(二) 根据不同物质中所含同种元素的原子个数找关系式
[例2] 银铜合金广泛用于航空工业,从切割废料中回收银并制备铜化工产品的工艺如下:
[思维建模] 用原子守恒找关系式的方法
(1)实际化工生产中往往涉及多步反应,但原料和产品中的某种主要元素是相同的,据此可以找出关系式,如利用转化反应中Cu原子守恒可得出关系式:Cu~CuO~CuSO4~CuAlO2,这样可避免书写化学方程式,缩短解题时间。
(2)寻找关系式时,要特别注意原料中的主要元素是否全部转化为产物,如不能完全转化,可以将分步转化率换算成总转化率进行计算。
[综合应用训练]
1.工业上,利用黄铜矿(主要成分是CuFeS2)冶炼金属,产生的废气可以制备硫酸。某黄铜矿中铜元素的质量分数为a%(假设杂质不含铜、铁、硫元素),其煅烧过程转化率为75%,得到的SO2转化为SO3的转化率为80%,SO3的吸收率为96%。现有黄铜矿100 t,其废气最多能制备98%的硫酸 ( )
A.1.8a t B.2.8a t C.3.2a t D.4.5a t
答案:A
(三)热重分析法
[典例] 热重分析法是程序控制温度下测量物质的质量与温度关系的一种实验方法。MgCl2·6H2O的热重曲线如图所示。已知:MgCl2·6H2O在空气中受热脱水时,不产生无水氯化镁。
分析图像,明确坐标含义 分析失重图像,横坐标一般是分解的温度,纵坐标一般为剩余固体的质量或固体残留率
依据性质,猜测各段反应 含结晶水的盐加热失重时一般先失去部分或全部结晶水,再失去非金属氧化物,失重最后一般为金属氧化物或金属,晶体中金属质量不减少,仍在残留固体中
整合数据,验证猜测结果 根据纵坐标的数据变化或题目给定的数据,根据金属原子守恒,即可求出失重后物质的化学式,或者判断出发生的化学反应
[思维建模] 三步突破热重分析题
[综合应用训练]
1.若胆矾(CuSO4·5H2O)的质量为0.80 g,在受热脱水过程中测得固体质量随温度变化的曲线如图所示。
2.草酸钴是制备钴氧化物的重要原料。如图为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300 ℃及以上所得固体均为钴氧化物。
(2)取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3价),用480 mL 5 mol·L-1盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比(列式计算)。
3.(1)25.35 g MnSO4·H2O样品受热分解过程的热重曲线(样品质量随温度变化的曲线)如图所示。
①300 ℃时,所得固体的化学式为____________。
②1 150 ℃时,反应的化学方程式为_______________
_______________________________________________ 。
(2)若称取100 g MgCO3·nH2O晶体进行热重分析,得到的热重曲线如图所示,则该晶体中n=________(取整数)。
谢
谢
观
看
同课章节目录
