2024届高考化学一轮复习 第二章 化学常用计量 第2讲 物质的量浓度及配制 课件(共54张PPT)
文档属性
| 名称 | 2024届高考化学一轮复习 第二章 化学常用计量 第2讲 物质的量浓度及配制 课件(共54张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-18 21:44:34 | ||
图片预览











文档简介
(共54张PPT)
第2讲 物质的量浓度及配制(基础落实课)
逐点清(一) 物质的量浓度及其有关计算
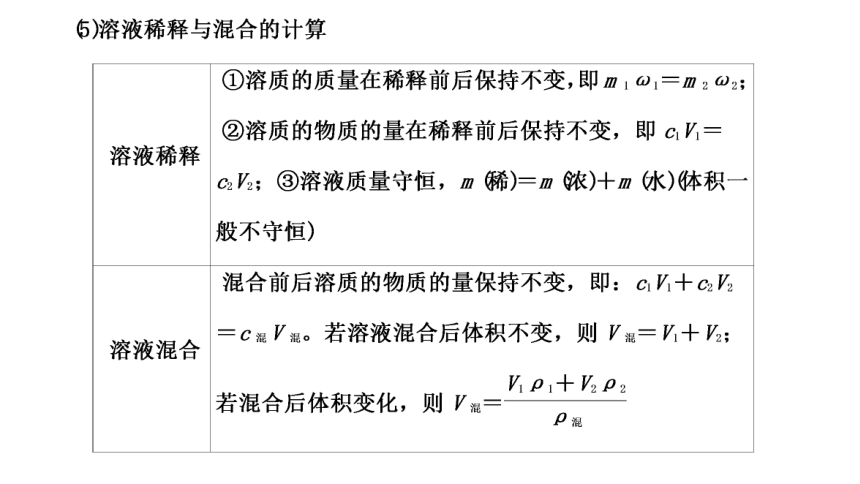
(一)溶液组成的两种表示方法
1.物质的量浓度(cB)
2.溶质的质量分数(ω)
2.计算类型
(1)标准状况下,气体溶于水形成溶液的浓度的计算
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)1 mol NaCl溶于1 L水中形成溶液浓度为1 mol·L-1 ( )
(2)从1 L 0.1 mol·L-1的NaOH溶液中取出100 mL,其浓度仍为0.1 mol·
L-1 ( )
(3)1 L 0.5 mol·L-1 CaCl2溶液中,Ca2+与Cl-的物质的量浓度都是0.5 mol·L-1 ( )
(4)34 g NH3通入100 g水中所得溶液的溶质质量分数为34% ( )
×
×
×
√
(5)将25 g CuSO4·5H2O晶体溶于75 g水中所得溶质的质量分数为25% ( )
(6)将40 g SO3溶于60 g水中所得溶质的质量分数为49% ( )
(7)将62 g Na2O溶于水中,配成1 L溶液,所得溶质的物质的量浓度为
1 mol·L-1 ( )
×
×
√
2.标准状况下,将2.24 L NH3通入200 g水中形成的溶液(密度为0.9 g·cm-3),请回答:
(1)溶液中溶质物质的量为__________ mol,溶质质量为________ g。
(2)溶液质量为________ g,溶液体积为________ L。
(3)溶液溶质的物质的量浓度为______________,溶质质量分数为________。
[题点考法·全面练通]
题点(一) 物质的量浓度的有关计算与换算
1.已知0.5 L的NaCl溶液中含有0.5 mol Na+。下列关于该溶液的说法正 确的是 ( )
A.该溶液中溶质的物质的量浓度为0.5 mol·L-1
B.该溶液中含有58.5 g NaCl
C.配制100 mL该溶液,则应用托盘天平称量5.9 g NaCl
D.量取100 mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.5 mol
4.98%的浓H2SO4(ρ=1.84 g·cm-3)的物质的量浓度为________ mol·L-1。
答案:18.4
6.现有V L 0.5 mol·L-1的盐酸,欲将其浓度扩大一倍,以下方法中最宜采用的是 ( )
A.加热浓缩到原来体积的一半
B.加入5 mol·L-1的盐酸0.125V L
C.加入10 mol·L-1的盐酸0.1V L,再稀释至1.5V L
D.标准状况下通入11.2 L氯化氢气体
答案:C
逐点清(二) 一定物质的量浓度溶液的配制
1.配制仪器——容量瓶
(1)构造及用途
结构 细颈、梨形、平底玻璃容器,带磨口玻璃塞
标志 温度、容积和刻度线
规格 _______、_______、_______、1 000 mL等
用途 配制一定体积一定物质的量浓度的溶液
原则 遵循“大而近”的原则,如配制“450 mL”溶液时,应选用500 mL规格的容量瓶
100 mL
250 mL
500 mL
[注意] ①不能将固体或浓溶液直接在容量瓶中溶解或稀释;②不能将过冷或过热的溶液转移到容量瓶中,因为容量瓶的容积是在瓶身所标温度下确定的;③向容量瓶中注入液体时,一定要用玻璃棒引流;④容量瓶不能用作反应容器或用来长期贮存溶液;⑤不能配制任意体积的溶液,只能配制容量瓶上规定容积的溶液。
容量瓶使用前一定要检查是否漏水。操作方法:向容量瓶中加入适量水,盖上瓶塞,倒立, 观察是否漏水,若不漏水,然后将容量瓶正立过来,旋转瓶塞180°,再倒立,观察是否漏水
(2)查漏操作
2.一定物质的量浓度溶液的配制过程
(1)主要仪器:托盘天平、药匙、量筒、烧杯、容量瓶、玻璃棒、胶头滴管。
(2)配制流程分析
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)要配制1 mol·L-1 NaCl溶液100 mL,可用托盘天平称量5.85 g NaCl配制 ( )
(2)溶解或稀释时,可以在容量瓶中进行 ( )
(3)配制0.100 0 mol·L-1氯化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流 ( )
×
×
√
(4)最后定容时,在液面离刻度线1~2 cm时可以改用胶头滴管定容
( )
(5)配制时没有洗涤烧杯,所配溶液浓度偏大 ( )
(6)用蒸馏水洗净容量瓶后未干燥,直接配制所得溶液浓度偏小 ( )
×
×
√
2.(2022·广东等级考·节选)(1)配制250 mL 0.1 mol·L-1的HAc(醋酸)溶液,需5 mol·L-1HAc 溶液的体积为_______mL。
(2)下列关于250 mL容量瓶的操作,正确的是_______。
解析:(1)溶液稀释过程中,溶质的物质的量不变,因此250 mL×0.1 mol·L-1=V×5 mol·L-1,解得V=5.0 mL。
(2)容量瓶使用过程中,不能用手等触碰瓶口,以免污染试剂,故A错误;定容时,视线应平视刻度线且与溶液凹液面相切,不能仰视或俯视,故B错误;向容量瓶中转移液体,需用玻璃棒引流,玻璃棒下端位于刻度线以下,同时玻璃棒不能接触容量瓶口,故C正确;定容完成后,盖上瓶塞,将容量瓶来回颠倒,将溶液摇匀,颠倒过程中,左手食指抵住瓶塞,防止瓶塞脱落,右手扶住容量瓶底部,防止容量瓶从左手掉落,故D错误。
答案:(1)5.0 (2)C
[题点考法·全面练通]
题点(一) 一定浓度溶液的配制
1.为了配制100 mL 1 mol·L-1NaOH溶液,下列操作错误的是 ( )
①选择刚用蒸馏水洗净的100 mL容量瓶进行配制
②NaOH固体在烧杯里刚好完全溶解,立即把溶液转移到容量瓶中
③用蒸馏水洗涤烧杯内壁2~3次,洗涤液都移入容量瓶中
④使蒸馏水沿着玻璃棒注入容量瓶,直到溶液的凹液面恰好与刻度线相切⑤由于不慎,液面超过了容量瓶的刻度线,这时采取的措施是使用胶头滴管吸出液体超过的一部分
A.②④⑤ B.①⑤ C.②③⑤ D.①②
解析:①配制100 mL 1 mol·L-1的NaOH溶液,应选择100 mL容量瓶,因为容量瓶定容时仍需要加蒸馏水,所以使用前不需要干燥,正确;②NaOH溶于水时放热,所以在配制溶液时不能立即把溶液转移到容量瓶中,错误;③用蒸馏水洗涤烧杯内壁2~3次,洗涤液均转入容量瓶中,是为了将溶质全部转移到容量瓶中,正确;④定容时,为了防止加水超过刻度线,当加水至液面距离刻度线1~2 cm时,应改用胶头滴管滴加,使溶液凹液面的最低点与刻度线相平,错误;⑤液面超过了容量瓶的刻度线,吸出溶液会减少溶质的质量,导致配制的溶液浓度偏低,实验失败,应重新配制,错误。
答案:A
2.实验时需用约10%H2O2溶液100 mL,现用市售30%(密度近似为1 g·cm-3)的H2O2来配制,简述其具体配制方法。
答案:用量筒量取33 mL 30%H2O2溶液加入烧杯中,再加入67 mL水(或加水稀释至100 mL),搅拌均匀。
3.实验室需要配制0.50 mol·L-1 NaCl溶液480 mL。按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(带砝码、最小砝码为5 g)、药匙、烧杯、_______ 、 _______ 、 _______ 、 _______以及等质量的两片同种纸片。
(2)计算。配制该溶液需取NaCl晶体_______ g。
(3)称量。
①天平调平之后,应将天平的游码调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置:
②称量过程中NaCl晶体应放于天平的_______(填“左盘”或“右盘”)。
③称量完毕,将试剂倒入烧杯中。
(4)溶解、冷却。该步实验中需要使用玻璃棒,目的是_____________________。
(5)转移、洗涤。在转移时应使用玻璃棒引流,需要洗涤烧杯2~3次是为了 ____________________________。
(6)定容。向容量瓶中加水至液面接近刻度线______处,改用_______加水,使溶液凹液面与刻度线相切。
(7)摇匀、装瓶。
解析:配制480 mL 0.50 mol·L-1的NaCl溶液,必须用500 mL的容量瓶。m(NaCl)=0.50 mol·L-1×0.5 L×58.5 g·mol-1≈14.6 g(托盘天平精确到0.1 g)。用托盘天平称量时,物品放在左盘。配制一定物质的量浓度溶液的一般步骤为计算→称量(或量取)→溶解、冷却→转移、洗涤→定容、摇匀→装瓶贴签。
答案:(1)500 mL容量瓶 量筒 胶头滴管 玻璃棒
(2)14.6 (3)①
题点(二) 配制误差分析
4.配制250 mL 0.10 mol·L-1的NaOH溶液时,下列实验操作会使配得的溶液浓度偏小的是 ( )
①将NaOH固体放在纸上称量,再转移到烧杯中溶解 ②烧杯中NaOH溶液移入容量瓶后没有洗涤烧杯 ③实验用的容量瓶洗净后未干燥,里面含有少量水 ④定容时采用俯视
A.①② B.①②④ C.①③ D.①④
解析:①部分氢氧化钠粘在纸上,溶质质量偏小,所得的溶液浓度偏小;②容量瓶中溶质偏少,所得的溶液浓度偏小;③由于定容时需要加入蒸馏水,对溶液浓度无影响;④溶液体积偏小,所得的溶液浓度偏大。
答案:A
5.下列操作是否正确,对实验结果的影响请用“偏大”“偏小”或“无影响”表示。
(1)配制500 mL 0.1 mol·L-1的硫酸铜溶液,用托盘天平称取胆矾8.0 g:____。
(2)配制一定物质的量浓度的NaOH溶液,需称量溶质4.4 g,称量时物码放置颠倒:_____________。
(3)用量筒量取浓硫酸时,仰视读数:__________。
(4)定容时,加水超过刻度线,用胶头滴管吸取多余的液体至刻度线: __________ 。
(5)配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容: __________ 。
(6)定容摇匀后,发现液面下降,继续加水至刻度线:__________。
(7)定容时仰视刻度线: ________。
(8)定容摇匀时少量溶液外流: _______。
(9)容量瓶中原有少量蒸馏水: ________。
答案:(1)偏小 (2)偏小 (3)偏大 (4)偏小 (5)偏大 (6)偏小 (7)偏小 (8)无影响 (9)无影响
[思维建模] 视线引起误差的分析方法
①仰视容量瓶刻度线(图a),导致溶液体积偏大,结果偏低。
②俯视容量瓶刻度线(图b),导致溶液体积偏小,结果偏高。
逐点清(三) 溶解度及溶解度曲线应用
(一)两种溶解度
1.固体的溶解度
续表
表示 方法 通常指该气体(其压强为101 kPa)在一定温度时溶解于1体积水里达到饱和状态时气体的体积,常记为1∶x。如NH3、HCl、SO2、CO2气体常温时在水中的溶解度分别为1∶700、1∶500、1∶40、1∶1
影响 因素 气体溶解度的大小与温度和压强有关,温度升高,溶解度减小;压强增大,溶解度增大
2.气体的溶解度
(二)溶解度曲线及其应用
1.常见物质的溶解度曲线
点的意义 曲线上的点叫饱和点。
①曲线上任一点表示对应温度下该物质的溶解度。
②两曲线的交点表示两物质在该交点的温度下溶解度相等
线的意义 溶解度曲线表示物质的溶解度随温度变化的趋势,其变化趋势分为三种。
①陡升型:大部分固体物质的溶解度随温度升高而增大,且变化较大,提纯时常采用降温结晶(冷却热饱和溶液)的方法。
②下降型:极少数物质的溶解度随温度升高反而减小,如熟石灰的饱和溶液升温时变浑浊。
③缓升型:少数物质的溶解度随温度变化不大,提纯时常采用蒸发结晶(蒸发溶剂)的方法
2.溶解度曲线的意义
[题点考法·全面练通]
题点(一) 根据溶解度曲线确定结晶方式
1.请填写下列物质的结晶方法。
(1)氯化钠:__________________________________ 。
(2)硝酸钾: __________________________________。
(3)硫酸铜晶体: __________________________________。
(4)从FeCl3溶液中得到FeCl3·6H2O固体: _______________________ 。
答案:(1)蒸发结晶 (2)蒸发浓缩、冷却结晶
(3)蒸发浓缩、冷却结晶 (4)在HCl气氛中加热,蒸发结晶
2.已知四种盐的溶解度(S)曲线如图所示,下列说法不正确的是 ( )
A.NaCl可以通过将NaCl溶液蒸发结晶得到晶体
B.NaCl中混有少量Mg(ClO3)2杂质,可采用将热
的饱和溶液冷却结晶方法得到NaCl
C.Mg(ClO3)2中混有少量NaCl杂质,可用重结晶法提纯
D.可用MgCl2和NaClO3制备Mg(ClO3)2
解析:含少量Mg(ClO3)2的NaCl溶液,可以采用蒸发溶剂而结晶的方法得到NaCl晶体。
答案:B
题点(二) 利用溶解度曲线进行物质的分离与提纯
3.以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下。
回答下列问题。
(1)欲制备10.7 g NH4Cl, 理论上需NaCl ______ g。
(2)实验室进行蒸发浓缩用到的主要仪器有_________、烧杯、玻璃棒、酒精灯等。
(3)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为_______。
(4)不用其他试剂,检查NH4Cl产品是否纯净的方法及操作是______________________________________________________________。
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是________。
谢
谢
观
看
第2讲 物质的量浓度及配制(基础落实课)
逐点清(一) 物质的量浓度及其有关计算
(一)溶液组成的两种表示方法
1.物质的量浓度(cB)
2.溶质的质量分数(ω)
2.计算类型
(1)标准状况下,气体溶于水形成溶液的浓度的计算
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)1 mol NaCl溶于1 L水中形成溶液浓度为1 mol·L-1 ( )
(2)从1 L 0.1 mol·L-1的NaOH溶液中取出100 mL,其浓度仍为0.1 mol·
L-1 ( )
(3)1 L 0.5 mol·L-1 CaCl2溶液中,Ca2+与Cl-的物质的量浓度都是0.5 mol·L-1 ( )
(4)34 g NH3通入100 g水中所得溶液的溶质质量分数为34% ( )
×
×
×
√
(5)将25 g CuSO4·5H2O晶体溶于75 g水中所得溶质的质量分数为25% ( )
(6)将40 g SO3溶于60 g水中所得溶质的质量分数为49% ( )
(7)将62 g Na2O溶于水中,配成1 L溶液,所得溶质的物质的量浓度为
1 mol·L-1 ( )
×
×
√
2.标准状况下,将2.24 L NH3通入200 g水中形成的溶液(密度为0.9 g·cm-3),请回答:
(1)溶液中溶质物质的量为__________ mol,溶质质量为________ g。
(2)溶液质量为________ g,溶液体积为________ L。
(3)溶液溶质的物质的量浓度为______________,溶质质量分数为________。
[题点考法·全面练通]
题点(一) 物质的量浓度的有关计算与换算
1.已知0.5 L的NaCl溶液中含有0.5 mol Na+。下列关于该溶液的说法正 确的是 ( )
A.该溶液中溶质的物质的量浓度为0.5 mol·L-1
B.该溶液中含有58.5 g NaCl
C.配制100 mL该溶液,则应用托盘天平称量5.9 g NaCl
D.量取100 mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.5 mol
4.98%的浓H2SO4(ρ=1.84 g·cm-3)的物质的量浓度为________ mol·L-1。
答案:18.4
6.现有V L 0.5 mol·L-1的盐酸,欲将其浓度扩大一倍,以下方法中最宜采用的是 ( )
A.加热浓缩到原来体积的一半
B.加入5 mol·L-1的盐酸0.125V L
C.加入10 mol·L-1的盐酸0.1V L,再稀释至1.5V L
D.标准状况下通入11.2 L氯化氢气体
答案:C
逐点清(二) 一定物质的量浓度溶液的配制
1.配制仪器——容量瓶
(1)构造及用途
结构 细颈、梨形、平底玻璃容器,带磨口玻璃塞
标志 温度、容积和刻度线
规格 _______、_______、_______、1 000 mL等
用途 配制一定体积一定物质的量浓度的溶液
原则 遵循“大而近”的原则,如配制“450 mL”溶液时,应选用500 mL规格的容量瓶
100 mL
250 mL
500 mL
[注意] ①不能将固体或浓溶液直接在容量瓶中溶解或稀释;②不能将过冷或过热的溶液转移到容量瓶中,因为容量瓶的容积是在瓶身所标温度下确定的;③向容量瓶中注入液体时,一定要用玻璃棒引流;④容量瓶不能用作反应容器或用来长期贮存溶液;⑤不能配制任意体积的溶液,只能配制容量瓶上规定容积的溶液。
容量瓶使用前一定要检查是否漏水。操作方法:向容量瓶中加入适量水,盖上瓶塞,倒立, 观察是否漏水,若不漏水,然后将容量瓶正立过来,旋转瓶塞180°,再倒立,观察是否漏水
(2)查漏操作
2.一定物质的量浓度溶液的配制过程
(1)主要仪器:托盘天平、药匙、量筒、烧杯、容量瓶、玻璃棒、胶头滴管。
(2)配制流程分析
微点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)要配制1 mol·L-1 NaCl溶液100 mL,可用托盘天平称量5.85 g NaCl配制 ( )
(2)溶解或稀释时,可以在容量瓶中进行 ( )
(3)配制0.100 0 mol·L-1氯化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流 ( )
×
×
√
(4)最后定容时,在液面离刻度线1~2 cm时可以改用胶头滴管定容
( )
(5)配制时没有洗涤烧杯,所配溶液浓度偏大 ( )
(6)用蒸馏水洗净容量瓶后未干燥,直接配制所得溶液浓度偏小 ( )
×
×
√
2.(2022·广东等级考·节选)(1)配制250 mL 0.1 mol·L-1的HAc(醋酸)溶液,需5 mol·L-1HAc 溶液的体积为_______mL。
(2)下列关于250 mL容量瓶的操作,正确的是_______。
解析:(1)溶液稀释过程中,溶质的物质的量不变,因此250 mL×0.1 mol·L-1=V×5 mol·L-1,解得V=5.0 mL。
(2)容量瓶使用过程中,不能用手等触碰瓶口,以免污染试剂,故A错误;定容时,视线应平视刻度线且与溶液凹液面相切,不能仰视或俯视,故B错误;向容量瓶中转移液体,需用玻璃棒引流,玻璃棒下端位于刻度线以下,同时玻璃棒不能接触容量瓶口,故C正确;定容完成后,盖上瓶塞,将容量瓶来回颠倒,将溶液摇匀,颠倒过程中,左手食指抵住瓶塞,防止瓶塞脱落,右手扶住容量瓶底部,防止容量瓶从左手掉落,故D错误。
答案:(1)5.0 (2)C
[题点考法·全面练通]
题点(一) 一定浓度溶液的配制
1.为了配制100 mL 1 mol·L-1NaOH溶液,下列操作错误的是 ( )
①选择刚用蒸馏水洗净的100 mL容量瓶进行配制
②NaOH固体在烧杯里刚好完全溶解,立即把溶液转移到容量瓶中
③用蒸馏水洗涤烧杯内壁2~3次,洗涤液都移入容量瓶中
④使蒸馏水沿着玻璃棒注入容量瓶,直到溶液的凹液面恰好与刻度线相切⑤由于不慎,液面超过了容量瓶的刻度线,这时采取的措施是使用胶头滴管吸出液体超过的一部分
A.②④⑤ B.①⑤ C.②③⑤ D.①②
解析:①配制100 mL 1 mol·L-1的NaOH溶液,应选择100 mL容量瓶,因为容量瓶定容时仍需要加蒸馏水,所以使用前不需要干燥,正确;②NaOH溶于水时放热,所以在配制溶液时不能立即把溶液转移到容量瓶中,错误;③用蒸馏水洗涤烧杯内壁2~3次,洗涤液均转入容量瓶中,是为了将溶质全部转移到容量瓶中,正确;④定容时,为了防止加水超过刻度线,当加水至液面距离刻度线1~2 cm时,应改用胶头滴管滴加,使溶液凹液面的最低点与刻度线相平,错误;⑤液面超过了容量瓶的刻度线,吸出溶液会减少溶质的质量,导致配制的溶液浓度偏低,实验失败,应重新配制,错误。
答案:A
2.实验时需用约10%H2O2溶液100 mL,现用市售30%(密度近似为1 g·cm-3)的H2O2来配制,简述其具体配制方法。
答案:用量筒量取33 mL 30%H2O2溶液加入烧杯中,再加入67 mL水(或加水稀释至100 mL),搅拌均匀。
3.实验室需要配制0.50 mol·L-1 NaCl溶液480 mL。按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(带砝码、最小砝码为5 g)、药匙、烧杯、_______ 、 _______ 、 _______ 、 _______以及等质量的两片同种纸片。
(2)计算。配制该溶液需取NaCl晶体_______ g。
(3)称量。
①天平调平之后,应将天平的游码调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置:
②称量过程中NaCl晶体应放于天平的_______(填“左盘”或“右盘”)。
③称量完毕,将试剂倒入烧杯中。
(4)溶解、冷却。该步实验中需要使用玻璃棒,目的是_____________________。
(5)转移、洗涤。在转移时应使用玻璃棒引流,需要洗涤烧杯2~3次是为了 ____________________________。
(6)定容。向容量瓶中加水至液面接近刻度线______处,改用_______加水,使溶液凹液面与刻度线相切。
(7)摇匀、装瓶。
解析:配制480 mL 0.50 mol·L-1的NaCl溶液,必须用500 mL的容量瓶。m(NaCl)=0.50 mol·L-1×0.5 L×58.5 g·mol-1≈14.6 g(托盘天平精确到0.1 g)。用托盘天平称量时,物品放在左盘。配制一定物质的量浓度溶液的一般步骤为计算→称量(或量取)→溶解、冷却→转移、洗涤→定容、摇匀→装瓶贴签。
答案:(1)500 mL容量瓶 量筒 胶头滴管 玻璃棒
(2)14.6 (3)①
题点(二) 配制误差分析
4.配制250 mL 0.10 mol·L-1的NaOH溶液时,下列实验操作会使配得的溶液浓度偏小的是 ( )
①将NaOH固体放在纸上称量,再转移到烧杯中溶解 ②烧杯中NaOH溶液移入容量瓶后没有洗涤烧杯 ③实验用的容量瓶洗净后未干燥,里面含有少量水 ④定容时采用俯视
A.①② B.①②④ C.①③ D.①④
解析:①部分氢氧化钠粘在纸上,溶质质量偏小,所得的溶液浓度偏小;②容量瓶中溶质偏少,所得的溶液浓度偏小;③由于定容时需要加入蒸馏水,对溶液浓度无影响;④溶液体积偏小,所得的溶液浓度偏大。
答案:A
5.下列操作是否正确,对实验结果的影响请用“偏大”“偏小”或“无影响”表示。
(1)配制500 mL 0.1 mol·L-1的硫酸铜溶液,用托盘天平称取胆矾8.0 g:____。
(2)配制一定物质的量浓度的NaOH溶液,需称量溶质4.4 g,称量时物码放置颠倒:_____________。
(3)用量筒量取浓硫酸时,仰视读数:__________。
(4)定容时,加水超过刻度线,用胶头滴管吸取多余的液体至刻度线: __________ 。
(5)配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容: __________ 。
(6)定容摇匀后,发现液面下降,继续加水至刻度线:__________。
(7)定容时仰视刻度线: ________。
(8)定容摇匀时少量溶液外流: _______。
(9)容量瓶中原有少量蒸馏水: ________。
答案:(1)偏小 (2)偏小 (3)偏大 (4)偏小 (5)偏大 (6)偏小 (7)偏小 (8)无影响 (9)无影响
[思维建模] 视线引起误差的分析方法
①仰视容量瓶刻度线(图a),导致溶液体积偏大,结果偏低。
②俯视容量瓶刻度线(图b),导致溶液体积偏小,结果偏高。
逐点清(三) 溶解度及溶解度曲线应用
(一)两种溶解度
1.固体的溶解度
续表
表示 方法 通常指该气体(其压强为101 kPa)在一定温度时溶解于1体积水里达到饱和状态时气体的体积,常记为1∶x。如NH3、HCl、SO2、CO2气体常温时在水中的溶解度分别为1∶700、1∶500、1∶40、1∶1
影响 因素 气体溶解度的大小与温度和压强有关,温度升高,溶解度减小;压强增大,溶解度增大
2.气体的溶解度
(二)溶解度曲线及其应用
1.常见物质的溶解度曲线
点的意义 曲线上的点叫饱和点。
①曲线上任一点表示对应温度下该物质的溶解度。
②两曲线的交点表示两物质在该交点的温度下溶解度相等
线的意义 溶解度曲线表示物质的溶解度随温度变化的趋势,其变化趋势分为三种。
①陡升型:大部分固体物质的溶解度随温度升高而增大,且变化较大,提纯时常采用降温结晶(冷却热饱和溶液)的方法。
②下降型:极少数物质的溶解度随温度升高反而减小,如熟石灰的饱和溶液升温时变浑浊。
③缓升型:少数物质的溶解度随温度变化不大,提纯时常采用蒸发结晶(蒸发溶剂)的方法
2.溶解度曲线的意义
[题点考法·全面练通]
题点(一) 根据溶解度曲线确定结晶方式
1.请填写下列物质的结晶方法。
(1)氯化钠:__________________________________ 。
(2)硝酸钾: __________________________________。
(3)硫酸铜晶体: __________________________________。
(4)从FeCl3溶液中得到FeCl3·6H2O固体: _______________________ 。
答案:(1)蒸发结晶 (2)蒸发浓缩、冷却结晶
(3)蒸发浓缩、冷却结晶 (4)在HCl气氛中加热,蒸发结晶
2.已知四种盐的溶解度(S)曲线如图所示,下列说法不正确的是 ( )
A.NaCl可以通过将NaCl溶液蒸发结晶得到晶体
B.NaCl中混有少量Mg(ClO3)2杂质,可采用将热
的饱和溶液冷却结晶方法得到NaCl
C.Mg(ClO3)2中混有少量NaCl杂质,可用重结晶法提纯
D.可用MgCl2和NaClO3制备Mg(ClO3)2
解析:含少量Mg(ClO3)2的NaCl溶液,可以采用蒸发溶剂而结晶的方法得到NaCl晶体。
答案:B
题点(二) 利用溶解度曲线进行物质的分离与提纯
3.以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下。
回答下列问题。
(1)欲制备10.7 g NH4Cl, 理论上需NaCl ______ g。
(2)实验室进行蒸发浓缩用到的主要仪器有_________、烧杯、玻璃棒、酒精灯等。
(3)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为_______。
(4)不用其他试剂,检查NH4Cl产品是否纯净的方法及操作是______________________________________________________________。
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是________。
谢
谢
观
看
同课章节目录
