化学人教版(2019)必修第一册2.3.4一定物质的量浓度溶液的配制(共31张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.3.4一定物质的量浓度溶液的配制(共31张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 719.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 08:30:13 | ||
图片预览







文档简介
(共31张PPT)
一定物质的量浓度溶液的配制
学习目标:
1.了解容量瓶的特点、用途及使用注意事项。
2.掌握配制一定物质的量浓度溶液的方法及操作,能进行实验误差分析。
分点突破(一) 配制一定物质的量浓度的溶液
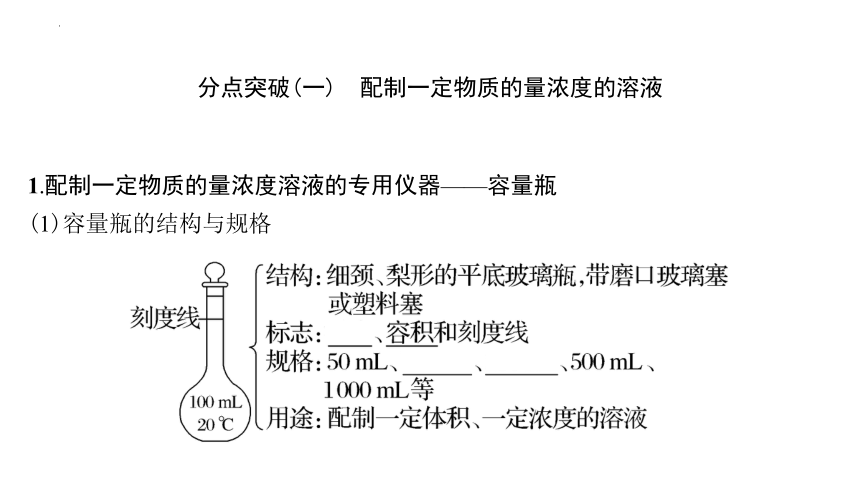
1.配制一定物质的量浓度溶液的专用仪器——容量瓶
(1)容量瓶的结构与规格
(2)容量瓶的查漏方法
使用前要检查容量瓶是否漏水,检查方法:加水→塞瓶塞→倒立→观察是否漏水→正立→瓶塞旋转180°→倒立→观察是否漏水。
(3)容量瓶使用的“四忌”
一忌:用容量瓶溶解固体和稀释浓溶液。
二忌:给容量瓶加热。
三忌:把容量瓶用作反应容器。
四忌:用容量瓶长期存放溶液。
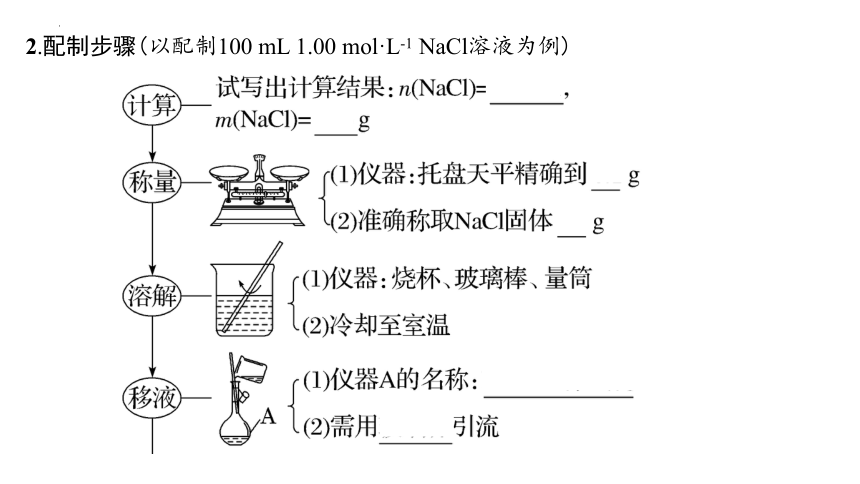
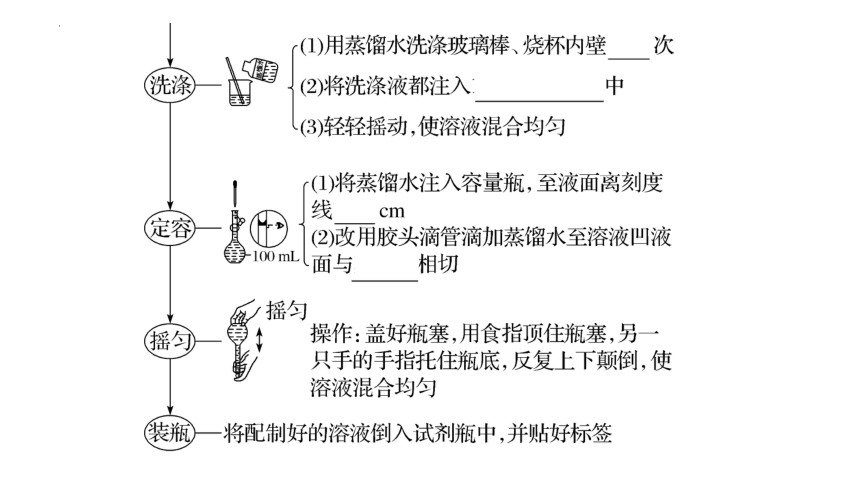
2.配制步骤(以配制100 mL 1.00 mol·L-1 NaCl溶液为例)
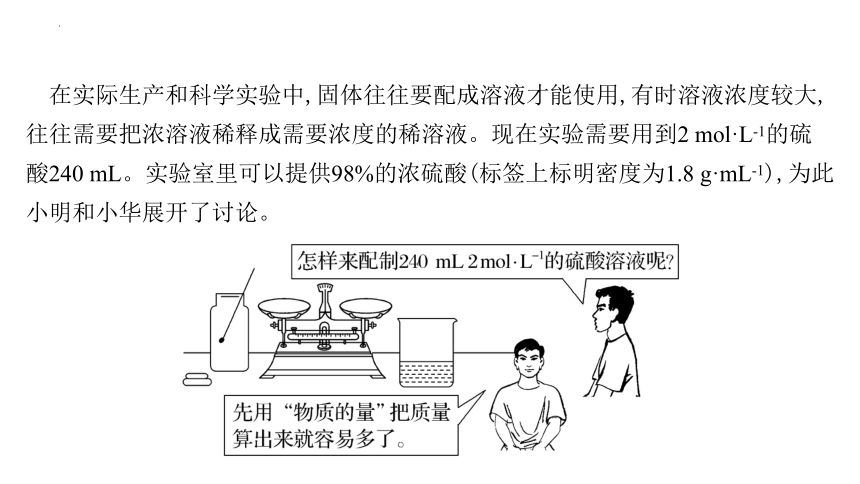
在实际生产和科学实验中,固体往往要配成溶液才能使用,有时溶液浓度较大,往往需要把浓溶液稀释成需要浓度的稀溶液。现在实验需要用到2 mol·L-1的硫酸240 mL。实验室里可以提供98%的浓硫酸(标签上标明密度为1.8 g·mL-1),为此小明和小华展开了讨论。
1.能否将固体或液体直接在容量瓶中溶解或稀释
提示:不能,因为物质溶解或稀释时会有热量的变化,造成溶液体积有误差,配制的浓度不准确。应先在烧杯中溶解或稀释并恢复至室温后再转移至容量瓶中。
2.98%浓硫酸的物质的量浓度是多少 配制240 mL 2 mol·L-1稀硫酸时选用容量瓶的规格是多少 需要浓硫酸的体积是多少
提示:98%浓硫酸的物质的量浓度是18 mol·L-1;配制240 mL 2 mol·L-1稀硫酸应选用250 mL的容量瓶;需要浓硫酸的体积为≈0.027 8 L(即27.8 mL)。
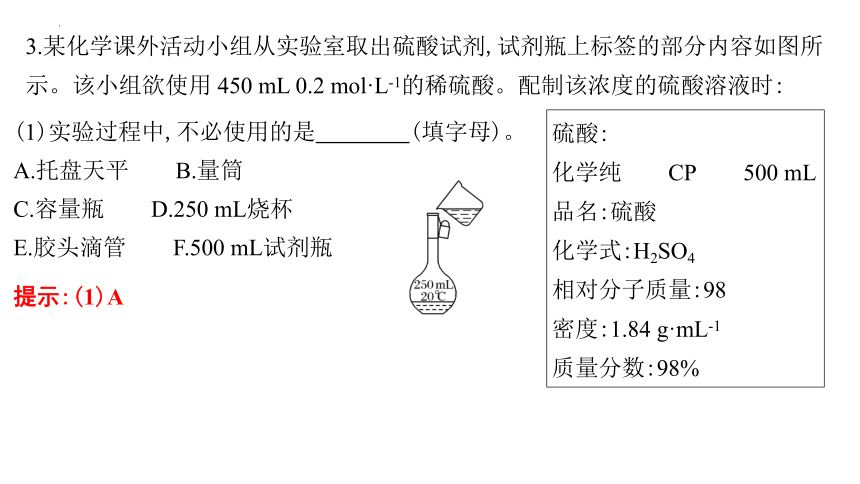
3.某化学课外活动小组从实验室取出硫酸试剂,试剂瓶上标签的部分内容如图所示。该小组欲使用 450 mL 0.2 mol·L-1的稀硫酸。配制该浓度的硫酸溶液时:
硫酸:
化学纯 CP 500 mL
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g·mL-1
质量分数:98%
(1)实验过程中,不必使用的是 (填字母)。
A.托盘天平 B.量筒
C.容量瓶 D.250 mL烧杯
E.胶头滴管 F.500 mL试剂瓶
提示:(1)A
(2)除上述仪器可使用外,还缺少的仪器是 。
提示:(2)玻璃棒
(3)量取浓硫酸的体积为 mL,应选用的量筒和容量瓶规格分别为 、 。
提示:(3)5.4 10 mL 500 mL
(4)如图是该小组转移溶液的示意图,图中的错误是
。
提示:(4)未用玻璃棒引流;未采用500 mL容量瓶
1.容量瓶是配制一定物质的量浓度溶液的专用仪器,选择容量瓶应遵循“大而近”的原则:所配溶液的体积等于或略小于容量瓶的容积。
2.使用容量瓶注意“五不”:不能溶解固体;不能稀释浓溶液;不能加热;不能作反应容器;不能长期贮存溶液。
3.一定物质的量浓度溶液的配制口诀
计算称量做先锋,溶解冷却随后行;
移液洗涤三两次,玻棒引流记心中;
胶头滴管来滴定,视线液面刻度平;
倒转移入试剂瓶,贴好标签便告成。
1.下列关于容量瓶的构造和使用描述中不正确的是( )
A.用于配制一定体积、浓度准确的溶液
B.容量瓶不能加热,也不宜长时间贮存所配溶液
C.容量瓶上标有温度、容积和刻度线
D.用蒸馏水洗净后,再用待配溶液润洗
解析:D 容量瓶只需用蒸馏水洗净,不需干燥,不能用待配溶液润洗。
2.配制100 mL 1.00 mol·L-1的NaCl溶液,必须用到的仪器是( )
A.漏斗 B.试管
C.100 mL容量瓶 D.烧瓶
解析:C 配制100 mL 1.00 mol·L-1的NaCl溶液,需要使用的仪器有天平、烧杯、胶头滴管、100 mL容量瓶、量筒、玻璃棒,不需要使用的仪器是漏斗、试管、烧瓶。
3.配制100 mL 0.5 mol·L-1 Na2CO3溶液。下列操作错误的是( )
A.选用100 mL容量瓶进行配制
B.将Na2CO3固体溶解并冷却至室温后移至容量瓶中
C.移液后用蒸馏水洗涤烧杯内壁、玻璃棒两次,洗涤液移至容量瓶中
D.沿玻璃棒向容量瓶中注入蒸馏水,至溶液的凹液面恰好与容量瓶刻度线相切
解析:D 沿玻璃棒向容量瓶中注入蒸馏水,当液面离刻度线1~2 cm时,改用胶头滴管加水至溶液的凹液面恰好与容量瓶刻度线相切,D错误。
分点突破(二) 配制一定物质的量浓度溶液的误差分析
1.误差的分析方法
(1)原理依据:c==。
(2)判断结论
①凡是使m或n增大的因素或使V减小的因素,使c偏大。
②凡是使m或n减小的因素或使V增大的因素,使c偏小。
2.配制100 mL 1.00 mol·L-1的氯化钠溶液常出现的误差
能引起误差的操作 因变量 c
n V 称量 ①砝码生锈(没有脱落) 偏大 不变 偏大
②少量氯化钠粘在称量纸上 偏小 不变 偏小
③使用游码,且药品砝码位置颠倒 偏小 不变 偏小
偏大
偏大
偏小
偏小
偏小
偏小
能引起误差的操作 因变量 c
n V 转移 ④有少量液体溅出 偏小 不变 偏小
⑤容量瓶内有少量水 不变 不变 不变
⑥未洗涤或洗涤液未注入容量瓶 偏小 不变 偏小
定容 ⑦仰视刻度线 不变 偏大 偏小
⑧超过刻度线,吸出一部分水 偏小 不变 偏小
⑨摇匀后液面下降,补充水 不变 偏大 偏小
装瓶 ⑩试剂瓶刚用蒸馏水洗过 不变 偏大 偏小
不变
偏小
偏小
不变
不变
偏小
偏小
偏大
偏小
偏小
不变
偏小
不变
偏大
偏小
偏大
偏小
1.若用浓硫酸配制稀硫酸,量取浓硫酸时用到量筒,量筒 (填“有”或“无”)0刻度线,精确度一般为 mL。下列操作会对所配稀硫酸浓度有何影响(填“偏大”“偏小”或“无影响”)。
(1)量取浓硫酸时俯视刻度线: 。
提示:无 0.1 (1)偏小
(2)量取浓硫酸时仰视刻度线: 。
提示:无 0.1 (2)偏大
(3)清洗量筒,将残留在量筒中的硫酸也倒入溶解用的烧杯中: 。
提示:无 0.1 (3)偏大
2.①配制盐酸,用量筒量取盐酸时俯视刻度线
②转移溶液时不慎将少量液体洒到容量瓶外面
③定容时俯视刻度线
④未冷却到室温就将溶液转移到容量瓶并定容
⑤定容后塞上瓶塞反复摇匀,静置后,发现液面低于刻度线,再加水至刻度线
⑥容量瓶内有少量水
⑦称量4.0 g NaOH配制0.1 mol·L-1 NaOH溶液1 000 mL时,砝码错放在左盘
⑧称量Na2CO3固体时,砝码上有杂质
上述操作中,使所配制的溶液浓度偏高的是 (填序号,下同),无影响的是 ,偏低的是 。
提示:③④⑧ ⑥⑦ ①②⑤
俯视、仰视导致的误差分析
(1)用容量瓶定容
①图Ⅰ:定容时俯视刻度线,溶液体积偏小,所配制溶液的浓度偏高。
②图Ⅱ:定容时仰视刻度线,溶液体积偏大,所配制溶液的浓度偏低。
(2)用量筒量取一定体积的溶液
①图Ⅲ:若俯视刻度线,则实际量取的液体体积偏小,所配溶液浓度偏低。
②图Ⅳ:若仰视刻度线,则实际量取的液体体积偏大,所配溶液浓度偏高。
1.配制一定物质的量浓度的NaOH溶液,会造成溶液浓度偏高的是( )
A.溶液转移时液体洒出容量瓶外
B.使用的容量瓶未完全干燥
C.没有洗涤烧杯和玻璃棒2~3次
D.定容时俯视液面
解析:D A项,溶液转移时液体洒出容量瓶外,n偏小,浓度偏低;B项,使用的容量瓶未完全干燥,对n、V无影响,浓度不变;C项,没有洗涤烧杯和玻璃棒2~3次,n偏小,浓度偏低;D项,定容时俯视液面,V偏小,浓度偏高。
2.氯化钡主要用于金属热处理、钡盐制造、电子仪表,也用于机械加工中作热处理剂。下列操作使配制的BaCl2溶液浓度可能偏低的有( )
A.将砝码放在左盘上,BaCl2放在右盘上进行称量
B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,未加水至刻度线
D.定容时俯视刻度线
解析:A 误差分析根据c==,由m、V的大小判断。A项将砝码放错位置后,称得的BaCl2质量可能偏小,所得溶液浓度可能偏低;B项无影响;C项摇匀后,液面下降是由于部分液体沾在刻度线以上的内壁上,溶液体积未变,不需加水;D项定容时俯视刻度线,溶液的体积偏小,溶液的浓度偏高。
1.实验室配制250 mL 0.10 mol·L-1 NaCl溶液时,下列不必使用的玻璃仪器是( )
解析:B 一般用托盘天平称量,在烧杯中溶解,玻璃棒搅拌,冷却后转移到250 mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2 cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切,盖好瓶塞,摇匀,装瓶,所以不需要的是分液漏斗。
2.配制100 mL 0.5 mol·L-1Na2S2O3溶液,下列操作正确的是( )
解析:C 称量应该左物右码,A错误;容量瓶定容摇匀应该一手托底部,一手拿颈部倒置摇匀,B错误;移液过程中使用玻璃棒引流且玻璃棒应该伸入刻度线以下,C正确;视线应该与刻度线处保持水平,当凹液面与刻度线相切时停止滴加,D错误。
3.实验室需要100 mL 1 mol·L-1的H2SO4溶液,现用市售98%的浓硫酸(密度为1.84 g·cm-3)配制,用量筒取用的浓硫酸体积最适宜的是( )
A.5.4 mL B.3.3 mL
C.13.5 mL D.27.2 mL
解析:A 98%的浓硫酸(密度为1.84 g·cm-3)的物质的量浓度c== mol·L-1=18.4 mol·L-1,设需要浓硫酸体积为V,稀释前后溶质的物质的量不变,有18.4 mol·L-1×V=1 mol·L-1×100 mL,解得:V=5.4 mL。
4.在溶液的配制过程中会引起浓度偏高的是( )
A.配制500 mL 0.1 mol·L-1的硫酸铜溶液,用托盘天平称取胆矾8.0 g
B.配制NaOH溶液时,NaOH固体放在烧杯中称量时间过长
C.定容时,仰视刻度线
D.配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容
解析:D A项,需要称取胆矾的质量为0.5 L×0.1 mol·L-1×250 g·mol-1=12.5 g,称取的质量偏小,浓度偏低,错误;B项,NaOH固体放在烧杯中称量时间过长,会吸收空气中的水蒸气和二氧化碳,导致氢氧化钠的质量偏少,浓度偏低,错误;C项,定容时,仰视刻度线,导致溶液的体积偏大,浓度偏低,错误;D项,NaOH固体溶于水放热,未经冷却立即转移到容量瓶中并定容,导致溶液的体积偏小,浓度偏高,正确。
5.实验小组需要配制100 mL 0.5 mol·L-1的Na2CO3溶液,同学们分工合作进行实验。
(1)甲同学需要称取Na2CO3固体的质量是 g。
解析:(1)100 mL 0.5 mol·L-1的碳酸钠溶液中碳酸钠的质量为0.5 mol·L-1×0.1 L×106 g·mol-1=5.3 g。
答案:(1)5.3
(2)乙同学溶解Na2CO3固体时,需要用到的仪器有:量筒、烧杯和 。
解析:(2)溶解Na2CO3固体时,用到的仪器有量筒、烧杯和玻璃棒。
答案:(2)玻璃棒
(3)丙同学的下列操作中,正确的是 。
A.转移液体时,不慎将溶液洒落在容量瓶外
B.液面离容量瓶刻度线下1~2 cm时,改用胶头滴管滴加蒸馏水
C.溶液配制完成后,长期将溶液储存在容量瓶中
解析:(3)A项,转移液体时,不慎将溶液洒落在容量瓶外,会导致溶液中溶质的物质的量偏小,配制的溶液浓度偏低,错误;B项,液面离容量瓶刻度线下 1~2 cm时,为防止加入的蒸馏水超过刻度线,应改用胶头滴管滴加蒸馏水,正确;C项,容量瓶是精量器,不能用来溶解、稀释和储存溶液,则溶液配制完成后,不能长期将溶液储存在容量瓶中,应转移到试剂瓶中储存,并贴上标签,错误。
答案:(3)B
(4)若在定容时俯视刻度线,则此操作导致所配Na2CO3溶液的物质的量浓度 (填“偏高”或“偏低”)。
解析:(4)若在定容时俯视刻度线会导致加入的蒸馏水体积偏小,溶液体积偏小,配制的溶液浓度偏高。
答案:(4)偏高
一定物质的量浓度溶液的配制
学习目标:
1.了解容量瓶的特点、用途及使用注意事项。
2.掌握配制一定物质的量浓度溶液的方法及操作,能进行实验误差分析。
分点突破(一) 配制一定物质的量浓度的溶液
1.配制一定物质的量浓度溶液的专用仪器——容量瓶
(1)容量瓶的结构与规格
(2)容量瓶的查漏方法
使用前要检查容量瓶是否漏水,检查方法:加水→塞瓶塞→倒立→观察是否漏水→正立→瓶塞旋转180°→倒立→观察是否漏水。
(3)容量瓶使用的“四忌”
一忌:用容量瓶溶解固体和稀释浓溶液。
二忌:给容量瓶加热。
三忌:把容量瓶用作反应容器。
四忌:用容量瓶长期存放溶液。
2.配制步骤(以配制100 mL 1.00 mol·L-1 NaCl溶液为例)
在实际生产和科学实验中,固体往往要配成溶液才能使用,有时溶液浓度较大,往往需要把浓溶液稀释成需要浓度的稀溶液。现在实验需要用到2 mol·L-1的硫酸240 mL。实验室里可以提供98%的浓硫酸(标签上标明密度为1.8 g·mL-1),为此小明和小华展开了讨论。
1.能否将固体或液体直接在容量瓶中溶解或稀释
提示:不能,因为物质溶解或稀释时会有热量的变化,造成溶液体积有误差,配制的浓度不准确。应先在烧杯中溶解或稀释并恢复至室温后再转移至容量瓶中。
2.98%浓硫酸的物质的量浓度是多少 配制240 mL 2 mol·L-1稀硫酸时选用容量瓶的规格是多少 需要浓硫酸的体积是多少
提示:98%浓硫酸的物质的量浓度是18 mol·L-1;配制240 mL 2 mol·L-1稀硫酸应选用250 mL的容量瓶;需要浓硫酸的体积为≈0.027 8 L(即27.8 mL)。
3.某化学课外活动小组从实验室取出硫酸试剂,试剂瓶上标签的部分内容如图所示。该小组欲使用 450 mL 0.2 mol·L-1的稀硫酸。配制该浓度的硫酸溶液时:
硫酸:
化学纯 CP 500 mL
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g·mL-1
质量分数:98%
(1)实验过程中,不必使用的是 (填字母)。
A.托盘天平 B.量筒
C.容量瓶 D.250 mL烧杯
E.胶头滴管 F.500 mL试剂瓶
提示:(1)A
(2)除上述仪器可使用外,还缺少的仪器是 。
提示:(2)玻璃棒
(3)量取浓硫酸的体积为 mL,应选用的量筒和容量瓶规格分别为 、 。
提示:(3)5.4 10 mL 500 mL
(4)如图是该小组转移溶液的示意图,图中的错误是
。
提示:(4)未用玻璃棒引流;未采用500 mL容量瓶
1.容量瓶是配制一定物质的量浓度溶液的专用仪器,选择容量瓶应遵循“大而近”的原则:所配溶液的体积等于或略小于容量瓶的容积。
2.使用容量瓶注意“五不”:不能溶解固体;不能稀释浓溶液;不能加热;不能作反应容器;不能长期贮存溶液。
3.一定物质的量浓度溶液的配制口诀
计算称量做先锋,溶解冷却随后行;
移液洗涤三两次,玻棒引流记心中;
胶头滴管来滴定,视线液面刻度平;
倒转移入试剂瓶,贴好标签便告成。
1.下列关于容量瓶的构造和使用描述中不正确的是( )
A.用于配制一定体积、浓度准确的溶液
B.容量瓶不能加热,也不宜长时间贮存所配溶液
C.容量瓶上标有温度、容积和刻度线
D.用蒸馏水洗净后,再用待配溶液润洗
解析:D 容量瓶只需用蒸馏水洗净,不需干燥,不能用待配溶液润洗。
2.配制100 mL 1.00 mol·L-1的NaCl溶液,必须用到的仪器是( )
A.漏斗 B.试管
C.100 mL容量瓶 D.烧瓶
解析:C 配制100 mL 1.00 mol·L-1的NaCl溶液,需要使用的仪器有天平、烧杯、胶头滴管、100 mL容量瓶、量筒、玻璃棒,不需要使用的仪器是漏斗、试管、烧瓶。
3.配制100 mL 0.5 mol·L-1 Na2CO3溶液。下列操作错误的是( )
A.选用100 mL容量瓶进行配制
B.将Na2CO3固体溶解并冷却至室温后移至容量瓶中
C.移液后用蒸馏水洗涤烧杯内壁、玻璃棒两次,洗涤液移至容量瓶中
D.沿玻璃棒向容量瓶中注入蒸馏水,至溶液的凹液面恰好与容量瓶刻度线相切
解析:D 沿玻璃棒向容量瓶中注入蒸馏水,当液面离刻度线1~2 cm时,改用胶头滴管加水至溶液的凹液面恰好与容量瓶刻度线相切,D错误。
分点突破(二) 配制一定物质的量浓度溶液的误差分析
1.误差的分析方法
(1)原理依据:c==。
(2)判断结论
①凡是使m或n增大的因素或使V减小的因素,使c偏大。
②凡是使m或n减小的因素或使V增大的因素,使c偏小。
2.配制100 mL 1.00 mol·L-1的氯化钠溶液常出现的误差
能引起误差的操作 因变量 c
n V 称量 ①砝码生锈(没有脱落) 偏大 不变 偏大
②少量氯化钠粘在称量纸上 偏小 不变 偏小
③使用游码,且药品砝码位置颠倒 偏小 不变 偏小
偏大
偏大
偏小
偏小
偏小
偏小
能引起误差的操作 因变量 c
n V 转移 ④有少量液体溅出 偏小 不变 偏小
⑤容量瓶内有少量水 不变 不变 不变
⑥未洗涤或洗涤液未注入容量瓶 偏小 不变 偏小
定容 ⑦仰视刻度线 不变 偏大 偏小
⑧超过刻度线,吸出一部分水 偏小 不变 偏小
⑨摇匀后液面下降,补充水 不变 偏大 偏小
装瓶 ⑩试剂瓶刚用蒸馏水洗过 不变 偏大 偏小
不变
偏小
偏小
不变
不变
偏小
偏小
偏大
偏小
偏小
不变
偏小
不变
偏大
偏小
偏大
偏小
1.若用浓硫酸配制稀硫酸,量取浓硫酸时用到量筒,量筒 (填“有”或“无”)0刻度线,精确度一般为 mL。下列操作会对所配稀硫酸浓度有何影响(填“偏大”“偏小”或“无影响”)。
(1)量取浓硫酸时俯视刻度线: 。
提示:无 0.1 (1)偏小
(2)量取浓硫酸时仰视刻度线: 。
提示:无 0.1 (2)偏大
(3)清洗量筒,将残留在量筒中的硫酸也倒入溶解用的烧杯中: 。
提示:无 0.1 (3)偏大
2.①配制盐酸,用量筒量取盐酸时俯视刻度线
②转移溶液时不慎将少量液体洒到容量瓶外面
③定容时俯视刻度线
④未冷却到室温就将溶液转移到容量瓶并定容
⑤定容后塞上瓶塞反复摇匀,静置后,发现液面低于刻度线,再加水至刻度线
⑥容量瓶内有少量水
⑦称量4.0 g NaOH配制0.1 mol·L-1 NaOH溶液1 000 mL时,砝码错放在左盘
⑧称量Na2CO3固体时,砝码上有杂质
上述操作中,使所配制的溶液浓度偏高的是 (填序号,下同),无影响的是 ,偏低的是 。
提示:③④⑧ ⑥⑦ ①②⑤
俯视、仰视导致的误差分析
(1)用容量瓶定容
①图Ⅰ:定容时俯视刻度线,溶液体积偏小,所配制溶液的浓度偏高。
②图Ⅱ:定容时仰视刻度线,溶液体积偏大,所配制溶液的浓度偏低。
(2)用量筒量取一定体积的溶液
①图Ⅲ:若俯视刻度线,则实际量取的液体体积偏小,所配溶液浓度偏低。
②图Ⅳ:若仰视刻度线,则实际量取的液体体积偏大,所配溶液浓度偏高。
1.配制一定物质的量浓度的NaOH溶液,会造成溶液浓度偏高的是( )
A.溶液转移时液体洒出容量瓶外
B.使用的容量瓶未完全干燥
C.没有洗涤烧杯和玻璃棒2~3次
D.定容时俯视液面
解析:D A项,溶液转移时液体洒出容量瓶外,n偏小,浓度偏低;B项,使用的容量瓶未完全干燥,对n、V无影响,浓度不变;C项,没有洗涤烧杯和玻璃棒2~3次,n偏小,浓度偏低;D项,定容时俯视液面,V偏小,浓度偏高。
2.氯化钡主要用于金属热处理、钡盐制造、电子仪表,也用于机械加工中作热处理剂。下列操作使配制的BaCl2溶液浓度可能偏低的有( )
A.将砝码放在左盘上,BaCl2放在右盘上进行称量
B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,未加水至刻度线
D.定容时俯视刻度线
解析:A 误差分析根据c==,由m、V的大小判断。A项将砝码放错位置后,称得的BaCl2质量可能偏小,所得溶液浓度可能偏低;B项无影响;C项摇匀后,液面下降是由于部分液体沾在刻度线以上的内壁上,溶液体积未变,不需加水;D项定容时俯视刻度线,溶液的体积偏小,溶液的浓度偏高。
1.实验室配制250 mL 0.10 mol·L-1 NaCl溶液时,下列不必使用的玻璃仪器是( )
解析:B 一般用托盘天平称量,在烧杯中溶解,玻璃棒搅拌,冷却后转移到250 mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2 cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切,盖好瓶塞,摇匀,装瓶,所以不需要的是分液漏斗。
2.配制100 mL 0.5 mol·L-1Na2S2O3溶液,下列操作正确的是( )
解析:C 称量应该左物右码,A错误;容量瓶定容摇匀应该一手托底部,一手拿颈部倒置摇匀,B错误;移液过程中使用玻璃棒引流且玻璃棒应该伸入刻度线以下,C正确;视线应该与刻度线处保持水平,当凹液面与刻度线相切时停止滴加,D错误。
3.实验室需要100 mL 1 mol·L-1的H2SO4溶液,现用市售98%的浓硫酸(密度为1.84 g·cm-3)配制,用量筒取用的浓硫酸体积最适宜的是( )
A.5.4 mL B.3.3 mL
C.13.5 mL D.27.2 mL
解析:A 98%的浓硫酸(密度为1.84 g·cm-3)的物质的量浓度c== mol·L-1=18.4 mol·L-1,设需要浓硫酸体积为V,稀释前后溶质的物质的量不变,有18.4 mol·L-1×V=1 mol·L-1×100 mL,解得:V=5.4 mL。
4.在溶液的配制过程中会引起浓度偏高的是( )
A.配制500 mL 0.1 mol·L-1的硫酸铜溶液,用托盘天平称取胆矾8.0 g
B.配制NaOH溶液时,NaOH固体放在烧杯中称量时间过长
C.定容时,仰视刻度线
D.配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容
解析:D A项,需要称取胆矾的质量为0.5 L×0.1 mol·L-1×250 g·mol-1=12.5 g,称取的质量偏小,浓度偏低,错误;B项,NaOH固体放在烧杯中称量时间过长,会吸收空气中的水蒸气和二氧化碳,导致氢氧化钠的质量偏少,浓度偏低,错误;C项,定容时,仰视刻度线,导致溶液的体积偏大,浓度偏低,错误;D项,NaOH固体溶于水放热,未经冷却立即转移到容量瓶中并定容,导致溶液的体积偏小,浓度偏高,正确。
5.实验小组需要配制100 mL 0.5 mol·L-1的Na2CO3溶液,同学们分工合作进行实验。
(1)甲同学需要称取Na2CO3固体的质量是 g。
解析:(1)100 mL 0.5 mol·L-1的碳酸钠溶液中碳酸钠的质量为0.5 mol·L-1×0.1 L×106 g·mol-1=5.3 g。
答案:(1)5.3
(2)乙同学溶解Na2CO3固体时,需要用到的仪器有:量筒、烧杯和 。
解析:(2)溶解Na2CO3固体时,用到的仪器有量筒、烧杯和玻璃棒。
答案:(2)玻璃棒
(3)丙同学的下列操作中,正确的是 。
A.转移液体时,不慎将溶液洒落在容量瓶外
B.液面离容量瓶刻度线下1~2 cm时,改用胶头滴管滴加蒸馏水
C.溶液配制完成后,长期将溶液储存在容量瓶中
解析:(3)A项,转移液体时,不慎将溶液洒落在容量瓶外,会导致溶液中溶质的物质的量偏小,配制的溶液浓度偏低,错误;B项,液面离容量瓶刻度线下 1~2 cm时,为防止加入的蒸馏水超过刻度线,应改用胶头滴管滴加蒸馏水,正确;C项,容量瓶是精量器,不能用来溶解、稀释和储存溶液,则溶液配制完成后,不能长期将溶液储存在容量瓶中,应转移到试剂瓶中储存,并贴上标签,错误。
答案:(3)B
(4)若在定容时俯视刻度线,则此操作导致所配Na2CO3溶液的物质的量浓度 (填“偏高”或“偏低”)。
解析:(4)若在定容时俯视刻度线会导致加入的蒸馏水体积偏小,溶液体积偏小,配制的溶液浓度偏高。
答案:(4)偏高
