2.2.2氯气与碱的反应 氯离子的检验课件(共28页)-2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.2.2氯气与碱的反应 氯离子的检验课件(共28页)-2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 08:45:31 | ||
图片预览







文档简介
(共28张PPT)
氯气与碱的反应 氯离子的检验
学习目标:
1.熟知氯气与碱的反应,漂白粉的主要成分、漂白原理及保存方法。
2.通过对比实验掌握氯离子的检验方法。
分点突破(一) 氯气与碱的反应
1.与氢氧化钠溶液反应——制取漂白液
(1)制取反应的化学方程式:Cl2+2NaOHNaCl+NaClO+H2O。
(2)离子方程式:Cl2+2OH-Cl-+ClO-+H2O。
(3)漂白液的有效成分是次氯酸钠。
2.与石灰乳反应——制取漂白粉
(1)制取反应的化学方程式:2Ca(OH)2+2Cl2CaCl2+Ca(ClO)2+2H2O。
(2)漂白粉的主要成分是 CaCl2、Ca(ClO)2 ,有效成分是 Ca(ClO)2 ,漂粉精的主要成分是 Ca(ClO)2 。
(3)漂白粉的漂白原理:利用复分解反应原理,漂白粉中的 次氯酸钙 与酸(如盐酸或碳酸等)反应生成具有漂白性的 次氯酸 。
CaCl2、Ca(ClO)2
Ca(ClO)2
Ca(ClO)2
次氯酸钙
次氯酸
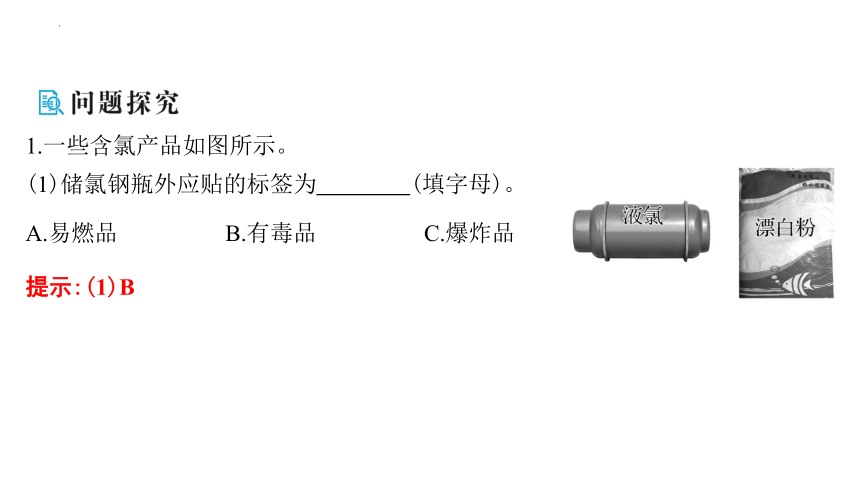
1.一些含氯产品如图所示。
(1)储氯钢瓶外应贴的标签为 (填字母)。
A.易燃品 B.有毒品 C.爆炸品
提示:(1)B
(2)漂白粉的有效成分是 (填化学式),老师新买的漂白粉没有保存说明书,请你为漂白粉设计一份保存注意事项,并用化学用语解释设计原因。
注意事项(不超过30个字):
。
解释(用化学用语):
。
提示:(2)Ca(ClO)2 密封,在阴凉干燥处保存,避免与酸性物质接触
Ca(ClO)2+CO2+H2OCaCO3+2HClO、
2HClO 2HCl+O2↑
2.用次氯酸盐而不用氯水做漂白剂的优点是什么 工业制取漂白粉时,为什么用石灰乳而不用澄清石灰水
提示:次氯酸盐便于保存且使用时生成的次氯酸浓度比氯水中的大。Ca(OH)2在水中溶解度小,用石灰乳可以更好地(吸收Cl2)制取漂白粉。
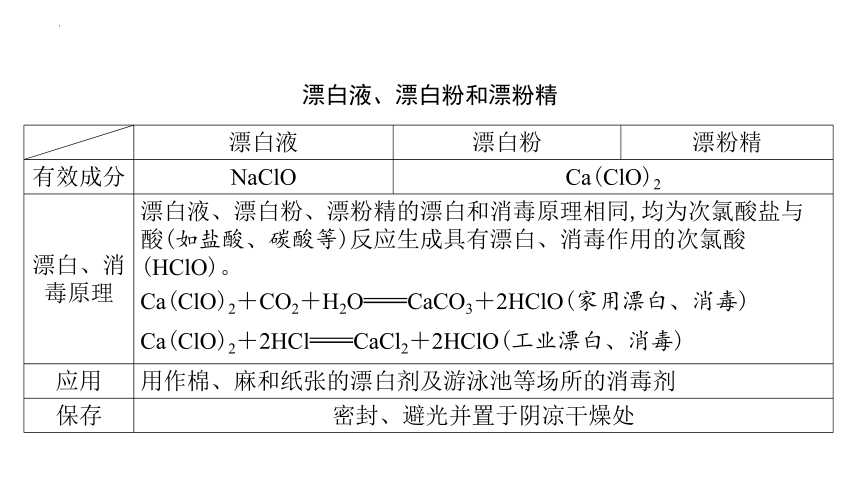
漂白液、漂白粉和漂粉精
漂白液 漂白粉 漂粉精
有效成分 NaClO Ca(ClO)2
漂白、消 毒原理 漂白液、漂白粉、漂粉精的漂白和消毒原理相同,均为次氯酸盐与酸(如盐酸、碳酸等)反应生成具有漂白、消毒作用的次氯酸(HClO)。 Ca(ClO)2+CO2+H2OCaCO3+2HClO(家用漂白、消毒) Ca(ClO)2+2HClCaCl2+2HClO(工业漂白、消毒)
应用 用作棉、麻和纸张的漂白剂及游泳池等场所的消毒剂
保存 密封、避光并置于阴凉干燥处
名师点拨
(1)ClO-具有强氧化性,与还原性离子(如I-、S2-、Fe2+等)因发生氧化还原反应不能大量共存。
(2)洁厕剂中含有HCl,不能与84消毒液混合使用,因为二者发生反应生成Cl2,使人中毒,反应的离子方程式为ClO-+Cl-+2H+Cl2↑+H2O。
1.由于氯气不便于保存,生活中常用的含氯消毒剂是84消毒液或漂白粉。下列关于工业生产的说法正确的是( )
A.工业上利用H2和Cl2的混合气体在光照下反应来制取盐酸
B.工业上以氯气和澄清石灰水为原料制造漂白粉
C.工业上将氯气溶于NaOH溶液中制备漂白粉
D.漂白粉要干燥和密封保存
解析:D H2和Cl2的混合气体在光照下易发生爆炸,工业上利用H2在Cl2中燃烧来制取盐酸,A错误;工业上以氯气和石灰乳为原料制造漂白粉,B、C
错误;如果漂白粉露置在潮湿的空气中,会缓慢变质而失效,发生反应的化学方程式为Ca(ClO)2+CO2+H2OCaCO3+2HClO,2HClO 2HCl+O2↑,D正确。
2.为加速漂粉精的消毒作用,最佳做法为( )
A.加少量稀盐酸 B.用水湿润
C.加入苛性钠溶液 D.加入少量氯化钙
解析:A 漂粉精的主要成分为次氯酸盐,其作用是次氯酸盐遇到酸反应生成次氯酸,次氯酸具有强氧化性,能起到消毒、杀菌的作用,所以为加速漂粉精的消毒作用,最好加入盐酸,能更快、更多地生成次氯酸,增强漂白性,A符合题意。
3.漂粉精暴露在潮湿的空气中易失效,其原因与下列叙述无关的是( )
A.HClO的酸性比H2CO3的弱
B.Ca(ClO)2是盐
C.HClO见光易分解
D.Ca(ClO)2能与碳酸反应
解析:B HClO的酸性比H2CO3的弱,漂粉精暴露在潮湿的空气中,其主要成分Ca(ClO)2易吸收空气中的H2O和CO2而生成HClO:Ca(ClO)2+H2O+CO2CaCO3+2HClO,HClO见光易分解:2HClO 2HCl+O2↑,生成无漂白性的物质而失效,该过程与Ca(ClO)2是盐无关。
分点突破(二) 氯离子的检验
1.Cl-检验的实验探究
实验现象 离子方程式
加入AgNO3溶液 加入稀HNO3
稀盐酸 产生白色沉淀 沉淀 不溶解 Ag++Cl-AgCl↓
NaCl溶液 产生白色沉淀 沉淀 不溶解 Ag++Cl-AgCl↓
Na2CO3 溶液 产生白色沉淀 沉淀 溶解 ,放出无色气体 2Ag++CAg2CO3↓,
Ag2CO3+2H+2Ag++H2O+CO2↑
不溶解
不溶解
溶解
2.Cl-的检验方法
待测液 酸化液 白色沉淀 含有Cl-
1.检验Cl-时为何要加入稀硝酸酸化
提示:加稀硝酸酸化的目的是排除C等的干扰。
2.有一包白色固体,它可能含有KCl、K2CO3、KNO3中的一种或几种,现进行如下实验:
①溶于水,得无色溶液;
②向上述溶液中滴加AgNO3溶液,生成白色沉淀;
③再滴加稀硝酸,沉淀减少但不完全消失,同时有气泡生成。
根据上述现象判断:
(1)白色固体一定含有的成分是 ,可能含有的成分是 。
提示:(1)KCl和K2CO3 KNO3
(2)写出上述实验中有关反应的离子方程式:
。
提示:(2)Ag++Cl-AgCl↓、2Ag++CAg2CO3↓、Ag2CO3+2H+2Ag++H2O+CO2↑
氯离子的检验及规范答题
(1)规范描述:取少量待测液于一洁净试管中,加入硝酸酸化的AgNO3溶液,若观察到溶液中有白色沉淀生成,说明溶液中含有Cl-。
(2)检验时要加稀硝酸,以排除C等离子的干扰,不能用稀硫酸,因为Ag2SO4微溶,会干扰实验,更不能用盐酸,因为盐酸中含有Cl-。
(3)若待测液中含有S,需先用足量Ba(NO3)2溶液除去S,然后再加入稀硝酸酸化的AgNO3溶液,检验Cl-的存在。
1.自来水厂常使用氯气消毒,市场上有些小商小贩用自来水充当纯净水出售。下列试剂中,可用来辨其真伪的是( )
A.酚酞溶液 B.氯化钡溶液
C.氢氧化钠溶液 D.硝酸银溶液
解析:D 自来水厂常使用氯气消毒,Cl2+H2OHCl+HClO,则自来水中含有Cl-,而纯净水中无Cl-,检验Cl-的存在,可用硝酸银溶液,生成不溶于水和酸的AgCl沉淀;氯水中存在氢离子显酸性,遇酚酞不变色,与氯化钡溶液不反应,与氢氧化钠发生中和反应,均无明显现象,不能鉴别。
2.向某未知溶液中加入AgNO3溶液,有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,有无色无味的气体生成,将气体通入澄清石灰水,澄清石灰水变浑浊。由此判断该溶液中含有( )
A.Cl-、S B.Cl-、N
C.Cl-、C D.Cl-、OH-
解析:C 加入AgNO3溶液,有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,说明有部分沉淀不溶解,则溶液中含有Cl-,有无色无味且使澄清石灰水变浑浊的气体生成,则溶液中含有C。
1.84消毒液的主要有效成分是( )
A.NaOH B.NaCl
C.NaClO D.Na2CO3
解析:C 84消毒液可由氯气与NaOH溶液反应制取:2NaOH+Cl2NaCl+NaClO+H2O,84消毒液的有效成分是NaClO,C项正确。
2.下列物质的保存方法错误的是( )
A.过氧化钠密封保存
B.钠保存在石蜡油中
C.漂白粉在敞口容器中长期存放
D.新制氯水保存在棕色试剂瓶并置于冷暗处
解析:C 漂白粉的有效成分Ca(ClO)2会与空气中CO2、水蒸气反应从而变质,故漂白粉不能敞口放置,C错误。
3.检验某未知溶液中是否含有氯离子(Cl-),正确的操作是( )
A.向未知溶液中加入AgNO3溶液,有白色沉淀产生
B.向未知溶液中加入AgNO3溶液,有白色沉淀产生,加入盐酸,沉淀不消失
C.向未知溶液中加入稀硝酸酸化后,再加入AgNO3溶液,有白色沉淀产生
D.向未知溶液中加入稀盐酸酸化后,再加入AgNO3溶液,有白色沉淀产生
解析:C A操作不正确,不能排除C等离子的干扰;B操作不正确,因为Ag2CO3与HCl反应时,生成的AgCl仍是白色沉淀;D操作不正确,用盐酸酸化,引入了Cl-,无法确定原溶液中是否含有Cl-。
4.下列有关漂白粉和漂白液的说法正确的是( )
①漂白液的有效成分是NaClO,漂白粉的有效成分是Ca(ClO)2
②漂白粉和Fe(OH)3胶体都常用于自来水的处理,二者的作用原理不相同
③漂白粉在空气中久置不可能发生氧化还原反应
④漂白粉在空气中不稳定,可用于漂白纸张
A.②④ B.①②
C.③④ D.①③
解析:B 漂白液的有效成分是NaClO,漂白粉的主要成分是CaCl2、Ca(ClO)2,有效成分是 Ca(ClO)2,①正确;漂白粉用于自来水杀菌消毒,Fe(OH)3胶体用于除去水中的悬浮杂质,二者的作用原理不同,②正确;漂白粉在空气中久置的化学方程式为 Ca(ClO)2+H2O+CO2CaCO3+2HClO,2HClO2HCl+O2↑,既有复分解反应,又有氧化还原反应,③不正确;漂白粉能用于漂白纸张,与其强氧化性有关,与不稳定性无关,④不正确。
5.“化学——我们的生活,我们的未来”,学习化学应该明白“从生活中来,到生活中去”的道理。请填空:
(1)氯水和漂白粉都有漂白作用,也可用于水体的杀菌消毒。工业上利用氯气和石灰乳反应可制得漂白粉,其化学方程式为 。
答案:(1)2Cl2+2Ca(OH)2CaCl2+Ca(ClO)2+2H2O
(2)漂白粉真正起消毒作用的物质是HClO。漂白粉在水中释放HClO的途径如下:
途径1:Ca(ClO)2+2H2OCa(OH)2+2HClO
途径2:漂白粉溶于水后,受空气中CO2的作用,产生有漂白、杀菌作用的次氯酸,反应的化学方程式为
。
解析:(2)漂白粉溶于水后,吸收空气中的CO2,生成次氯酸和碳酸钙沉淀,其化学方程式为Ca(ClO)2+H2O+CO2CaCO3+2HClO。
答案:(2)Ca(ClO)2+H2O+CO2CaCO3+2HClO
解析:(3)池水碱性过强,次氯酸的浓度减小,杀毒作用会减弱。
(4)①将灼热的铜丝伸入盛有氯气的集气瓶中,反应现象为 。
②将反应后的产物溶于水配成饱和溶液,向溶液中加入一小块金属钠,反应的化学方程式有 。
(3)游泳池水的酸碱性对漂粉精的消毒效果影响明显。
池水碱性过强,杀毒作用会 (填“增强”或“减弱”)。池水酸性过强,会刺激眼睛和皮肤。通常加入Na2CO3、NaHCO3以降低酸性。
答案:(3)减弱
解析:(4)①灼热的铜丝在盛有氯气的集气瓶中剧烈燃烧、放热、生成棕黄色的烟;②向CuCl2饱和溶液中加入一小块金属钠,钠和水反应生成NaOH和氢气:2Na+2H2O2NaOH+H2↑,NaOH和CuCl2反应生成Cu(OH)2沉淀和NaCl:2NaOH+CuCl22NaCl+Cu(OH)2↓。
答案:(4)①剧烈燃烧、放热、产生棕黄色的烟
②2Na+2H2O2NaOH+H2↑、2NaOH+CuCl2Cu(OH)2↓+2NaCl(或2Na+2H2O+CuCl2Cu(OH)2↓+2NaCl+H2↑)
氯气与碱的反应 氯离子的检验
学习目标:
1.熟知氯气与碱的反应,漂白粉的主要成分、漂白原理及保存方法。
2.通过对比实验掌握氯离子的检验方法。
分点突破(一) 氯气与碱的反应
1.与氢氧化钠溶液反应——制取漂白液
(1)制取反应的化学方程式:Cl2+2NaOHNaCl+NaClO+H2O。
(2)离子方程式:Cl2+2OH-Cl-+ClO-+H2O。
(3)漂白液的有效成分是次氯酸钠。
2.与石灰乳反应——制取漂白粉
(1)制取反应的化学方程式:2Ca(OH)2+2Cl2CaCl2+Ca(ClO)2+2H2O。
(2)漂白粉的主要成分是 CaCl2、Ca(ClO)2 ,有效成分是 Ca(ClO)2 ,漂粉精的主要成分是 Ca(ClO)2 。
(3)漂白粉的漂白原理:利用复分解反应原理,漂白粉中的 次氯酸钙 与酸(如盐酸或碳酸等)反应生成具有漂白性的 次氯酸 。
CaCl2、Ca(ClO)2
Ca(ClO)2
Ca(ClO)2
次氯酸钙
次氯酸
1.一些含氯产品如图所示。
(1)储氯钢瓶外应贴的标签为 (填字母)。
A.易燃品 B.有毒品 C.爆炸品
提示:(1)B
(2)漂白粉的有效成分是 (填化学式),老师新买的漂白粉没有保存说明书,请你为漂白粉设计一份保存注意事项,并用化学用语解释设计原因。
注意事项(不超过30个字):
。
解释(用化学用语):
。
提示:(2)Ca(ClO)2 密封,在阴凉干燥处保存,避免与酸性物质接触
Ca(ClO)2+CO2+H2OCaCO3+2HClO、
2HClO 2HCl+O2↑
2.用次氯酸盐而不用氯水做漂白剂的优点是什么 工业制取漂白粉时,为什么用石灰乳而不用澄清石灰水
提示:次氯酸盐便于保存且使用时生成的次氯酸浓度比氯水中的大。Ca(OH)2在水中溶解度小,用石灰乳可以更好地(吸收Cl2)制取漂白粉。
漂白液、漂白粉和漂粉精
漂白液 漂白粉 漂粉精
有效成分 NaClO Ca(ClO)2
漂白、消 毒原理 漂白液、漂白粉、漂粉精的漂白和消毒原理相同,均为次氯酸盐与酸(如盐酸、碳酸等)反应生成具有漂白、消毒作用的次氯酸(HClO)。 Ca(ClO)2+CO2+H2OCaCO3+2HClO(家用漂白、消毒) Ca(ClO)2+2HClCaCl2+2HClO(工业漂白、消毒)
应用 用作棉、麻和纸张的漂白剂及游泳池等场所的消毒剂
保存 密封、避光并置于阴凉干燥处
名师点拨
(1)ClO-具有强氧化性,与还原性离子(如I-、S2-、Fe2+等)因发生氧化还原反应不能大量共存。
(2)洁厕剂中含有HCl,不能与84消毒液混合使用,因为二者发生反应生成Cl2,使人中毒,反应的离子方程式为ClO-+Cl-+2H+Cl2↑+H2O。
1.由于氯气不便于保存,生活中常用的含氯消毒剂是84消毒液或漂白粉。下列关于工业生产的说法正确的是( )
A.工业上利用H2和Cl2的混合气体在光照下反应来制取盐酸
B.工业上以氯气和澄清石灰水为原料制造漂白粉
C.工业上将氯气溶于NaOH溶液中制备漂白粉
D.漂白粉要干燥和密封保存
解析:D H2和Cl2的混合气体在光照下易发生爆炸,工业上利用H2在Cl2中燃烧来制取盐酸,A错误;工业上以氯气和石灰乳为原料制造漂白粉,B、C
错误;如果漂白粉露置在潮湿的空气中,会缓慢变质而失效,发生反应的化学方程式为Ca(ClO)2+CO2+H2OCaCO3+2HClO,2HClO 2HCl+O2↑,D正确。
2.为加速漂粉精的消毒作用,最佳做法为( )
A.加少量稀盐酸 B.用水湿润
C.加入苛性钠溶液 D.加入少量氯化钙
解析:A 漂粉精的主要成分为次氯酸盐,其作用是次氯酸盐遇到酸反应生成次氯酸,次氯酸具有强氧化性,能起到消毒、杀菌的作用,所以为加速漂粉精的消毒作用,最好加入盐酸,能更快、更多地生成次氯酸,增强漂白性,A符合题意。
3.漂粉精暴露在潮湿的空气中易失效,其原因与下列叙述无关的是( )
A.HClO的酸性比H2CO3的弱
B.Ca(ClO)2是盐
C.HClO见光易分解
D.Ca(ClO)2能与碳酸反应
解析:B HClO的酸性比H2CO3的弱,漂粉精暴露在潮湿的空气中,其主要成分Ca(ClO)2易吸收空气中的H2O和CO2而生成HClO:Ca(ClO)2+H2O+CO2CaCO3+2HClO,HClO见光易分解:2HClO 2HCl+O2↑,生成无漂白性的物质而失效,该过程与Ca(ClO)2是盐无关。
分点突破(二) 氯离子的检验
1.Cl-检验的实验探究
实验现象 离子方程式
加入AgNO3溶液 加入稀HNO3
稀盐酸 产生白色沉淀 沉淀 不溶解 Ag++Cl-AgCl↓
NaCl溶液 产生白色沉淀 沉淀 不溶解 Ag++Cl-AgCl↓
Na2CO3 溶液 产生白色沉淀 沉淀 溶解 ,放出无色气体 2Ag++CAg2CO3↓,
Ag2CO3+2H+2Ag++H2O+CO2↑
不溶解
不溶解
溶解
2.Cl-的检验方法
待测液 酸化液 白色沉淀 含有Cl-
1.检验Cl-时为何要加入稀硝酸酸化
提示:加稀硝酸酸化的目的是排除C等的干扰。
2.有一包白色固体,它可能含有KCl、K2CO3、KNO3中的一种或几种,现进行如下实验:
①溶于水,得无色溶液;
②向上述溶液中滴加AgNO3溶液,生成白色沉淀;
③再滴加稀硝酸,沉淀减少但不完全消失,同时有气泡生成。
根据上述现象判断:
(1)白色固体一定含有的成分是 ,可能含有的成分是 。
提示:(1)KCl和K2CO3 KNO3
(2)写出上述实验中有关反应的离子方程式:
。
提示:(2)Ag++Cl-AgCl↓、2Ag++CAg2CO3↓、Ag2CO3+2H+2Ag++H2O+CO2↑
氯离子的检验及规范答题
(1)规范描述:取少量待测液于一洁净试管中,加入硝酸酸化的AgNO3溶液,若观察到溶液中有白色沉淀生成,说明溶液中含有Cl-。
(2)检验时要加稀硝酸,以排除C等离子的干扰,不能用稀硫酸,因为Ag2SO4微溶,会干扰实验,更不能用盐酸,因为盐酸中含有Cl-。
(3)若待测液中含有S,需先用足量Ba(NO3)2溶液除去S,然后再加入稀硝酸酸化的AgNO3溶液,检验Cl-的存在。
1.自来水厂常使用氯气消毒,市场上有些小商小贩用自来水充当纯净水出售。下列试剂中,可用来辨其真伪的是( )
A.酚酞溶液 B.氯化钡溶液
C.氢氧化钠溶液 D.硝酸银溶液
解析:D 自来水厂常使用氯气消毒,Cl2+H2OHCl+HClO,则自来水中含有Cl-,而纯净水中无Cl-,检验Cl-的存在,可用硝酸银溶液,生成不溶于水和酸的AgCl沉淀;氯水中存在氢离子显酸性,遇酚酞不变色,与氯化钡溶液不反应,与氢氧化钠发生中和反应,均无明显现象,不能鉴别。
2.向某未知溶液中加入AgNO3溶液,有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,有无色无味的气体生成,将气体通入澄清石灰水,澄清石灰水变浑浊。由此判断该溶液中含有( )
A.Cl-、S B.Cl-、N
C.Cl-、C D.Cl-、OH-
解析:C 加入AgNO3溶液,有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,说明有部分沉淀不溶解,则溶液中含有Cl-,有无色无味且使澄清石灰水变浑浊的气体生成,则溶液中含有C。
1.84消毒液的主要有效成分是( )
A.NaOH B.NaCl
C.NaClO D.Na2CO3
解析:C 84消毒液可由氯气与NaOH溶液反应制取:2NaOH+Cl2NaCl+NaClO+H2O,84消毒液的有效成分是NaClO,C项正确。
2.下列物质的保存方法错误的是( )
A.过氧化钠密封保存
B.钠保存在石蜡油中
C.漂白粉在敞口容器中长期存放
D.新制氯水保存在棕色试剂瓶并置于冷暗处
解析:C 漂白粉的有效成分Ca(ClO)2会与空气中CO2、水蒸气反应从而变质,故漂白粉不能敞口放置,C错误。
3.检验某未知溶液中是否含有氯离子(Cl-),正确的操作是( )
A.向未知溶液中加入AgNO3溶液,有白色沉淀产生
B.向未知溶液中加入AgNO3溶液,有白色沉淀产生,加入盐酸,沉淀不消失
C.向未知溶液中加入稀硝酸酸化后,再加入AgNO3溶液,有白色沉淀产生
D.向未知溶液中加入稀盐酸酸化后,再加入AgNO3溶液,有白色沉淀产生
解析:C A操作不正确,不能排除C等离子的干扰;B操作不正确,因为Ag2CO3与HCl反应时,生成的AgCl仍是白色沉淀;D操作不正确,用盐酸酸化,引入了Cl-,无法确定原溶液中是否含有Cl-。
4.下列有关漂白粉和漂白液的说法正确的是( )
①漂白液的有效成分是NaClO,漂白粉的有效成分是Ca(ClO)2
②漂白粉和Fe(OH)3胶体都常用于自来水的处理,二者的作用原理不相同
③漂白粉在空气中久置不可能发生氧化还原反应
④漂白粉在空气中不稳定,可用于漂白纸张
A.②④ B.①②
C.③④ D.①③
解析:B 漂白液的有效成分是NaClO,漂白粉的主要成分是CaCl2、Ca(ClO)2,有效成分是 Ca(ClO)2,①正确;漂白粉用于自来水杀菌消毒,Fe(OH)3胶体用于除去水中的悬浮杂质,二者的作用原理不同,②正确;漂白粉在空气中久置的化学方程式为 Ca(ClO)2+H2O+CO2CaCO3+2HClO,2HClO2HCl+O2↑,既有复分解反应,又有氧化还原反应,③不正确;漂白粉能用于漂白纸张,与其强氧化性有关,与不稳定性无关,④不正确。
5.“化学——我们的生活,我们的未来”,学习化学应该明白“从生活中来,到生活中去”的道理。请填空:
(1)氯水和漂白粉都有漂白作用,也可用于水体的杀菌消毒。工业上利用氯气和石灰乳反应可制得漂白粉,其化学方程式为 。
答案:(1)2Cl2+2Ca(OH)2CaCl2+Ca(ClO)2+2H2O
(2)漂白粉真正起消毒作用的物质是HClO。漂白粉在水中释放HClO的途径如下:
途径1:Ca(ClO)2+2H2OCa(OH)2+2HClO
途径2:漂白粉溶于水后,受空气中CO2的作用,产生有漂白、杀菌作用的次氯酸,反应的化学方程式为
。
解析:(2)漂白粉溶于水后,吸收空气中的CO2,生成次氯酸和碳酸钙沉淀,其化学方程式为Ca(ClO)2+H2O+CO2CaCO3+2HClO。
答案:(2)Ca(ClO)2+H2O+CO2CaCO3+2HClO
解析:(3)池水碱性过强,次氯酸的浓度减小,杀毒作用会减弱。
(4)①将灼热的铜丝伸入盛有氯气的集气瓶中,反应现象为 。
②将反应后的产物溶于水配成饱和溶液,向溶液中加入一小块金属钠,反应的化学方程式有 。
(3)游泳池水的酸碱性对漂粉精的消毒效果影响明显。
池水碱性过强,杀毒作用会 (填“增强”或“减弱”)。池水酸性过强,会刺激眼睛和皮肤。通常加入Na2CO3、NaHCO3以降低酸性。
答案:(3)减弱
解析:(4)①灼热的铜丝在盛有氯气的集气瓶中剧烈燃烧、放热、生成棕黄色的烟;②向CuCl2饱和溶液中加入一小块金属钠,钠和水反应生成NaOH和氢气:2Na+2H2O2NaOH+H2↑,NaOH和CuCl2反应生成Cu(OH)2沉淀和NaCl:2NaOH+CuCl22NaCl+Cu(OH)2↓。
答案:(4)①剧烈燃烧、放热、产生棕黄色的烟
②2Na+2H2O2NaOH+H2↑、2NaOH+CuCl2Cu(OH)2↓+2NaCl(或2Na+2H2O+CuCl2Cu(OH)2↓+2NaCl+H2↑)
