2.2.1氯气的性质课件(共29页)-2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.2.1氯气的性质课件(共29页)-2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 623.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 08:48:12 | ||
图片预览







文档简介
(共29张PPT)
氯气的性质
学习目标:
结合真实情境中的应用实例或通过实验探究,了解氯及其重要化合物的主要性质,认识这些物质在生产中的应用和对生态环境的影响。
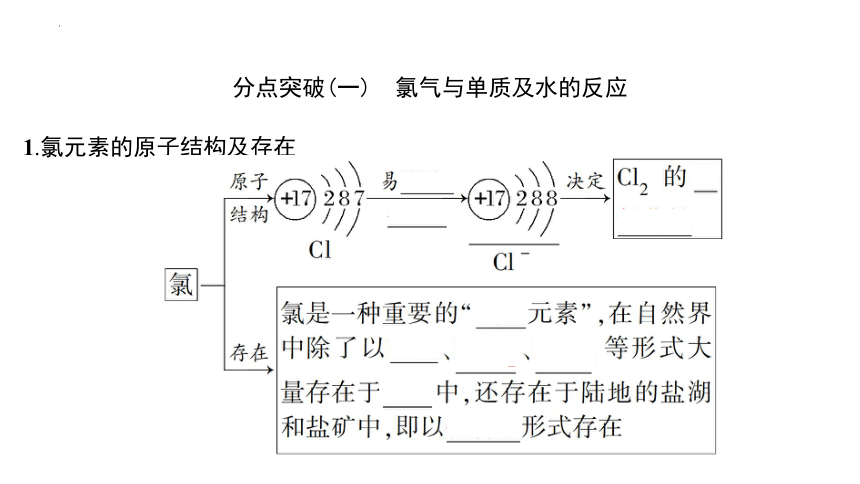
分点突破(一) 氯气与单质及水的反应
1.氯元素的原子结构及存在
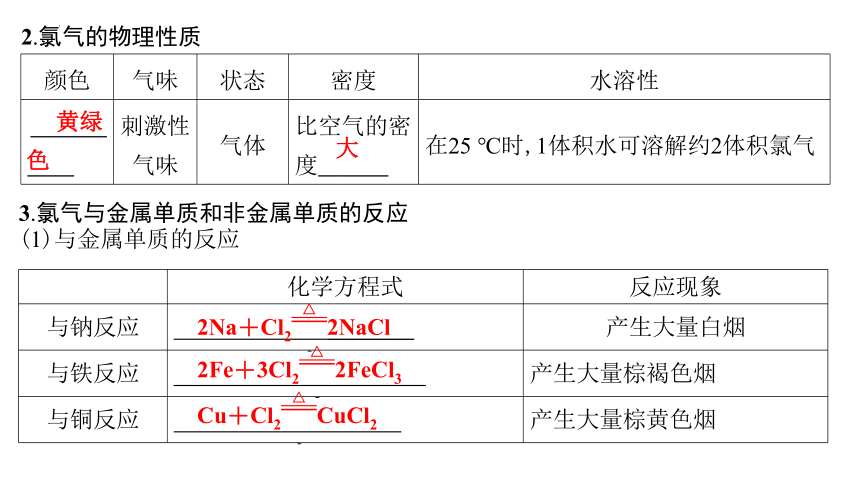
2.氯气的物理性质
颜色 气味 状态 密度 水溶性
黄绿色 刺激性 气味 气体 比空气的密度 大 在25 ℃时,1体积水可溶解约2体积氯气
黄绿
色
大
3.氯气与金属单质和非金属单质的反应
(1)与金属单质的反应
化学方程式 反应现象
与钠反应 2Na+Cl22NaCl 产生大量白烟
与铁反应 2Fe+3Cl22FeCl3 产生大量棕褐色烟
与铜反应 Cu+Cl2CuCl2 产生大量棕黄色烟
2Na+Cl22NaCl
2Fe+3Cl22FeCl3
Cu+Cl2CuCl2
(2)与非金属单质(如H2)的反应
实验操作 实验现象 实验结论
纯净的H2在Cl2中安静地燃烧,发出 苍白 色火焰,集气瓶口有 白雾 产生 H2与Cl2反应的化学方程式: H2+Cl22HCl ;生成的HCl溶于水得到盐酸
苍白
白雾
H2+
Cl22HCl
下列化合物中,不能通过两种单质直接化合制取的是 。
①FeCl3 ②CuCl2 ③HCl ④FeCl2 ⑤Na2O2
提示:④ Cl2与金属反应生成高价态的氯化物,所以FeCl2不能由两种单质直接化合制取。
1.下列有关实验现象的描述中正确的是( )
A.氢气在氯气中燃烧,产生苍白色的火焰,在瓶口出现白烟
B.钠在氯气中燃烧,产生白烟
C.铜丝在氯气中燃烧,生成CuCl2,产生蓝色的烟
D.红热的铁丝在氯气中剧烈燃烧,生成黑色固体
解析:B 氢气在氯气中燃烧生成HCl,产生苍白色火焰,HCl遇到空气中的水蒸气会形成盐酸小液滴,所以瓶口处有白雾出现,A错误;铜丝在氯气中燃烧生成氯化铜,产生棕黄色的烟,C错误;铁丝在氯气中燃烧生成氯化铁,产生棕褐色的烟,D错误。
2.下列氯化物中,既能由金属和氯气直接化合制得,又能由金属和盐酸反应制得的是( )
A.CuCl2 B.FeCl2
C.MgCl2 D.FeCl3
解析:C 铜不能和盐酸反应;铁和氯气反应生成FeCl3,Fe与盐酸反应生成FeCl2;Mg与盐酸、氯气反应均能生成MgCl2。
分点突破(二) 氯气与水的反应
1.与水的反应
Cl2的水溶液称为 氯水 ,Cl2与水反应的化学方程式为 Cl2+H2OHCl+HClO ,离子方程式为 Cl2+H2OH++Cl-+HClO 。
氯水
Cl2+H2OHCl+
HClO
Cl2+H2OH++Cl-+HClO
2.漂白原理的探究
实验序号 实验操作 实验现象 结论
Ⅰ 有色布条不褪色 氯气本身没有漂白性,氯气与水反应的产物 HClO有漂白性
Ⅱ 有色布条褪色
HClO有
漂白性
3.HClO的性质
(1)弱酸性
次氯酸是 易溶 于水的弱酸,比碳酸酸性 弱 ,写出氯气和水反应的离子方程式: Cl2+H2OH++Cl-+HClO 。
(2)不稳定性
在光照条件下分解:2HClO 2HCl+O2↑。
(3)强氧化性
HClO具有强氧化性,因此能杀菌消毒、漂白有色物质,能使有色布条褪色,能使酸碱指示剂褪色。
易溶
弱
Cl2+H2OH++Cl-+HClO
某学习小组设计以下实验探究氯水的成分与性质。
(1)2 mL新制氯水呈浅黄绿色,说明氯水中存在 。
提示:Cl2
(2)实验一中产生的气泡是 气体,由实验一中的现象,说明氯水中含有的粒子是 ,写出该反应的离子方程式: 。
提示:CO2 H+ C+2H+CO2↑+2H2O
(3)由实验二中的现象,说明氯水有哪些性质
提示:氯水能使紫色石蕊溶液变红,说明氯水具有酸性;一段时间后红色褪去,说明氯水具有漂白性。
(4)实验三中2 mL新制氯水在太阳光下放置发生的反应是 ,实验中“红色不褪去”的原因是
。
提示:2HClO 2HCl+O2↑ 长时间放置的氯水中无HClO,失去漂白性,故红色不褪去
(5)由实验四中的现象,说明氯水中的粒子是 ,写出反应的离子方程式: 。
提示:Cl- Cl-+Ag+AgCl↓
1.氯水的成分
2.氯水中主要成分的实验验证方法
3.液氯、新制氯水和久置氯水的比较
物质 液氯 新制氯水 久置氯水
成分 Cl2 Cl2、HClO、H2O、H+、Cl-、ClO-、OH- H+、Cl-、OH-、H2O
分类 纯净物 混合物 混合物
颜色 黄绿色 浅黄绿色 无色
性质 氧化性 酸性、氧化性、漂白性 酸性
保存 方法 特制 钢瓶 棕色试剂瓶盛装,置于阴凉处,一般现配现用 置于普通试剂瓶,玻璃塞即可(会腐蚀橡胶)
名师点拨
(1)实验室中氯水需现用现配。保存氯水时,应避免光照、受热,实验室通常将氯水置于棕色试剂瓶中密封保存。
(2)光照氯水,浅黄绿色逐渐褪去,溶液的pH逐渐减小(HClO转化为强酸HCl):2HClO 2HCl+O2↑。
(3)不能用pH试纸测氯水的pH,应用pH计测量。
1.下列有关新制氯水的说法错误的是( )
A.加入CaCO3不发生反应
B.具有酸性和氧化性
C.强光照射有气体产生
D.具有漂白性
解析:A 加入CaCO3与盐酸反应生成氯化钙、二氧化碳和水,A错误;氯水中含盐酸和次氯酸,所以具有酸性和氧化性,B正确;在光照时HClO会分解:2HClO 2HCl+O2↑,C正确;次氯酸具有漂白性,D正确。
2.氯气的水溶液称为氯水,氯水中含有多种分子和离子,因此氯水有多重性质。下列有关新制氯水的说法中不正确的是( )
A.新制氯水呈黄绿色,且有刺激性气味,但久置后黄绿色消失
B.新制氯水滴在紫色石蕊试纸上,试纸变成红色,不会变白
C.向淀粉碘化钾溶液中加入氯水,溶液变成蓝色,说明Cl2与盐发生了置换反应
D.新制氯水滴到Na2CO3溶液中,有气体产生,说明氯水中含有H+
解析:B 新制氯水中主要含有Cl2、H2O、HClO、H+、Cl-、ClO-,溶液显酸性,滴在紫色石蕊试纸上,试纸变成红色,由于HClO具有强氧化性,会将有色物质氧化变为无色物质,因此新制氯水滴在紫色石蕊试纸上,试纸先变成红色,后变白,B错误。
3.下列关于新制氯水和久置氯水的说法正确的是( )
A.新制氯水可保存在无色细口瓶中
B.向新制氯水和久置氯水中分别加入少量石灰石粉末,都能溶解
C.可用pH试纸测定新制氯水和久置氯水的pH
D.新制氯水能与 Na2CO3 反应,久置氯水不能与Na2CO3 反应
解析:B A项,新制氯水中有HClO,HClO见光易分解,则新制氯水应保存在棕色细口瓶中,并放置在冷暗处,错误;C项,新制氯水能漂白pH试纸,不能用pH试纸测定新制氯水的pH,错误;D项,新制氯水和久置氯水中都有盐酸,都能与Na2CO3反应,错误。
HClO的漂白性(探究与创新)
某化学小组进行了以下实验:
发现氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。
请设计实验,得出正确结论。
(1)提出问题:氯水中哪种物质能使红色布条褪色
(2)收集资料:①氯气有强氧化性;②氯气与水反应生成稀盐酸和次氯酸;③次氯酸有强氧化性。
提示:(3)①氯气使红色布条褪色 ②次氯酸使红色布条褪色 ③稀盐酸使红色布条褪色
(3)提出假设:
① ;
② ;
③ ;
④水使红色布条褪色。
提示:(4)②把红色布条伸入次氯酸溶液中,布条褪色 ③把红色布条伸入稀盐酸中,布条不褪色
(4)验证假设:实验①:把红色布条放入充满氯气的集气瓶中,布条不褪色;
实验②: ;
实验③: ;
实验④:把红色布条放在水里,布条不褪色。
(5)得出的实验结论是 。
提示:(5)次氯酸使红色布条褪色
Cl2和HClO都具有强氧化性,但HClO的氧化性强于Cl2。当与Fe2+、I-等一般还原剂反应时,是Cl2表现氧化性。消毒和漂白是HClO表现强氧化性。
1.某同学在一pH试纸上滴几滴新制的氯水,现象如图所示。下列有关该实验的说法正确的是( )
A.该实验说明Cl2分子具有漂白性
B.该实验说明H+扩散速度比HClO分子快
C.将实验后的pH试纸在酒精灯上微热,试纸又恢复为原来的颜色
D.若用久置的氯水进行实验,实验现象相同
解析:B HClO具有漂白性,Cl2无漂白性,A错误;由实验可知,滴加氯水后,溶液边缘变成红色,而中央部分变为白色,可说明H+的扩散速度比HClO分子快,B正确;HClO的漂白持久、稳定,实验后的pH试纸受热不会恢复为原来的颜色,C错误;久置的氯水主要成分为稀盐酸,无漂白性,故不会产生相同的实验现象,D错误。
2.用图示装置探究Cl2的漂白原理,其中红纸①是干燥的,红纸②~④分别用表中的试剂润湿。已知:ⅰ.Na2CO3与HClO反应生成NaHCO3;ⅱ.NaHCO3不与HClO反应。向中心Ca(ClO)2粉末上滴加几滴盐酸,迅速盖上培养皿,产生大量黄绿色气体,红纸变化如表。
编号 试剂 红纸变化
① — 不褪色
② 蒸馏水 逐渐褪色
③ 饱和食盐水 几乎不褪色
④ NaHCO3溶液 快速褪色
A.对比①②的现象,说明红纸褪色涉及反应Cl2+H2OHCl+HClO
B.对比②③的现象,不能说明使红纸褪色的粒子是HClO
C.对比②③④的现象,说明HClO浓度越大,漂白效果越好
D.④中试剂可用Na2CO3溶液代替
下列对于该实验的分析错误的是( )
解析:D A项,红纸①干燥,不褪色;红纸②湿润,褪色,说明Cl2不能使红纸褪色,而Cl2与水生成的产物使红纸褪色,正确;B项,红纸②褪色,说明Cl2+H2OHCl+HClO可使红纸褪色;③中饱和食盐水抑制Cl2+H2O
HCl+HClO的发生,但不能说明能使红纸褪色的粒子是HClO,正确;C项,②中发生反应Cl2+H2OHCl+HClO,③中饱和食盐水抑制Cl2+H2OHCl+HClO的发生,④中NaHCO3溶液不与HClO反应,但是与HCl反应,增大溶液中HClO浓度,褪色最快,说明HClO浓度越大,漂白效果越好,正确;D项,Na2CO3溶液与HClO反应生成NaHCO3,消耗HClO,故不能用Na2CO3溶液代替NaHCO3溶液,错误。
氯气的性质
学习目标:
结合真实情境中的应用实例或通过实验探究,了解氯及其重要化合物的主要性质,认识这些物质在生产中的应用和对生态环境的影响。
分点突破(一) 氯气与单质及水的反应
1.氯元素的原子结构及存在
2.氯气的物理性质
颜色 气味 状态 密度 水溶性
黄绿色 刺激性 气味 气体 比空气的密度 大 在25 ℃时,1体积水可溶解约2体积氯气
黄绿
色
大
3.氯气与金属单质和非金属单质的反应
(1)与金属单质的反应
化学方程式 反应现象
与钠反应 2Na+Cl22NaCl 产生大量白烟
与铁反应 2Fe+3Cl22FeCl3 产生大量棕褐色烟
与铜反应 Cu+Cl2CuCl2 产生大量棕黄色烟
2Na+Cl22NaCl
2Fe+3Cl22FeCl3
Cu+Cl2CuCl2
(2)与非金属单质(如H2)的反应
实验操作 实验现象 实验结论
纯净的H2在Cl2中安静地燃烧,发出 苍白 色火焰,集气瓶口有 白雾 产生 H2与Cl2反应的化学方程式: H2+Cl22HCl ;生成的HCl溶于水得到盐酸
苍白
白雾
H2+
Cl22HCl
下列化合物中,不能通过两种单质直接化合制取的是 。
①FeCl3 ②CuCl2 ③HCl ④FeCl2 ⑤Na2O2
提示:④ Cl2与金属反应生成高价态的氯化物,所以FeCl2不能由两种单质直接化合制取。
1.下列有关实验现象的描述中正确的是( )
A.氢气在氯气中燃烧,产生苍白色的火焰,在瓶口出现白烟
B.钠在氯气中燃烧,产生白烟
C.铜丝在氯气中燃烧,生成CuCl2,产生蓝色的烟
D.红热的铁丝在氯气中剧烈燃烧,生成黑色固体
解析:B 氢气在氯气中燃烧生成HCl,产生苍白色火焰,HCl遇到空气中的水蒸气会形成盐酸小液滴,所以瓶口处有白雾出现,A错误;铜丝在氯气中燃烧生成氯化铜,产生棕黄色的烟,C错误;铁丝在氯气中燃烧生成氯化铁,产生棕褐色的烟,D错误。
2.下列氯化物中,既能由金属和氯气直接化合制得,又能由金属和盐酸反应制得的是( )
A.CuCl2 B.FeCl2
C.MgCl2 D.FeCl3
解析:C 铜不能和盐酸反应;铁和氯气反应生成FeCl3,Fe与盐酸反应生成FeCl2;Mg与盐酸、氯气反应均能生成MgCl2。
分点突破(二) 氯气与水的反应
1.与水的反应
Cl2的水溶液称为 氯水 ,Cl2与水反应的化学方程式为 Cl2+H2OHCl+HClO ,离子方程式为 Cl2+H2OH++Cl-+HClO 。
氯水
Cl2+H2OHCl+
HClO
Cl2+H2OH++Cl-+HClO
2.漂白原理的探究
实验序号 实验操作 实验现象 结论
Ⅰ 有色布条不褪色 氯气本身没有漂白性,氯气与水反应的产物 HClO有漂白性
Ⅱ 有色布条褪色
HClO有
漂白性
3.HClO的性质
(1)弱酸性
次氯酸是 易溶 于水的弱酸,比碳酸酸性 弱 ,写出氯气和水反应的离子方程式: Cl2+H2OH++Cl-+HClO 。
(2)不稳定性
在光照条件下分解:2HClO 2HCl+O2↑。
(3)强氧化性
HClO具有强氧化性,因此能杀菌消毒、漂白有色物质,能使有色布条褪色,能使酸碱指示剂褪色。
易溶
弱
Cl2+H2OH++Cl-+HClO
某学习小组设计以下实验探究氯水的成分与性质。
(1)2 mL新制氯水呈浅黄绿色,说明氯水中存在 。
提示:Cl2
(2)实验一中产生的气泡是 气体,由实验一中的现象,说明氯水中含有的粒子是 ,写出该反应的离子方程式: 。
提示:CO2 H+ C+2H+CO2↑+2H2O
(3)由实验二中的现象,说明氯水有哪些性质
提示:氯水能使紫色石蕊溶液变红,说明氯水具有酸性;一段时间后红色褪去,说明氯水具有漂白性。
(4)实验三中2 mL新制氯水在太阳光下放置发生的反应是 ,实验中“红色不褪去”的原因是
。
提示:2HClO 2HCl+O2↑ 长时间放置的氯水中无HClO,失去漂白性,故红色不褪去
(5)由实验四中的现象,说明氯水中的粒子是 ,写出反应的离子方程式: 。
提示:Cl- Cl-+Ag+AgCl↓
1.氯水的成分
2.氯水中主要成分的实验验证方法
3.液氯、新制氯水和久置氯水的比较
物质 液氯 新制氯水 久置氯水
成分 Cl2 Cl2、HClO、H2O、H+、Cl-、ClO-、OH- H+、Cl-、OH-、H2O
分类 纯净物 混合物 混合物
颜色 黄绿色 浅黄绿色 无色
性质 氧化性 酸性、氧化性、漂白性 酸性
保存 方法 特制 钢瓶 棕色试剂瓶盛装,置于阴凉处,一般现配现用 置于普通试剂瓶,玻璃塞即可(会腐蚀橡胶)
名师点拨
(1)实验室中氯水需现用现配。保存氯水时,应避免光照、受热,实验室通常将氯水置于棕色试剂瓶中密封保存。
(2)光照氯水,浅黄绿色逐渐褪去,溶液的pH逐渐减小(HClO转化为强酸HCl):2HClO 2HCl+O2↑。
(3)不能用pH试纸测氯水的pH,应用pH计测量。
1.下列有关新制氯水的说法错误的是( )
A.加入CaCO3不发生反应
B.具有酸性和氧化性
C.强光照射有气体产生
D.具有漂白性
解析:A 加入CaCO3与盐酸反应生成氯化钙、二氧化碳和水,A错误;氯水中含盐酸和次氯酸,所以具有酸性和氧化性,B正确;在光照时HClO会分解:2HClO 2HCl+O2↑,C正确;次氯酸具有漂白性,D正确。
2.氯气的水溶液称为氯水,氯水中含有多种分子和离子,因此氯水有多重性质。下列有关新制氯水的说法中不正确的是( )
A.新制氯水呈黄绿色,且有刺激性气味,但久置后黄绿色消失
B.新制氯水滴在紫色石蕊试纸上,试纸变成红色,不会变白
C.向淀粉碘化钾溶液中加入氯水,溶液变成蓝色,说明Cl2与盐发生了置换反应
D.新制氯水滴到Na2CO3溶液中,有气体产生,说明氯水中含有H+
解析:B 新制氯水中主要含有Cl2、H2O、HClO、H+、Cl-、ClO-,溶液显酸性,滴在紫色石蕊试纸上,试纸变成红色,由于HClO具有强氧化性,会将有色物质氧化变为无色物质,因此新制氯水滴在紫色石蕊试纸上,试纸先变成红色,后变白,B错误。
3.下列关于新制氯水和久置氯水的说法正确的是( )
A.新制氯水可保存在无色细口瓶中
B.向新制氯水和久置氯水中分别加入少量石灰石粉末,都能溶解
C.可用pH试纸测定新制氯水和久置氯水的pH
D.新制氯水能与 Na2CO3 反应,久置氯水不能与Na2CO3 反应
解析:B A项,新制氯水中有HClO,HClO见光易分解,则新制氯水应保存在棕色细口瓶中,并放置在冷暗处,错误;C项,新制氯水能漂白pH试纸,不能用pH试纸测定新制氯水的pH,错误;D项,新制氯水和久置氯水中都有盐酸,都能与Na2CO3反应,错误。
HClO的漂白性(探究与创新)
某化学小组进行了以下实验:
发现氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。
请设计实验,得出正确结论。
(1)提出问题:氯水中哪种物质能使红色布条褪色
(2)收集资料:①氯气有强氧化性;②氯气与水反应生成稀盐酸和次氯酸;③次氯酸有强氧化性。
提示:(3)①氯气使红色布条褪色 ②次氯酸使红色布条褪色 ③稀盐酸使红色布条褪色
(3)提出假设:
① ;
② ;
③ ;
④水使红色布条褪色。
提示:(4)②把红色布条伸入次氯酸溶液中,布条褪色 ③把红色布条伸入稀盐酸中,布条不褪色
(4)验证假设:实验①:把红色布条放入充满氯气的集气瓶中,布条不褪色;
实验②: ;
实验③: ;
实验④:把红色布条放在水里,布条不褪色。
(5)得出的实验结论是 。
提示:(5)次氯酸使红色布条褪色
Cl2和HClO都具有强氧化性,但HClO的氧化性强于Cl2。当与Fe2+、I-等一般还原剂反应时,是Cl2表现氧化性。消毒和漂白是HClO表现强氧化性。
1.某同学在一pH试纸上滴几滴新制的氯水,现象如图所示。下列有关该实验的说法正确的是( )
A.该实验说明Cl2分子具有漂白性
B.该实验说明H+扩散速度比HClO分子快
C.将实验后的pH试纸在酒精灯上微热,试纸又恢复为原来的颜色
D.若用久置的氯水进行实验,实验现象相同
解析:B HClO具有漂白性,Cl2无漂白性,A错误;由实验可知,滴加氯水后,溶液边缘变成红色,而中央部分变为白色,可说明H+的扩散速度比HClO分子快,B正确;HClO的漂白持久、稳定,实验后的pH试纸受热不会恢复为原来的颜色,C错误;久置的氯水主要成分为稀盐酸,无漂白性,故不会产生相同的实验现象,D错误。
2.用图示装置探究Cl2的漂白原理,其中红纸①是干燥的,红纸②~④分别用表中的试剂润湿。已知:ⅰ.Na2CO3与HClO反应生成NaHCO3;ⅱ.NaHCO3不与HClO反应。向中心Ca(ClO)2粉末上滴加几滴盐酸,迅速盖上培养皿,产生大量黄绿色气体,红纸变化如表。
编号 试剂 红纸变化
① — 不褪色
② 蒸馏水 逐渐褪色
③ 饱和食盐水 几乎不褪色
④ NaHCO3溶液 快速褪色
A.对比①②的现象,说明红纸褪色涉及反应Cl2+H2OHCl+HClO
B.对比②③的现象,不能说明使红纸褪色的粒子是HClO
C.对比②③④的现象,说明HClO浓度越大,漂白效果越好
D.④中试剂可用Na2CO3溶液代替
下列对于该实验的分析错误的是( )
解析:D A项,红纸①干燥,不褪色;红纸②湿润,褪色,说明Cl2不能使红纸褪色,而Cl2与水生成的产物使红纸褪色,正确;B项,红纸②褪色,说明Cl2+H2OHCl+HClO可使红纸褪色;③中饱和食盐水抑制Cl2+H2O
HCl+HClO的发生,但不能说明能使红纸褪色的粒子是HClO,正确;C项,②中发生反应Cl2+H2OHCl+HClO,③中饱和食盐水抑制Cl2+H2OHCl+HClO的发生,④中NaHCO3溶液不与HClO反应,但是与HCl反应,增大溶液中HClO浓度,褪色最快,说明HClO浓度越大,漂白效果越好,正确;D项,Na2CO3溶液与HClO反应生成NaHCO3,消耗HClO,故不能用Na2CO3溶液代替NaHCO3溶液,错误。
