2.2.3氯气的实验室制法课件(共35页)-2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.2.3氯气的实验室制法课件(共35页)-2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 08:53:42 | ||
图片预览






文档简介
(共35张PPT)
氯气的实验室制法
学习目标:
1.能利用典型代表物的性质和反应,设计氯气的制备、提纯和检验等简单任务的方案。
2.通过对氯气实验室制法的学习,学会研究气体的实验室制法的方法和程序。
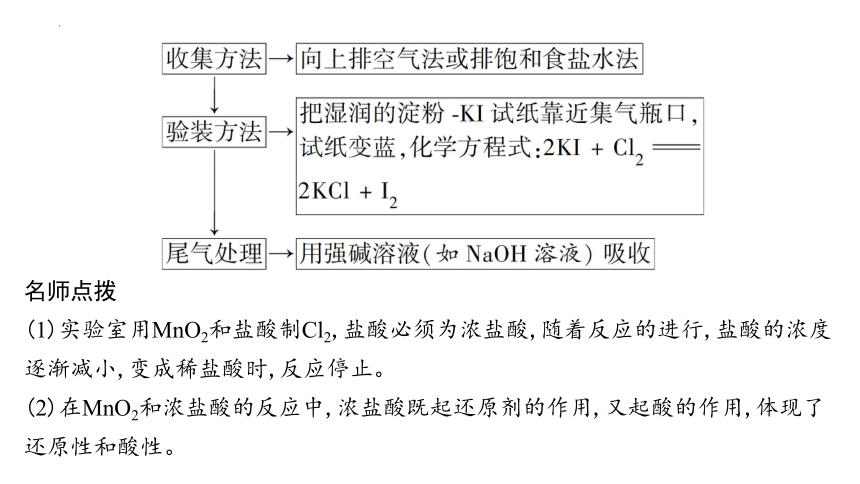
分点突破 氯气的实验室制法
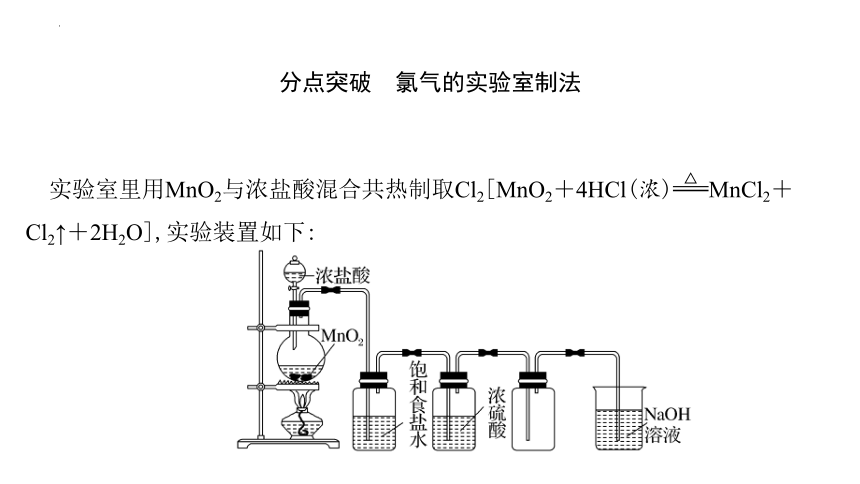
实验室里用MnO2与浓盐酸混合共热制取Cl2[MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O],实验装置如下:
1.用上述实验方法制得的Cl2中混有哪些杂质 上述装置中饱和食盐水和浓H2SO4的作用分别是什么
提示:Cl2中混有HCl和水蒸气。用饱和食盐水除去Cl2中的HCl气体,用浓H2SO4除去Cl2中的水蒸气。
2.烧杯中NaOH溶液的作用是什么 某同学认为可以用澄清石灰水代替NaOH溶液,同时还可以制得漂白粉,你认为该同学的想法是否合理 依据是什么
提示:NaOH溶液的作用是吸收多余的Cl2,以防污染环境。不合理;澄清石灰水中Ca(OH)2的浓度较小,不宜用来吸收尾气。
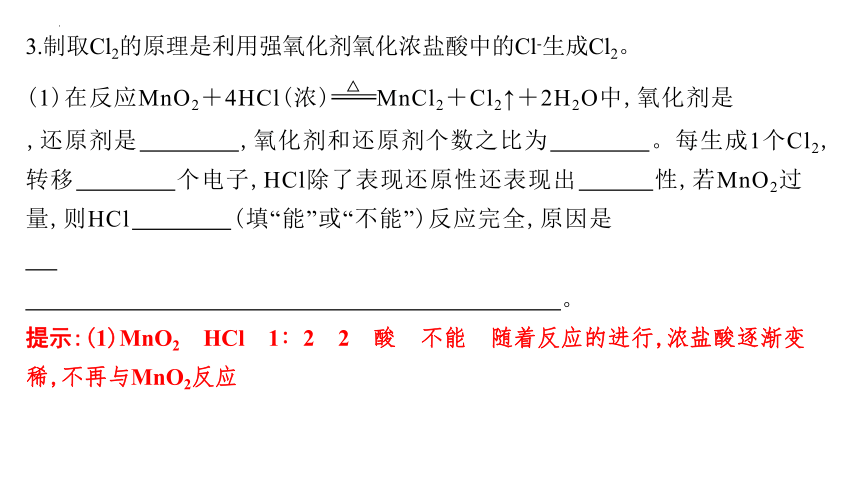
3.制取Cl2的原理是利用强氧化剂氧化浓盐酸中的Cl-生成Cl2。
(1)在反应MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O中,氧化剂是 ,还原剂是 ,氧化剂和还原剂个数之比为 。每生成1个Cl2,转移 个电子,HCl除了表现还原性还表现出 性,若MnO2过量,则HCl (填“能”或“不能”)反应完全,原因是
。
提示:(1)MnO2 HCl 1∶2 2 酸 不能 随着反应的进行,浓盐酸逐渐变稀,不再与MnO2反应
(2)KMnO4是一种很强的氧化剂,常温下即可与浓盐酸反应生成Cl2,请写出化学方程式,作还原剂的HCl占参与反应的多少
提示:(2)2KMnO4+16HCl(浓)2KCl+2MnCl2+5Cl2↑+8H2O,作还原剂的HCl占参与反应的。
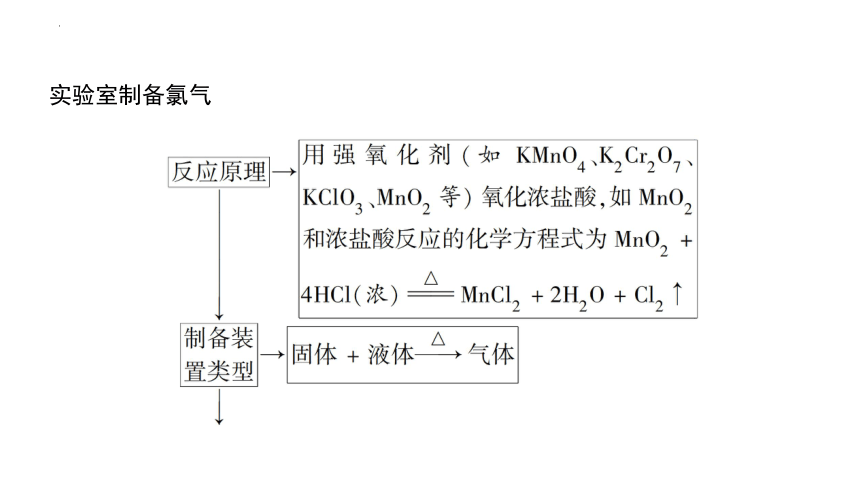
实验室制备氯气
名师点拨
(1)实验室用MnO2和盐酸制Cl2,盐酸必须为浓盐酸,随着反应的进行,盐酸的浓度逐渐减小,变成稀盐酸时,反应停止。
(2)在MnO2和浓盐酸的反应中,浓盐酸既起还原剂的作用,又起酸的作用,体现了还原性和酸性。
1.实验室常用二氧化锰与浓盐酸共热制取氯气,对于该反应,下列说法正确的是( )
A.二氧化锰是该反应的催化剂
B.该反应涉及的氧化物有两种
C.可用浓硫酸除去氯气中的氯化氢气体
D.反应中,还原剂与氧化产物的个数比为4∶1
解析:B Mn元素的化合价降低,二氧化锰作氧化剂,A错误;氧化物为MnO2、H2O,只有两种,B正确;用饱和食盐水除去氯气中的氯化氢气体,C错误;2 mol HCl失去电子被氧化,此时生成氧化产物(氯气)为1 mol,则还原剂与氧化产物的个数比为 2∶1,D错误。
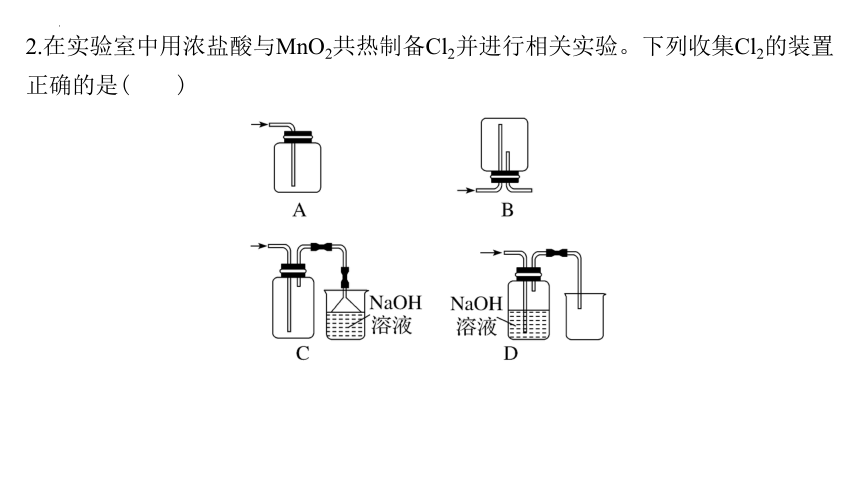
2.在实验室中用浓盐酸与MnO2共热制备Cl2并进行相关实验。下列收集Cl2的装置正确的是( )
解析:C 收集气体时,集气瓶不能堵住,应用双孔橡胶塞,A错误;该装置收集的是密度小于空气的气体,而氯气密度大于空气,且氯气有毒不能直接排放,B错误;该装置可收集比空气密度大的氯气,剩余的氯气需要用氢氧化钠溶液吸收,为防止倒吸,用倒扣在水面的漏斗,符合要求,C正确;氯气与氢氧化钠溶液反应,收集不到氯气,D错误。
3.某化学小组用如图所示装置制取氯气。下列说法不正确的是( )
A.该装置图中至少存在三处明显错误
B.该实验中收集氯气的方法不正确
C.为了防止氯气污染空气,必须进行尾气处理
D.湿润的淀粉碘化钾试纸若变蓝,证明有氯气逸出
解析:B 图中缺少加热装置,长颈漏斗的末端应伸入液面以下,缺少尾气处理装置,A正确;氯气的密度比空气大,应该用向上排空气法收集,B错误;氯气属于大气污染物,必须进行尾气处理,C正确;湿润的淀粉碘化钾试纸若变蓝,则可以证明有氯气逸出,原理为Cl2+2KI2KCl+I2,D正确。
制备气体的装置与连接方法(归纳与论证)
某同学利用Cl2氧化K2MnO4制备KMnO4的装置如图所示(夹持装置略):
已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
3Mn+2H2O2Mn+MnO2↓+4OH-
回答下列问题:
(1)装置A中a的作用是 ;
装置C中的试剂为 ;装置A中制备Cl2的化学方程式为 。
解析:(1)装置A中a的作用是平衡气压,使浓盐酸能够顺利滴下;该实验过程中有毒性较大的氯气参与反应,故装置C中盛放NaOH溶液,用于吸收有毒气体氯气,防止其逸出污染空气;酸性条件下,ClO-与Cl-发生氧化还原反应(归中反应)生成氯气,故装置A中制备Cl2的化学方程式是Ca(ClO)2+4HCl(浓)CaCl2+2Cl2↑+2H2O。
答案:(1)平衡气压,使浓盐酸顺利滴下 NaOH溶液 Ca(ClO)2+4HCl(浓)CaCl2+2Cl2↑+2H2O
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是 。
解析:(2)盐酸具有挥发性,则用浓盐酸制备的Cl2中含有HCl杂质,该杂质进入装置B中会使溶液碱性减弱,而溶液碱性减弱时Mn易发生歧化反应生成Mn和MnO2,又因为HCl还可还原装置B中生成的 KMnO4,导致产物损失,改进的方法是在装置A和装置B之间加装盛有饱和食盐水的洗气瓶,以除去Cl2中的HCl杂质。
答案:(2)在装置A、B之间加装盛有饱和食盐水的洗气瓶
实验室中制取气体装置的设计流程
(1)常见气体制备装置
反应物为固体(加热) 反应物为固体+液体(不加热) 反应物为固体+液体(加热)
装置示意图
典型气体 O2等 H2、O2、CO2等 Cl2等
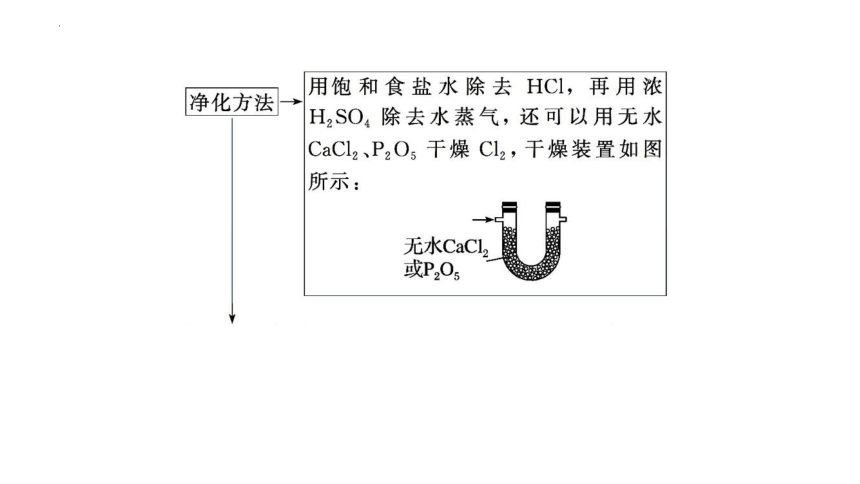
(2)常用除杂装置
①洗气瓶(甲):盛有液体除杂试剂,气流方向是长管进,短管出。
②干燥管(乙):盛有固体除杂试剂,气流方向是粗口进,细口出。
(3)常用气体收集方法
方法 排水法 向上排空气法 向下排空气法
装置
典型 气体 O2、H2等 O2、Cl2、CO2等 H2、NH3等
(4)常用气体尾气处理方法
方法 装置 典型气体
燃烧法 CO等
吸收法 Cl2、SO2等
收集法 CO等
1.下列制备气体的原理正确,并能用如图装置(夹持仪器略)进行反应和气体收集的是( )
A.MnO2与浓盐酸反应制取Cl2
B.H2O2与MnO2制取O2
C.石灰石与稀硫酸反应制取CO2
D.Cu与稀硫酸反应制取H2
解析:B MnO2与浓盐酸反应制取Cl2需要加热,A不选;H2O2与MnO2制取O2,反应不需加热,且氧气不溶于水,可以用排水法收集,B选;石灰石与稀硫酸反应生成的硫酸钙是微溶物质,会覆盖在石灰石表面,阻碍石灰石和稀硫酸的进一步接触,反应会很快停止,不适合制取CO2,C不选;Cu与稀硫酸不反应,不能制取H2,D不选。
2.下列能达到实验目的的是( )
A.①除去杂质气体CO2
B.②收集并吸收多余的Cl2
C.③干燥Cl2
D.④吸收HCl制盐酸
解析:C A项,导气管应该“长进短出”;B项,Cl2密度比空气密度大,Cl2会直接进入NaOH溶液,收集不到气体;D项,HCl易溶于水,会发生倒吸。
3.现提供下列实验装置:
(1)写出B装置中仪器甲的名称 。
(2)以高锰酸钾为原料制备氧气,还原产物是 (填名称),该反应的化学方程式为 。
解析:(2)高锰酸钾受热分解:2KMnO4K2MnO4+MnO2+O2↑,根据化学方程式,Mn的化合价由+7价降低为+6、+4价,还原产物为锰酸钾、二氧化锰。
答案:(1)分液漏斗
(2)锰酸钾、二氧化锰 2KMnO4K2MnO4+MnO2+O2↑
(3)过氧化钠(Na2O2)是一种淡黄色粉末状固体,是航空航天、潜水艇的供氧剂。常温下与水反应制取氧气,选择的发生装置是 (填字母)。检验该装置气密性的操作方法:
。
解析: (3)Na2O2与水反应不需要加热,又因为Na2O2为粉末,因此该反应不能使用启普发生器简易装置,应选用B装置;检验该装置气密性的操作方法:将该装置与D装置相连,向水槽中加水没过导管口,关闭分液漏斗下端活塞,用酒精灯微热或热毛巾捂锥形瓶的底部,若导管口有气泡,撤去酒精灯或热毛巾后,导管中有一段水柱,则装置气密性良好。
答案: (3)B 将该装置与D装置相连,向水槽中加水没过导管口,关闭分液漏斗下端活塞,用酒精灯微热或热毛巾捂锥形瓶的底部,若导管口有气泡,撤去酒精灯或热毛巾后,导管中有一段水柱,则装置气密性良好
1.下列关于实验室用MnO2制取Cl2的叙述中,不正确的是( )
A.MnO2与浓盐酸共热
B.用向下排空气法收集Cl2
C.缓慢加热反应
D.多余氯气常用较浓的碱液吸收
解析:B 因为氯气的密度比空气大,所以可用向上排空气法收集Cl2,B错误。
2.实验室制取氯气装置如图所示。主要操作步骤为:
①加热制取氯气 ②收集氯气 ③检查装置气密性
④处理尾气
下列选项中正确的实验操作顺序是( )
A.①②③④ B.③①②④
C.②④③① D.④③①②
解析:B 利用图中装置制取氯气,先检验气密性,再加热制备氯气,然后收集氯气,最后处理尾气,则正确的实验操作顺序是③①②④。
3.实验室制备氯气的化学方程式是MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑。下列关于实验室制氯气的说法错误的是( )
A.还原剂是HCl,氧化剂是MnO2
B.每生成1个Cl2,转移2个电子
C.每消耗87 g MnO2,起还原作用的HCl为146 g
D.生成的氯气中含有水蒸气和HCl
解析:C 在MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑中,MnO2是氧化剂,HCl是还原剂,每生成1个Cl2转移2个电子;每消耗87 g MnO2,参加反应的HCl为146 g,只有73 g HCl被氧化,即起还原作用的HCl为73 g;由于浓盐酸易挥发且反应需要加热,因此生成的氯气中含有水蒸气和HCl。
4.部分常见含氯物质的分类与相应化合价关系如图所示,下列推断不合理的是( )
A.a可以作氧化剂,也可以作还原剂
B.d的浓溶液与c的固体反应生成b与e
C.实验室可通过加热MnO2与d的浓溶液制得a
D.可存在a→c→e→d→b→a的循环转化关系
解析:B 由题干信息可知,物质a、b、c、d、e分别为Cl2、NaCl(或其他盐酸盐)、NaClO(或其他次氯酸盐)、HCl、HClO。a为Cl2,其中Cl元素的化合价为0价,既可以升高也可以降低,故既可作氧化剂,也可作还原剂,A合理;在浓溶液中由于存在反应ClO-+Cl-+2H+Cl2↑+H2O,故d的浓溶液即浓盐酸不可与c的固体即NaClO反应生成NaCl与HClO,B不合理;实验室可通过加热MnO2与d的浓溶液即浓盐酸制得a即Cl2,C合理;可存在a→c→e→d→b→a的循环转化关系即Cl2 ClO- HClO HCl Cl- Cl2,D合理。
5.氯的含氧酸盐具有较强的氧化性,能够杀菌消毒。某化学兴趣小组用氯气和相应的碱溶液反应制取NaClO和KClO3,制备装置如图所示(部分加持仪器略去)。已知:
①MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;
②氯气与碱反应,温度较高时生成Cl,温度较低时生成ClO-。
(1)在实验开始之前,应当进行的操作是 。
(2)盛装浓盐酸的仪器名称是 。
(3)装置B中的试剂为 。
答案:(3)饱和食盐水
答案:(1)检查装置气密性
答案:(2)分液漏斗
(4)a溶液是 ,原因是 。
(5)如果缺少装置B,对制取NaClO和KClO3的影响是 。
解析:MnO2与浓盐酸混合加热,发生氧化还原反应制取Cl2;浓盐酸具有挥发性,制取得到的Cl2中含有杂质HCl,可通过饱和NaCl溶液除去;在装置C中,Cl2与热的KOH溶液反应产生KCl、KClO3、H2O;剩余的Cl2被装置D中NaOH溶液吸收形成NaClO,为避免污染空气,多余的Cl2经过装置E中NaOH溶液吸收处理,然后排放。(5)在装置D中Cl2与NaOH溶液发生反应产生NaClO、NaCl、H2O。MnO2与浓盐酸混合加热,发生氧化还原反应制取Cl2,由于浓盐酸具有挥发性,制取得到的Cl2中含有杂质HCl,若没有装置B除去HCl,就会降低KClO3、NaClO的产率。
答案:(4)KOH溶液 氯气与碱反应,温度较高时生成Cl,C处采用水浴加热,欲制取KClO3
答案:(5)降低KClO3、NaClO的产率
(6)装置E的作用是 ,写出所发生反应的化学方程式: 。
解析: (6)多余的Cl2经过装置E中NaOH溶液被吸收,应产生NaClO、NaCl、H2O,该反应的化学方程式为Cl2+2NaOHNaClO+NaCl+H2O。
答案:(6)吸收多余氯气,以免污染空气 Cl2+2NaOHNaClO+NaCl+H2O
氯气的实验室制法
学习目标:
1.能利用典型代表物的性质和反应,设计氯气的制备、提纯和检验等简单任务的方案。
2.通过对氯气实验室制法的学习,学会研究气体的实验室制法的方法和程序。
分点突破 氯气的实验室制法
实验室里用MnO2与浓盐酸混合共热制取Cl2[MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O],实验装置如下:
1.用上述实验方法制得的Cl2中混有哪些杂质 上述装置中饱和食盐水和浓H2SO4的作用分别是什么
提示:Cl2中混有HCl和水蒸气。用饱和食盐水除去Cl2中的HCl气体,用浓H2SO4除去Cl2中的水蒸气。
2.烧杯中NaOH溶液的作用是什么 某同学认为可以用澄清石灰水代替NaOH溶液,同时还可以制得漂白粉,你认为该同学的想法是否合理 依据是什么
提示:NaOH溶液的作用是吸收多余的Cl2,以防污染环境。不合理;澄清石灰水中Ca(OH)2的浓度较小,不宜用来吸收尾气。
3.制取Cl2的原理是利用强氧化剂氧化浓盐酸中的Cl-生成Cl2。
(1)在反应MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O中,氧化剂是 ,还原剂是 ,氧化剂和还原剂个数之比为 。每生成1个Cl2,转移 个电子,HCl除了表现还原性还表现出 性,若MnO2过量,则HCl (填“能”或“不能”)反应完全,原因是
。
提示:(1)MnO2 HCl 1∶2 2 酸 不能 随着反应的进行,浓盐酸逐渐变稀,不再与MnO2反应
(2)KMnO4是一种很强的氧化剂,常温下即可与浓盐酸反应生成Cl2,请写出化学方程式,作还原剂的HCl占参与反应的多少
提示:(2)2KMnO4+16HCl(浓)2KCl+2MnCl2+5Cl2↑+8H2O,作还原剂的HCl占参与反应的。
实验室制备氯气
名师点拨
(1)实验室用MnO2和盐酸制Cl2,盐酸必须为浓盐酸,随着反应的进行,盐酸的浓度逐渐减小,变成稀盐酸时,反应停止。
(2)在MnO2和浓盐酸的反应中,浓盐酸既起还原剂的作用,又起酸的作用,体现了还原性和酸性。
1.实验室常用二氧化锰与浓盐酸共热制取氯气,对于该反应,下列说法正确的是( )
A.二氧化锰是该反应的催化剂
B.该反应涉及的氧化物有两种
C.可用浓硫酸除去氯气中的氯化氢气体
D.反应中,还原剂与氧化产物的个数比为4∶1
解析:B Mn元素的化合价降低,二氧化锰作氧化剂,A错误;氧化物为MnO2、H2O,只有两种,B正确;用饱和食盐水除去氯气中的氯化氢气体,C错误;2 mol HCl失去电子被氧化,此时生成氧化产物(氯气)为1 mol,则还原剂与氧化产物的个数比为 2∶1,D错误。
2.在实验室中用浓盐酸与MnO2共热制备Cl2并进行相关实验。下列收集Cl2的装置正确的是( )
解析:C 收集气体时,集气瓶不能堵住,应用双孔橡胶塞,A错误;该装置收集的是密度小于空气的气体,而氯气密度大于空气,且氯气有毒不能直接排放,B错误;该装置可收集比空气密度大的氯气,剩余的氯气需要用氢氧化钠溶液吸收,为防止倒吸,用倒扣在水面的漏斗,符合要求,C正确;氯气与氢氧化钠溶液反应,收集不到氯气,D错误。
3.某化学小组用如图所示装置制取氯气。下列说法不正确的是( )
A.该装置图中至少存在三处明显错误
B.该实验中收集氯气的方法不正确
C.为了防止氯气污染空气,必须进行尾气处理
D.湿润的淀粉碘化钾试纸若变蓝,证明有氯气逸出
解析:B 图中缺少加热装置,长颈漏斗的末端应伸入液面以下,缺少尾气处理装置,A正确;氯气的密度比空气大,应该用向上排空气法收集,B错误;氯气属于大气污染物,必须进行尾气处理,C正确;湿润的淀粉碘化钾试纸若变蓝,则可以证明有氯气逸出,原理为Cl2+2KI2KCl+I2,D正确。
制备气体的装置与连接方法(归纳与论证)
某同学利用Cl2氧化K2MnO4制备KMnO4的装置如图所示(夹持装置略):
已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
3Mn+2H2O2Mn+MnO2↓+4OH-
回答下列问题:
(1)装置A中a的作用是 ;
装置C中的试剂为 ;装置A中制备Cl2的化学方程式为 。
解析:(1)装置A中a的作用是平衡气压,使浓盐酸能够顺利滴下;该实验过程中有毒性较大的氯气参与反应,故装置C中盛放NaOH溶液,用于吸收有毒气体氯气,防止其逸出污染空气;酸性条件下,ClO-与Cl-发生氧化还原反应(归中反应)生成氯气,故装置A中制备Cl2的化学方程式是Ca(ClO)2+4HCl(浓)CaCl2+2Cl2↑+2H2O。
答案:(1)平衡气压,使浓盐酸顺利滴下 NaOH溶液 Ca(ClO)2+4HCl(浓)CaCl2+2Cl2↑+2H2O
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是 。
解析:(2)盐酸具有挥发性,则用浓盐酸制备的Cl2中含有HCl杂质,该杂质进入装置B中会使溶液碱性减弱,而溶液碱性减弱时Mn易发生歧化反应生成Mn和MnO2,又因为HCl还可还原装置B中生成的 KMnO4,导致产物损失,改进的方法是在装置A和装置B之间加装盛有饱和食盐水的洗气瓶,以除去Cl2中的HCl杂质。
答案:(2)在装置A、B之间加装盛有饱和食盐水的洗气瓶
实验室中制取气体装置的设计流程
(1)常见气体制备装置
反应物为固体(加热) 反应物为固体+液体(不加热) 反应物为固体+液体(加热)
装置示意图
典型气体 O2等 H2、O2、CO2等 Cl2等
(2)常用除杂装置
①洗气瓶(甲):盛有液体除杂试剂,气流方向是长管进,短管出。
②干燥管(乙):盛有固体除杂试剂,气流方向是粗口进,细口出。
(3)常用气体收集方法
方法 排水法 向上排空气法 向下排空气法
装置
典型 气体 O2、H2等 O2、Cl2、CO2等 H2、NH3等
(4)常用气体尾气处理方法
方法 装置 典型气体
燃烧法 CO等
吸收法 Cl2、SO2等
收集法 CO等
1.下列制备气体的原理正确,并能用如图装置(夹持仪器略)进行反应和气体收集的是( )
A.MnO2与浓盐酸反应制取Cl2
B.H2O2与MnO2制取O2
C.石灰石与稀硫酸反应制取CO2
D.Cu与稀硫酸反应制取H2
解析:B MnO2与浓盐酸反应制取Cl2需要加热,A不选;H2O2与MnO2制取O2,反应不需加热,且氧气不溶于水,可以用排水法收集,B选;石灰石与稀硫酸反应生成的硫酸钙是微溶物质,会覆盖在石灰石表面,阻碍石灰石和稀硫酸的进一步接触,反应会很快停止,不适合制取CO2,C不选;Cu与稀硫酸不反应,不能制取H2,D不选。
2.下列能达到实验目的的是( )
A.①除去杂质气体CO2
B.②收集并吸收多余的Cl2
C.③干燥Cl2
D.④吸收HCl制盐酸
解析:C A项,导气管应该“长进短出”;B项,Cl2密度比空气密度大,Cl2会直接进入NaOH溶液,收集不到气体;D项,HCl易溶于水,会发生倒吸。
3.现提供下列实验装置:
(1)写出B装置中仪器甲的名称 。
(2)以高锰酸钾为原料制备氧气,还原产物是 (填名称),该反应的化学方程式为 。
解析:(2)高锰酸钾受热分解:2KMnO4K2MnO4+MnO2+O2↑,根据化学方程式,Mn的化合价由+7价降低为+6、+4价,还原产物为锰酸钾、二氧化锰。
答案:(1)分液漏斗
(2)锰酸钾、二氧化锰 2KMnO4K2MnO4+MnO2+O2↑
(3)过氧化钠(Na2O2)是一种淡黄色粉末状固体,是航空航天、潜水艇的供氧剂。常温下与水反应制取氧气,选择的发生装置是 (填字母)。检验该装置气密性的操作方法:
。
解析: (3)Na2O2与水反应不需要加热,又因为Na2O2为粉末,因此该反应不能使用启普发生器简易装置,应选用B装置;检验该装置气密性的操作方法:将该装置与D装置相连,向水槽中加水没过导管口,关闭分液漏斗下端活塞,用酒精灯微热或热毛巾捂锥形瓶的底部,若导管口有气泡,撤去酒精灯或热毛巾后,导管中有一段水柱,则装置气密性良好。
答案: (3)B 将该装置与D装置相连,向水槽中加水没过导管口,关闭分液漏斗下端活塞,用酒精灯微热或热毛巾捂锥形瓶的底部,若导管口有气泡,撤去酒精灯或热毛巾后,导管中有一段水柱,则装置气密性良好
1.下列关于实验室用MnO2制取Cl2的叙述中,不正确的是( )
A.MnO2与浓盐酸共热
B.用向下排空气法收集Cl2
C.缓慢加热反应
D.多余氯气常用较浓的碱液吸收
解析:B 因为氯气的密度比空气大,所以可用向上排空气法收集Cl2,B错误。
2.实验室制取氯气装置如图所示。主要操作步骤为:
①加热制取氯气 ②收集氯气 ③检查装置气密性
④处理尾气
下列选项中正确的实验操作顺序是( )
A.①②③④ B.③①②④
C.②④③① D.④③①②
解析:B 利用图中装置制取氯气,先检验气密性,再加热制备氯气,然后收集氯气,最后处理尾气,则正确的实验操作顺序是③①②④。
3.实验室制备氯气的化学方程式是MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑。下列关于实验室制氯气的说法错误的是( )
A.还原剂是HCl,氧化剂是MnO2
B.每生成1个Cl2,转移2个电子
C.每消耗87 g MnO2,起还原作用的HCl为146 g
D.生成的氯气中含有水蒸气和HCl
解析:C 在MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑中,MnO2是氧化剂,HCl是还原剂,每生成1个Cl2转移2个电子;每消耗87 g MnO2,参加反应的HCl为146 g,只有73 g HCl被氧化,即起还原作用的HCl为73 g;由于浓盐酸易挥发且反应需要加热,因此生成的氯气中含有水蒸气和HCl。
4.部分常见含氯物质的分类与相应化合价关系如图所示,下列推断不合理的是( )
A.a可以作氧化剂,也可以作还原剂
B.d的浓溶液与c的固体反应生成b与e
C.实验室可通过加热MnO2与d的浓溶液制得a
D.可存在a→c→e→d→b→a的循环转化关系
解析:B 由题干信息可知,物质a、b、c、d、e分别为Cl2、NaCl(或其他盐酸盐)、NaClO(或其他次氯酸盐)、HCl、HClO。a为Cl2,其中Cl元素的化合价为0价,既可以升高也可以降低,故既可作氧化剂,也可作还原剂,A合理;在浓溶液中由于存在反应ClO-+Cl-+2H+Cl2↑+H2O,故d的浓溶液即浓盐酸不可与c的固体即NaClO反应生成NaCl与HClO,B不合理;实验室可通过加热MnO2与d的浓溶液即浓盐酸制得a即Cl2,C合理;可存在a→c→e→d→b→a的循环转化关系即Cl2 ClO- HClO HCl Cl- Cl2,D合理。
5.氯的含氧酸盐具有较强的氧化性,能够杀菌消毒。某化学兴趣小组用氯气和相应的碱溶液反应制取NaClO和KClO3,制备装置如图所示(部分加持仪器略去)。已知:
①MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;
②氯气与碱反应,温度较高时生成Cl,温度较低时生成ClO-。
(1)在实验开始之前,应当进行的操作是 。
(2)盛装浓盐酸的仪器名称是 。
(3)装置B中的试剂为 。
答案:(3)饱和食盐水
答案:(1)检查装置气密性
答案:(2)分液漏斗
(4)a溶液是 ,原因是 。
(5)如果缺少装置B,对制取NaClO和KClO3的影响是 。
解析:MnO2与浓盐酸混合加热,发生氧化还原反应制取Cl2;浓盐酸具有挥发性,制取得到的Cl2中含有杂质HCl,可通过饱和NaCl溶液除去;在装置C中,Cl2与热的KOH溶液反应产生KCl、KClO3、H2O;剩余的Cl2被装置D中NaOH溶液吸收形成NaClO,为避免污染空气,多余的Cl2经过装置E中NaOH溶液吸收处理,然后排放。(5)在装置D中Cl2与NaOH溶液发生反应产生NaClO、NaCl、H2O。MnO2与浓盐酸混合加热,发生氧化还原反应制取Cl2,由于浓盐酸具有挥发性,制取得到的Cl2中含有杂质HCl,若没有装置B除去HCl,就会降低KClO3、NaClO的产率。
答案:(4)KOH溶液 氯气与碱反应,温度较高时生成Cl,C处采用水浴加热,欲制取KClO3
答案:(5)降低KClO3、NaClO的产率
(6)装置E的作用是 ,写出所发生反应的化学方程式: 。
解析: (6)多余的Cl2经过装置E中NaOH溶液被吸收,应产生NaClO、NaCl、H2O,该反应的化学方程式为Cl2+2NaOHNaClO+NaCl+H2O。
答案:(6)吸收多余氯气,以免污染空气 Cl2+2NaOHNaClO+NaCl+H2O
