2.3.3物质的量浓度(共27张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 2.3.3物质的量浓度(共27张ppt)化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 684.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 00:00:00 | ||
图片预览








文档简介
(共27张PPT)
物质的量浓度
学习目标:
1.了解物质的量浓度的含义及其微观粒子间的关系。
2.能运用物质的量、摩尔质量、气体摩尔体积、物质的量浓度之间的相互关系进行简单计算。
分点突破(一) 物质的量浓度
1.溶质的质量分数
(1)概念:溶液中 溶质 的质量与溶液的质量之比。
(2)表达式:w(溶质)=×100%。
溶质
2.物质的量浓度
(1)概念:表示单位体积的溶液里所含溶质B的 物质的量 。
(2)符号:cB,常用单位: mol/L (或mol·L-1)。
(3)表达式:cB= 。
(4)示例:1 L碳酸钠溶液中含有1 mol Na2CO3,其物质的量浓度为 1 mol·L-1 ,其中c(Na+)= 2 mol·L-1 。
物质的量
mol/L
1 mol·L-1
2 mol·L-1
3.以物质的量(n)为桥梁联系宏观物质的量浓度、溶质质量与微观粒子数之间的关系
=nB=cB·V
=
1.将10 g CaCO3粉末加水配成100 mL溶液,CaCO3的物质的量浓度为1 mol·L-1吗
提示:CaCO3是难溶物,能够溶解的溶质的物质的量浓度远小于1 mol·L-1。
2.(1)1 L 0.5 mol·L-1的Al2(SO4)3溶液中n(Al3+)= ,c(Al3+)= ,n(S)= ,c(S)= ,c[Al2(SO4)3]∶c(Al3+)∶c(S)= ,由此可知,对于同一溶液中,不同粒子的浓度之比等于 。
提示:(1)1 mol 1 mol·L-1 1.5 mol 1.5 mol·L-1 1∶2∶3 粒子数之比
(2)某BaCl2溶液中,测得c(Cl-)=0.5 mol·L-1,则c(Ba2+)= 。
提示:(2)0.25 mol·L-1
(3)下列与0.2 mol·L-1 AlCl3溶液中c(Cl-)相同的是 (填序号)。
①0.2 mol·L-1 NaCl溶液 ②0.3 mol·L-1 MgCl2溶液 ③0.6 mol·L-1 KCl溶液
④0.2 mol·L-1 BaCl2溶液
提示:(3)②③
1.物质的量浓度表达式中,V表示溶液的体积,在进行简单计算时,一定要辨析所给体积是否为溶液的体积,溶液的体积不等于溶剂的体积,也不等于溶质、溶剂的体积和,应用溶液质量除以密度来求解溶液的体积。
2.注意整体与部分的关系,如:
0.2 mol·L-1的
Na2SO4溶液中
3.确定溶液中溶质的几种特殊情况
(1)带有结晶水的物质如CuSO4·5H2O溶于水时,其溶质是CuSO4,而不是CuSO4·5H2O。
(2)某些物质溶于水后与水发生反应生成了新物质,此时溶质为反应后的生成物,如Na、Na2O、Na2O2 NaOH,溶质为NaOH,SO3 H2SO4,溶质为H2SO4等。
(3)NH3溶于水后溶质为NH3·H2O,但计算浓度时是以NH3分子作为溶质。
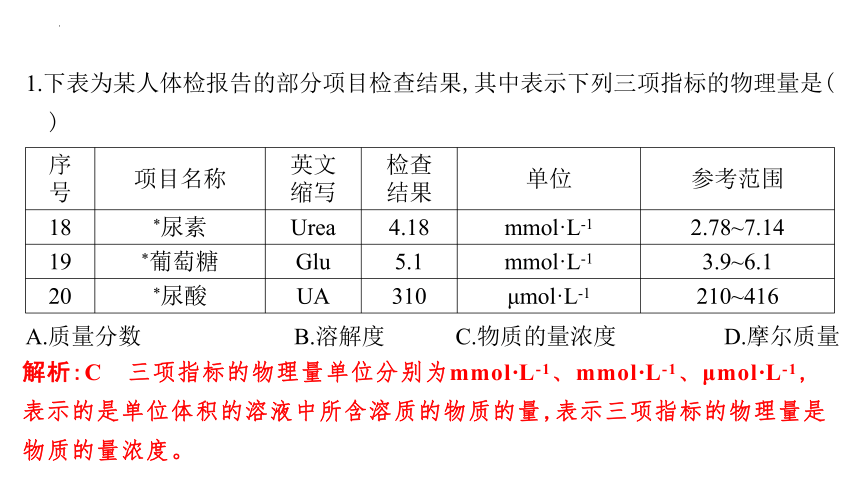
1.下表为某人体检报告的部分项目检查结果,其中表示下列三项指标的物理量是( )
序 号 项目名称 英文 缩写 检查 结果 单位 参考范围
18 *尿素 Urea 4.18 mmol·L-1 2.78~7.14
19 *葡萄糖 Glu 5.1 mmol·L-1 3.9~6.1
20 *尿酸 UA 310 μmol·L-1 210~416
A.质量分数 B.溶解度
解析:C 三项指标的物理量单位分别为mmol·L-1、mmol·L-1、μmol·L-1,表示的是单位体积的溶液中所含溶质的物质的量,表示三项指标的物理量是物质的量浓度。
C.物质的量浓度 D.摩尔质量
2.下列溶液中,钠离子物质的量浓度最大的是( )
A.1 000 mL 0.2 mol·L-1的NaCl溶液
B.100 mL 0.25 mol·L-1的Na2CO3 溶液
C.100 mL 0.3 mol·L-1的NaNO3 溶液
D.10 mL 0.2 mol·L-1的Na2SO4 溶液
解析:B A项,c(Na+)=0.2 mol·L-1×1=0.2 mol·L-1;B项,c(Na+)=0.25 mol·L-1×2=0.5 mol·L-1;C项,c(Na+)=0.3 mol·L-1×1=0.3 mol·L-1;D项,c(Na+)=0.2 mol·L-1×2=0.4 mol·L-1;则c(Na+)最大值是0.5 mol·L-1。
3.下列实验能达到目的的是( )
A.将58.5 g NaCl溶于1 L水中可得1 mol·L-1的NaCl溶液
B.将标准状况下22.4 L HCl溶于1 L水中可得 1 mol·L-1盐酸
C.将40 g NaOH溶于水配成1 L溶液可得1 mol·L-1的NaOH溶液
D.将78 g Na2O2溶于水配成1 L溶液可得到浓度为1 mol·L-1的溶液
解析:C A项,将58.5 g NaCl即1 mol氯化钠溶于1 L水中,所得溶液体积不是1 L,因此不能得到1 mol·L-1的NaCl溶液,错误;B项,将标准状况下22.4 L HCl即1 mol氯化氢溶于1 L水中,所得溶液体积不是1 L,因此不能得到1 mol·L-1盐酸,错误;D项,将78 g Na2O2即1 mol过氧化钠溶于水,得到2 mol氢氧化钠,配成1 L溶液可得到浓度为 2 mol·L-1的溶液,错误。
分点突破(二) 与物质的量浓度有关的计算
题型一 有关定义式的计算
【例1】 设NA为阿伏加德罗常数的值,200 mL Ba(NO3)2 溶液中含Ba2+ 和N 总数为0.45NA,则该溶液的物质的量浓度为( )
A.6.75 mol·L-1 B.2.25 mol·L-1
C.1.5 mol·L-1 D.0.75 mol·L-1
解析 根据化学式以及Ba2+ 与N 的总数为0.45NA,可得该溶液中含0.15 mol Ba2+ 和 0.3 mol N,则Ba(NO3)2 的物质的量为0.15 mol,该溶液的物质的量浓度为c===0.75 mol·L-1。
答案 D
【例2】 将标准状况下体积为V L的HCl气体溶于 1 L 水中,所得溶液的密度为ρ g·cm-3,计算所得溶液的物质的量浓度
答案 n(HCl)= mol
V(溶液)=
c(HCl)== mol·L-1。
有关定义式的计算
(1)计算基本公式:c==。
(2)计算的基本类型
①已知溶质的质量
M n c
②已知溶液中某种粒子的数目
N n c
③已知标准状况下气体的体积和溶液的密度(ρ g·mL-1)
题型二 与溶液稀释和混合有关的计算
【例3】 将50 mL 0.3 mol·L-1 NaOH溶液加水稀释后到300 mL,稀释后溶液中NaOH的物质的量浓度为( )
A.0.3 mol·L-1 B.0.03 mol·L-1
C.0.05 mol·L-1 D.0.04 mol·L-1
解析 根据溶液稀释前后溶质的物质的量不变得到0.05 L×0.3 mol·L-1=c×0.3 L,c=0.05 mol·L-1。
答案 C
(1)浓溶液稀释
①溶质的物质的量不变:c(浓)·V(浓)=c(稀)·V(稀);
②溶质的质量不变:m(浓)·w(浓)=m(稀)·w(稀);
③溶液的质量守恒:m(稀)=m(浓)+m(水)。
(2)相同溶质两溶液混合
①溶质的物质的量不变:c1V1+c2V2=c(混)·V(混);
②溶质的质量不变:m1w1+m2w2=m(混)·w(混)。
题型三 物质的量浓度与溶质的质量分数的换算
【例4】 如图是某市售盐酸试剂瓶标签上的部分数据。则该盐酸的物质的量浓度是( )
盐酸
化学式:HCl
相对分子质量:36.5
密度:1.18 g·cm-3
HCl的质量分数:36.5%
符号GB622-89
A.3 mol·L-1 B.8.4 mol·L-1
C.11.8 mol·L-1 D.0.5 mol·L-1
解析 盐酸的物质的量浓度为c== mol·L-1=11.8 mol·L-1。
答案 C
质量分数与物质的量浓度的换算
已知溶质B的摩尔质量为M g·mol-1,溶液的密度为ρ g·mL-1,溶质的质量分数为w。则cB=== mol·L-1。
1.将60 mL 12 mol·L-1的盐酸(ρ=1.15 g·cm-3)稀释成6 mol·L-1的盐酸(ρ=1.10 g·cm-3),需加水的体积为(假定水的密度为1.0 g·cm-3)( )
A.63 mL B.55 mL C.52.5 mL D.50 mL
解析:A 设稀释后溶液的体积为V,根据稀释前后HCl的物质的量相等,60 mL×12 mol·L-1=V×6 mol·L-1,V=120 mL,加水的质量为120 mL×1.10 g·mL-1-60 mL×1.15 g·mL-1=63 g,所以加水的体积为63 mL。
2.在80 g密度为d g·cm-3 的硫酸铁溶液中,含有2.8 g Fe3+,则此溶液中S 的物质的量浓度数值为( )
A. B. C. D.
解析:A n(Fe3+)==0.05 mol,溶液中n(S)=n(Fe3+)=×0.05 mol =0.075 mol,溶液体积==L,则S 的物质的量浓度为 = mol·L-1。
3.由KNO3、Zn(NO3)2和ZnSO4组成的混合溶液中 c(K+)=0.2 mol·L-1、c(S)=0.4 mol·L-1、c(N)=0.4 mol·L-1,则c(Zn2+)为( )
A.0.3 mol·L-1 B.0.4 mol·L-1
C.0.5 mol·L-1 D.0.6 mol·L-1
解析:C 根据溶液呈电中性,c(K+)+2c(Zn2+)=c(N)+2c(S),即0.2 mol·L-1+2c(Zn2+)=0.4 mol·L-1+2×0.4 mol·L-1,解得c(Zn2+)=0.5 mol·L-1。
1.下列对1 mol·L-1的Na2SO4溶液的叙述中正确的是( )
A.溶液中含有1 mol Na2SO4
B.它是由1 mol Na2SO4溶于1 L水形成的溶液
C.1 L该溶液含有142 g Na2SO4
D.从1 L该溶液中取出500 mL以后,剩余溶液的浓度为0.5 mol·L-1
解析:C A项,由于溶液体积未知,则不能确定溶质的物质的量,错误;B项,1 mol Na2SO4溶于1 L水,溶液的体积不等于1 L,错误;C项,1 L溶液中含有:m(Na2SO4)=1 L×1 mol·L-1×142 g·mol-1=142 g,正确;D项,从1 L该溶液中取出500 mL以后,溶液具有均一性,故剩余溶液的浓度仍为 1 mol·L-1,错误。
2.0.25 L NaOH溶液中溶有10 g NaOH,则此溶液的物质的量浓度为( )
A.2 mol·L-1 B.1 mol·L-1
C.0.5 mol·L-1 D.0.05 mol·L-1
解析:B n(NaOH)==0.25 mol,溶液的体积为0.25 L,c(NaOH)==1 mol·L-1。
3.在0.2 mol·L-1KAl(SO4)2溶液中,S的物质的量浓度为( )
A.0.1 mol·L-1 B.0.2 mol·L-1
C.0.4 mol·L-1 D.0.8 mol·L-1
解析:C 由化学式可知,S的物质的量浓度为 2×0.2 mol·L-1=0.4 mol·L-1。
4.在相同体积、相同物质的量浓度的两种酸溶液中,一定相等的是( )
A.溶质的质量 B.溶质的物质的量
C.溶质的质量分数 D.氢离子的物质的量
解析:B 在相同体积、相同物质的量浓度的两种酸溶液中,由n=cV可知,酸的物质的量一定相等,B正确;若二者的摩尔质量不同,则质量不同,A错误;由c= 可知,若二者的摩尔质量不同,密度不同,则质量分数不同,C错误;酸的元数不确定,无法判断氢离子的物质的量,D错误。
5.(1)用14.2 g无水硫酸钠配制成500 mL溶液,其物质的量浓度为 mol·L-1。
解析:(1)n(Na2SO4)==0.1 mol,c(Na2SO4)==0.2 mol·L-1。
答案:(1)0.2
(2)若从中取出50 mL溶液,其物质的量浓度为 mol·L-1,溶质的质量为 g。
解析:(2)从中取出50 mL溶液,浓度仍为0.2 mol·L-1,溶质的质量m=nM=cVM=0.2 mol·L-1×0.05 L×142 g·mol-1=1.42 g。
答案:(2)0.2 1.42
(3)若将这50 mL溶液用水稀释到100 mL,所得溶液中Na+的物质的量浓度为 mol·L-1,S的物质的量浓度为 mol·L-1。
解析:(3)50 mL溶液用水稀释到100 mL,根据c(浓)·V(浓)=c(稀)·V(稀),稀溶液中Na2SO4的物质的量浓度变为原来的,即0.1 mol·L-1,故所得溶液中Na+的物质的量浓度为0.2 mol·L-1,S的物质的量浓度为0.1 mol·L-1。
答案:(3)0.2 0.1
物质的量浓度
学习目标:
1.了解物质的量浓度的含义及其微观粒子间的关系。
2.能运用物质的量、摩尔质量、气体摩尔体积、物质的量浓度之间的相互关系进行简单计算。
分点突破(一) 物质的量浓度
1.溶质的质量分数
(1)概念:溶液中 溶质 的质量与溶液的质量之比。
(2)表达式:w(溶质)=×100%。
溶质
2.物质的量浓度
(1)概念:表示单位体积的溶液里所含溶质B的 物质的量 。
(2)符号:cB,常用单位: mol/L (或mol·L-1)。
(3)表达式:cB= 。
(4)示例:1 L碳酸钠溶液中含有1 mol Na2CO3,其物质的量浓度为 1 mol·L-1 ,其中c(Na+)= 2 mol·L-1 。
物质的量
mol/L
1 mol·L-1
2 mol·L-1
3.以物质的量(n)为桥梁联系宏观物质的量浓度、溶质质量与微观粒子数之间的关系
=nB=cB·V
=
1.将10 g CaCO3粉末加水配成100 mL溶液,CaCO3的物质的量浓度为1 mol·L-1吗
提示:CaCO3是难溶物,能够溶解的溶质的物质的量浓度远小于1 mol·L-1。
2.(1)1 L 0.5 mol·L-1的Al2(SO4)3溶液中n(Al3+)= ,c(Al3+)= ,n(S)= ,c(S)= ,c[Al2(SO4)3]∶c(Al3+)∶c(S)= ,由此可知,对于同一溶液中,不同粒子的浓度之比等于 。
提示:(1)1 mol 1 mol·L-1 1.5 mol 1.5 mol·L-1 1∶2∶3 粒子数之比
(2)某BaCl2溶液中,测得c(Cl-)=0.5 mol·L-1,则c(Ba2+)= 。
提示:(2)0.25 mol·L-1
(3)下列与0.2 mol·L-1 AlCl3溶液中c(Cl-)相同的是 (填序号)。
①0.2 mol·L-1 NaCl溶液 ②0.3 mol·L-1 MgCl2溶液 ③0.6 mol·L-1 KCl溶液
④0.2 mol·L-1 BaCl2溶液
提示:(3)②③
1.物质的量浓度表达式中,V表示溶液的体积,在进行简单计算时,一定要辨析所给体积是否为溶液的体积,溶液的体积不等于溶剂的体积,也不等于溶质、溶剂的体积和,应用溶液质量除以密度来求解溶液的体积。
2.注意整体与部分的关系,如:
0.2 mol·L-1的
Na2SO4溶液中
3.确定溶液中溶质的几种特殊情况
(1)带有结晶水的物质如CuSO4·5H2O溶于水时,其溶质是CuSO4,而不是CuSO4·5H2O。
(2)某些物质溶于水后与水发生反应生成了新物质,此时溶质为反应后的生成物,如Na、Na2O、Na2O2 NaOH,溶质为NaOH,SO3 H2SO4,溶质为H2SO4等。
(3)NH3溶于水后溶质为NH3·H2O,但计算浓度时是以NH3分子作为溶质。
1.下表为某人体检报告的部分项目检查结果,其中表示下列三项指标的物理量是( )
序 号 项目名称 英文 缩写 检查 结果 单位 参考范围
18 *尿素 Urea 4.18 mmol·L-1 2.78~7.14
19 *葡萄糖 Glu 5.1 mmol·L-1 3.9~6.1
20 *尿酸 UA 310 μmol·L-1 210~416
A.质量分数 B.溶解度
解析:C 三项指标的物理量单位分别为mmol·L-1、mmol·L-1、μmol·L-1,表示的是单位体积的溶液中所含溶质的物质的量,表示三项指标的物理量是物质的量浓度。
C.物质的量浓度 D.摩尔质量
2.下列溶液中,钠离子物质的量浓度最大的是( )
A.1 000 mL 0.2 mol·L-1的NaCl溶液
B.100 mL 0.25 mol·L-1的Na2CO3 溶液
C.100 mL 0.3 mol·L-1的NaNO3 溶液
D.10 mL 0.2 mol·L-1的Na2SO4 溶液
解析:B A项,c(Na+)=0.2 mol·L-1×1=0.2 mol·L-1;B项,c(Na+)=0.25 mol·L-1×2=0.5 mol·L-1;C项,c(Na+)=0.3 mol·L-1×1=0.3 mol·L-1;D项,c(Na+)=0.2 mol·L-1×2=0.4 mol·L-1;则c(Na+)最大值是0.5 mol·L-1。
3.下列实验能达到目的的是( )
A.将58.5 g NaCl溶于1 L水中可得1 mol·L-1的NaCl溶液
B.将标准状况下22.4 L HCl溶于1 L水中可得 1 mol·L-1盐酸
C.将40 g NaOH溶于水配成1 L溶液可得1 mol·L-1的NaOH溶液
D.将78 g Na2O2溶于水配成1 L溶液可得到浓度为1 mol·L-1的溶液
解析:C A项,将58.5 g NaCl即1 mol氯化钠溶于1 L水中,所得溶液体积不是1 L,因此不能得到1 mol·L-1的NaCl溶液,错误;B项,将标准状况下22.4 L HCl即1 mol氯化氢溶于1 L水中,所得溶液体积不是1 L,因此不能得到1 mol·L-1盐酸,错误;D项,将78 g Na2O2即1 mol过氧化钠溶于水,得到2 mol氢氧化钠,配成1 L溶液可得到浓度为 2 mol·L-1的溶液,错误。
分点突破(二) 与物质的量浓度有关的计算
题型一 有关定义式的计算
【例1】 设NA为阿伏加德罗常数的值,200 mL Ba(NO3)2 溶液中含Ba2+ 和N 总数为0.45NA,则该溶液的物质的量浓度为( )
A.6.75 mol·L-1 B.2.25 mol·L-1
C.1.5 mol·L-1 D.0.75 mol·L-1
解析 根据化学式以及Ba2+ 与N 的总数为0.45NA,可得该溶液中含0.15 mol Ba2+ 和 0.3 mol N,则Ba(NO3)2 的物质的量为0.15 mol,该溶液的物质的量浓度为c===0.75 mol·L-1。
答案 D
【例2】 将标准状况下体积为V L的HCl气体溶于 1 L 水中,所得溶液的密度为ρ g·cm-3,计算所得溶液的物质的量浓度
答案 n(HCl)= mol
V(溶液)=
c(HCl)== mol·L-1。
有关定义式的计算
(1)计算基本公式:c==。
(2)计算的基本类型
①已知溶质的质量
M n c
②已知溶液中某种粒子的数目
N n c
③已知标准状况下气体的体积和溶液的密度(ρ g·mL-1)
题型二 与溶液稀释和混合有关的计算
【例3】 将50 mL 0.3 mol·L-1 NaOH溶液加水稀释后到300 mL,稀释后溶液中NaOH的物质的量浓度为( )
A.0.3 mol·L-1 B.0.03 mol·L-1
C.0.05 mol·L-1 D.0.04 mol·L-1
解析 根据溶液稀释前后溶质的物质的量不变得到0.05 L×0.3 mol·L-1=c×0.3 L,c=0.05 mol·L-1。
答案 C
(1)浓溶液稀释
①溶质的物质的量不变:c(浓)·V(浓)=c(稀)·V(稀);
②溶质的质量不变:m(浓)·w(浓)=m(稀)·w(稀);
③溶液的质量守恒:m(稀)=m(浓)+m(水)。
(2)相同溶质两溶液混合
①溶质的物质的量不变:c1V1+c2V2=c(混)·V(混);
②溶质的质量不变:m1w1+m2w2=m(混)·w(混)。
题型三 物质的量浓度与溶质的质量分数的换算
【例4】 如图是某市售盐酸试剂瓶标签上的部分数据。则该盐酸的物质的量浓度是( )
盐酸
化学式:HCl
相对分子质量:36.5
密度:1.18 g·cm-3
HCl的质量分数:36.5%
符号GB622-89
A.3 mol·L-1 B.8.4 mol·L-1
C.11.8 mol·L-1 D.0.5 mol·L-1
解析 盐酸的物质的量浓度为c== mol·L-1=11.8 mol·L-1。
答案 C
质量分数与物质的量浓度的换算
已知溶质B的摩尔质量为M g·mol-1,溶液的密度为ρ g·mL-1,溶质的质量分数为w。则cB=== mol·L-1。
1.将60 mL 12 mol·L-1的盐酸(ρ=1.15 g·cm-3)稀释成6 mol·L-1的盐酸(ρ=1.10 g·cm-3),需加水的体积为(假定水的密度为1.0 g·cm-3)( )
A.63 mL B.55 mL C.52.5 mL D.50 mL
解析:A 设稀释后溶液的体积为V,根据稀释前后HCl的物质的量相等,60 mL×12 mol·L-1=V×6 mol·L-1,V=120 mL,加水的质量为120 mL×1.10 g·mL-1-60 mL×1.15 g·mL-1=63 g,所以加水的体积为63 mL。
2.在80 g密度为d g·cm-3 的硫酸铁溶液中,含有2.8 g Fe3+,则此溶液中S 的物质的量浓度数值为( )
A. B. C. D.
解析:A n(Fe3+)==0.05 mol,溶液中n(S)=n(Fe3+)=×0.05 mol =0.075 mol,溶液体积==L,则S 的物质的量浓度为 = mol·L-1。
3.由KNO3、Zn(NO3)2和ZnSO4组成的混合溶液中 c(K+)=0.2 mol·L-1、c(S)=0.4 mol·L-1、c(N)=0.4 mol·L-1,则c(Zn2+)为( )
A.0.3 mol·L-1 B.0.4 mol·L-1
C.0.5 mol·L-1 D.0.6 mol·L-1
解析:C 根据溶液呈电中性,c(K+)+2c(Zn2+)=c(N)+2c(S),即0.2 mol·L-1+2c(Zn2+)=0.4 mol·L-1+2×0.4 mol·L-1,解得c(Zn2+)=0.5 mol·L-1。
1.下列对1 mol·L-1的Na2SO4溶液的叙述中正确的是( )
A.溶液中含有1 mol Na2SO4
B.它是由1 mol Na2SO4溶于1 L水形成的溶液
C.1 L该溶液含有142 g Na2SO4
D.从1 L该溶液中取出500 mL以后,剩余溶液的浓度为0.5 mol·L-1
解析:C A项,由于溶液体积未知,则不能确定溶质的物质的量,错误;B项,1 mol Na2SO4溶于1 L水,溶液的体积不等于1 L,错误;C项,1 L溶液中含有:m(Na2SO4)=1 L×1 mol·L-1×142 g·mol-1=142 g,正确;D项,从1 L该溶液中取出500 mL以后,溶液具有均一性,故剩余溶液的浓度仍为 1 mol·L-1,错误。
2.0.25 L NaOH溶液中溶有10 g NaOH,则此溶液的物质的量浓度为( )
A.2 mol·L-1 B.1 mol·L-1
C.0.5 mol·L-1 D.0.05 mol·L-1
解析:B n(NaOH)==0.25 mol,溶液的体积为0.25 L,c(NaOH)==1 mol·L-1。
3.在0.2 mol·L-1KAl(SO4)2溶液中,S的物质的量浓度为( )
A.0.1 mol·L-1 B.0.2 mol·L-1
C.0.4 mol·L-1 D.0.8 mol·L-1
解析:C 由化学式可知,S的物质的量浓度为 2×0.2 mol·L-1=0.4 mol·L-1。
4.在相同体积、相同物质的量浓度的两种酸溶液中,一定相等的是( )
A.溶质的质量 B.溶质的物质的量
C.溶质的质量分数 D.氢离子的物质的量
解析:B 在相同体积、相同物质的量浓度的两种酸溶液中,由n=cV可知,酸的物质的量一定相等,B正确;若二者的摩尔质量不同,则质量不同,A错误;由c= 可知,若二者的摩尔质量不同,密度不同,则质量分数不同,C错误;酸的元数不确定,无法判断氢离子的物质的量,D错误。
5.(1)用14.2 g无水硫酸钠配制成500 mL溶液,其物质的量浓度为 mol·L-1。
解析:(1)n(Na2SO4)==0.1 mol,c(Na2SO4)==0.2 mol·L-1。
答案:(1)0.2
(2)若从中取出50 mL溶液,其物质的量浓度为 mol·L-1,溶质的质量为 g。
解析:(2)从中取出50 mL溶液,浓度仍为0.2 mol·L-1,溶质的质量m=nM=cVM=0.2 mol·L-1×0.05 L×142 g·mol-1=1.42 g。
答案:(2)0.2 1.42
(3)若将这50 mL溶液用水稀释到100 mL,所得溶液中Na+的物质的量浓度为 mol·L-1,S的物质的量浓度为 mol·L-1。
解析:(3)50 mL溶液用水稀释到100 mL,根据c(浓)·V(浓)=c(稀)·V(稀),稀溶液中Na2SO4的物质的量浓度变为原来的,即0.1 mol·L-1,故所得溶液中Na+的物质的量浓度为0.2 mol·L-1,S的物质的量浓度为0.1 mol·L-1。
答案:(3)0.2 0.1
