化学人教版(2019)必修第一册1.3.2氧化剂和还原剂(共30张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.3.2氧化剂和还原剂(共30张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 777.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 09:08:45 | ||
图片预览








文档简介
(共30张PPT)
氧化剂和还原剂
学习目标:
1.知道常见的氧化剂和还原剂。
2.能从物质类别、元素价态的角度,依据氧化还原反应原理,预测物质的化学性质和变化。
分点突破(一) 氧化剂和还原剂
1.氧化剂和还原剂
(1)氧化剂
①氧化剂是 得到 电子(或电子对 偏向 )的物质,具有氧化性。
②氧化剂在反应时所含元素的化合价 降低 ,本身被还原。
得到
偏向
降低
(2)还原剂
①还原剂是 失去 电子(或电子对 偏离 )的物质,具有还原性。
②还原剂在反应时所含元素的化合价 升高 ,本身被氧化。
失去
偏离
升高
2.氧化性和还原性
(1)氧化性:氧化剂所表现出 得电子 的性质。
(2)还原性:还原剂所表现出 失电子 的性质。
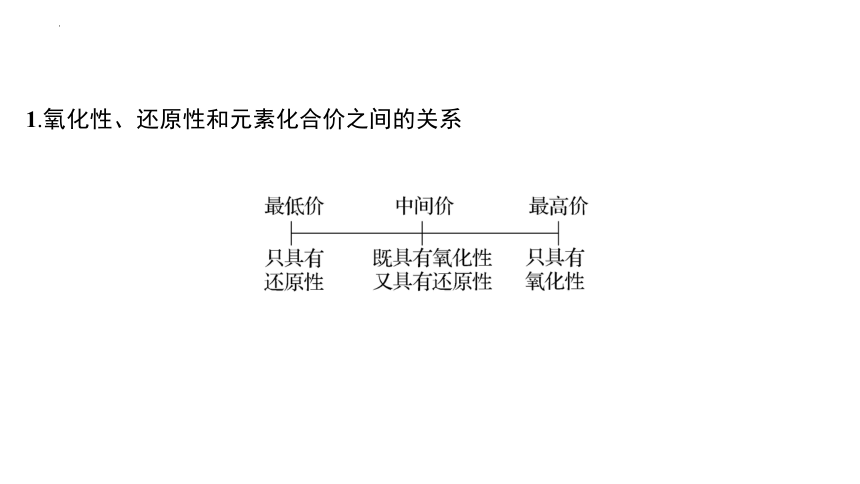
(3)在氧化还原反应中:同一元素的最高价态只能 得到 电子,具有 氧化 性;最低价态只能 失去 电子,具有 还原 性;中间价态既有氧化性又有还原性。
得电子
失电子
得到
氧化
失去
还原
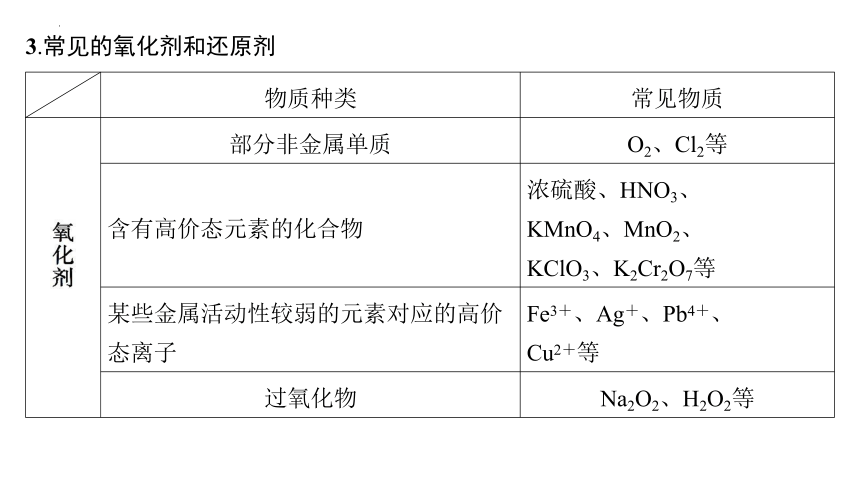
3.常见的氧化剂和还原剂
物质种类 常见物质
部分非金属单质 O2、Cl2等
含有高价态元素的化合物 浓硫酸、HNO3、
KMnO4、MnO2、
KClO3、K2Cr2O7等
某些金属活动性较弱的元素对应的高价态离子 Fe3+、Ag+、Pb4+、
Cu2+等
过氧化物 Na2O2、H2O2等
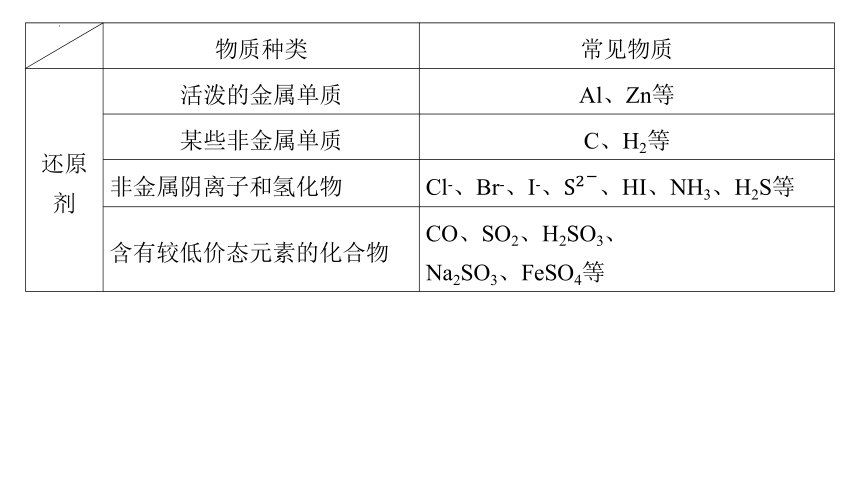
物质种类 常见物质
还原剂 活泼的金属单质 Al、Zn等
某些非金属单质 C、H2等
非金属阴离子和氢化物 Cl-、Br-、I-、、HI、NH3、H2S等
含有较低价态元素的化合物 CO、SO2、H2SO3、
Na2SO3、FeSO4等
氧化还原反应在生活中有着重要的应用:
(1)治理汽车尾气的一种方法是在汽车的排气管上装一个催化转换装置,使NO和CO反应,生成CO2 和N2。写出该反应的化学方程式并用双线桥法标出电子转移的方向和数目 。
(2)向5%H2O2溶液中滴加酸性KMnO4 溶液,可以观察到KMnO4 溶液紫色褪去,有大量气泡产生。这说明H2O2溶液有 (填“氧化性”或“还原性”,下同),H2O2生成的产物为 ;向5%H2O2溶液中滴加淀粉碘化钾溶液,可以观察到溶液变蓝。这说明H2O2溶液有 ,H2O2生成的产物为 。从化合价的角度分析H2O2既有氧化性又有还原性的原因是
。
提示:还原性 O2 氧化性 H2O H2O2中氧元素是-1 价,是该元素的中间价态
1.氧化性、还原性和元素化合价之间的关系
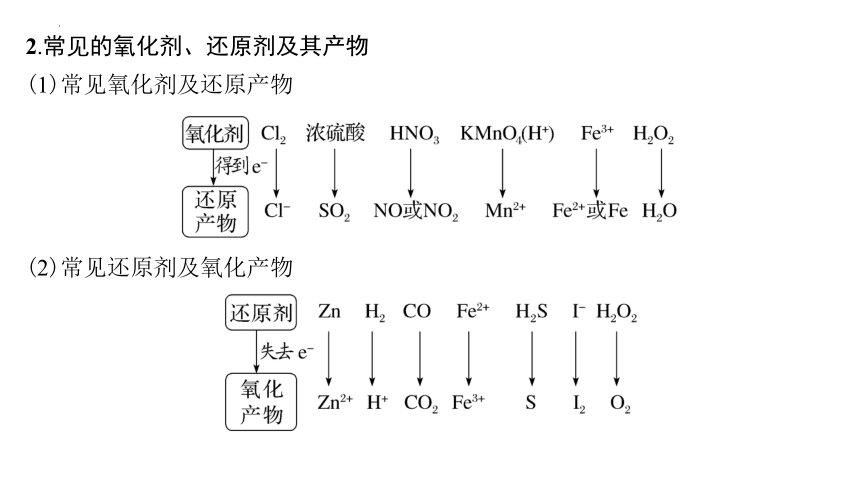
2.常见的氧化剂、还原剂及其产物
(1)常见氧化剂及还原产物
(2)常见还原剂及氧化产物
1.下列变化需要加入氧化剂才能实现的是( )
A.KMnO4→MnO2 B.Cu→Cu(NO3)2
C.H2SO4→BaSO4 D.Fe2O3→Fe
解析:B KMnO4 加热分解为锰酸钾、二氧化锰和氧气,KMnO4→MnO2 不需要加入氧化剂,不选A;Cu→Cu(NO3)2,铜元素化合价升高,需要加入氧化剂才能实现,选B;H2SO4→BaSO4 ,元素化合价不变,属于非氧化还原反应,不选C;Fe2O3→Fe,铁元素化合价降低,需要加入还原剂才能实现,不选D。
2.下列反应中,H2O2只作还原剂的是( )
A.2Mn+5H2O2+6H+2Mn2++5O2↑+8H2O
B.SO2+H2O2H2SO4
C.2Fe2++H2O2+2H+2Fe3++2H2O
D.2H2O2 O2↑+2H2O
解析:A A项,Mn中Mn化合价降低,作氧化剂,H2O2中O化合价升高,作还原剂;B项,SO2中S化合价升高,作还原剂,H2O2中O化合价降低,作氧化剂;C项,Fe2+化合价升高,作还原剂,H2O2中O化合价降低,作氧化剂;D项,H2O2中O化合价既升高又降低,既是氧化剂又是还原剂。
分点突破(二) 物质氧化性和还原性强弱比较
1.根据氧化还原反应的方向判断
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
2.根据元素的活动性顺序比较
特点:上左下右可反应,隔之愈远愈易行。
3.根据反应的难易(反应条件)比较
(1)2KMnO4+16HCl(浓)2KCl+2MnCl2+5Cl2↑+8H2O
(2)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
由反应条件可判断氧化性:KMnO4 > MnO2。
4.根据变价元素被氧化或被还原的程度比较
(1)2Fe+3Cl2 2FeCl3
(2)Fe+SFeS
铁元素被氯气氧化为+3价,被硫氧化为+2价,其氧化性:氯气 > 硫。
>
>
已知下列反应:
①Cl2+2NaBr2NaCl+Br2
②2KI+Br22KBr+I2
③Na2S+I22NaI+S↓
(1)Cl-、Br-、I-、S2-的还原性由强到弱的顺序是 。
提示:(1)S2->I->Br->Cl-
(2)Cl2、Br2、I2、S的氧化性由强到弱的顺序是 。
提示:(2)Cl2>Br2>I2>S
(3)判断Cl2与Na2S能否反应 (填“能”或“否”)。
提示:(3)能
(4)判断I2与NaCl能否共存 (填“能”或“否”)。
提示:(4)能
1.判断物质氧化性、还原性强弱应注意的问题
(1)不能根据得失电子的多少判断氧化性、还原性的强弱。
(2)对同一元素而言,一般价态越高,氧化性越强,如F>F。
(3)氧化性、还原性的强弱还与物质的浓度等有关,如浓硝酸的氧化性强于稀硝酸。
①先假设反应成立。
②然后根据氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物,列出假设反应中的上述关系。
③结合题干信息判断该结论是否符合事实,若符合事实,则反应成立;反之,则不成立。
2.判断氧化还原反应能否发生的方法——假设法
已知物质的氧化性或还原性的强弱关系,判断某一氧化还原反应能否发生时可采用假设法。
1.已知如下反应:①2Br+Cl2Br2+2Cl;②Cl+5Cl-+6H+3Cl2+3H2O;③2FeCl3+2KI2FeCl2+2KCl+I2;④2FeCl2+Cl22FeCl3。下列各粒子氧化能力由强到弱的顺序正确的是( )
A.Cl>Br>Cl2>Fe3+>I2
B.Br>Cl2>Cl>I2>Fe3+
C.Br>Cl>Cl2>Fe3+>I2
D.Br>Cl>Fe3+>Cl2>I2
解析:C 反应①中氧化剂是Br,氧化产物是Cl,则氧化性:Br>Cl;同理,由反应②知,氧化性:Cl>Cl2;由反应③知,氧化性:Fe3+>I2;由反应④知,氧化性:Cl2>Fe3+;综上可知,氧化性:Br>Cl>Cl2>Fe3+>I2。
2.PbO2、KMnO4、Cl2、FeCl3、Cu2+的氧化性依次减弱。下列反应在水溶液中不可能发生的是( )
A.Cu+2Fe3+Cu2++2Fe2+
B.10Cl-+2Mn+16H+2Mn2++5Cl2↑+8H2O
C.2Fe2++Cl22Fe3++2Cl-
D.5Pb2++2Mn+2H2O5PbO2+2Mn2++4H+
解析:D A项,Fe3+的氧化性比Cu2+的氧化性强,反应能发生;B项,Mn的氧化性比Cl2的氧化性强,反应能发生;C项,Cl2的氧化性比Fe3+的氧化性强,反应能发生;D项,PbO2的氧化性比Mn的氧化性强,所以Mn不能将Pb2+氧化为PbO2,反应不能发生。
氧化还原反应中的反应规律(归纳与论证)
1.反应KClO3+6HCl(浓)KCl+3Cl2↑+3H2O中,被氧化的氯原子与被还原的氯原子的个数之比为( )
A.1∶6 B.6∶1
C.1∶5 D.5∶1
解析:D KClO3中的氯元素由+5价被还原为0价,HCl中的氯元素部分由-1价被氧化为0价,由得失电子守恒可知,被氧化的氯原子(化合价升高的氯原子)和被还原的氯原子(化合价降低的氯原子)的个数之比为5∶1。
2.已知还原性:S2->Br-,Cl2具有强氧化性,在含Na2S、NaBr混合液中通入Cl2,依次写出反应的离子方程式: 、 。
答案:S2-+Cl2S↓+2Cl-
2Br-+Cl2Br2+2Cl-
1.守恒律
氧化还原反应中,还原剂失去电子总数=氧化剂得到电子总数。或者表达为化合价降低的总数=化合价升高的总数。
2.先后律
(1)同一种氧化剂与多种还原剂反应时,还原性强的还原剂先被氧化。
(2)同一种还原剂与多种氧化剂反应时,氧化性强的氧化剂先被还原。
如,还原性:Fe2+>Br-,把Cl2通入FeBr2溶液时,Cl2先氧化Fe2+,而不是先氧化Br-。
①含义:同种元素的不同价态之间发生氧化还原反应时,高价态+低价态→中间价态,即“只靠拢,不交叉”。
②图示表达如下:
3.价态律
(1)归中规律
(2)歧化规律
①同种元素的中间价态可自身发生氧化还原反应生成高价态和低价态,即中间价态→高价态+低价态。
②实例:3NO2+H2O2HNO3+NO。
1.向AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后,有金属析出,过滤、洗涤后往滤渣中加入稀盐酸,有无色气体放出,则滤液中一定存在( )
A.Fe2+ B.Cu2+、Fe2+
C.Ag+、Fe2+ D.Ag+、Cu2+、Fe2+
解析:A 在金属活动性顺序中,活动性:Fe>H>Cu>Ag,往滤渣中加入稀盐酸,有无色气体放出,则说明滤渣中含有铁,铁能与硝酸银反应生成硝酸亚铁和银,能与硝酸铜反应生成硝酸亚铁和铜,当有铁剩余时,说明硝酸铜和硝酸银全部参加反应,滤液中无硝酸铜和硝酸银,只有生成的硝酸亚铁。
2.Na2S在碱性溶液中被NaClO氧化为Na2SO4,NaClO被还原为NaCl,则反应中Na2S与NaClO的个数比为( )
A.1∶3 B.1∶4
C.4∶1 D.1∶2
答案:B
3.某同学写出以下三个化学方程式(未配平):
①NO+HNO3N2O3+H2O
②NH3+NOHNO2+H2O
③N2O4+H2OHNO3+HNO2
其中你认为不可能实现的是 (填序号)。
解析:氧化还原反应中元素化合价有升必有降。②中NH3、NO中氮的化合价分别为-3价、+2价,生成HNO2(氮的化合价为+3价)的过程中氮元素的化合价都是升高,此反应不可能实现。
答案:②
4.在一定条件下,PbO2与Cr3+反应,产物是Cr2和Pb2+,则Cr3+与PbO2反应的化学计量数之比为 。
解析:PbO2中铅元素为+4价,Cr2中铬元素为+6价,设Cr3+与PbO2反应的化学计量数之比为 x∶y,根据得失电子守恒规律有(4-2)y=(6-3)x,解得x∶y=2∶3。
答案:2∶3
氧化剂和还原剂
学习目标:
1.知道常见的氧化剂和还原剂。
2.能从物质类别、元素价态的角度,依据氧化还原反应原理,预测物质的化学性质和变化。
分点突破(一) 氧化剂和还原剂
1.氧化剂和还原剂
(1)氧化剂
①氧化剂是 得到 电子(或电子对 偏向 )的物质,具有氧化性。
②氧化剂在反应时所含元素的化合价 降低 ,本身被还原。
得到
偏向
降低
(2)还原剂
①还原剂是 失去 电子(或电子对 偏离 )的物质,具有还原性。
②还原剂在反应时所含元素的化合价 升高 ,本身被氧化。
失去
偏离
升高
2.氧化性和还原性
(1)氧化性:氧化剂所表现出 得电子 的性质。
(2)还原性:还原剂所表现出 失电子 的性质。
(3)在氧化还原反应中:同一元素的最高价态只能 得到 电子,具有 氧化 性;最低价态只能 失去 电子,具有 还原 性;中间价态既有氧化性又有还原性。
得电子
失电子
得到
氧化
失去
还原
3.常见的氧化剂和还原剂
物质种类 常见物质
部分非金属单质 O2、Cl2等
含有高价态元素的化合物 浓硫酸、HNO3、
KMnO4、MnO2、
KClO3、K2Cr2O7等
某些金属活动性较弱的元素对应的高价态离子 Fe3+、Ag+、Pb4+、
Cu2+等
过氧化物 Na2O2、H2O2等
物质种类 常见物质
还原剂 活泼的金属单质 Al、Zn等
某些非金属单质 C、H2等
非金属阴离子和氢化物 Cl-、Br-、I-、、HI、NH3、H2S等
含有较低价态元素的化合物 CO、SO2、H2SO3、
Na2SO3、FeSO4等
氧化还原反应在生活中有着重要的应用:
(1)治理汽车尾气的一种方法是在汽车的排气管上装一个催化转换装置,使NO和CO反应,生成CO2 和N2。写出该反应的化学方程式并用双线桥法标出电子转移的方向和数目 。
(2)向5%H2O2溶液中滴加酸性KMnO4 溶液,可以观察到KMnO4 溶液紫色褪去,有大量气泡产生。这说明H2O2溶液有 (填“氧化性”或“还原性”,下同),H2O2生成的产物为 ;向5%H2O2溶液中滴加淀粉碘化钾溶液,可以观察到溶液变蓝。这说明H2O2溶液有 ,H2O2生成的产物为 。从化合价的角度分析H2O2既有氧化性又有还原性的原因是
。
提示:还原性 O2 氧化性 H2O H2O2中氧元素是-1 价,是该元素的中间价态
1.氧化性、还原性和元素化合价之间的关系
2.常见的氧化剂、还原剂及其产物
(1)常见氧化剂及还原产物
(2)常见还原剂及氧化产物
1.下列变化需要加入氧化剂才能实现的是( )
A.KMnO4→MnO2 B.Cu→Cu(NO3)2
C.H2SO4→BaSO4 D.Fe2O3→Fe
解析:B KMnO4 加热分解为锰酸钾、二氧化锰和氧气,KMnO4→MnO2 不需要加入氧化剂,不选A;Cu→Cu(NO3)2,铜元素化合价升高,需要加入氧化剂才能实现,选B;H2SO4→BaSO4 ,元素化合价不变,属于非氧化还原反应,不选C;Fe2O3→Fe,铁元素化合价降低,需要加入还原剂才能实现,不选D。
2.下列反应中,H2O2只作还原剂的是( )
A.2Mn+5H2O2+6H+2Mn2++5O2↑+8H2O
B.SO2+H2O2H2SO4
C.2Fe2++H2O2+2H+2Fe3++2H2O
D.2H2O2 O2↑+2H2O
解析:A A项,Mn中Mn化合价降低,作氧化剂,H2O2中O化合价升高,作还原剂;B项,SO2中S化合价升高,作还原剂,H2O2中O化合价降低,作氧化剂;C项,Fe2+化合价升高,作还原剂,H2O2中O化合价降低,作氧化剂;D项,H2O2中O化合价既升高又降低,既是氧化剂又是还原剂。
分点突破(二) 物质氧化性和还原性强弱比较
1.根据氧化还原反应的方向判断
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
2.根据元素的活动性顺序比较
特点:上左下右可反应,隔之愈远愈易行。
3.根据反应的难易(反应条件)比较
(1)2KMnO4+16HCl(浓)2KCl+2MnCl2+5Cl2↑+8H2O
(2)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
由反应条件可判断氧化性:KMnO4 > MnO2。
4.根据变价元素被氧化或被还原的程度比较
(1)2Fe+3Cl2 2FeCl3
(2)Fe+SFeS
铁元素被氯气氧化为+3价,被硫氧化为+2价,其氧化性:氯气 > 硫。
>
>
已知下列反应:
①Cl2+2NaBr2NaCl+Br2
②2KI+Br22KBr+I2
③Na2S+I22NaI+S↓
(1)Cl-、Br-、I-、S2-的还原性由强到弱的顺序是 。
提示:(1)S2->I->Br->Cl-
(2)Cl2、Br2、I2、S的氧化性由强到弱的顺序是 。
提示:(2)Cl2>Br2>I2>S
(3)判断Cl2与Na2S能否反应 (填“能”或“否”)。
提示:(3)能
(4)判断I2与NaCl能否共存 (填“能”或“否”)。
提示:(4)能
1.判断物质氧化性、还原性强弱应注意的问题
(1)不能根据得失电子的多少判断氧化性、还原性的强弱。
(2)对同一元素而言,一般价态越高,氧化性越强,如F>F。
(3)氧化性、还原性的强弱还与物质的浓度等有关,如浓硝酸的氧化性强于稀硝酸。
①先假设反应成立。
②然后根据氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物,列出假设反应中的上述关系。
③结合题干信息判断该结论是否符合事实,若符合事实,则反应成立;反之,则不成立。
2.判断氧化还原反应能否发生的方法——假设法
已知物质的氧化性或还原性的强弱关系,判断某一氧化还原反应能否发生时可采用假设法。
1.已知如下反应:①2Br+Cl2Br2+2Cl;②Cl+5Cl-+6H+3Cl2+3H2O;③2FeCl3+2KI2FeCl2+2KCl+I2;④2FeCl2+Cl22FeCl3。下列各粒子氧化能力由强到弱的顺序正确的是( )
A.Cl>Br>Cl2>Fe3+>I2
B.Br>Cl2>Cl>I2>Fe3+
C.Br>Cl>Cl2>Fe3+>I2
D.Br>Cl>Fe3+>Cl2>I2
解析:C 反应①中氧化剂是Br,氧化产物是Cl,则氧化性:Br>Cl;同理,由反应②知,氧化性:Cl>Cl2;由反应③知,氧化性:Fe3+>I2;由反应④知,氧化性:Cl2>Fe3+;综上可知,氧化性:Br>Cl>Cl2>Fe3+>I2。
2.PbO2、KMnO4、Cl2、FeCl3、Cu2+的氧化性依次减弱。下列反应在水溶液中不可能发生的是( )
A.Cu+2Fe3+Cu2++2Fe2+
B.10Cl-+2Mn+16H+2Mn2++5Cl2↑+8H2O
C.2Fe2++Cl22Fe3++2Cl-
D.5Pb2++2Mn+2H2O5PbO2+2Mn2++4H+
解析:D A项,Fe3+的氧化性比Cu2+的氧化性强,反应能发生;B项,Mn的氧化性比Cl2的氧化性强,反应能发生;C项,Cl2的氧化性比Fe3+的氧化性强,反应能发生;D项,PbO2的氧化性比Mn的氧化性强,所以Mn不能将Pb2+氧化为PbO2,反应不能发生。
氧化还原反应中的反应规律(归纳与论证)
1.反应KClO3+6HCl(浓)KCl+3Cl2↑+3H2O中,被氧化的氯原子与被还原的氯原子的个数之比为( )
A.1∶6 B.6∶1
C.1∶5 D.5∶1
解析:D KClO3中的氯元素由+5价被还原为0价,HCl中的氯元素部分由-1价被氧化为0价,由得失电子守恒可知,被氧化的氯原子(化合价升高的氯原子)和被还原的氯原子(化合价降低的氯原子)的个数之比为5∶1。
2.已知还原性:S2->Br-,Cl2具有强氧化性,在含Na2S、NaBr混合液中通入Cl2,依次写出反应的离子方程式: 、 。
答案:S2-+Cl2S↓+2Cl-
2Br-+Cl2Br2+2Cl-
1.守恒律
氧化还原反应中,还原剂失去电子总数=氧化剂得到电子总数。或者表达为化合价降低的总数=化合价升高的总数。
2.先后律
(1)同一种氧化剂与多种还原剂反应时,还原性强的还原剂先被氧化。
(2)同一种还原剂与多种氧化剂反应时,氧化性强的氧化剂先被还原。
如,还原性:Fe2+>Br-,把Cl2通入FeBr2溶液时,Cl2先氧化Fe2+,而不是先氧化Br-。
①含义:同种元素的不同价态之间发生氧化还原反应时,高价态+低价态→中间价态,即“只靠拢,不交叉”。
②图示表达如下:
3.价态律
(1)归中规律
(2)歧化规律
①同种元素的中间价态可自身发生氧化还原反应生成高价态和低价态,即中间价态→高价态+低价态。
②实例:3NO2+H2O2HNO3+NO。
1.向AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后,有金属析出,过滤、洗涤后往滤渣中加入稀盐酸,有无色气体放出,则滤液中一定存在( )
A.Fe2+ B.Cu2+、Fe2+
C.Ag+、Fe2+ D.Ag+、Cu2+、Fe2+
解析:A 在金属活动性顺序中,活动性:Fe>H>Cu>Ag,往滤渣中加入稀盐酸,有无色气体放出,则说明滤渣中含有铁,铁能与硝酸银反应生成硝酸亚铁和银,能与硝酸铜反应生成硝酸亚铁和铜,当有铁剩余时,说明硝酸铜和硝酸银全部参加反应,滤液中无硝酸铜和硝酸银,只有生成的硝酸亚铁。
2.Na2S在碱性溶液中被NaClO氧化为Na2SO4,NaClO被还原为NaCl,则反应中Na2S与NaClO的个数比为( )
A.1∶3 B.1∶4
C.4∶1 D.1∶2
答案:B
3.某同学写出以下三个化学方程式(未配平):
①NO+HNO3N2O3+H2O
②NH3+NOHNO2+H2O
③N2O4+H2OHNO3+HNO2
其中你认为不可能实现的是 (填序号)。
解析:氧化还原反应中元素化合价有升必有降。②中NH3、NO中氮的化合价分别为-3价、+2价,生成HNO2(氮的化合价为+3价)的过程中氮元素的化合价都是升高,此反应不可能实现。
答案:②
4.在一定条件下,PbO2与Cr3+反应,产物是Cr2和Pb2+,则Cr3+与PbO2反应的化学计量数之比为 。
解析:PbO2中铅元素为+4价,Cr2中铬元素为+6价,设Cr3+与PbO2反应的化学计量数之比为 x∶y,根据得失电子守恒规律有(4-2)y=(6-3)x,解得x∶y=2∶3。
答案:2∶3
